扭脱甲基杆菌AM1生物加工过程研究进展
2017-12-06王山山崔兰玉薛正莲邢新会
王山山, 崔兰玉,薛正莲,张 翀,邢新会
(1. 安徽工程大学 生物与化学工程学院,安徽 芜湖 241000;2. 清华大学 化学工程系 生物化工研究所 工业生物催化教育部重点实验室,北京 100084;3. 清华大学 合成与系统生物学中心,北京 100084)
扭脱甲基杆菌AM1生物加工过程研究进展
王山山1, 崔兰玉2,3,薛正莲1,张 翀2,3,邢新会2,3
(1. 安徽工程大学 生物与化学工程学院,安徽 芜湖 241000;2. 清华大学 化学工程系 生物化工研究所 工业生物催化教育部重点实验室,北京 100084;3. 清华大学 合成与系统生物学中心,北京 100084)
甲醇作为重要的一碳化工原料,可由甲烷、合成气和CO2等转化制得。扭脱甲基杆菌AM1是以甲醇作为唯一碳源和能源来进行生物发酵的微生物。由于原料来源广泛,发酵过程染菌的风险低,且能够利用合成培养基降低生产成本,同时产物后处理简单,扭脱甲基杆菌AM1被广泛利用在生物化工领域。目前,扭脱甲基杆菌AM1以甲醇作为碳源,已经成功实现了工业化生产单细胞蛋白。随着分子生物学技术的发展,扭脱甲基杆菌AM1以甲醇为底物有望合成更多高附加值的产品。本文中,笔者对扭脱甲基杆菌AM1生物加工过程进行综述,希望对甲醇基生物工业有所启发。
甲醇;生物化工;高附加值产品;扭脱甲基杆菌AM1
甲醇作为一种重要的化工原料,可由煤、石油、天然气、合成气等化石资源以及生物质等可再生资源生产。在我国,甲醇是煤化工的重要产物,据CMAI数据显示,目前我国甲醇产量占世界产量的50%。随着低温、低压合成甲醇技术的快速推广,甲醇的产量仍然在不断增长。甲醇的高值化转化和利用成为碳一化工的重要课题。早在20世纪70年代,英国、挪威和日本等国以甲醇为碳源,利用甲基营养型微生物实现了大规模生产单细胞蛋白[1]。为了开辟甲醇的利用新途径,近年来,随着代谢工程、合成生物学、基因组学和生物过程工程的进步,对甲醇利用微生物的认识和工程化改造能力不断深入,通过途径工程实现了以甲醇为碳源生产多种高附加值产品。
甲基营养型微生物简称甲基营养菌,是一类能以非C—C键化合物作为碳源和能源的微生物的统称[2],广泛存在于空气、水、土壤以及植物表面,在全球碳循环中具有重要作用[3]。甲基营养菌能够以甲醇作为唯一碳源和能源,在廉价的合成培养基上生长并合成各种代谢产物,自甲基营养菌(Methylomonasmethanica)在1906年首次发现以来,得到了广泛而深入的研究[4]。
甲基营养型细菌主要分布在朊细菌门(P r o t e o b a c t e r i a)、α-朊细菌亚门(α-P r o t e o b a c t e r i a)、α-变形菌纲(α-Epsilonproteobacteria)、根瘤菌目(Rhizobiales)甲基杆菌科(Methylobacteriaceae)和甲基杆菌属(Methylobacterium)中[3-5]。系统发生学分类主要是根据甲基营养菌的生理生化特征来分的,能够利用丝氨酸(Serine)循环和卡尔文循环(CBB)进行甲醛同化作用的为α-变形菌纲;能够单一性利用非甲烷甲基类营养物质的为β-变形菌纲;能够利用核酮糖单磷酸循环(RuMP)进行甲醛同化作用的为γ-变形菌纲[6-7]。
扭脱甲基杆菌AM1(MethylobacteriumextorquensAM1)是以甲醇为唯一碳源和能源生长代谢的甲醇营养菌,它可以通过聚羟基脂肪酸酯(PHB)合成途径、甲基丙二酸单酰辅酶A(EMC)循环、Serine循环进行C1同化作用。扭脱甲基杆菌AM1菌体呈粉红色,属于严格好氧型微生物,在细菌分类学上属于α-变形菌纲,是革兰氏阴性菌[8]。扭脱甲基杆菌是研究甲基代谢的模式菌株,在1960年被发现后,研究工作主要集中在菌体培养和生理特性研究,直到20世纪80年代才开始基因克隆方面的研究。
本文中,笔者将首先综述甲基营养微生物的代谢特征,随后着重介绍甲基营养菌模式微生物扭托甲基杆菌AM1在甲醇高值化生物加工过程中的最新研究进展,并讨论其面临的机遇与挑战。
1 微生物细胞代谢甲醇的方式
甲基营养型微生物有4种甲醇代谢方式[9]如图1所示。它们分别是XuMP 循环、丝氨酸循环、CBB循环和RuMP循环。对于一些甲基营养型细菌,有丝氨酸循环的α-变形杆菌称为I型菌株,而含有核酮糖单磷酸途径的γ-变形杆菌纲称为II型菌株,能以甲烷为碳源的称为III型菌株[10]。分别以扭脱甲基杆菌AM1、甲基营养型酵母(Methylotrophic yeast)、能以甲烷为碳源的菌株(AcidimethylosilexfumarolicumSolV)、嗜有机甲基菌(Methylophilusmethylotrophus)和甲基单胞菌(Methylomonasmethanolica)研究最多,其中后2种实现了工业规模生产单细胞蛋白。
在甲基营养型酵母中[11],2.06CH3OH+2.02O2+0.15NH3+nutrient→CH1.75O0.5N0.15(biomass)+1.06CO2+3.47H2O,ΔH=-268.4 kJ/mol,约49%的甲醇形成生物量,51%的甲醇生成能量,酵母的生物细胞得率为0.37~0.45[12]。
I型菌株中甲醇代谢方程[13]:1.63CH3OH+1.39O2+0.23NH3+nutrient→CH169O038N024(biomass)+0.63CO2+2.76H2O,ΔH=-449.7 kJ/mol,约38%的甲醇生成能量,62%形成生物量。I型菌株细胞得率为0.55 g/g,要高于甲基营养型酵母[12],II型菌株能够再利用细胞代谢产生的约1/5的CO2形成约50%生物量,相当于减少了16%甲醇消耗[14],因此,I型菌株生物量底物得率要高于II型菌株。I型菌株特别是模式微生物AM1,已经成为甲基营养型细菌的模式菌株。
甲基营养菌以甲醇作为碳源,利用核酮糖单磷酸循环、丝氨酸循环进行生长和代谢,已经被用来合成多种高附加值产品,以甲醇作为碳源的甲基营养菌的生长参数如表1所示。
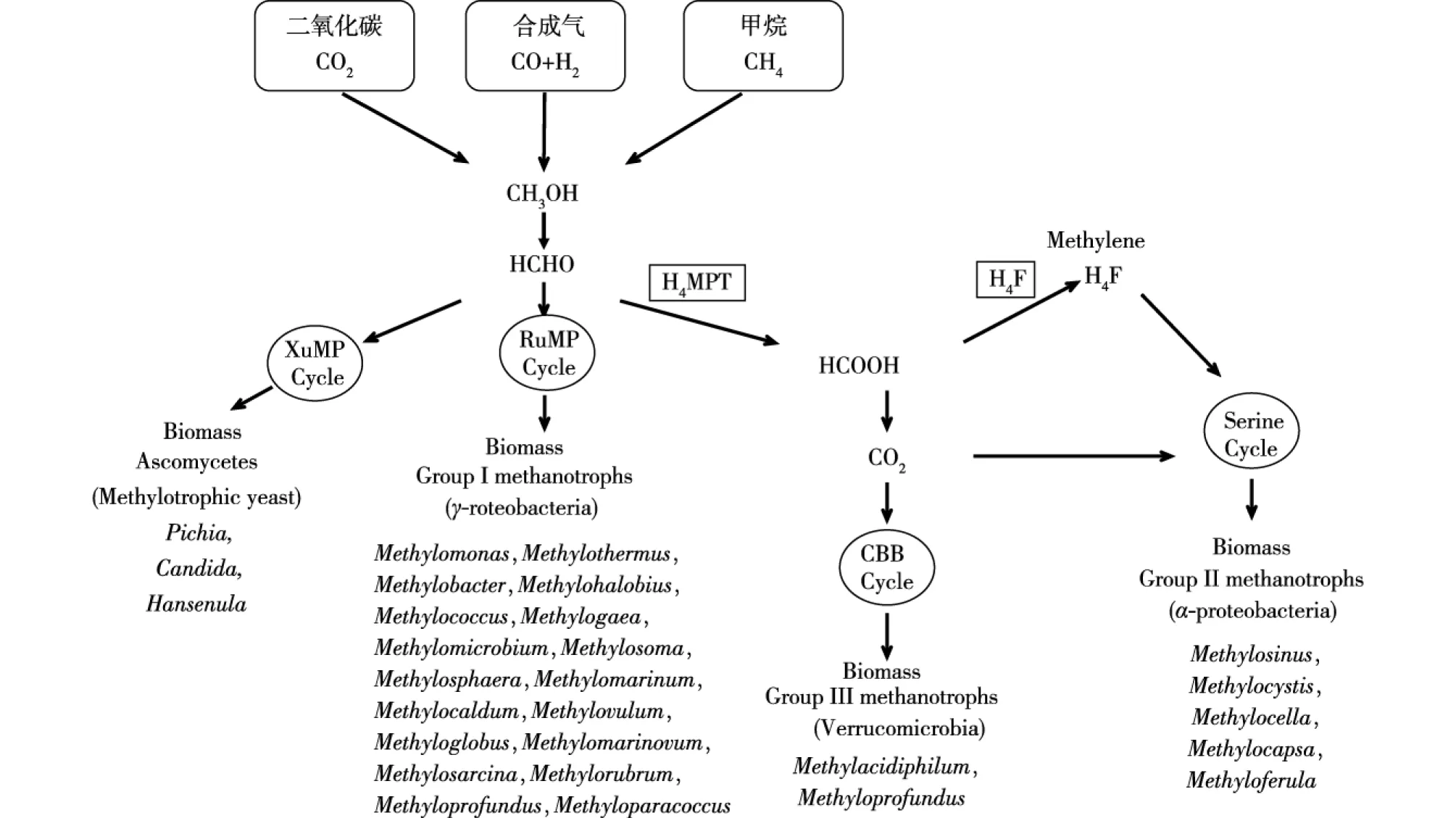
图1 甲醇在甲基营养菌中的代谢方式[8]Fig.1 Metabolic patterns of methanol in methylotrophic bacteria
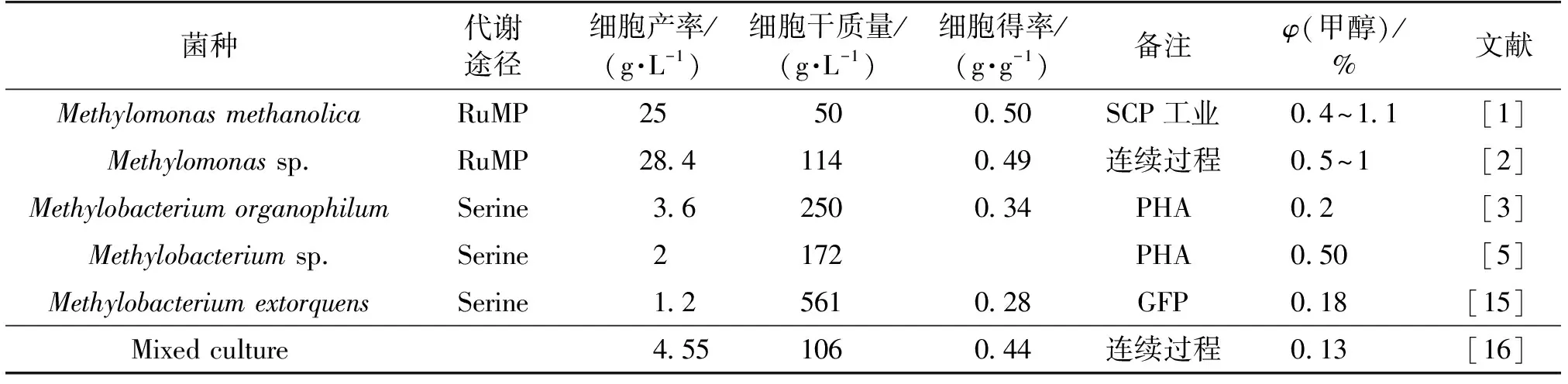
菌种代谢途径细胞产率/(g·L-1)细胞干质量/(g·L-1)细胞得率/(g·g-1)备注φ(甲醇)/%文献MethylomonasmethanolicaRuMP2550050SCP工业04~11[1]Methylomonassp.RuMP284114049连续过程05~1[2]MethylobacteriumorganophilumSerine36250034PHA02[3]Methylobacteriumsp.Serine2172PHA050[5]MethylobacteriumextorquensSerine12561028GFP018[15]Mixedculture455106044连续过程013[16]
注:SCP—单细胞蛋白;Mixed culture—多菌混合培养。
2 扭脱甲基杆菌AM1甲醇高值化生物加工过程
扭脱甲基杆菌AM1的C1代谢图谱[17]、全基因序列[18]和代谢网络[19]等均得到了阐明,各国科学家的研究大多基于PHB合成途径、EMC循环和Serine循环构建大量工程菌株用于生产多种化合物,特别是2014年以来,各国研究者不断尝试利用基因工程的手段表达外源基因来生产功能化PHB[20]、生物能源[21]、富康酸[22]和蛇麻烯[23]等,随着人们认识的深入,将大大拓展甲基营养菌的应用前景。下面将从PHB循环产物、EMC循环的化学品和氨基酸产物这几个方面来介绍扭脱甲基杆菌AM1利用甲醇作为底物生产多种高附加值化合物的情况。
2.1 PHB循环产物
PHB(聚β-羟基丁酸)是菌体储能物质,具有优良的生物可降解性和组织相容性,可用于包装、医药卫生和纺织等领域。AM1作为天然产PHB的菌株,有30多年研究历史,PHB产量最高达到149 g/L,占细胞干质量的64%,细胞得率达到0.2 g/g[24]。表2为不同的研究者利用M.extorquens生产PHB情况。
从表2可知,原始菌株可以达到较高的细胞密度(83.88 g/L)[24],工程菌发酵最高仅为5 g/L[30]。M.extorquens发酵过程或者摇瓶培养过程中甲醇体积分数均不高于1%(7.94 g/L)。从工业应用的角度来看,PHB作为大宗化学品,提高总产量和单位时间产量是关键,除了要解决工程菌株代谢平衡的问题,提高菌株耐受甲醇的能力也十分重要。
日本名古屋大学的Suzuki教授对高密度发酵产PHB的研究最为充分,他们的研究获得了最高的生物量,具有重要的参考价值[24]。他们根据细胞生长和产PHB的过程曲线,将发酵分为2个阶段,分别为细胞生长阶段和产PHB阶段,研究了氮源补料的两种策略。细胞生长阶段通过氨水来控制的pH,当细胞质量浓度达到60 g/L,细胞进入产PHB阶段后,采取2种策略:①停止补加氨水并且不再流加任何氮源;②氨水进入恒速补料模式:0.52、0.26、0.08和0.02 g/h的补料速率。在2种补氮方式中,微量元素与氨水同时流加。结果发现:在PHB生产阶段,添加少量氮源比不添加氮源更有利于积累PHB,但添加过量的氮源会导致细胞中的PHB降解。方式①在175 h达到136 g/L的PHB产量,得率为0.18 g/g;在90 h时,PHB占细胞干质量的60%。方式②中,氨水流加速率为0.08 g/h时,在58 h,PHB就占细胞干质量的60%,在100 h,细胞干质量达到200 g/L,但方式②也有一些问题,比如氨水恒速流加导致氨水过量对细胞造成毒害。1986年,Suzuki等[25]用第2种氮源流加方式,研究补料液中的碳氮比(C/N比)为750、100、125、163、213和250时对PHB产量的影响。首先将补料C/N比与单位细胞中PHB的含量进行线性拟合,然后将单位细胞中PHB的含量与尾气中的CO2含量进行线性拟合,实现通过检测尾气中CO2浓度自动控制补料液中的C/N比来达到更高的PHB产量。当发酵121 h,在C/N比为100的条件下,PHB产量达到136 g/L,延长培养时间为170 h,PHB产量达到149 g/L,细胞干质量达到233 g/L,细胞中PHB含量为64%,产物得率为0.2 g/g。研究还发现,通过C/N比可以控制PHB在细胞中的含量,PHB的比生成速率以及微生物的代谢能够维持在较高的水平。
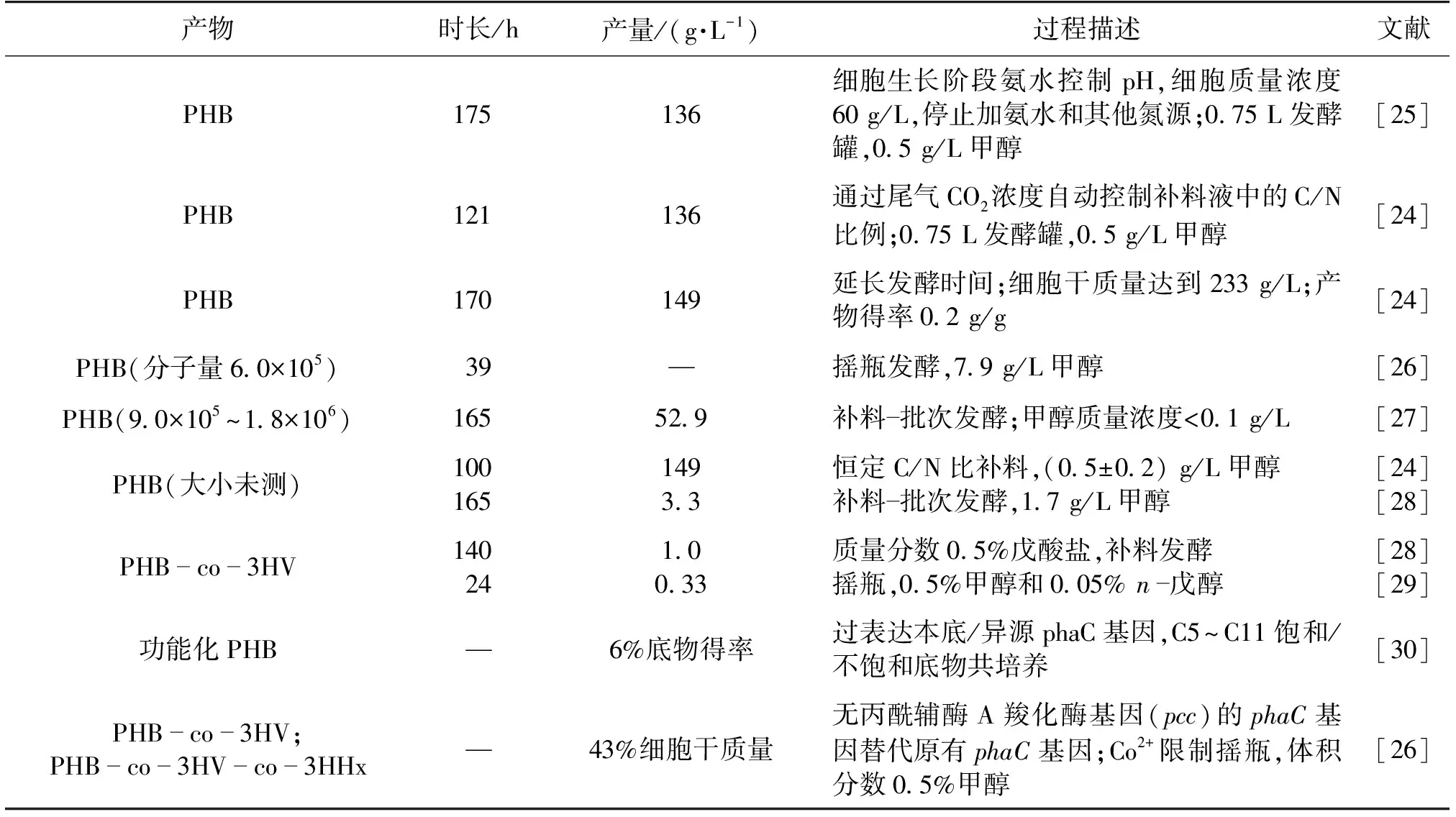
表2 利用M. extorquens 生产PHB情况
由于纯的PHB结晶度较高,刚性和脆性存在不足,通过将PHB与羟基烷酸酯或其他单体共聚生成功能型PHB来改善纯PHB的机械性能。培养基中添加戊酸酯、正戊醇[28-29]、饱和/非饱和羧酸[27]等底物就能利用合成功能型PHB。但通过外源添加辅助底物会增加经济成本。因此,在2014年,Orita等[20]通过代谢网络改造菌株,不需添加其他底物,仅利用甲醇就能生产功能型 PHB,大大节约成本,但目前菌株产量比较低,还需进一步改进。
2.2 基于丝氨酸循环及EMC循环的化学品合成
丝氨酸循环和EMC循环,它们拥有部分相同代谢途径,使得这两个循环之间构成了相互联系的代谢循环网络,而这样的代谢网络是M.extorquensAM1菌株能够更好地利用甲醇作为碳源进行正常生长代谢和生产高附加值产品的重要基础。丝氨酸循环途径是M.extorquensAM1在代谢中重要的中心代谢途径,存在于各中心代谢途径的交汇处,同时它在代谢中拥有同化途径的大部分碳流。2009年,Peyraud等[31]通过13C代谢组学分析首次发现AM1含有EMC循环,EMC循环的碳流丰富,约占细胞总碳流的1/4,该循环含有多个分支,包括饱和/不饱和的化合物,手性的C4和C5-酰基辅酶A酯等,使得AM1具有生产特殊化合物的潜能,能够合成相应的二元羧酸,如乙基丙二酸、(2S)-甲基丁二酸、甲基延胡索酸和(2R/2S)-甲基丙二酸等[31]。表3为研究者们利用M.extorquensAM1丝氨酸循环和EMC循环表达外源产物的研究结果总结。

表3 利用M. extorquensAM1丝氨酸及EMC循环表达外源产物
最近几年M.extorquensAM1的应用研究主要集中在EMC途径辅酶A衍生物的合成。EMC循环途径是辅酶A代谢物的途径,包含了从二碳到五碳的辅酶A物质,这些辅酶A物质是萜类化合物、生物燃料、生物塑料、生物医药等的前体物质,具有非常大的开发价值。Sonntag等[22]研究发现了大肠杆菌的酰基辅酶A硫酯酶YciA可切割Mesaconyl-CoA和(2S)-Methylsuccinyl-CoA的辅酶A,生成新的物质中康酸酯和2-甲基琥珀酸[22]。随着方法技术和操作工具的不断完善,对M.extorquensAM1的改造手段也越来越丰富。Hu等研究者在M.extorquensAM1中构建异源1-丁醇合成途径,并利用基因过表达和基因敲除技术提高1-丁醇产量。Sonntag等[23]在M.extorquensAM1中构建异源蛇麻烯合成途径,利用基因过表达和核糖体结合位点(RBS)工程方法调节酶的表达生产蛇麻烯。笔者所在课题组的Zhu等[33]研究者在M.extorquensAM1中构建异源甲羟戊酸上游合成途径,利用基因过表达、基因筛选和RBS工程方法优化酶的表达生产甲羟戊酸,并利用代谢组学方法找到途径的限速步。由表3可知:目前尝试利用EMC循环表达外源产物还处于摇瓶水平,仅Schrader课题组达到了30 g/L的细胞密度,但Sonntag等[23]使用MP培养基中大量添加价格昂贵的哌嗪-1,4-二乙磺酸(PIPES)作为缓冲液,难以用于工业应用。崔兰玉等[34]通过培养基组分的优化,得到了既能够满足M.extorquensAM1菌体稳定生长,同时又降低了成本的MC培养基,为以后M.extorquensAM1能够利用低成本的培养基进行高附加值的产品的生产研究提供了更有利的方法。
2.3 氨基酸以及蛋白质生产
AM1的丝氨酸循环,占细胞大部分碳流[30],提供了从廉价甲醇来生产丝氨酸的可能性。Sirriote等[33]进行了利用冻融的AM1细胞产丝氨酸的尝试,冻融后的细胞膜呈多孔的结构,有利于丝氨酸分泌到胞外,控制甲醇质量浓度在104 mg/mL,使细胞处于静息状态,抑制丝氨酸消耗,丝氨酸终产量达到54.9 g/L[33]。重组(异源)蛋白包括医药蛋白和工业酶制剂,占据着数十亿美元的市场份额,目前医药蛋白生产的主要宿主是大肠杆菌和毕赤酵母。许多研究者尝试利用AM1表达外源蛋白,见表4。
以AM1作为宿主进行产4种蛋白的尝试,也仍处于摇瓶培养阶段。绿色荧光蛋白(GFP)产量最高,达到14 g/L,占细胞干质量的16%。大肠杆菌和毕赤酵母表达异源蛋白的产量已经超过5 g/L,超过细胞干质量的50%[40]。虽然AM1蛋白表达量低,而且缺少蛋白质转录后的修饰机制,但相对于毕赤酵母,AM1具有更高的细胞得率,培养初期以甲醇作为唯一碳源,控制过程也相对简单,将来调整AM1的蛋白分泌机制,提高蛋白产量,会是一个很有前景的研究方向。
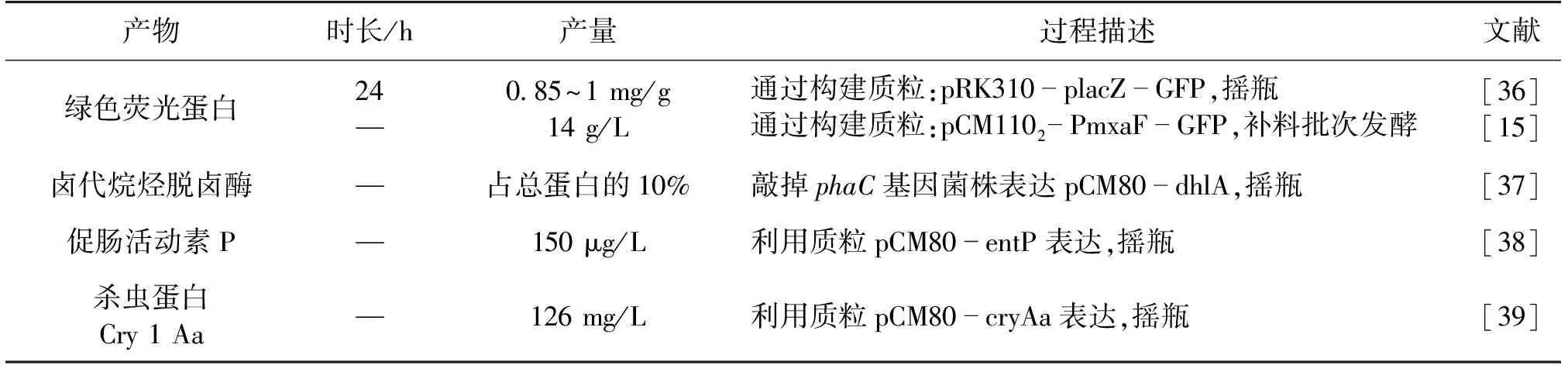
表4 利用M.extorquens AM1表达外源蛋白
3 存在问题与挑战
微生物细胞工厂在生产生物产品方面已经成为了不可取代的重要平台,已经生产了多种有价值的高附加值产品。通过途径工程的手段来改造微生物细胞的方法,使得微生物细胞工厂能生产出更多自身本不能合成的产品。M.extorquensAM1能以甲醇作为碳源进行生长代谢,是甲醇基微生物细胞工厂的重要宿主菌。利用M.extorquensAM1为宿主菌来生产高附加值产品是研究甲基菌的重要方向。扭脱甲基杆菌经过多位研究者50多年的研究,它的生理生化特性被研究透彻。随着生物技术的发展以及对该菌认知的积累,M.extorquensAM1的基础研究工作得到快速发展,尤其是组学方面的研究取得了一系列的突破进展。这些组学研究让我们对M.extorquensAM1有了深入的理解,为工程化改造菌株生产高附加值产品提供了重要的指导。总的来说,早期M.extorquensAM1的应用案例都是基于发酵调控策略或简单的基因过表达,但在2014年之后,随着组学研究的不断深入和基因操作工具的不断丰富,对M.extorquensAM1的改造涉及多层次的基因水平调控,产品种类开始多样化,作为碳一微生物细胞工厂逐渐受到广泛关注。
然而,甲醇作为底物仍然面临两个重要挑战:一个是发酵过程中高耗氧、高产热的问题。另一个是甲醇的细胞毒性,工业生产中需要严格控制甲醇浓度,不利于发酵过程的放大。关于第一个问题,是底物本身存在的缺陷,这一缺陷在高密度培养中会更加明显,解决高耗氧过程中氧传递是这一过程的关键因素。关于第二个问题,目前仅有AM1耐受丁醇的报道[39],且发现K+/质子泵对丁醇的耐受性至关重要。关于AM1甲醇耐受性的研究非常少,其耐受甲醇机理尚不清楚,如何获得高耐受甲醇的菌株对工业生产和解析甲基菌耐受甲醇的机理都非常重要。
目前,大多数微生物只能利用甲醇作为底物来生产少量的高附加值产品,远远达不到以甲醇为底物大规模生产高附加值产品的工业化规模的要求。到现在为止,只有英国帝国化学工业集团(ICI)以甲醇作为碳源,利用亲甲醇嗜热假单胞菌(Methylophilusmethylotrophus)生产单细胞蛋白实现了工业化生产。在工业化规模高密度培养过程中,传热和传氧会成为限制性因素。由于甲醇的还原态低于葡萄糖,单位氧气的产物得率比葡萄糖低2~3倍,氧化1 g甲醇需要消耗更多的氧气(0.85 g)。高耗氧也意味着高产热,对设备的冷却能力要求更高,运行成本也相对增加,特别是在高密度培养的工业化规模中,这种缺点会更加明显。同时,由于基因操作工具的匮乏,导致甲基营养菌只能以生产单细胞蛋白为主。
相对糖基底物与人争粮的问题,甲醇作为工业产品,不受价格调控、不受进口限制、来源广泛等优点,使得其作为一种有前景的可替代碳源成为可能。甲醇基生物合成是以甲醇作为碳源,利用甲醇营养型微生物代谢合成多种化合物的过程。而利用扭脱甲基杆菌AM1作为宿主菌来生产高附加值产品是一种很有前景的生产方式。随着对扭脱甲基杆菌AM1研究的深入,各种基因操作方法建立起来,AM1已经成为研究甲基营养菌的模式菌株。希望随着各种基因操作方法建立,更多的微生物能够参与到以甲醇为底物的工业化生产高附加值产品中来,促进甲醇基生物工业的快速发展。
[1] MOGRENH.SCP from methanol:the nonprotein process[J].Process Biochem,1979,14:2-7.
[2] SHAY L K,HUNT H R,WEGNER GH.High-productivity fermentation process for cultivating industrial microorganisms[J].J Ind Microbiol,1987,2(2):79-85.
[3] KIM S W,KIM P,LEE H S,et al.High production of poly-β-hydroxybutyrate (PHB) fromMethylobacteriumorganophilumunder potassium limitation[J].Biotechnol Lett,1996,18(1):25-30.
[4] SÖHNGEN N L.Uber Bakterien,welche methan ab kohlenstoffnahrung und energiequelle gerbrauchen[J].Z Parasitenkd,1906,15:513-517.
[5] KIM P,KIM J H,OH D K.Improvement in cell yield ofMethylobacteriumsp.by reducing the inhibition of medium components for poly-β-hydroxybutyrate production[J].World J Microbiol Biotechnol,2003,19(4):357-361.
[6] HANSON R S,HANSON T E.Methanotrophic bacteria[J].Microbiol Rev,1996,60(2):439-471.
[7] LIDSTROM M E.Proteobacteria:alpha and beta subclasses[M].New York:Springer,2006:618-634.
[8] PEEL D,QUAYLE J R.Microbial growth on C1 compounds 1 isolation andcharacterization ofPseudomonasAM1[J].Biochem J,1961,81(3):465-469.
[9] KALYUZHNAYA M G,PURIB A W,LIDSTROM M E.Metabolic engineering in methanotrophic bacteria[J].Metab Eng,2015,29:142-152.
[10] CHAO H J,SONG X P,SUN J H,et al.Advances in methylotrophy[J].J Microbiol,2009,36(11):1727-1737.
[11] EGLI T,LINDLEY N D.Mitochondrial activities in the methylotrophic yeastKloeckerasp.2201 during growth with glucose and/or methanol[J].J Genet Microbiol,1984,130(12):3239-3249.
[12] DIJKHUIZEN L,HANSENT A,HARDER W.Methanol,a potential feedstock for biotechnological processes[J].Trends Biotechnol,1985,3(10):262-267.
[13] SCHRADER J,SCHILLING M,HOLTMANN D,et al.Methanol-based industrial biotechnology:current status and future perspectives of methylotrophic bacteria[J].Cell,2008,27(2):107-115.
[14] RABERT C,WEINACKER D.Recombinants proteins for industrial uses:utilization ofPichiapastorisexpression system[J].Braz J Microbiol,2013,44(2):351-356.
[15] BÉLANGER L,FIGUEIRA M M,BOURQUE D,et al.Production of heterologous protein byMethylobacteriumextorquensin high cell density fermentation[J].FEMS Microbiol Lett,2004,231(2):197-204.
[16] CRÉMIEUX A,CHEVALIER J,COMBET M,et al.Mixed culture of bacteria utilizing methanol for growth:I.isolation and identification[J].Eur J Appl Microbiol,1977,4(1):1-9.
[17] GUO X,LIDSTROM M E.Metabolite profiling analysis ofMethylobacteriumextorquensAM1 by comprehensive two-dimensional gas chromatography coupled with time-of-flight mass spectrometry[J].Biotechnol Bioeng,2008,99(4):929-940.
[18] VUILLEUMIER S,CHISTOSERDOVA L,LEE M C,et al.Methylobacterium genome sequences:a reference blueprint to investigate microbial metabolism of C1 compounds from natural and industrial sources[J].PLoS ONE,2009,4(5):e5584.
[19] PEYRAUD R,SCHNEIDER K,KIEFER P,et al.Genome-scale reconstruction and system level investigation of the metabolic network ofMethylobacteriumextorquensAM1[J].BMC Syst Biol,2011,5(1):1-22.
[20] ORITA I,NISHIKAWA K,NAKAMURA S,et al.Biosynthesis of polyhydroxyalkanoate copolymers from methanol byMethylobacteriumextorquensAM1 and the engineered strains under cobalt-deficient conditions[J].Appl Microbiol Biotechnol,2014,98(8):3715-3725.
[21] HU B,LIDSTROM M E.Metabolic engineering ofMethylobacteriumextorquensAM1 for 1-butanol production[J].Biotechnol Biofuels,2014,7(1):1-10.
[22] SONNTAG F,BUCHHAUPT M,SCHRADER J.Thioesterases for ethylmalonyl-CoA pathway derived dicarboxylic acid production inMethylobacteriumextorquensAM1[J].Appl Microbiol Biotechnol,2014,98(10):4533-4544.
[23] SONNTAG F,KRONER C,LUBUTA P,et al.EngineeringMethylobacteriumextorquensfor de novo synthesis of the sesquiterpenoidα-humulene from methanol[J].Metab Eng,2015,32:82-94.
[24] SUZUKI T,YAMANE T,SHIMIZU S.Mass production of poly-p-hydroxybutyric acid by fed-batch culture with controlled carbon/nitrogen feeding[J].Appl Microbiol Biotechnol,1986,24(5):370-374.
[25] SUZUKI T,YAMANE T,SHIMIZU S.Kinetics and effect of nitrogen source feeding on production of poly-p-hydroxybutyric acid by fed-batch culture[J].Appl Microbiol Biotechnol,1986,24(5):366-369.
[26] TAIDI B,ANDERSON A J,DAWES E,et al.Effect of carbon source and concentration on the molecular mass of poly(3-hydroxybutyrate) produced byMethylobacteriumextorquensandAlcaligeneseutrophus[J].Appl Microbiol Biotechnol,1994,40(6):786-790.
[27] BOURQUE D,POMERLEAU Y,GROLEAU D.High-cell-density production of poly-hydroxybutyrate (PHB) from methanol byMethylobacteriumextorquens:production of high-molecular-mass PHB[J].Appl Microbiol Biotechnol,1995,44(3/4):367-376.
[28] BOURQUE D,OUELLETTE B,ANDRE G,et al.Production of poly-β-hydroxybutyrate from methanol:characterization of a new isolate ofMethylobacteriumextorquens[J].Appl Microbiol Biotechnol,1992,37(1):7-12.
[29] UEDA S,MATSUMOTO S,TAKAGI A,et al.Synthesis of poly(3-hydroxybutyrate-co-3-hydroxyvalerate) from methanol andn-amyl alcohol by the methylotrophic bacteriaParacoccusdenitrificansandMethylobacteriumextorquens[J].Appl Environ Microbiol,1992,58(11):3574-3579.
[30] PEYRAUD R,KIEFER P,CHRISTEN P,et al.Demonstration of the ethylmalonyl-CoA pathway by using13C metabolomics[J].Proc Natl Acad Sci USA,2009,106(12):4846-4851.
[31] ALBERB E.Biotechnological potential of the ethylmalonyl-CoA pathway[J].Appl Microbiol Biotechnol,2011,89(1):17-25.
[32] LIANG W F,CUI L Y,CUI J Y,et al. Biosensor-assisted transcriptional regulator engineering forMethylobacteriumextorquensAM1 to improve mevalonate synthesis by increasing the acetyl-CoA supply[J]. Metab Eng,2017,39:159-168.
[33] ZHU W L,CUI J Y,CUI L Y,et al. Bioconversion of methanol to value-added mevalonate by engineeredMethylobacteriumextorquensAM1 containing an optimized mevalonate pathway[J]. Appl Microbiol Biotechnol,2016,100(5): 2171-2182.
[34] CUI L Y,LIANG W F,ZHU W L,et al. Medium redesign for stable cultivation and high production of mevalonate by recombinantMethtylobacteriumextorquensAM1 with mevalonate synthetic pathway[J]. Biochem Eng J,2017,119: 67-73.
[35] SIRIROTE P,YAMANE T S S.Production of L-serine from methanol and glycine by resting cells of a methylotroph under automatically controlled conditions[J].J Ferment Technol,1986,64:389-396.
[36] FIGUEIRA M M,LARAMÉE L,MURRELL J C,et al.Production of green fluorescent protein by the methylotrophic bacteriumMethylobacteriumextorquens[J].FEMS Microbiol Lett,2000,193(2):195-200.
[37] FITZGERALD K A,LIDSTROM M E.Overexpression of a heterologous protein,haloalkane dehalogenase,in a poly-β-hydroxybutyrate-deficient strain of the facultative methylotrophMethylobacteriumextorquensAM1[J].Biotechnol Bioeng,2003,81(3):263-268.
[38] GUTIÉRREZ J,BOURQUE D,CRIADO R S,et al.Heterologous extracellular production of enterocin P fromEnterococcusfaeciumP13 in the methylotrophic bacteriumMethylobacteriumextorquens[J].FEMS Microbiol Lett,2005,248(1):125-131.
[39] CHOI Y J,GRINGORTEN J L,BELANGER L,et al.Production of an insecticidal crystal protein fromBacillusthuringiensisby the methylotrophMethylobacteriumextorquens[J].Appl Environ Microbiol,2008,74(16):5178-5182.
[40] MACAULEY-PATRICK S,FAZENDA M L,MCNEIL B,et al.Heterologous protein production using thePichiapastorisexpression system[J].Yeast,2005,22(4):249-270.
[41] HU B,YANG Y M,BECKD A C,et al.Comprehensive molecular characterization ofMethylobacteriumextorquensAM1 adapted for 1-butanol tolerance[J].Biotechnol Biofuels,2016,99(1):1-14.
(责任编辑 管珺)
Progressinbioprocessingofvalue-addedmethanolproduct
WANG Shanshan1,CUI Lanyu2,XUE Zhenglian1,ZHANG Chong2,XING Xinhui2
(1. College of Biologicol and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China; 2. Key Laboratory of Industrial Biocatalysis of Ministry of Education,Institute of Biochemical Engineering, Department of Chemical Engineering,Tsinghua University,Beijing 100084,China;3. Center for Synthetic & System Biology,Tsinghua University,Beijing 100084,China)
Methanol as an important feedstock for one-carbon industry,can be produced from methane,syngas and carbon dioxide.Because of good availability of raw materials,low risk of contamination during the fermentation process,and compatibility with synthetic media,bio-fermentation with methanol as carbon source can significantly reduce production cost and simplify product down-streamprocessing,henceMethylobacteriumextorquensAM1 has been widely applied in biochemical engineering.For example,fermentation with methanol as carbon source,M.extorquensAM1 has been demonstrated as a successful approach to achieve the industrialization of single-cell protein production.With the development of molecular biology methods,microbial cell factory with methanol as the feedstock is expected to expand its value-added product spectrum.In this article,we reviewed the recent advances in bioprocessing of methanol-based value-added product byM.extorquensAM1 to enlighten the methanol-based bioindustry.
methanol; biochemical industry; high value-added products;MethylobacteriumextorquensAM1
10.3969/j.issn.1672-3678.2017.06.004
2017-09-17
国家自然科学基金(21376137)
王山山(1991—),男,安徽滁州人,研究方向:工业微生物育种;张 翀(联系人)副教授,E-mail:chongzhang@mail.thu.edu.cn;薛正莲(联系人)教授,xuezhen0851@sina.com
Q93
A
1672-3678(2017)06-0026-08
