HDAC1基因沉默的hUC-MSCs移植对创伤性脑损伤小鼠的神经保护作用*
2017-12-06马珊珊黄团结刘雯雯刘艳霞关方霞
许 玲,邢 衢,马珊珊#,程 田,杨 璐,黄团结,程 康,刘雯雯,刘艳霞,李 鹏,关方霞
HDAC1基因沉默的hUC-MSCs移植对创伤性脑损伤小鼠的神经保护作用*
许 玲1),邢 衢1),马珊珊1)#,程 田1),杨 璐1),黄团结1),程 康1),刘雯雯1),刘艳霞1),李 鹏1),关方霞1,2)#
HDAC1;基因沉默;hUC-MSC;创伤性脑损伤;小鼠;神经保护
目的:观察组蛋白去乙酰化酶1(HDAC1)基因沉默的人脐带间充质干细胞(hUC-MSCs)静脉移植对创伤性脑损伤小鼠神经功能恢复的影响。方法80只健康成年C57BL/6小鼠,利用立体定位仪和颅脑打击器制作中度脑损伤模型,分为Sham组、Vehicle组、hUC-MSCs移植组和联合组(n=20)。移植后第1、3、7、14、21和28天,采用改良神经功能损伤评分系统评价小鼠神经功能恢复情况;通过Morris水迷宫实验、挂线实验、新物体识别实验评价小鼠长期运动及认知功能。结晶紫染色评估小鼠的脑损伤体积和观察海马CA3区神经元形态学改变;湿重法检测脑含水量;伊文斯蓝染色检测血脑屏障的开放程度。结果与Vehicle组相比,hUC-MSCs移植组和联合组小鼠神经功能损伤评分降低,水迷宫实验中逃避潜伏期增加、穿越平台次数及在平台象限停留时间增加,挂线时间和辨别指数增加,其中联合组各指标均有明显改善(P<0.05)。与hUC-MSCs移植组相比,联合组小鼠脑损伤体积减少、脑含水量降低、血脑屏障开放程度减轻(P<0.05),且海马CA3区神经元丢失减少。结论HDAC1基因沉默的hU-MSCs移植对创伤性脑损伤小鼠有较好的神经保护作用。
创伤性脑损伤(traumatic brain injury,TBI)是导致死亡和长期残疾的主要原因[1]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)在体内外环境诱导下,可向神经细胞分化,并已广泛应用于脑损伤、脊髓损伤等中枢神经疾病,但是损伤部位的微环境导致移植后干细胞的存活率低,成神经分化效果不理想[2-3]。表观遗传机制在疾病状态中的重要作用日益明显,在少突胶质细胞的早期分化阶段,组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)表达增加。另一方面,成熟的少突胶质细胞中HDAC1表达下降,这提示HDAC1在神经分化过程中发挥重要作用[4-5]。因此,该实验通过慢病毒介导的shRNA靶向干扰hUC-MSCs中的HDAC1基因沉默[6],观察HDAC1沉默的hUC-MSCs静脉移植TBI小鼠后能否发挥神经保护作用,促进神经功能恢复。
1 材料与方法
1.1实验材料hUC-MSCs由关方霞教授课题组前期冻存,DMEM/F12培养基购自宝信生物科技有限公司,胎牛血清购自美国Gemini公司,结晶紫、伊文斯蓝(EB)购自美国Sigma公司,其他试剂均为国产分析纯。
1.2动物模型的建立及分组80只健康成年C57BL/6小鼠,体重20~25 g,雌雄各半,购自北京维通利华实业有限公司[许可证号:SYXK(京)2006-0024]。使用100 g/L水合氯醛按5 mL/kg剂量进行腹腔注射,小鼠麻醉后利用立体定位仪和颅脑打击器制作中度脑损伤模型。采用随机数字表法分为Sham组、Vehicle组、hUC-MSCs移植组和联合组(即HDAC1基因沉默的hUC-MSCs移植组)(n=20,每组3只备用)。造模后6 h,hUC-MSCs移植组由尾静脉移植hUC-MSCs(1×106细胞/只);联合组由尾静脉移植HDAC1基因沉默的hUC-MSCs(1×106细胞/只)。
1.3神经功能评分脑损伤后第1、3、7、14、21和28天,每组10只小鼠,采用改良神经功能损伤评分(modified neurologic severity score,mNSS)系统进行评分并记录分值[7]。mNSS结果为0(正常)~18(最严重)分。
1.4Morris水迷宫实验脑损伤后第24天,每组8只小鼠,利用Morris水迷宫实验检测小鼠空间学习与记忆能力。水迷宫装置放在一个相对密闭、光照恒定的房间,由一台轨迹跟踪摄像机、摄像机相连的计算机和一个圆形水池(直径120 cm,深度60 cm,水深50 cm,水温22 ℃±2 ℃)组成。将圆形水池平均分为Ⅰ、Ⅱ、Ⅲ、Ⅳ象限,选取一个象限的中心,水下1 cm处放置直径15 cm圆台,首先让小鼠熟悉水迷宫环境,将小鼠背向平台、面向池壁分别从4个不同象限中间的入水点放入水池中,让其自由游泳,观察其90 s内能否达到平台,如果不能,则帮助其找到平台,让动物熟悉、记忆平台位置。然后记录小鼠从4个入水点到达平台的时间(逃避潜伏期)和其在正确平台象限停留的时间、穿越平台次数。
1.5挂线实验脑损伤后第27天,每组8只小鼠,具体操作方法如下:将1根金属线(直径1 mm,长55 cm)悬空固定于高于桌面50 cm处,将小鼠后肢用胶带固定(防止小鼠攀爬),前肢放置于金属线上,下面放置海绵垫子,防止小鼠摔伤,记录小鼠挂线时间。
1.6新物体识别实验脑损伤后第27天,每组8只小鼠,具体操作方法如下:将小鼠放置在一个50 cm×50 cm×25 cm不透明箱子中,进行环境适应10 min。24 h后,将2个相同体积、相同颜色的物体(4 cm×4 cm×4 cm红色立方体)放入箱子中,让小鼠探索10 min后放入原来的笼子。1 h后,将其中1个红色立方体用绿色的球形物体(直径4 cm)代替,再次将小鼠放置到此箱子中,让其探索5 min,期间应用录像机记录小鼠探索情况。此时红色立方体为旧物体,而绿色球形物体为新物体,在电脑上分析小鼠探索新旧物体所用时间,计算小鼠的辨别指数:辨别指数=探索新物体所用时间/(探索新物体所用时间+探索旧物体所用时间)×100%。
1.7脑含水量测定脑损伤后第3天,每组3只小鼠,采用干湿重法测定脑含水量。小鼠麻醉后,断头取损伤侧脑组织,快速称量,得到湿重。将脑组织放入100 ℃烤箱中,48 h后称量,得到干重。脑含水量=(湿重-干重)/湿重×100%。
1.8脑损伤体积测定脑损伤后第28天,每组3只小鼠,40 g/L多聚甲醛灌注后取脑组织并切片,厚度30 μm,进行结晶紫染色。使用Image J软件计算大脑损伤体积。
1.9损伤侧脑组织EB含量测定脑损伤后3天,每组3只小鼠,于尾静脉注射质量分数2% EB 0.1 mL,循环1 h后麻醉小鼠,灌注并断头取脑。取损伤侧脑组织加入1 mL甲酰胺,组织匀浆后60 ℃水浴孵育48 h,再将水浴后的上述溶液以1 000 r/min离心10 min后取上清液。用酶标仪在620 nm处检测其吸光度,计算小鼠脑组织EB含量,结果以每g脑组织中EB含量表示。
1.10统计学处理采用SPSS 19.0进行分析。不同组间Morris水迷宫实验、悬挂实验、新物体识别实验结果及脑损伤体积、脑含水量、EB含量的比较均采用单因素方差分析,两两比较采用LSD-t检验;不同组间mNSS的比较采用重复测量数据的方差分析。检验水准α=0.05。
2 结果
2.1各组小鼠神经功能评分的比较Sham组小鼠mNSS均为0分,其他各组小鼠均出现不同程度神经功能缺损,见表1。

表1 各组小鼠mNSS比较
F组间=2 705.490,F时间=94.570,F交互=18.170,P均<0.05;#:与Vehicle组相比,P<0.05;*:与hUC-MSCs移植组相比,P<0.05。
2.2各组小鼠学习记忆能力的比较结果见表2。
2.3各组小鼠挂线时间和辨别指数的比较结果见表3。
2.4各组小鼠脑含水量、损伤体积和EB含量的比较结果见图1、表4。Vehicle组海马CA3区海马锥体细胞稀疏,层次不清晰,神经元密度明显降低;联合组的神经元密度较Vehicle组明显增加。Sham组脑损伤体积为0,与hUC-MSCs移植组和Vehicle组相比,TBI后联合组小鼠的脑含水量、损伤体积、EB含量减少。
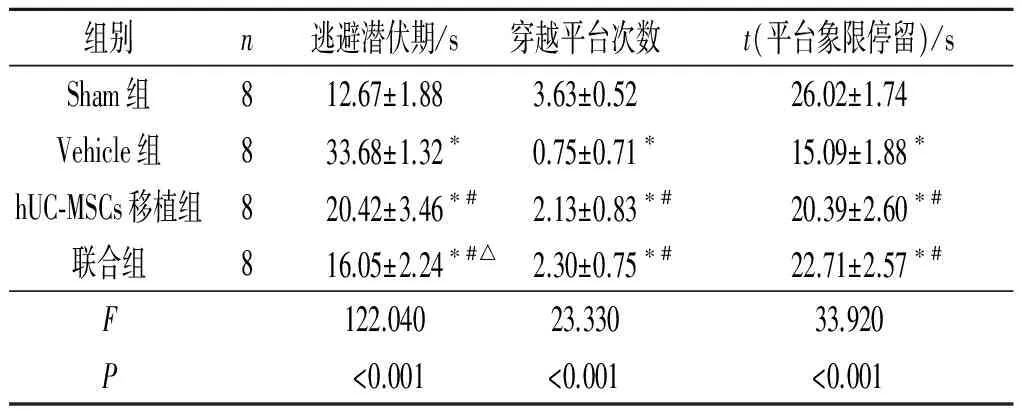
表2 各组小鼠水迷宫实验结果的比较
*:与Sham组相比,P<0.05;#:与Vehicle组相比,P<0.05;△:与hUC-MSCs移植组相比,P<0.05。
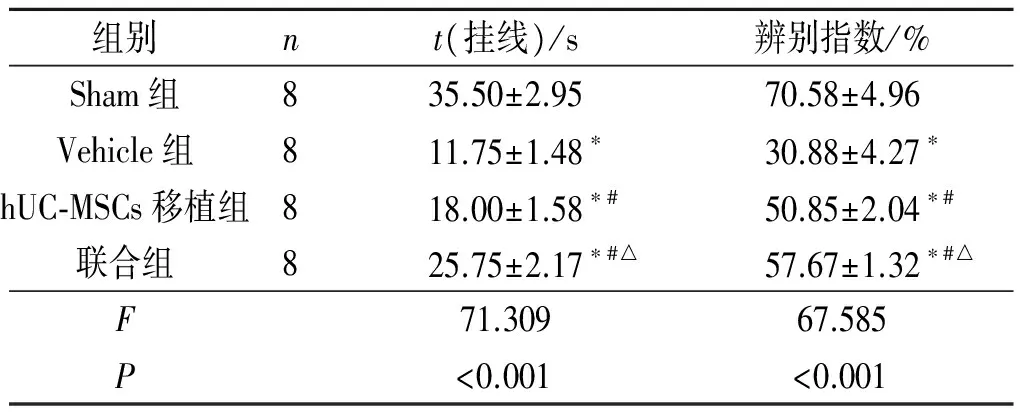
表3 各组小鼠挂线时间和辨别指数的比较
*:与Sham组相比,P<0.05;#:与Vehicle组相比,P<0.05;△:与hUC-MSCs移植组相比,P<0.05。

A:Sham组;B:Vehicle组;C:hUC-MSCs移植组;D:联合组。图1 各组小鼠损伤侧海马CA3区神经元形态学改变(结晶紫,×200)
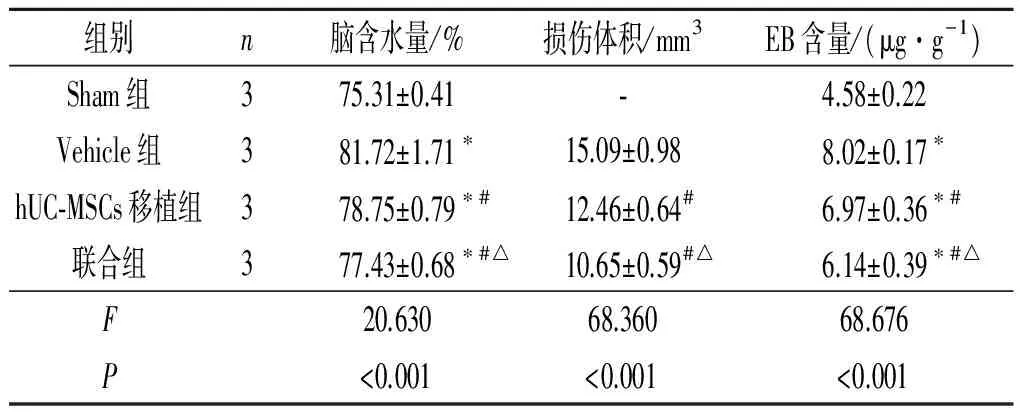
组别n脑含水量/%损伤体积/mm3EB含量/(μg·g-1)Sham组375.31±0.41⁃4.58±0.22Vehicle组381.72±1.71∗15.09±0.988.02±0.17∗hUC⁃MSCs移植组378.75±0.79∗#12.46±0.64#6.97±0.36∗#联合组377.43±0.68∗#△10.65±0.59#△6.14±0.39∗#△F20.63068.36068.676P<0.001<0.001<0.001
*:与Sham组相比,P<0.05;#:与Vehicle组相比,P<0.05;△:与hUC-MSCs移植组相比,P<0.05。
3 讨论
组蛋白乙酰化修饰在神经疾病的发生发展中发挥关键作用,多种疾病的发生伴随乙酰化水平的改变[8-9]。采用多种组蛋白去乙酰化酶抑制剂可以明显改善疾病症状,发挥神经修复作用[10-11]。Tubastatin A通过上调α-微管蛋白乙酰化水平和FGF-21的表达,减轻脑梗死,减少大鼠神经细胞死亡[10]。VPA可改善大鼠运动功能,减轻炎症,减少细胞凋亡[11]。但是目前国内外的组蛋白去乙酰化酶抑制剂多为广谱性、非特异性制剂,对不同HDAC亚型、不同的疾病作用靶点的认识仍不十分明确[12]。因此,靶向沉默HDAC1,不仅能促进干细胞在中枢神经系统疾病治疗中发挥作用,也可为设计特异性组蛋白去乙酰化酶抑制剂并应用于TBI治疗提供实验基础和理论依据。
脑损伤是一种严重的神经损伤疾病,主要表现为学习记忆功能减退、运动功能受损等。因此,损伤后的神经功能评价是神经修复的关键指标之一。该实验采用多种方法观察脑损伤小鼠的行为学变化。mNSS评价动物神经功能恢复情况,Morris水迷宫实验、挂线实验和新物体识别实验测试动物空间探索能力、运动及学习记忆能力。作者发现HDAC1基因沉默的hUC-MSCs移植脑损伤小鼠可以显著提高小鼠的运动、学习、记忆能力及改善情绪,说明HDAC1基因沉默的hUC-MSCs可以明显改善脑损伤小鼠的神经功能。
血脑屏障由许多细胞组成,在维持中枢神经系统的神经元代谢中共同发挥作用[13]。神经元、相关的神经胶质细胞和血脑屏障中的细胞共同构成“神经血管单元”[14]。TBI可能不仅仅损害神经元,而且可能损害星形胶质细胞、小胶质细胞、少突胶质细胞和脑血管内皮细胞,甚至整个“神经血管单元”[15]。TBI后会引起原发性损伤或继发性损伤。继发性损伤过程伴随着脑细胞代谢障碍、局部脑血流下降、脑水肿、颅内压增高、免疫系统激活和血脑屏障通透性增加等[16]。海马CA3区主要参与长期记忆的维持,TBI后CA1、CA3和齿状回等部位神经细胞丢失,突触传递功能障碍,造成认知和记忆功能障碍[17]。与行为学结果一致,组织学观察显示联合组在修复损伤、减少海马CA3区神经元丢失和限制血脑屏障开放程度方面都要优于hUC-MSCs移植组。
综上所述,HDAC1基因沉默的hUC-MSCs对损伤后的行为和认知功能具有多方面的改善作用,如改变血脑屏障通透性、减少海马CA3区神经元丢失,保护了大脑的完整性和神经功能,这可能是其发挥TBI保护作用的关键机制。
[1] 罗积慎,郝江,何毅,等.右美托咪啶在颅脑创伤应激控制中的作用及其对神经内分泌的影响[J].解放军医学杂志,2013,38(11):917
[2] JIN W,XU YP,YANG AH,et al.Invitroinduction and differentiation of umbilical cord mesenchymal stem cells into neuron-like cells by all-trans retinoic acid[J].Int J Ophthalmol,2015,8(2):250
[3] ARUTYUNYAN I,ELCHANINOV A,MAKAROV AA.Umbilical cord as prospective source for mesenchymal stem cell-based therapy[J].Stem Cells Int,2016,2016:6901286
[4] FELLING RJ,SONG H.Epigenetic mechanisms of neuroplasciticy and the implications for stroke recovery[J].Exp Neurol,2015,268:37
[5] KASSIS H,CHOPP M,LIU XS,et al.Histone deacetylase expression in white matter oligodendrocytes after stroke[J].Neurochem Int,2014,77:17
[6] 邢衢.慢病毒介导的HDAC1基因沉默对hUC-MSCs神经分化和TBI治疗的促进作用[D].郑州:郑州大学,2016.
[7] CHENG T,WANG W,LI Q,et al.Cerebroprotection of flavanol(-)-epicatechin after traumatic brain injury via Nrf2-dependent and -independent pathways[J].Free Radic Biol Med,2016,92:15
[8] MAHGOUB M,MONTEGGIA LM.A role for histone deacetylases in the cellular and behavioral mechanisms underlying learning and memory[J].Learn Mem,2014,21(10):564
[9] CHO Y,CAVALLI V.HDAC signaling in neuronal development and axon regeneration[J].Curr Opin Neurobiol,2014,27:118
[10]WANG Z,LENG Y,WANG J,et al.Tubastatin A, an HDAC6 inhibitor, alleviates stroke-induced brain infarction and functional deficits: potential roles of α-tubulin acetylation and FGF-21 up-regulation[J].Sci Rep,2016,6:19626
[11]TAI YT,LEE WY,LEE FP,et al.Low dose of valproate improves motor function after traumatic brain injury[J].Biomed Res Int,2014,2014:980657
[12]MOSER MA,HAGELKRUYS A,SEISER C.Transcription and beyond: the role of mammalian class Ⅰ lysine deacetylases[J].Chromosoma,2014,123(1/2):67
[13]CHOW BW,GU CH.The molecular constituents of the blood-brain barrier[J].Trends Neurosci,2015,38(10):598
[14]WHITTLE N,SINGEWALD N.HDAC inhibitors as cognitive enhancers in fear, anxiety and trauma therapy: where do we stand?[J].Biochem Soc Trans,2014,42(2):569
[15]BROWN JA,PENSABENE V,MARKOV DA,et al.Recreating blood-brain barrier physiology and structure on chip: a novel neurovascular microfluidic bioreactor[J].Biomicrofluidics,2015,9(5):054124
[16]TAO XG,SHI JH,HAO SY,et al.Protective effects of calpain inhibition on neurovascular unit injury through downregulating nuclear factor-κB-related inflammation during traumatic brain injury in mice[J].Chin Med J(Engl),2017,130(2):187
[17]MALIK SZ,MOTAMEDI S,ROYO NC,et al.Identification of potentially neuroprotective genes upregulated by neurotrophin treatment of CA3 neurons in the injured brain[J].J Neurotrauma,2011,28(3):415
(2017-03-31收稿 责任编辑姜春霞)
Neural protective effect of transplantation of hUC-MSCs with silenced HDAC1 in traumatic brain injury mice
XULing1),XINGQu1),MAShanshan1),CHENGTian1),YANGLu1),HUANGTuanjie1),CHENGKang1),LIUWenwen1),LIUYanxia1),LIPeng1),GUANFangxia1,2)
1)CollegeofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)StemCellLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
HDAC1;gene silencing;hUC-MSC;traumatic brain injury;mouse;neuroprotection
Aim: To evaluate whether transplantation of hUC-MSCs with silenced HDAC1 could facilitate recovery of nerve function in the mice model of traumatic brain injury.MethodsModerate traumatic brain injury mice models were made by the stereotaxic apparatus and modified weight-drop model. Eighty C57BL/6 mice were randomly allocated into four groups: Sham group, Vehicle group, hUC-MSCs group and Combination group(n=20). After brain injury, mice neurological function was evaluated by the modified neurological severity score on the 1st, 3rd, 7th, 14th, 21st and 28th day. The indexes of motor function and cognitive function were evaluatedviathe Morris water maze test, the tail suspension test and the novel object recognition, respectively. The size of cortical lesion and the morphological changes of neurons in hippocampal CA3 area were detected by crystal violet staining. Brain water content was measured with wet-dry weight formula. Blood brain barrier permeability was measured by Evans blue staining.ResultsCompared with Vehicle group, the modified neurological severity scores significantly decreased in hUC-MSCs group and Combination group, the escape latency distinctly reduced accompanied with a sharp increase in both the times of crossing the plat and the time in target quadrant, time of wire hanging and discrimination index were increased, especially in Combination group(P<0.05). The evaluating indexes in Combination group such as brain damage volume, brain water content,localized opening blood brain barrier and the loss of neurons in the hippocampal CA3 area were appreciably reduced(P<0.05).ConclusionTransplantation of hUC-MSCs with HDAC1 deficiency could provide a better neuroprotection in traumatic brain injury mice.
10.13705/j.issn.1671-6825.2017.06.009
*国家自然科学基金资助项目 U1404313,81471306,81601078;河南省高校科技创新团队基金资助项目 15IRTSTHN022;河南省科技创新人才计划基金资助项目 154200510008;河南省国际人才合作项目 2016GH03,2016GH15;河南省高等学校重点科研项目 17A310012
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院干细胞研究室 郑州 450052
#通信作者:关方霞,女,1969年2月生,博士,教授,研究方向:干细胞与再生医学,E-mail:guanfangxia@126.com;马珊珊,女,1984年5月生,博士,副教授,研究方向:干细胞与神经功能修复,E-mail:mashanshan84@163.com
R742
