长期乙醇暴露对大鼠肺组织中TREM-1/2通路表达的影响*
2017-12-06张伟宏徐高磊易诗琪张译铮沈建明杨静尘杨东斌
张伟宏,徐高磊,易诗琪,张译铮,沈建明,杨静尘,杨东斌
长期乙醇暴露对大鼠肺组织中TREM-1/2通路表达的影响*
张伟宏1,2),徐高磊3),易诗琪4),张译铮4),沈建明4),杨静尘4),杨东斌2)#
肺;乙醇;TREM-1;TREM-2
目的:探讨长期乙醇暴露对大鼠肺组织中TREM-1/2通路表达的影响。方法将40只SD大鼠随机分为2组。乙醇组按2.5 mL/(kg·d)的剂量灌胃体积分数20%的乙醇;对照组灌胃等量清水。4周后,运用免疫组化染色及Western blot技术检测大鼠肺组织中TREM-1、TREM-2及信号衔接蛋白DAP-12的表达。结果4周后,对照组大行动敏捷,食欲良好,无腹泻,体重增加明显;与对照组比较,乙醇组大鼠体重无明显增加,出现腹泻症状,大鼠肺组织中TREM-1表达下调,TREM-2和DAP-12表达上调(P<0.05)。结论长期乙醇暴露可能破坏大鼠肺巨噬细胞TREM-1/2通路的平衡,导致大鼠免疫力低下。
目前我国饮酒人数超过2亿。酗酒是一个严重的全球问题,每年酗酒致死的人数占全球死亡人数的3.8%[1]。单核巨噬细胞作为肺部抵御外界入侵的防线,在特异性和非特异性免疫中均起着重要作用。机体摄入的乙醇在代谢过程中会造成氧化负荷加重[2]、肺巨噬细胞内锌离子浓度减少[3]等现象,并通过一系列分子机制导致肺免疫功能受损。髓系细胞触发受体 (triggering receptor expressed on myeloid cells,TREM)是于2000年被发现的一个免疫球蛋白超家族受体,目前已证实有TREM-1、TREM-2和TREM-3[4]。TREM-1是IgG超家族的细胞膜受体,在肺组织里主要选择性表达于肺泡巨噬细胞表面。TREM-1活化可促使TNF-α、IL-1β等炎症因子释放[5],促进并扩大炎症反应[6]。TREM-2与TREM-1作用相反[7-9]。适配器DNAX激活蛋白12(DNAX-activation protein 12,DAP-12)是一种信号衔接蛋白,存在于巨噬细胞表面,通过与TREM-1及TREM-2结合,影响巨噬细胞的功能[10]。该实验拟采用长期乙醇暴露下的SD大鼠模型,研究乙醇暴露对肺巨噬细胞TREM-1/DAP-12、TREM-2/DAP-12信号通路的影响,从信号传导途径揭示乙醇诱导的肺免疫功能改变的分子机制,为进一步研究相关疾病的治疗提供实验依据。
1 材料与方法
1.1动物模型的建立和实验分组将健康成年SD大鼠(郑州大学实验动物中心)分区分笼饲养。所有动物均排除肺部和全身疾病,实验过程中维持标准化环境条件,动物饲以标准化颗粒饲料(郑州大学实验动物中心),可以自由进食、饮水,自然昼夜节律。选取成年大鼠40只,随机分为两组,每组20只。乙醇组以2.5 mL/(kg·d)的剂量灌胃体积分数20%的乙醇,持续4周;对照组给予清水。
1.2肺组织中TREM-1、TREM-2和DAP-12蛋白的Westernblot法检测山羊抗鼠TREM-1多克隆抗体(E-19)、山羊抗鼠TREM-2多克隆抗体(G-16)和山羊抗鼠DAP-12多克隆抗体(A-20)购自美国Santa Cruz公司。Western blot具体步骤:大鼠颈椎脱臼处死,迅速剥离肺组织,用匀浆器碾碎部分(n=12)组织,提取蛋白并测定蛋白浓度,然后进行电泳、转膜,封闭2 h后加入E-19(稀释度1500)、G-16(稀释度11 000)、A-20(稀释度1500)4 ℃孵育过夜,TBST振荡洗涤3×10 min,加入辣根过氧化物酶标记的抗鼠IgG二抗(稀释度11 000,碧云天公司)室温摇床孵育2 h,TBST振荡洗涤3×10 min,加入ECL试剂反应4 min,最后用X光胶片压片,显、定影后拍照并分析。以β-actin作为内参。以目的蛋白与内参条带灰度值的比值作为目的蛋白的表达水平。
1.3肺组织中TREM-1、TREM-2和DAP-12蛋白的免疫组化法检测另取适量的肺组织(n=20)于多聚甲醛中固定,石蜡包埋后切片,切片厚度 5~8 μm。脱蜡后,0.1 mol/L PBS漂洗3×5 min,体积分数3%过氧化氢封闭内源性过氧化物酶,蒸馏水洗2次,加入10 mmol/L枸橼酸钠缓冲液(pH 6.0)以修复抗原,PBS清洗,血清封闭,滴加E-19(稀释度1300)、G-16(稀释度1500)、A-20(稀释度1300)4 ℃过夜。PBS 冲洗,滴加生物素标记的二抗37 ℃孵育10~30 min,滴加辣根过氧化物酶标记的链霉卵白素(PBS 稀释)37 ℃孵育10~30 min, DAB显色,自来水充分冲洗,复染,封片。用Image J软件分析计算单位面积中的阳性细胞数。
1.4统计学处理采用SPSS 17.0进行数据处理,两组大鼠肺组织中TREM-1、TREM-2和DAP-12表达水平的比较采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1两组大鼠行为及外观的比较乙醇组大鼠体毛发黄、光泽不佳,动作迟缓,嗜睡,实验期间体重无明显增加,食量较小,出现腹泻症状。上述表现随实验时间越长而更为显著。对照组大鼠体毛光泽自然,行动敏捷,食欲良好,无腹泻,体重增加明显。
2.2两组大鼠肺组织中TREM-1、TREM-2和DAP-12蛋白的Westernblot法检测结果见图1、表1。Western blot结果显示,与对照组比较,乙醇组大鼠肺组织中TREM-1蛋白表达水平降低,TREM-2和DAP-12蛋白表达水平升高。
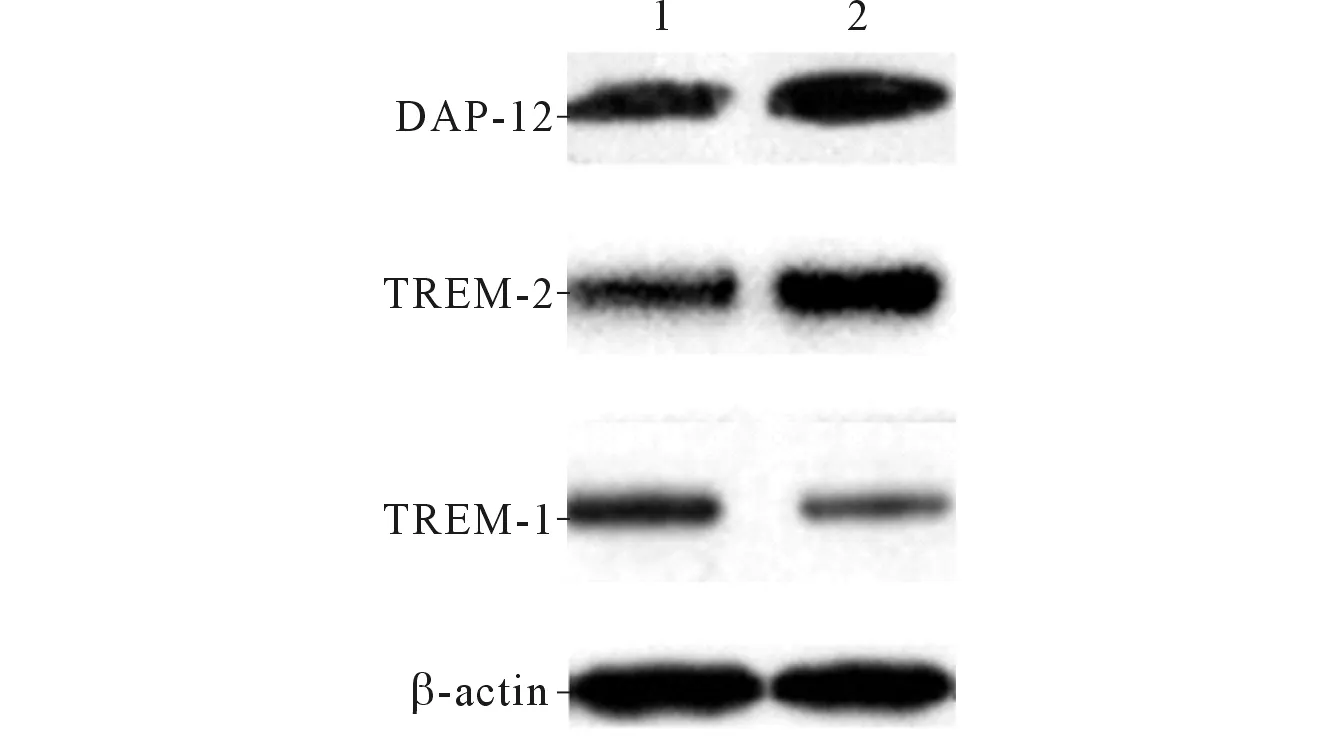
1:对照组;2:乙醇组。图1 两组大鼠肺组织中TREM-1、TREM-2和DAP-12蛋白的Western blot法检测

组别nTREM⁃1TREM⁃2DAP⁃12对照组120.59±0.060.50±0.100.71±0.06乙醇组120.28±0.070.97±0.071.07±0.11t8.0606.4504.590P<0.001<0.001<0.001
2.3两组大鼠肺组织中TREM-1、TREM-2和DAP-12蛋白的免疫组化检测结果免疫组化结果显示,TREM-1阳性细胞主要分布于肺泡壁间隙,肺泡腔内也可见少量阳性细胞;TREM-2阳性细胞主要分布于肺间质内;DAP-12蛋白表达呈阳性(图2)。与对照组比较,乙醇组TREM-1蛋白表达水平降低,TREM-2、DAP-12蛋白表达水平升高(表2)。

1:对照组;2:乙醇组;A:TREM-1;B:TREM-2;C:DAP-12。图2 两组大鼠肺组织中TREM-1、TREM-2和DAP-12蛋白的免疫组化法检测

表2 两组大鼠肺组织中TREM-1、TREM-2和DAP-12蛋白的免疫组化检测结果的比较个/mm2
3 讨论
TREM-1多在单核巨噬细胞表达,虽然其天然配体至今未知,但TREM-1激动性抗体诱导受体交联后,受体与DAP-12结合,可导致下游信号传导事件,包括磷脂酶、细胞外信号相关激酶(ERK)1/2磷酸化,以及细胞内钙离子浓度和促炎症细胞因子的分泌[11],放大炎症反应。与TREM-1相反,TREM-2通过TREM-2/DAP-12介导的信号传导通路,可活化免疫受体的酪氨酸残基,传递激活信号,从而激活一系列的细胞内酪氨酸蛋白磷酸化以及相关的酶促反应,影响巨噬细胞的活动,抑制TREM-1对炎症反应的促进作用。两者之间随着外界环境的变化,维持着一定的动态平衡,对机体的炎症反应及免疫能力起着重要的调节作用。
该研究结果显示,与对照组大鼠比较,乙醇组大鼠肺组织中TREM-1表达水平降低,而TREM-2和DAP-12表达水平显著升高,提示TREM-1与TREM-2之间的平衡被破坏,而这种失衡可能是大鼠免疫能力下降的关键因素。长期乙醇暴露条件下,大鼠肺组织中TREM-2与DAP-12水平升高,高水平的TREM-2通过与TREM-1竞争DAP-12,从而抑制细胞炎症因子的产生,减少肺部巨噬细胞的募集,致使肺部免疫力下降,一旦病原体等外来入侵物增加,机体就不能通过炎症反应来抵御外部入侵,导致肺部感染的发生[12]。
综上所述,长期乙醇暴露可使大鼠肺组织中TREM-1和TREM-2的表达失衡,从而导致大鼠的免疫调节网络产生缺陷,进而造成免疫功能下降,其具体机制值得进一步研究。
[1] REHM J,MATHERS C,POPOVA S,et al.Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders[J].Lancet,2009,373(9682):2223
[2] DHOUIB H,JALLOULI M,DRAIEF M,et al.Oxidative damage and histopathological changes in lung of rat chronically exposed to nicotine alone or associated to ethanol[J].Pathol Biol (Paris),2015,63(6):258
[3] MEHTA AJ,YELIGAR SM,ELON L,et al.Alcoholism causes alveolar macrophage zinc deficiency and immune dysfunction[J].AM J Respir Crit Care Med,2013,188(6):716
[4] CHEN LC,LASKIN JD,GORDON MK,et al.Regulation of TREM expression in hepatic macrophages and endothelial cells during acute endotoxemia[J].Exp Mol Pathol,2008,84(2):145
[5] BLEHARSKI JR,KIESSLER V,BUONSANTI C,et al.A role for tiggering receptor expressed on myeloid cells-1 in host defense during the early-induced and adaptive phases of the immune response[J].J Immunol,2003,170(7):3812
[6] BARUAH S,KECK K,VREMIDS M,et al.Identification of a novel splice variant isoform of TREM-1 in human neutrophil granules[J].J Immunol,2015,195(12):5725
[7] DUAN JX,SUN GY,ZHOU Y,et al.Effect of TREM-2 on the IL-10 and TNF-alpha expression of macrophage[J].Regul Pept,2012,177(1):S19
[8] PHONGSISAY V,IIZASA E,HARA HA.Evidence for TLR4 and FcR gamma-CARD9 activation by cholera toxin B subunit and its direct bindings to TREM2 and LMIR5 receptors[J].Mol Immunol,2015,66(2):463
[9] LIU D,DONG Y,LIU Z,et al.Impact of TREM-2 gene silencing on inflammatory response of endotoxin-induced acute lung injury in mice[J].Mol Cell Biochem,2014,394(1/2):155
[10]TAYLOR PR,MARTINEZ-POMARES L,STACEY M,et al.Macrophage receptors and immune recognition[J].Annu Rev Immunol,2005,23:901
[11]PANDUPUSPITASARI NS,KHAN FA,HUANG CJ,et al.Novel attributions of TREMs in immunity[J].Curr Issues Mol Biol,2016,20:47
[12]SANFILIPPO AM,FURUYA Y,ROBERTS S,et al.Allergic lung inflammation reduces tissue invasion and enhances survival from pulmonary pneumococcal infection in mice, which correlates with increased expression of transforming growth factor beta 1 and siglecF(low) alveolar macrophages[J].Infect Immun,2015,83(7):2976
(2017-03-22收稿 责任编辑王 曼)
Effect of long-term alcohol exposure on TREM-1/2 pathway expression in rat lung tissue
ZHANGWeihong1,2),XUGaolei3),YIShiqi4),ZHANGYizheng4),SHENJianming4),YANGJingchen4),YANGDongbin2)
1)SchoolofNursing,ZhengzhouUniversity,Zhengzhou450001 2)ThePeople'sHospitalofHebiCity,Hebi,Henan458030 3)DepartmentofHumanAnatomy,CollegeofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou450001 4)ClinicalMedicineCollege,ZhengzhouUniversity,Zhengzhou450052
lung;alcohol;TREM-1;TREM-2
Aim: To investigate the effect of long-term alcohol exposure on the expressions of TREM-1,TREM-2 and DAP-12 in rat lung tissue.MethodsForty SD rats were allocated into 2 groups randomly. The rats in alcohol group were lavagely given alcohol(volume fraction of 20%) at dose of 2.5 mL/(kg·d), and those in control group were given water. After four weeks, immunohistochemical staining and Western blot technique were used to detect the expressions of TREM-1,TREM-2 and DAP-12 in lung tissue.ResultsAfter 4 weeks, the control rats had agile action, good appetite, no diarrhea, and gained weight obviously. Compared with control group, the rats in alcohol group had no significant weight gain, and showed diarrhea symptoms, TREM-1 expression in rat lung tissue decreased, and TREM-2 and DAP-12 expressions increased(P<0.05).ConclusionLong-term alcohol exposure may destroy the balance of TREM-1/2 pathway, thereby cause low immunity.
10.13705/j.issn.1671-6825.2017.06.008
*国家自然科学基金资助项目 U1404814;河南省高校科技创新人才支持计划 17HASTIT048
1)郑州大学护理学院 郑州 450001 2)鹤壁市人民医院 河南鹤壁 458030 3)郑州大学基础医学院人体解剖学教研室 郑州 450001 4)郑州大学临床医学院 郑州 450052
#通信作者,男,1974年2月生,博士,在站博士后,研究方向:慢性病的基础与临床,E-mail:dongbinyang@126.com
R322.8
