支气管哮喘患者外周血单个核细胞TIPE2、TF的表达*
2017-12-06赵俊伟
时 光,赵俊伟,明 亮
支气管哮喘患者外周血单个核细胞TIPE2、TF的表达*
时 光,赵俊伟,明 亮#
支气管哮喘;肿瘤坏死因子-α诱导蛋白-8样因子-2;组织因子
目的:检测支气管哮喘患者外周血单个核细胞(PBMCs)肿瘤坏死因子-α诱导蛋白-8样因子-2(TIPE2)、组织因子(TF)表达水平及二者的相关性,并探讨二者与哮喘控制水平的相关性。方法108例哮喘患者根据哮喘控制水平分为未控制组53例,部分控制组55例,另选择同时期健康体检者51人(健康对照组)。Western blot 法检测3组患者PBMCs中TIPE2、TF的表达水平,Spearman秩相关分析二者的相关性,受试者工作曲线评估TIPE2和TF对支气管哮喘的诊断价值。结果与部分控制组和健康对照组相比,未控制组PBMCs中TIPE2表达水平降低(P<0.01);与健康对照组相比,部分控制组PBMCs中TIPE2表达水平降低(P<0.01)。与健康对照组相比,部分控制组和未控制组PBMCs中TF表达水平升高(P<0.01),而二组间差异无统计学意义(P>0.05)。哮喘患者PBMCs中TIPE2与TF的表达水平呈负相关(rS=-0.414,P<0.001)。以TIPE2<0.364、TF>0.354作为区分哮喘患者和健康者的依据,诊断哮喘的敏感度和特异度分别为68.4%、95.5%(TIPE2)和39.5%、100.0%(TF)。以TIPE2<0.115作为诊断哮喘未控制患者的依据,其敏感度为76.7%,特异度为100.0%。结论哮喘患者PBMCs中TIPE2表达水平降低,TF表达水平升高,二者呈负相关;TIPE2与哮喘控制水平相关。
支气管哮喘(简称哮喘)是由多种细胞(T淋巴细胞、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、巨噬细胞、中性粒细胞和上皮细胞)及细胞组分参与的慢性气道炎症性疾病。随着全球工业化和气候变化,哮喘发病率呈逐年上升的趋势[1]。哮喘气道炎症导致气流受限、气道高反应性和症状反复发作。其炎症过程中释放的炎性介质会损伤血管内皮细胞,启动机体外源性凝血途径促进血栓的形成,导致哮喘患者机体高凝状态[2]。而肺部血栓的形成会使哮喘进一步加重,并增加肺栓塞的风险[3]。2008年美国宾夕法尼亚大学Sun等首次在自身性脑脊髓炎患者中发现高表达的肿瘤坏死因子-α诱导蛋白-8样因子-2蛋白(tumour necrosis factor-α induced protein 8 like 2,TIPE2),其主要在免疫细胞如淋巴细胞和巨噬细胞表达,在调节免疫平衡和炎症反应方面发挥重要作用[4-5]。组织因子(tissue factor,TF)不仅是外源性凝血途径的关键因子,还是一种重要的促血管生成因子,通过促进支气管上皮细胞下血管生成,参与哮喘气道重塑[6]。炎症因子和凝血物质相互作用,共同促进哮喘病情的发生发展[7]。有学者[8]发现,TIPE2在儿童哮喘患者外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中表达下降,但其中的作用机制尚不明确。在脐静脉内皮细胞中,TIPE2可下调TF的表达[9],但在支气管哮喘中二者的关系尚不明确。该研究旨在探讨不同控制水平的哮喘患者PBMCs中TIPE2、TF的表达情况,并分析其在哮喘诊断中的价值,为诊断和治疗支气管哮喘提供新的思路。
1 对象与方法
1.1研究对象收集郑州大学第一附属医院2015年12月至2016年6月门诊及住院确诊的支气管哮喘患者108例,男55例,女53例,年龄35~65岁,平均53.8岁。支气管哮喘诊断符合2008年中华医学会制定的哮喘诊断标准和全球哮喘防治创议(GINA 2014版)的哮喘诊断标准,所有入组患者支气管舒张试验均为阴性。参照2008年中华医学会制定的哮喘诊断标准,根据哮喘控制水平将哮喘患者分为哮喘未控制组53例和部分控制组55例[10]。排除标准:排除肺栓塞、慢性支气管炎、肺结核、慢性阻塞性肺疾病及血液系统疾病的患者;其他过敏性疾病患者;肝脏功能异常的患者;近两个月内服用激素类药物患者。同时纳入同时期的健康体检者51人,男25人,女26人,年龄32~63岁,平均49.3岁。其纳入标准为:非吸烟者,无呼吸系统慢性疾病史,近两周无呼吸道感染史,无心、肺、脑及其他疾病,无过敏性疾病史。3组患者年龄、性别分布差异均无统计学意义(P>0.05)。所有入组研究对象均签署知情同意书。
1.2主要材料兔抗人TF单克隆抗体购自Abcam公司,兔抗人TIPE2多克隆抗体、鼠抗人β-actin单克隆抗体购自Proteintech公司,BCA蛋白检测试剂盒、蛋白裂解液购自碧云天公司。
1.3标本采集与PBMCs分离及蛋白样品制备所有研究对象均于入组次日上午8至9点采集静脉血2 mL,乙二胺四乙酸二钾抗凝,用Percoll 法分离PBMCs后,PBS洗涤3次,弃上清,加入蛋白裂解液,4 ℃裂解10 min后,加入5×Loading Buffer,100 ℃煮沸10 min,-20 ℃保存备用。
1.4Westernblot检测PBMCs中TIPE2、TF蛋白表达水平参照Zhu等[11]的方法。BCA法测定样品蛋白浓度,PBS调整浓度至0.5 g/L,每孔上样量10 μL。进行SDS-PAGE电泳,80 V恒压15 min,然后120 V恒压电泳至溴酚蓝刚跑出胶面终止电泳。按顺序放置胶、膜和滤纸,300 mA恒流、60 min转膜。用含50 g/L脱脂奶粉的Tris-HCl缓冲液浸泡PVDF膜,室温摇床封闭2 h。加一抗(β-actin按11 000稀释,TF和TIPE2按1500稀释),4 ℃孵育过夜。TBST充分洗涤PVDF膜3次,每次5 min,加二抗,浸泡PVDF膜,室温孵育2 h。ECL电化学发光曝光显影。以β-actin为内参,应用GelPro软件分析蛋白条带。
1.5统计学处理所有数据采用GraphPad Prism 5软件和MecCalc软件进行统计分析。采用单因素方差分析比较3组PBMCs中TIPE2和TF表达水平的差异,两两比较采用SNK-q检验。用Spearman法分析哮喘患者PBMCs中TIPE2和TF表达水平的关系。采用受试者工作曲线(ROC)分析TIPE2、TF对支气管哮喘的诊断价值。检验水准α=0.05。
2 结果
2.1各组PBMCs中TIPE2、TF蛋白表达情况与部分控制组和健康对照组相比,未控制组PBMCs中TIPE2表达水平降低(P<0.01);与健康对照组相比,部分控制组PBMCs中TIPE2表达水平降低(P<0.01)。与健康对照组相比,部分控制组和未控制组PBMCs中TF表达水平升高(P<0.01),而二组间差异无统计学意义(P>0.05)。见图1、表1。
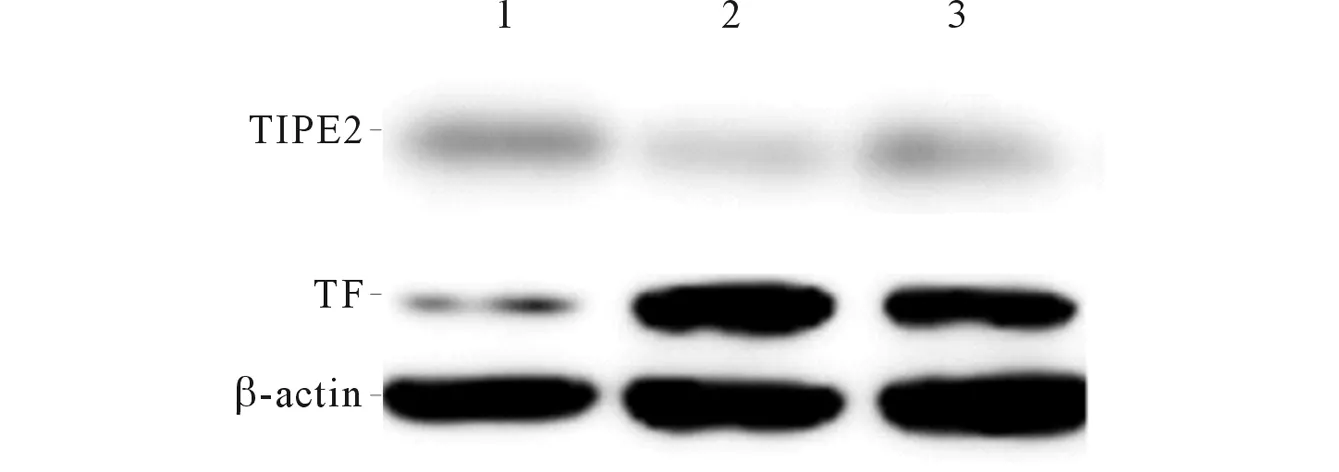
1:健康对照组;2:未控制组;3:部分控制组。图1 3组PBMCs中TIPE2、TF蛋白的表达
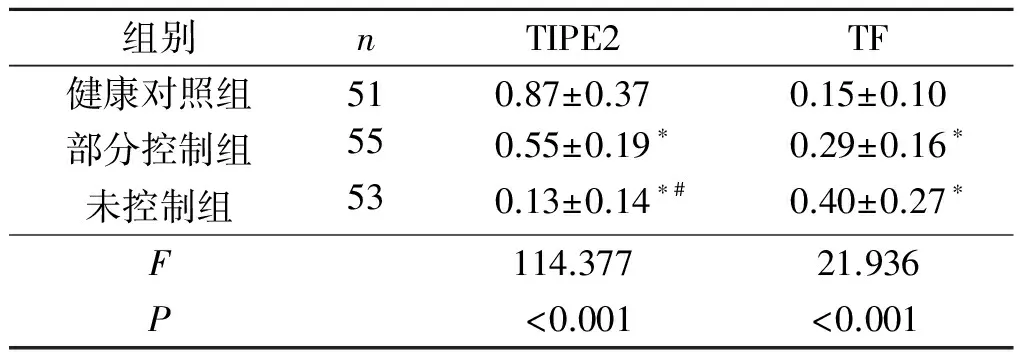
组别nTIPE2TF健康对照组510.87±0.370.15±0.10部分控制组550.55±0.19∗0.29±0.16∗未控制组530.13±0.14∗#0.40±0.27∗F114.37721.936P<0.001<0.001
*:与健康对照组比较,P<0.01;#:与部分控制组比较,P<0.01。
2.2哮喘患者PBMCs中TIPE2与TF蛋白表达水平的关系哮喘患者PBMCs中TIPE2蛋白与TF蛋白的表达水平呈负相关(rS=-0.414,P<0.001)。
2.3TIPE2、TF蛋白表达水平诊断支气管哮喘的ROC曲线及曲线下面积(AUC)分析根据ROC曲线评价TIPE2、TF诊断支气管哮喘患者的价值,其中TIPE2的AUC为0.876(95%CI=0.846~0.906);TF的AUC为0.722(95%CI=0.677~0.768)。根据约登指数最大原则计算TIPE2的临界值为0.364,TF的临界值为0.354,据此,TIPE2、TF蛋白表达水平诊断支气管哮喘的价值见表2。

表2 TIPE2、TF蛋白表达水平诊断支气管哮喘的价值 %
2.4TIPE2、TF蛋白表达水平诊断哮喘未控制患者的ROC曲线及AUC分析根据ROC曲线评价TIPE2、TF区分哮喘未控制患者和哮喘部分控制患者的价值,其中TIPE2的AUC为0.939(95%CI=0.912~0.915);TF的AUC为0.536(95%CI=0.469~0.603)。根据约登指数最大原则计算TIPE2的临界值为0.115,TF的临界值为0.424,据此,TIPE2、TF蛋白表达水平诊断哮喘未控制患者的价值见表3。

表3 TIPE2、TF蛋白表达水平诊断哮喘未控制患者的价值 %
3 讨论
TIPE2是一种新近发现的负性调节免疫平衡和炎症的蛋白分子[5]。TIPE2在多种炎症性和自身免疫性疾病中的作用研究较多。TIPE2-/-小鼠容易引发多种器官如肺部、肝脏、脾脏等的炎症[12]。有研究[13]表明,在乙型肝炎患者PBMCs中,TIPE2 mRNA表达水平下调,且TIPE2表达水平和血清ALT、AST、病毒载量呈负相关;此外,与野生型小鼠相比,TIPE2-/-小鼠表现为对乙肝病毒诱导炎症的高反应性。系统性红斑狼疮患者PBMCs中TIPE2 mRNA表达水平降低,且与SLE疾病活动度评分和抗黏液病毒蛋白MX1 mRNA水平呈负相关[14]。Ma等[8]研究表明,与健康对照者相比,哮喘儿童PBMCs中TIPE2 mRNA表达水平下降,并且和炎症因子血浆IgE、EO及IL-4水平呈负相关。该研究结果表明哮喘患者PBMCs中TIPE2、TF的表达与哮喘控制水平有关。健康对照组、部分控制组、未控制组PBMCs中TIPE2呈逐渐降低的趋势,表明TIPE2可能参与哮喘炎症性疾病的发病。
哮喘患者急性发作期缺氧可导致血管内皮细胞损伤,内皮细胞损伤可加重炎症反应,并且激活凝血系统导致血栓形成,而凝血系统的激活,又可加重炎症反应,导致内皮细胞损伤加重,三者相互交联、共同促进哮喘发生发展[2, 12, 15]。有研究[9]表明,脐静脉内皮细胞中TIPE2可下调TF的表达。该研究发现,与健康对照相比,哮喘患者PBMCs中TF表达水平升高,但是在不同控制水平的哮喘患者之间差异无统计学意义;TIPE2蛋白表达水平和TF表达水平呈负相关,其中的调节机制有待进一步探讨。
使用ROC曲线分析TIPE2和TF对支气管哮喘的诊断价值,发现TIPE2的AUC为0.876,高于TF的0.722,结合不同控制水平的哮喘患者PBMCs中TIPE2表达水平有差异,提示TIPE2诊断哮喘的价值高于TF。TIPE2的表达水平可反映哮喘病情严重程度、控制水平及用于哮喘治疗效果的评价,对诊断和治疗方案的选择具有重要应用价值。
综上所述,与健康对照者相比,哮喘患者PBMCs中TIPE2表达水平降低,TF表达水平升高,且二者呈负相关。不同控制水平哮喘患者PBMCs中TIPE2蛋白表达水平差异有统计学意义,而TF表达水平差异无统计学意义。TIPE2对支气管哮喘的诊断价值优于TF。研究存在不足之处为仅初步探讨TIPE2、TF与哮喘控制水平的关系,TIPE2通过何种途径参与哮喘病理机制,以及TIPE2与TF之间的信号调节通路,尚需要进一步研究。
[1] LEE YS,BAEK S,KO Y,et al.New scoring system for the differentiation of chronic obstructive pulmonary disease and asthma[J].Respirology,2015,20(4):626
[2] SNEEBOER MM,FENS N,VAN DE POL MA,et al.Loss of asthma control and activation of coagulation and fibrinolysis[J].Clin Exp Allergy,2016,46(3):422
[3] MAJOOR CJ,KAMPHUISEN PW,ZWINDERMAN AH,et al.Risk of deep vein thrombosis and pulmonary embolism in asthma[J].Eur Respir J,2013,42(3):655
[4] SUN HH,GONG SY,CARMODY RJ,et al.TIPE2, a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J].Cell,2008,133(3):415
[5] LOU YW,LIU SX.The TIPE (TNFAIP8) family in inflammation, immunity, and cancer[J].Mol Immunol,2011,49(1/2):4
[6] PARK JA,SHARIF AS,TSCHUMPERLIN DJ,et al.Tissue factor-bearing exosome secretion from human mechanically stimulated bronchial epithelial cells in vitro and in vivo[J].J Allergy Clin Immunol,2012,130(6):1375
[7] WITKOWSKI M,LANDMESSER U,RAUCH U.Tissue factor as a Link between inflammation and coagulation[J].Trends Cardiovasc Med,2016,26(4):297
[8] MA Y,LIU X,WEI Z,et al.The expression and significance of TIPE2 in peripheral blood mononuclear cells from asthmatic children[J].Scand J Immunol,2013,78(6):523
[9] 毛欣茹.TIPE2对脐静脉内皮细胞TF表达的影响及其机制研究[D].广州:南方医科大学,2014.
[10]中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案)[J].中华结核和呼吸杂志,2008,31(3):177
[11]ZHU Y,TAO M,WU J,et al.Adenovirus-directed expression of TIPE2 suppresses gastric cancer growth via induction of apoptosis and inhibition of AKT and ERK1/2 signaling[J].Cancer Gene Ther,2016,23(4):98
[12]KEMONA-CHETNIK I,BODZENTA-LUKASZYK A, KUCHAREWICZ I,et al.Tissue factor and tissue factor pathway inhibitor during specific bronchial challenge in allergic asthma patients[J].Przegl Lek,2005,62(2):98
[13]XI WJ,HU YJ,LIU YG,et al.Roles of TIPE2 in hepatitis B virus-induced hepatic inflammation in humans and mice[J].Mol Immunol,2011,48(9/10):1203
[14]LI D,SONG L,FAN Y,et al.Down-regulation of TIPE2 mRNA expression in peripheral blood mononuclear cells from patients with systemic lupus erythematosus[J].Clin Immunol,2009,133(3):422
[15]MITCHEL JA,ANTONIAK S,LEE JH,et al.IL-13 augments compressive stress-induced tissue factor expression in human airway epithelial cells[J].Am J Respir Cell Mol Biol,2016,54(4):524
(2016-11-03收稿 责任编辑徐春燕)
Expressions of TIPE2 and TF in peripheral blood mononuclear cells of patients with bronchial asthma
SHIGuang,ZHAOJunwei,MINGLiang
DepartmentofClinicalLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity;KeyClinicalLaboratoryofHenanProvince;DepartmentofLaboratoryMedicine,ZhengzhouUniversity,Zhengzhou450052
bronchial asthma;tumor necrosis factor-α induced protein 8 like 2;tissue factor
Aim: To detect the expression levels of tumor necrosis factor-α induced protein 8 like 2(TIPE2) and tissue factor(TF) in peripheral blood mononuclear cells(PBMCs) of patients with bronchial asthma, and to investigate the relationship between TF or TIPE2 with asthma control level.MethodsOne hundred and eight cases of asthma were allocated into two groups: the partial control group(55 cases) and the uncontrolled group(53 cases), and 51 healthy persons were selected as healthy control group. The expression levels of TIPE2 and TF in PBMCs were detected by Western blot. Correlation between TF and TIPE2 was analyzed by Spearman correlation. Evaluation of the diagnostic value of TIPE2 and TF in bronchial asthma was operated by receiver operating curve.ResultsCompared with healthy control and partial control groups, the expression level of TIPE2 in PBMCs of uncontrolled group was significantly lower(P<0.01), which was lower in partial control group than that in healthy control group(P<0.01). Compared with healthy control group, the expression level of TF in partial control group and uncontrolled group was significantly higher(P<0.01),and there existed no significant difference between partial control group and uncontrolled group(P>0.05). The expression of TIPE2 was negatively correlated with TF in PBMCs of asthma patients(r=-0.414,P<0.001). When, determining TIPE2 less than 0.364, TF value greater than 0.354 as the distinction between asthma patients and healthy subjects, the sensitivity and specificity of diagnosis of asthma were 68.4%, 95.5% for TIPE2,and 39.5%, 100.0% for TF, respectively. Using TIPE2 less than 0.115 as dividing line between asthma partial control group and asthma uncontrolled group, the sensitivity and specificity were 76.7% and 100.0%, respectively.ConclusionThe expression of TIPE2 in PBMCs of patients with asthma is lower, while that of TF is higher. The TIPE2 expression in PBMCs of asthma patients is negatively correlated with TF expression. The TIPE2 expression degree is related to the level of asthma control.
10.13705/j.issn.1671-6825.2017.06.006
*国家自然科学基金资助项目 81501715;河南省科技攻关项目 162102310142,152102410067
郑州大学第一附属医院检验科;河南省检验医学重点实验室;郑州大学医学检验系 郑州 450052
#通信作者,男,1964年3月生,博士,教授,主任技师,研究方向:凝血与炎症方向,E-mail:mingliang2016@126.com
R562.2
