M2型巨噬细胞对食管癌移植瘤脉管生成的影响*
2017-12-06贺璐璐孙淼淼陈金艳杨建萍王正洋郑湘予陈奎生
兰 青,贺璐璐,韦 娜,孙淼淼,陈金艳,杨建萍,王正洋,郑湘予,陈奎生
M2型巨噬细胞对食管癌移植瘤脉管生成的影响*
兰 青1,2),贺璐璐1,2),韦 娜1,2),孙淼淼2,3),陈金艳1,2),杨建萍1,2),王正洋1,2),郑湘予1,2),陈奎生1,2)#
肿瘤相关巨噬细胞;食管癌;移植瘤;VEGF;VEGF-C
目的:探讨M2型巨噬细胞对食管癌移植瘤脉管生成的影响及其可能机制。方法应用PMA及IL-4将人淋巴瘤U937单核细胞诱导为M2型巨噬细胞。16只裸鼠分为2组,每组8只,注射与M2型巨噬细胞共培养的EC9706细胞或单独注射EC9706细胞;观察2组荷瘤裸鼠成瘤情况,采用原位杂交法检测移植瘤中VEGF和 VEGF-C mRNA的表达,采用免疫组化方法检测2组移植瘤中VEGF和VEGF-C蛋白的表达,分别用CD31、D2-40标记2组移植瘤中血管和淋巴管,计算MVD与LMVD值。结果M2型巨噬细胞与EC9706细胞共培养组裸鼠移植瘤中VEGF、VEGF-C mRNA及蛋白表达水平高于单独注射EC9706细胞的对照组(P<0.05), MVD及LMVD值亦高于对照组(P<0.05)。结论M2型巨噬细胞可通过分泌VEGF、VEGF-C促进裸鼠食管癌移植瘤中血管、淋巴管的生成。
食管癌是我国常见的肿瘤之一,具有预后差,复发率和死亡率高等特点,严重威胁人类健康[1]。研究[2-5]表明肿瘤相关巨噬细胞(tumor associated macrophage,TAM)会活化成为两种不同的类型:经典活化的巨噬细胞(M1型TAM)与替代性活化的巨噬细胞(M2型TAM),其中M2型TAM常见的标志物有CD206、CD163等,且M2型TAM与肿瘤发展以及肿瘤脉管生成有关[6]。作者探讨M2型TAM对食管癌移植瘤脉管生成的影响及其可能机制,为寻找抑制食管癌脉管转移的新靶点提供理论依据。
1 材料与方法
1.1材料人淋巴瘤U937单核细胞购于中国科学院上海生命科学研究院细胞资源中心;人食管鳞癌EC9706细胞由中国医学科学院肿瘤研究所分子肿瘤学国家重点实验室馈赠。SPF级BALB/c裸鼠均来源于上海斯莱克实验动物有限公司,均为雌性,体重18~22 g,动物质量合格证:SXCK沪2014-0006。兔抗人CD206、CD163多克隆抗体(美国Abcam公司),鼠抗人CD31、D2-40单克隆抗体(北京中杉金桥生物技术有限公司),佛波酯(PMA,美国Sigma公司),重组人IL-4(美国Peprotech公司),原位杂交试剂盒(武汉博士德生物工程有限公司)。
1.2M2型巨噬细胞的诱导及鉴定将PMA加入含体积分数10%胎牛血清的RPMI 1640 完全培养基,调终质量浓度为200 μg/L。使用该浓度培养基重悬U937单核细胞,调整细胞密度为106mL-1,接种至6孔板并诱导18 h,加入20 μg/L的IL-4,显微镜下见U937细胞增殖速度减慢,贴壁生长,即为M2型巨噬细胞。鉴定:采用细胞免疫化学SP法染色。取细胞悬液滴至载玻片上制作成细胞涂片,40 g/L多聚甲醛溶液固定,室温20 min;山羊血清工作液封闭;滴加PBS稀释的CD206或CD163,4 ℃冰箱内孵育14~16 h;次日,滴加二抗,DAB显色,苏木精复染,中性树胶封片。0.01 mol/L PBS溶液代替一抗作阴性对照。
1.3细胞共培养将EC9706细胞制成密度为2×105mL-1细胞悬液,与6×105mL-1的M2型巨噬细胞的细胞悬液按11的体积比混合,接种于6孔板中,置于37 ℃、体积分数5% CO2细胞培养箱进行共培养,24 h后换液。取对数生长期的细胞进行实验。
1.4动物分组16只裸鼠按随机数字表分为2组,每组8只,分别注射共培养细胞(共培养组)和EC9706细胞(对照组)。裸鼠体内肿瘤最大径≥2 mm时,视为移植瘤模型建立成功。每隔3 d用游标卡尺测量并记录瘤体的纵、横径。4周时,麻醉下脱颈椎处死全部裸鼠,解剖后剥除肿瘤,测量并计算肿瘤体积。
1.5免疫组化方法检测2组移植瘤中VEGF、VEGF-C蛋白及CD31和D2-40的表达移植瘤组织经石蜡包埋、4 μm切片,常规脱蜡至水。免疫组化用SP法染色:按试剂盒步骤操作,一抗工作浓度130。最终DAB显色,苏木精复染,脱水透明封片后,置于显微镜下观察结果。以VEGF、VEGF-C、CD31和D2-40蛋白阳性表达的食管癌组织作阳性对照;以PBS代替一抗作阴性对照。挑选6个400倍视野进行观察并计数。阳性细胞百分比<10%计0分,10%~计1分,49%~75%计2分,>75%计3分;按染色深浅评分:细胞无染色为0分,浅黄色为1分,棕黄色为2分,深棕色为3分。染色强度与阳性细胞百分比所得评分相乘。
1.6原位杂交检测2组移植瘤中VEGF、VEGF-CmRNA的表达移植瘤组织经石蜡包埋、切片,附着在APES处理过的载玻片上。经预杂交及杂交后,42 ℃SSC洗涤切片;滴加10 g/L乙酰化BSA孵育10 min,滴加链霉亲和素碱性磷酸酶,经显色,核固红复染,脱水,透明,封片,观察。以VEGF、VEGF-C mRNA阳性表达的食管癌组织作阳性对照;以不含探针的杂交液进行杂交作阴性对照。参照相关文献[7],在显微镜下选择5个高倍视野进行观察,阳性细胞百分比≤5%计0分, 5%~计1分, 25%~计2分,50%~计3分,≥76%计4分;胞质不着色计0分,浅蓝色计1分,蓝紫色计2分,深紫蓝色计3分。染色强度与阳性细胞百分比所得评分相乘。
1.7血管、淋巴管密度值的测定根据Weidner计数法,在40倍光镜视野下确定血管的高密度区域,然后在5个200倍视野下对CD31标记的血管内皮细胞以及D2-40标记的淋巴管内皮细胞进行观察。CD31将血管内皮细胞染成棕黄色,单独或多个成簇状排列。D2-40一般只针对淋巴管内皮染色,细胞胞浆为棕黄色。只要与周围肿瘤细胞或间质细胞分界清楚,即可计为1个微血管或微淋巴管,计算微血管密度(MVD)、微淋巴管密度(LMVD)。采用双盲法进行计数。
1.8统计学处理应用SPSS 17.0处理数据,采用两独立样本t检验比较2组裸鼠移植瘤中VEGF、VEGF-C蛋白和mRNA的表达以及MVD、LMVD,检验水准α=0.05。
2 结果
2.1M2型巨噬细胞的鉴定人淋巴瘤U937单核巨噬细胞经PMA诱导成为巨噬细胞,再经IL-4诱导分化成M2型TAM,细胞体由圆形逐渐变为多边形,生长方式由悬浮生长渐变为贴壁生长。 细胞免疫化学染色结果显示诱导所得细胞中CD206和CD163的阳性率均达到100%,证实诱导所得细胞为M2型巨噬细胞(图1)。
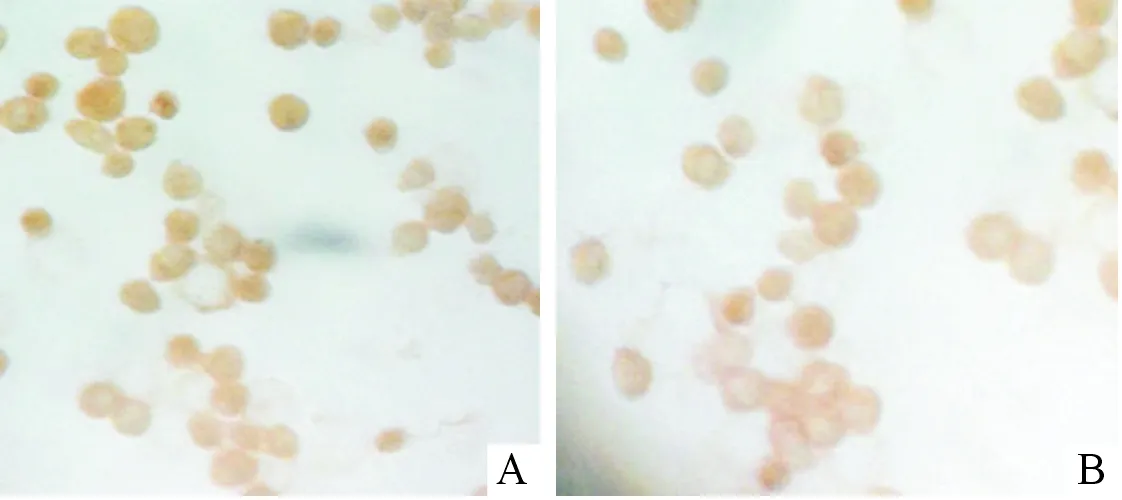
图1 人淋巴瘤U937单核细胞中CD206(A)、CD163(B)的表达(SP,×400)
2.2食管癌移植瘤模型的建立2组裸鼠分组注射细胞后,经过7 d成瘤潜伏期后,肉眼可见裸鼠胸段有肿物形成。接种4周后2组裸鼠皮下均形成肿瘤,成瘤率100%,裸鼠无一死亡,成活率100%。此时处死裸鼠,分离肿瘤,测得共培养组肿瘤体积为(1 855.33±101.99) mm3,大于对照组[(1 011.98±111.10) mm3](t=5.283,P=0.036)。
2.3 2组裸鼠移植瘤组织中VEGF、VEGF-C蛋白及mRNA的表达共培养组裸鼠移植瘤组织中VEGF、VEGF-C蛋白及mRNA的表达均高于对照组。结果见图2、表1。
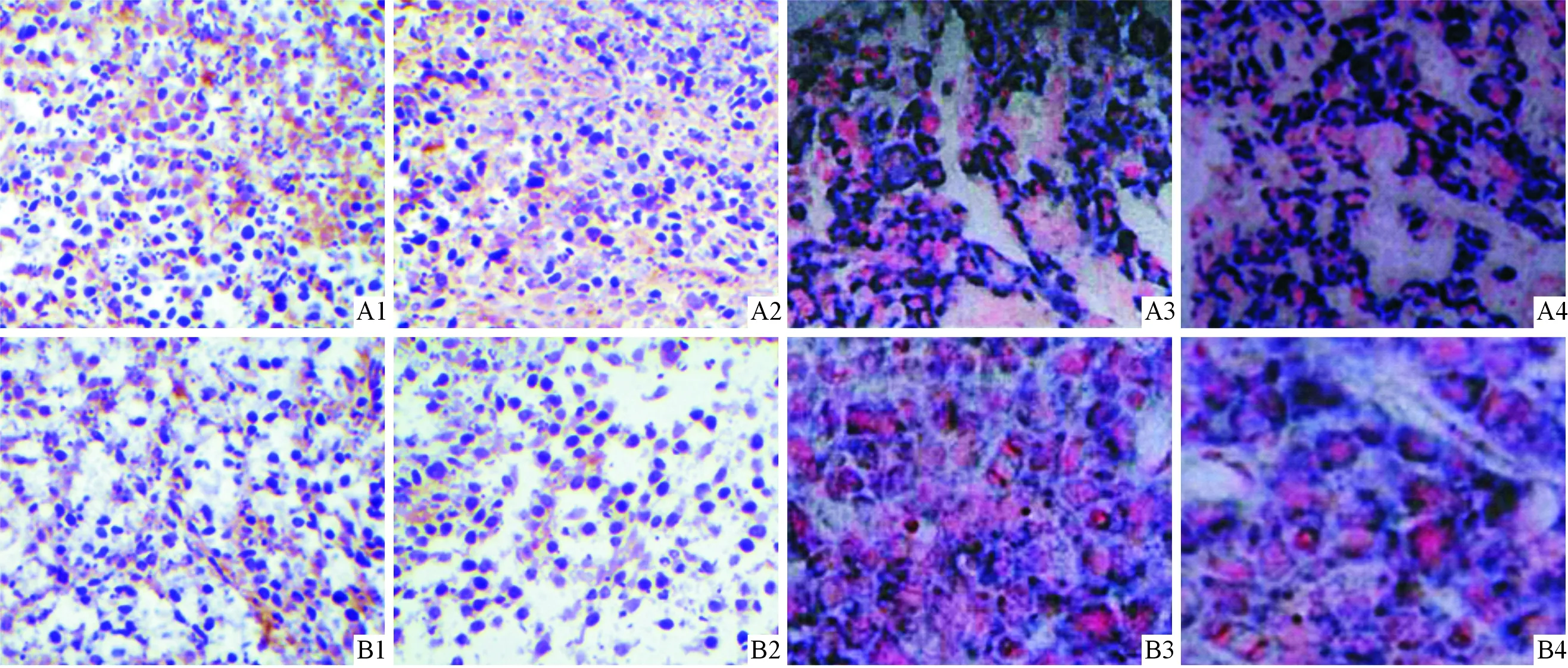
A:共培养组;B:对照组;1:VEGF蛋白;2:VEGF-C蛋白;3:VEGF mRNA;4:VEGF-C mRNA。图2 2组裸鼠移植瘤中VEGF、VEGF-C蛋白及mRNA的表达

组别nVEGF蛋白VEGF⁃C蛋白VEGFmRNAVEGF⁃CmRNA对照组845.19±18.6340.69±12.7826.37±11.9731.27±3.12共培养组852.41±15.2648.23±15.3236.63±13.2137.51±3.59t5.3506.1286.3305.380P0.0240.0310.0270.036
2.4 2组裸鼠移植瘤中MVD和LMVD比较
共培养组裸鼠移植瘤中CD31标记的MVD和D2-40标记的LMVD高于对照组,见图3、表2。

A:共培养组;B:对照组;1:MVD(CD31染色,×200);2:LMVD(D2-40染色,×200)。图3 2组裸鼠移植瘤中MVD和LMVD比较

组别nCD31标记MVDD2⁃40标记LMVD对照组826.58±6.5310.09±1.21共培养组829.21±5.7812.13±1.37t6.5727.491P0.0310.027
3 讨论
肿瘤脉管新生是一个众多因素参与的极其复杂的过程,其中肿瘤细胞产生的VEGF是最为重要的促进脉管生成的细胞因子, 通过下调或沉默肿瘤细胞中VEGF的表达,进而减少肿瘤脉管生成的研究报道有很多,但抑制肿瘤脉管生成的效应并不理想[8]。
近年来研究[9]发现肿瘤微环境中TAM的浸润不但与肿瘤侵袭转移和耐药有关,而且也参与了肿瘤的脉管生成。TAM主要分两类,即经典活化的M1型TAM和替代性活化的M2型TAM。M1型TAM标志物主要有CD16、CD32等,M2型TAM标志物主要有CD163、CD206等。该研究表明人淋巴瘤U937单核细胞经PMA诱导成为巨噬细胞,再经IL-4诱导分化成M2型巨噬细胞。
Berggreen等[10]建立了小鼠牙周炎模型,并证实了炎症环境下巨噬细胞聚集与生成淋巴管有紧密联系:经VEGFR-3受体信号的刺激,VEGF-C/D分泌,进而促进小鼠牙周微淋巴管的生长。Hagemann等[11]研究发现卵巢癌细胞与单核细胞共培养后,能够高表达M2巨噬细胞特性的CD163和CD206;卵巢癌组织中MVD与TAM分布呈正相关,提示TAM在卵巢癌血管形成中起着重要作用。
该研究结果显示,M2型TAM与EC9706细胞共培养组移植瘤中VEGF、VEGF-C蛋白及mRNA表达量高于对照组,且MVD及LMVD值亦高于对照组,提示M2型TAM可能通过分泌VEGF、VEGF-C促进裸鼠食管癌移植瘤中血管、淋巴管的生成。该研究结果为寻找抑制食管癌脉管转移的新靶点提供了理论依据。
[1] 王立东,宋昕.环境和遗传因素交互作用对食管癌发生的影响[J].郑州大学学报(医学版),2011,46(1):46
[2] FANTIN A, VIEIRA JM, GESTRI G,et al.Tissue macrophages act as cellular chaperones for vascular anastomosis downstream of VEGF-mediated endothelial tip cell induction[J]. Blood,2010,116(5):829
[3] RAUH MJ,HO V,PEREIRA C,et al.SHIP represses the generation of alternatively activated macrophages[J].Immunity,2005,23(4):361
[4] LEWIS CE,POLLARD JW.Distinct role of macrophages in different tumor microenvironments[J].Cancer Res,2006,66(2):605
[5] JI RC.Macrophages are important mediators of either tumor- or inflammation-induced lymphangiogenesis[J].Cell Mol Life Sci,2012,69(6):897
[6] BERSANI G,MARCONI D,LIMPIDO L,et al.Pilot study of light therapy and neurocognitive performance of attention and memory in healthy subjects[J].Psychol Rep,2008,102(1): 299
[7] AHLÉN J,ENBERG U,LARSSON C,et al.Malignant fibrous histiocytoma, aggressive fibromatosis and benign fibrous tumors express mRNA for the metalloproteinase inducer EMMPRIN and the metalloproteinases MMP-2 and MT1-MMP[J].Sarcoma,2001,5(3):143
[8] GAO P,ZHOU GY,ZHANG QH,et al.Lymphangiogenesis in gastric carcinoma correlates with prognosis[J].J Pathol,2009,218(2):192
[9] CHEN SJ,ZHANG QB,ZENG LJ,et al.Distribution and clinical significance of tumour-associated macrophages in pancreatic ductal adenocarcinoma: a retrospective analysis in China[J].Curr Oncol,2015,22(1):e11
[10]BERGGREEN E,WIIG H. Lymphangiogenesis and lymphatic function in periodontal disease[J].J Dent Res,2013,92(12):1074
[11]HAGEMANN T,WILSON J,BURKE F,et al.Ovarian cancer cells polarize macrophages toward a tumor-associated phenotype[J].J Immunol,2006,176(8):5023
(2017-01-09收稿 责任编辑徐春燕)
Effect of M2 type macrophage on angiogenesis and lymphangiogenesis of human esophageal cancer xenograft
LANQing1,2),HELulu1,2),WEINa1,2),SUNMiaomiao2,3),CHENJinyan1,2),YANGJianping1,2),WANGZhengyang1,2),ZHENGXiangyu1,2),CHENKuisheng1,2)
1)DepartmentofPathology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)HenanKeyLaboratoryforTumorPathology,Zhengzhou450052 3)DepartmentofPathology,theAffiliatedCancerHospital,ZhengzhouUniversity,Zhengzhou450052
tumor associated macrophage;esophageal carcinoma;xenograft;VEGF;VEGF-C
Aim: To investigate the effect of M2 type macrophage on angiogenesis and lymphangiogenesis of human esophageal cancer xenograft.MethodsHuman lymphoma U937 monocytes were induced into M2 type macrophage by PMA and IL-4. The M2 type macrophage was co-cultured with esophageal cancer EC9706 cells. Sixteen nude mice were allocated into two groups and were injected with co-culture M2 type macrophage with EC9706 cells(co-culture group) or single-culture EC9706 cells(control group). The formation of tumor in the 2 groups was observed. The mRNA expression levels of VEGF and VEGF-C in xenograft of the 2 groups were determined byin-situhybridization method. The levels of VEGF and VEGF-C proteins in xenograft of the 2 groups were detected by immunohistochemical technique. The expression levels of CD31 and D2-40 separately to mark the blood vessel and the lymphatic vessel were detected by immunohistochemistry, and the value of MVD and LMVD was calculated.ResultsThe protein and mRNA expression levels of VEGF and VEGF-C in co-culture group were significantly higher than those in control group(P<0.05). Both the value of MVD and that of LMVD in co-culture group were also higher than those in control group(P<0.05).ConclusionM2 type macrophage may promote angiogenesis and lymphatic vessel generation of esophageal cancer xenograft in nude mice by secreting VEGF and VEGF-C.
10.13705/j.issn.1671-6825.2017.06.004
*国家自然科学基金资助项目 81272370;河南省基础与前沿技术研究计划项目 152300410026,122300413204
1)郑州大学第一附属医院病理科 郑州 450052 2)河南省肿瘤病理重点实验室 郑州 450052 3)郑州大学附属肿瘤医院病理科 郑州 450052
#通信作者,男,1964年8月生,博士,教授,研究方向:肿瘤病理,E-mail:chenksh2002@163.com
R735.1
