IDH1/2基因突变与神经胶质瘤关系研究进展
2017-11-27张耀茹懿李霞林伟
张耀 茹懿 李霞* 林伟*
(第四军医大学:1西京医院神经外科;2基础部生物化学与分子生物学教研室,陕西 西安 710032)
·综述·
*通讯作者:林伟,副教授、副主任医师,硕士生导师,E-mail: linwei@fmmu.edu.cn;李霞,副教授,硕士生导师,E-mail:lixia@fmmu.edu.cn
IDH1/2基因突变与神经胶质瘤关系研究进展
张耀1茹懿2李霞2*林伟1*
(第四军医大学:1西京医院神经外科;2基础部生物化学与分子生物学教研室,陕西 西安 710032)
神经胶质瘤; 异柠檬酸脱氢酶; 突变; 2-羟基戊二酸; 肿瘤代谢
神经胶质瘤是中枢神经系统最为常见的原发性肿瘤,多数胶质瘤呈侵袭性生长,其高复发率、高致残率以及高死亡率严重威胁着人类健康,近几年针对胶质瘤的治疗技术虽有很大程度的提高,但是治疗效果并不十分理想。2008年,Parsons等[1]对20 661个蛋白质编码基因进行高通量表达分析研究,首次发现在胶质母细胞瘤中约有12%发生了异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)的基因突变,随后,更多学者进一步的研究发现IDH1/2突变作为预后良好标志普遍存在于Ⅱ级和Ⅲ级胶质瘤以及继发性胶质母细胞瘤,并在肿瘤的发生、发展以及演变过程发挥着重要作用,本文就IDH的功能、突变IDH的特点、与胶质瘤的关系、致癌机制及其导致胶质瘤代谢的改变作一综述。
一、IDH的功能概述
IDH有IDH1、IDH2和IDH3三种同工酶。IDH1和IDH2是烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosophate acid, NADP+)依赖型同型二聚体酶,催化异柠檬酸氧化脱羧生成α-酮戊二酸(α-Ketoglutarate, α-KG)、还原性烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)和二氧化碳,二者所催化的上述反应为可逆反应。IDH3是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine Dinucleotide, NAD+)依赖型异四聚体酶,催化异柠檬酸氧化脱羧生成α-KG、还原性烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide, NADH)和二氧化碳,由于IDH3是三羧酸循环的限速酶,其所催化的氧化脱羧反应在生理条件下是不可逆的。
虽然不同亚型的IDH催化的反应过程相似且部分重叠,但是各自却具有不同的重要生理功能。IDH1存在于细胞质和过氧化物酶体中,其代谢产物α-KG对于维持细胞质和细胞核内大量双加氧酶的活性是必需的,其另一代谢产物NADPH为脂质生物合成提供关键的还原当量,同时还是极其重要的抗氧化剂用以保护细胞免受氧化应激以及放射性损害;研究发现IDH1在细胞缺氧状态下可羧化α-KG生成异柠檬酸,后者进一步裂解生成乙酰辅酶A,作为支持脂质合成的原料[2]。IDH2和IDH3定位于线粒体基质,IDH2被认为在缺氧状态下维持细胞能量产生以及促进细胞增殖[3-4],同时亦可以产生NADPH用以保护线粒体免于氧化应激损害。IDH3则是作为三羧酸循环关键酶参与线粒体能量代谢(图1)。
二、IDH1/2基因突变特点
人类基因组中异柠檬酸脱氢酶的编码基因有五种,两种基因分别编码IDH1和IDH2,另外三种基因则分别编码IDH3的四个亚基-2个α亚基、1个β亚基和1个γ亚基。神经胶质瘤细胞中IDH基因突变有以下几个特点:①IDH1/2基因突变主要发生在低级别胶质瘤细胞中,约60%~80%的Ⅱ级和Ⅲ级胶质瘤以及高达90%继发性胶质母细胞瘤存在有IDH基因突变[5];②在神经胶质胶质瘤中,IDH1突变频率远高于IDH2的突变频率,目前尚未发现IDH3基因突变[5];③IDH1/2突变均为杂合型突变,IDH1/2突变型酶为异源二聚体,分别由正常和突变型IDH基因编码[6];④IDH1/2突变在发生上具有相对独立互斥的特点,极少同时发生突变[7],提示二者突变在诱发肿瘤过程中或有着相同或者类似机制,或二者同时发生突变会对细胞产生致死损害;⑤IDH1/2在神经胶质瘤中突变类型均是单个氨基酸错义突变,常见突变位点是第132位精氨酸残基,约80%~90%的突变类型是R132H,其它较为常见的突变类型依次是R132C、R132G、R132S[8];⑥IDH基因发生突变后其不再具有原有酶活性,而是获得催化α-KG还原为2-羟基戊二酸(2-hydroxyglutarate, 2-HG)这一新的酶活性[9];⑦IDH1/2突变型胶质瘤患者的预后明显好于非突变型患者[10]。
三、IDH1/2突变致瘤机制
现代分子生物学普遍认为细胞中信息的表达不仅受DNA序列遗传调控,还受到表观遗传调控,即在核苷酸序列不发生改变的情况下,基因的表达水平以及功能发生改变,并可产生可遗传表型,IDH1/2突变相关的表观遗传修饰改变包括DNA和组蛋白的异常甲基化。由于2-HG在结构上与α-KG相似,可竞争性抑制α-KG依赖性酶,其中包括10-11移位(ten-eleven translocation, TET)蛋白家族TET2以及组蛋白赖氨酸去甲基化酶,而二者在DNA和组蛋白的去甲基化过程中发挥着重要功能,因此IDH1/2突变可导致DNA和组蛋白的异常高甲基化, 从而引起表观遗传异常修饰改变而影响某些相关基因的转录表达,进而导致肿瘤的发生[11]。
缺氧诱导因子-1α(hypoxia-inducible factor 1α, HIF-1α)在肿瘤的发生发展过程中有着重要的作用,其可激活下游60余种靶基因转录,如血管内皮生长因子、人促进红细胞素、糖酵解酶等,以使肿瘤细胞适应低氧环境从而促进肿瘤的生长。在正常氧分压条件下,HIF1-α亚基上的脯氨酸残基被α-KG依赖性脯氨酰羟化酶羟基化,进而发生泛素化和蛋白酶体降解。有学者证实2-HG可竞争性抑制α-KG依赖脯氨酸羟化酶的活性,从而导致细胞内HIF-1α水平升高进而诱导肿瘤的发生[12]。与此相反,Koivunen等[13]发现2-HG可激活另一脯氨酸-4-羟化酶,因而促进HIF-1α泛素化降解,降低细胞内HIF-1α水平。
此外,IDH1/2突变可导致分化相关基因高甲基化,从而抑制肿瘤细胞的分化,使得肿瘤细胞停留在低分化状态[14];针对IDH1/2突变的小分子抑制剂已于2013年成功开发,研究证实该小分子抑制剂可抑制肿瘤生长,并促进相关分化基因组蛋白去甲基化,进而诱导肿瘤细胞分化。有趣的是体外低剂量抑制剂处理IDH1/2突变型胶质瘤细胞可以抑制其生长,但胶质瘤细胞DNA高甲基化状态并未改变,亦未诱导肿瘤细胞分化[15],意味着逆转IDH1/2突变型胶质瘤高甲基化表型并不是抑制其生长所必须的,IDH1/2突变引起的其它未知改变可能在肿瘤的增殖过程中发挥着重要作用。
四、IDH1/2突变的代谢改变
1.IDH1/2突变对糖代谢的影响:Izquierdo等[16]发现在IDH1突变型胶质瘤细胞中丙酮酸脱氢酶的活性是降低的。在另一研究中,Mustafa等[17]发现在IDH1突变型胶质母细胞瘤细胞内某些三羧酸循环代谢酶如柠檬酸合酶、顺乌头酸酶以及IDH2酶活性增高,同时还观测到胞内乳酸脱氢酶B活性增高而乳酸脱氢酶A的活性减弱,因而突变型细胞生成乳酸能力减弱。有意思的是,IDH1突变一方面导致丙酮酸脱氢酶活性降低,另一方面又引起细胞内乳酸含量降低,而后者与绝大部分肿瘤细胞所表现的Warburg效应相悖。
2.IDH1/2突变对氨基酸代谢的影响:IDH1/2突变导致细胞内由α-KG生成的2-HG含量呈百倍的升高,但是细胞内α-KG的含量并未因此显著降低,仅表现为稍低于野生型肿瘤细胞,仍较正常脑组织内的含量高[18],因而推断IDH1/2突变型胶质瘤细胞还有其它代谢途径来弥补α-KG池的损耗。在IDH1/2突变型胶质瘤细胞中,2-HG含量增加的同时亦伴随有谷氨酸含量降低;Chen等[19]研究发现IDH1/2突变型胶质瘤细胞内谷氨酸脱氢酶1和谷氨酸脱氢酶2表达增高,谷氨酸脱氢酶2可以逆转IDH1/2突变对肿瘤细胞的抑制作用从而促进胶质瘤细胞生长;亦有研究发现抑制谷氨酰胺酶活性可以较温和地抑制IDH1/2突变型胶质瘤细胞的增殖,谷氨酰胺酶可以催化谷氨酰胺生成谷氨酸,谷氨酸在谷氨酸脱氢酶的作用下进一步生成α-KG,从而代偿了α-KG的消耗[20]。IDH1/2突变多见于神经胶质瘤,其它肿瘤组织亦发现有IDH1/2突变,但是突变频率远低于神经胶质细胞,大脑半球存在着大量的兴奋性神经递质谷氨酸,包绕在突触间隙的星形胶质细胞可表达兴奋性氨基酸转运体-2,其可转运摄取间隙中多余的谷氨酸以保护神经元免于兴奋性氨基酸毒性作用,摄入的谷氨酸在谷氨酸脱氢酶的催化下生成α-KG,可弥补由于IDH1/2突变造成的α-KG消耗,使得肿瘤的发生成为可能。由于兴奋性氨基酸转运体-2在体外培养的低级别胶质瘤中往往表达缺失,亦从另一个角度解释了为什么内源型IDH1/2突变胶质瘤细胞在体外很难培养成功。同时亦有研究发现细胞外基质中谷氨酸可以促进胶质瘤干细胞的生长,无论细胞内IDH1是否发生突变,以及谷氨酸脱氢酶是否高表达[19]。
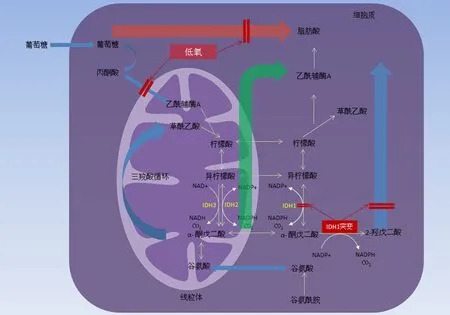
图1 IDH1突变型胶质瘤细胞在缺氧状态下脂质从头合成途径示意图
3.IDH1/2突变对脂质代谢的影响:IDH1/2不仅参与异柠檬酸氧化脱羧,在脂质合成过程中亦有着重要作用[2-4]。IDH1可以羧化还原α-KG生成异柠檬酸,进一步生成柠檬酸参与脂质合成,尤其在缺氧环境下细胞几乎完全依赖IDH1催化由谷氨酸派生的α-KG所介导的脂质合成[2],由此推测IDH1突变会影响细胞脂质的合成,并对突变型细胞生长增殖产生不利影响。同时Mustafa等[17]发现在IDH1突变型胶质母细胞瘤细胞内IDH2酶活性增高,突变细胞可能通过线粒体以及IDH2途径代偿IDH1突变造成的不利影响(图1示IDH1突变型胶质瘤细胞在缺氧状态下脂质从头合成途径),这可从另一角度解释为什么胶质瘤细胞极少同时发生IDH1和IDH2突变,二者若同时突变可能会对胶质细胞产生致死效应。由此推测抑制IDH2基因的表达可以抑制IDH1突变型胶质瘤的生长增殖,可能为胶质瘤的治疗提供一种新的策略。
脑器官富含脂类物质,其主要包括磷脂、鞘脂以及甘油,约占脑组织干重的50%以上。在星形胶质细胞中,磷脂占到所有脂类物质的70%左右,主要由磷脂酰胆碱(卵磷脂)以及磷脂酰乙醇胺(脑磷脂)构成,其中约70%磷脂酰乙醇胺以缩醛磷脂乙醇胺形式存在,Esmaeili等[21]发现在IDH1突变型胶质瘤细胞中磷脂酰胆碱水平升高,而磷脂酰乙醇胺含量降低。由于缩醛磷脂在过氧化物酶体合成过程中需要IDH1参与,亦有实验证实在IDH1突变型胶质瘤细胞中缩醛磷脂乙醇胺含量降低约50%左右[22],既往研究发现缩醛磷脂具有广泛的生物学功能,可能与肿瘤相关。
综上所述,IDH1/2突变对细胞的生长发育有着双重的影响,一方面由于代谢产物2-HG在细胞内的积累可以影响多种α-KG依赖性酶如TET2和组蛋白赖氨酸去甲基化酶,进而导致DNA甲基化和表观遗传改变,可能参与肿瘤的发生;另一方面其影响脂质的合成,从而影响细胞的增殖。Gilbert等[23]研究亦证实IDH1突变可抑制胶质瘤的生长,并且对不同类型的胶质瘤细胞有着不同的影响,这取决于各细胞类型不同的遗传背景。但是亦有实验验证IDH1突变可使细胞获得增值优势以及在软琼脂形成细胞集落的能力[13],因此在解释IDH1/2突变对不同类型细胞的不同影响时应持谨慎态度。
IDH突变被认为是胶质瘤发生过程中的早期事件,若该突变不仅仅是作为始动因素参与胶质瘤的发生,而且在胶质瘤进一步恶性发展过程中亦起到重要作用,那么应用IDH突变抑制剂可能是有效的治疗手段以达到阻止胶质瘤进一步的恶性突变进展;尚若IDH1/2突变只是作为始动因素参与胶质瘤的发生,后期恶性演变不再依赖该突变,那么IDH突变抑制剂的治疗效用则可能是无效的[25],目前已经研发出针对IDH1/2突变的相关疫苗[24],期临床效用需要进一步验证。由于IDH1/2突变型胶质瘤很难在体外培养成功,因此限制了某些相关研究。将来采用的实验模型应是能够准确反映内源型IDH1/2突变型胶质瘤的本质特性,并利用该模型深入探究IDH1/2 突变在胶质瘤发生发展过程中的作用机制,以便为将来临床治疗提供新的途径和方法。
1PARSONS D W, JONES S, ZHANG X, et al. An integrated genomic analysis of human glioblastoma multiforme [J]. Science, 2008, 321(5897): 1807-1812.
2METALLO C M, GAMEIRO P A, BELL E L, et al. Reductive glutamine metabolism by IDH1 mediates lipogenesis under hypoxia [J]. Nature, 2012, 481(7381): 380-384.
3WISE D R, WARD P S, SHAY J E, et al. Hypoxia promotes isocitrate dehydrogenase-dependent carboxylation of alpha-ketoglutarate to citrate to support cell growth and viability [J]. Proc Natl Acad Sci U S A, 2011, 108(49): 19611-19616.
4FILIPP F V, SCOTT D A, RONAI Z A, et al. Reverse TCA cycle flux through isocitrate dehydrogenases 1 and 2 is required for lipogenesis in hypoxic melanoma cells [J]. Pigment Cell Melanoma Res, 2012, 25(3): 375-383.
5HARTMANN C, MEYER J, BALSS J, et al. Type and frequency of IDH1 and IDH2 mutations are related to astrocytic and oligodendroglial differentiation and age: a study of 1010 diffuse gliomas [J]. Acta Neuropathol, 2009, 118(4): 469-474.
6DUNCAN C G, BARWICK B G, JIN G, et al. A heterozygous IDH1R132H/WT mutation induces genome-wide alterations in DNA methylation [J]. Genome Res, 2012, 22(12): 2339-2355.
7KLOOSTERHOF N K, BRALTEN L B, DUBBINK H J, et al. Isocitrate dehydrogenase-1 mutations: A fundamentally new understanding of diffuse glioma? [J]. Lancet Oncol, 2011, 12(1): 83-91.
8YAN H, PARSONS D W, JIN G, et al. IDH1 and IDH2 mutations in gliomas [J]. N Engl J Med, 2009, 360(8): 765-773.
9DANG L, WHITE D W, GROSS S, et al. Cancer-associated IDH1 mutations produce 2-hydroxyglutarate [J]. Nature, 2009, 462(7274): 739-744.
10SABHA N, KNOBBE C B, MAGANRI M, et al. Analysis of IDH mutation, 1p/19q deletion, and PTEN loss delineates prognosis in clinical low-grade diffuse gliomas [J]. Neuro Oncol, 2014, 16(7): 914-923.
11TURCAN S, ROHLE D, GOENKA A, et al. IDH1 mutation is sufficient to establish the glioma hypermethylator phenotype [J]. Nature, 2012, 483(7390): 479-483.
12ZHAO S, LIN Y, XU W, et al. Glioma-derived mutations in IDH1 dominantly inhibit IDH1 catalytic activity and induce HIF-1alpha [J]. Science, 2009, 324(5924): 261-265.
13KOIVUNEN P, LEE S, DUNCAN C G, et al. Transformation by the (R)-enantiomer of 2-hydroxyglutarate linked to EGLN activation [J]. Nature, 2012, 483(7390): 484-488.
14LU C, WARD P S, KAPOOR G S, et al. IDH mutation impairs histone demethylation and results in a block to cell differentiation [J]. Nature, 2012, 483(7390): 474-478.
15ROHLE D, POPOVICI-MULLER J, PALASKAS N, et al. An inhibitor of mutant IDH1 delays growth and promotes differentiation of glioma cells [J]. Science, 2013, 340(6132): 626-630.
16IZQUIERDO-GARCIA J L, CAI L M, CHAUMEIL M M, et al. Glioma cells with the IDH1 mutation modulate metabolic fractional flux through pyruvate carboxylase [J]. PLoS One, 2014, 9(9): e108289.
17MUSTAFA D A, SWAGEMAKERS S M, BUISE L, et al. Metabolic alterations due to IDH1 mutation in glioma: opening for therapeutic opportunities? [J]. Acta Neuropathol Commun, 2014, 2: 6.
18VAN LITH S A, NAVIS A C, VERRIJP K, et al. Glutamate as chemotactic fuel for diffuse glioma cells: Are they glutamate suckers? [J]. Biochim Biophys Acta, 2014, 1846(1): 66-74.
19CHEN R, NISHIMURA M C, KHARBANDA S, et al. Hominoid-specific enzyme GLUD2 promotes growth of IDH1(R132H) glioma [J]. Proc Natl Acad Sci USA, 2014, 111(39): 14217-14222.
20SELTZER M J, BENNETT B D, JOSHI A D, et al. Inhibition of glutaminase preferentially slows growth of glioma cells with mutant IDH1 [J]. Cancer Res, 2010, 70(22): 8981-8987.
21ESMAEILI M, HAMANS B C, NAVIS A C, et al. IDH1 R132H mutation generates a distinct phospholipid metabolite profile in glioma [J]. Cancer Res, 2014, 74(17): 4898-4907.
22BOGDANOVIC E. IDH1, lipid metabolism and cancer: shedding new light on old ideas [J]. Biochim Biophys Acta, 2015, 1850(9): 1781-1785.
23GILBERT M R, LIU Y, NELTNER J, et al. Autophagy and oxidative stress in gliomas with IDH1 mutations [J]. Acta Neuropathol, 2014, 127(2): 221-233.
24TURKALP Z, KARAMCHANDANI J, DAS S. IDH mutation in glioma: New insights and promises for the future [J]. JAMA Neurol, 2014, 71(10): 1319-1325.
25SCHUMACHER T, BUNSE L, PUSCH S, et al. A vaccine targeting mutant IDH1 induces antitumour immunity [J]. Nature, 2014, 512(7514): 324-327.
1671-2897(2017)16-081-03
张耀,硕士研究生,E-mail:zhangyaosjwk@126.com
R 739.4
A
2015-06-23;
2015-07-20)
