电磁刺激对脊髓神经干细胞增殖与分化作用研究
2017-11-27冯枫牟翔袁华王冰水刘卫
冯枫 牟翔 袁华 王冰水 刘卫
(第四军医大学西京医院康复理疗科,陕西 西安 710032)
·论著·
电磁刺激对脊髓神经干细胞增殖与分化作用研究
冯枫 牟翔*袁华 王冰水 刘卫
(第四军医大学西京医院康复理疗科,陕西 西安 710032)
目的探讨电磁刺激对大鼠脊髓神经干细胞(NSCs)向功能性神经元增殖分化的作用及可能的机制。方法体外分离培养妊娠第14天(E14 d)的Wistar大鼠脊髓NSCs,无血清培养14 d后,分为对照组和电磁刺激组。电磁刺激组置于脉冲强磁场条件下用促增殖参数(0.1 Hz、4T、8次)进行干预,每次脉冲放电20 ms。对照组不做干预处理。干预后第1天,10%胎牛血清诱导贴壁分化;诱导贴壁后第7天,蛋白免疫印迹法(Western Blot)检测β-catenin蛋白表达情况;NCSs分化后第14天,免疫荧光染色检测神经元MAP2表达情况,红外可视膜片钳技术记录神经元自发放电情况。结果干预后,免疫荧光染色显示电磁刺激组MAP2阳性细胞数45.4%±3.1%,较对照组38.3%±6.0%明显增多(Plt;0.05)。Western Blot检测结果显示干预后第7天,电磁刺激组神经干细胞β-catenin 蛋白量较对照组增高。膜片钳实验结果显示,诱导后第14天,可以记录到神经元自发放电,是有生理功能的。结论强电磁刺激能够促进大鼠脊髓神经干细胞增殖分化为功能性神经元。
脊髓; 神经干细胞; 电磁刺激; 细胞分化
神经干细胞(neural stem cells, NSCs)具有分化为神经元、星形胶质细胞及少突胶质细胞的能力,它的发现和研究是神经生物学领域重要进展之一[1]。电磁刺激技术在中枢神经系统疾病诊治中的应用受到越来越多的关注[2]。电磁刺激是通过脉冲磁场诱导产生的感应电流促进神经干细胞增殖[3],目前其促进增殖的机制尚不清楚。位于中枢神经系统内的NSCs具有子代细胞可兴奋性和稳定性的双重电生理特性[4]。本文旨在了解电磁刺激对Wistar大鼠脊髓神经干细胞(NSCs)向功能性神经元增殖分化的作用及可能的机制。
材料与方法
一、材料
1.主要试剂:杜尔贝克改良的含有F-12营养混合物的伊戈尔培养基(DMEM/F12)、B27细胞培养添加剂(Gibco),碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)(Sigma),1%青链霉素、胎牛血清(FBS)(Hyclon),小鼠抗大鼠微管相关蛋白2(MAP2)抗体(Sigma),羊抗小鼠Alexa Fluor 绿色荧光二抗(Invitrogen),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)制备试剂盒(上海鼎杰),肌动蛋白(Actin)(SANTA)。人工脑脊液(artificial cerebrospinal fluid, ACSF)(mmol/L): NaCl 126,KCl 5.4,MgCl21,CaCl21.8,NaH2PO40.33,Glucose 10,羟乙基哌嗪乙磺酸(HEPES) 10,氢氧化钠(sodium hydroxide, NaOH)调pH至7.4;电极内液(pipette solution)(mmol/L):KCl 20,天冬氨酸钾potassium asparate 110,MgCl21,HEPES 5,乙二醇双(2-氨基乙基醚)四乙酸 (EGTA) 10,三磷酸腺苷二钠(Na2-ATP) 5,氢氧化钾(potassium hydroxide, KOH)调pH至7.2;河豚毒素(tetrodotoxin, TTX)(Sigma)。
2.实验动物:孕14 d Wistar大鼠,由第四军医大学实验动物中心提供。
二、方法
1.神经干细胞原代培养:取妊娠第14天(embryonic,E14 d)孕鼠行6%水合氯醛0.6 mL/100 g腹腔麻醉处死,于75%乙醇中消毒3 min,无菌条件下取出子宫,置于预冷的无二价阳离子的Hank's平衡盐缓冲液(D-Hank's)中。解剖显微镜下取出胚胎(n=6),剥离脊髓组织并去除硬脊膜,眼科剪充分剪碎(1 mm3),1 mL加样枪反复吹打组织块约50次,过滤制成细胞悬液,1000 r/min离心5 min,后小心去除上清液,进行无血清培养。
2.实验分组:将培养的第3代NSCs制成单细胞悬液,随机分装在2个1 mL注射器内,A组标记为对照组不行电磁干预,B组为实验组,置于脉冲强磁场内,给予0.1 Hz、4T,持续20 ms脉冲强磁场干预8次[3]。
3.形态学实验:干预后第1 天,10%胎牛血清诱导贴壁分化,分化后第7天,在相差显微镜下观察两组NSCs生长形态;分化后第14天,进行细胞免疫荧光染色鉴定NSCs的子代细胞。
4.蛋白免疫印迹实验(Western Blot):电磁刺激干预、并贴壁分化后第7天,分别提取实验组及对照组细胞胞质蛋白,行SDS-PAGE凝胶电泳,内参为Actin。采用 Alpha 图像软件处理系统,分析两组目标条带的光密度值和灰度值,计算两组目的/内参的比值,即 β-连环蛋白(β-catenin)的相对表达量。
5.膜片钳实验:脉冲强磁场干预后第14天,应用全细胞膜片钳技术记录神经元自发放电。所用微电极用两步法拉制而成,充灌电极内液后电阻在3 MΩ左右。用ACSF以3 mL/min恒速灌流冲洗细胞表面,形成高阻封接(gt;5 GΩ)后,脉冲式抽吸打破细胞膜,形成全细胞记录,电流钳模式下进行记录。实 验 过 程 由 计 算 机 软 件pCLAMP9(Axon Instrument)控制,数-模转换器完成刺激信号的产生、反馈信号的采集以及数据分析。实验在室温(20~24 ℃)下进行。
结 果
一、细胞形态观察和鉴定
神经干细胞培养至第7天,在相差显微镜下可见培养瓶中体积较大的神经球悬浮生长,形态呈桑葚状,胞质透亮,折光性强(图1);至第14天,对成熟神经元标记物微管相关蛋白2(MAP2)进行免疫荧光标记,镜下可见绿色荧光标记的MAP2阳性的神经元,并且电磁刺激组MAP2阳性细胞数量大于对照组(图2)。
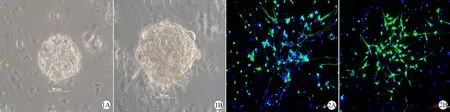
图1 相差显微镜下对照组和电磁刺激组神经球形态 (×40)
Fig 1 Morphology of neurosphere under phase contrast microscope in control and electromagnetic stimulation group (×40)
A: Control group; B: In electromagnetic stimulation group, the size of neurosphere was larger than that of the control group.
Scale bar=50 μm.
图2 对照组和电磁刺激组微管相关蛋白2免疫荧光染色 (×20)
Fig 2 Microtubule associated protein 2 immunofluorescence staining in control and electromagnetic stimulation group (×20)
A: Control group; B: In electromagnetic stimulation group, the number of MAP2 positive cells was greater than that in the control group.
二、Western Blot结果
在电磁刺激后第7天,Western Blot 检测实验组和对照组神经干细胞β-catenin 蛋白的表达(图3)。实验组神经干细胞β-catenin蛋白量(β-catenin: 326955, Actin: 332613, 目的/内参: 0.9830)较对照组(β-catenin: 135488, Actin: 318421, 目的/内参: 0.4255)增高约2倍。
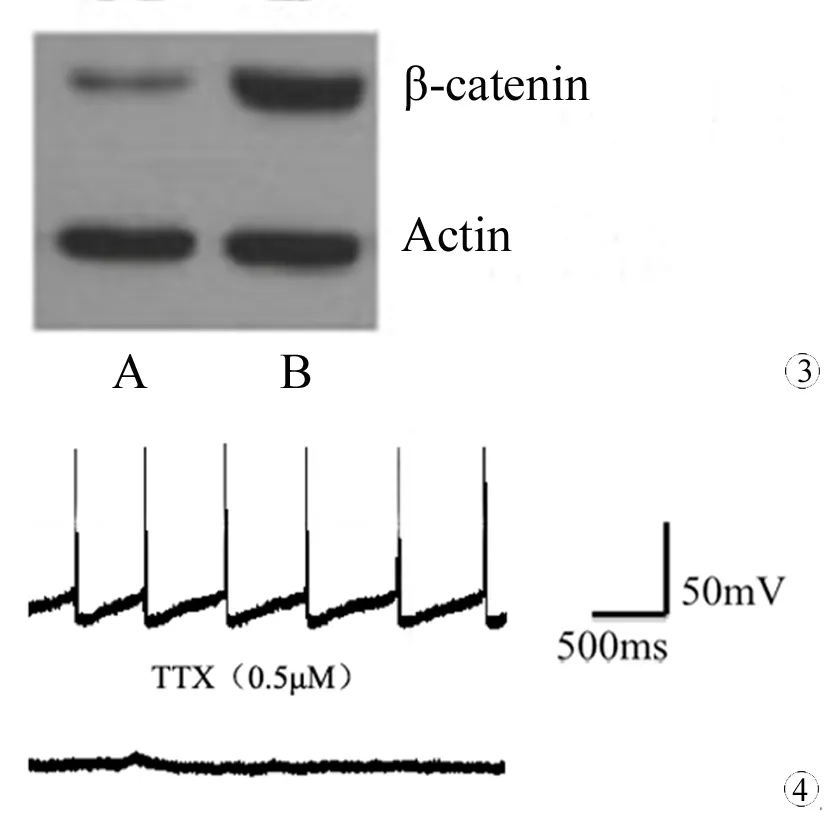
图3 对照组和电磁刺激组神经干细胞β-catenin 蛋白的表达
Fig 3 β-catenin protein expression on neural stem cells in control and electromagnetic stimulation group
A: Control group; B: In electromagnetic stimulation group, the expression of β-catenin protein of NSCs was about 2 times higher than that of the control group.
图4 神经元具有自发放电,且该动作电位可被TTX阻断抑制
Fig 4 Neurons differentiated from NSCs could discharge spontaneously and be inhibited by TTX
三、膜片钳实验结果
电磁刺激后第14天,应用全细胞膜片钳技术可记录到NSCs分化的神经元具有自发放电,动作电位可被快钠离子通道阻断剂TTX(0.5 μM)阻断(图4)。表明,电磁刺激后,脊髓NSCs分化为成熟的神经元,具有电生理活性。
讨 论
近年来研究发现神经干细胞与其他干细胞相比具有其自身独特的优势,因此其成为神经领域研究的热点之一[5]。另外,胚胎源性神经干细胞由于其自身独特的特点,如与脊髓损伤区的细胞同源、来源丰富和易于培养等,被认为是一种治疗脊髓损伤的理想干细胞[6-7]。研究发现移植的神经干细胞在体内能继续存活,而且存活下来的移植细胞能从移植部位向受损神经区域迁移,并基本保留了神经干细胞自我更新和多向分化的能力,移植细胞在宿主体内分泌特殊的递质和神经营养因子,改善损伤组织的局部微环境,促进神经元存活和轴突生长,使受损神经得以较快修复或者再生,重新建立起来的突触联系在神经细胞之间形成新的神经环路,在结构和功能上替代受损的神经元[8-10]。
脉冲强磁场与超高压和极低温一样,属于极端的物理实验条件,已有文献报导, 脉冲强磁场(0.1 Hz 、4T、8次)是促神经干细胞增殖最佳参数,增殖效应在干预后第七天最显著,且增殖的神经干细胞仍具有向神经元和胶质细胞分化的能力[3],该参数下脉冲强磁场可能是通过 Wnt/β-catenin通路发挥作用。
有关神经干细胞增殖分化的调节机制,Wnt 信号通路被认为在胚胎神经系统生长发育过程中起关键作用。Wnt 是一条十分保守的信号传导通路,从低等生物体到高等生物都具有高度同源性,Wnt/β-catenin 途径是该通路的经典分支,在神经系统的发育中起重要作用[11-12]。β-catenin又叫连环蛋白,是Wnt/β-catenin途径中的多功能蛋白,当Wnt通路处于关闭状态时,胞浆内的降解蛋白复合体却是活化状态,结合β-catenin并使之磷酸化,被磷酸化的β-catenin降解,无法进入细胞核与转录因子作用,不能启动核内靶基因。Wnt通路被激活时,胞质内调节β-catenin的降解复合体解离而失活,β-catenin去磷酸化,与核内的转录因子结合并相互作用,激活下游靶基因,启动基因的转录及表达。因此,在Wnt通路激活时,胞质内调控细胞增殖的关键分子β-catenin的表达水平是增高的[13-15]。本次实验显示脉冲强磁场作用于神经干细胞后,细胞β-catenin表达上调,而β-catenin表达增高又是Wnt信号激活的标志,所以,脉冲强磁场促神经干细胞增殖的机制可能是通过Wnt/β-catenin途径介导的。
1SANTILLI G, LAMORTE G, CARLESSI L, et al. Mild hypoxia enhances proliferation and multipotency of human neural stem cells [J]. PLos One, 2010, 5(1): e8575.
2OKANO H. Stem cell biology of the central nervous system [J]. J Neurosci Res, 2002, 69(6): 698-707.
3MENG D, XU T, GUO F, et al. The effects of high-intensity pulsed electromagnetic field on proliferation and differentiation of neural stem cells of neonatal rat in vitro [J]. J Huanzhong Univ Sci Technolog Med Sci, 2009, 29(6): 732-736.
4刘暌, 王红云. 胚胎大鼠神经干细胞电生理特性检测 [J]. 中华神经外科杂志, 2001, 17(5): 271-274.
5李剑锋, 闫金玉. 神经干细胞移植治疗脊髓损伤的研究现状 [J]. 中国组织工程研究与临床康复, 2009, 13(14): 2771-2774.
6CAI P Q, SUN G Y, CAI P S, et al. Survival of transplanted neurotrophin-3 expressing human neural stem cells and motor function in a rat model of spinal cord injury [J]. Neural Regen Res, 2009, 4(7): 485-491.
7ANDRES R H, HORIE N, SLIKKER W, et al. Human neural stem cells enhance structural plasticity and axonal transport in the ischaemic brain [J]. Brain, 2011, 134(6): 1777-1789.
8FUJIMOTO M, HAYASHI H, TAKAGI Y, et al. Transplantation of telencephalic neural progenitors induced from embryonic stem cells into subacute phase of focal cerebral ischemia [J]. Lab Invest, 2012, 92(4): 522-531.
9OH J S, PARK I S, KIM K N, et al. Transplantation of an adipose stem cell cluster in a spinal cord injury [J]. Neuroreport, 2012, 23(5): 277-282.
10尹小雨, 陈刚. 干细胞移植治疗脊髓损伤进展 [J]. 中华神经外科疾病研究杂志, 2014, 13(1): 89-91.
11VEEMAN M T, AXELROD J D, MOON R T. A second canon: eunctions and mechanisms of beta-catenin-independent Wnt signaling [J]. Dev Cell, 2003, 5(3): 367-377.
12WOODHEAD G J, MUTCH C A, OLSON E C, et al. Cell autonomous beta-catenin signaling regulates cortical precursor proliferation [J]. J Neurosci, 2006, 26(48): 12620-12630.
13BRVIA V, GRADL D, SCHAMBORNY A, et al. Bete-arrestin is a necessary component of Wnt/beta-catenin signaling in vitro and in vivo [J]. Proc Natl Acad Sci USA, 2007, 104(16): 6690-6695.
14DANIELS D L, EKLOF SPINK K, WEIS W I. bete-catenin: molecular plasticity and drug design [J]. Trends Biochem Sci, 2001, 26(11): 672-678.
15BREMBECK F H, ROSARIO M, BIRCHMEIRE W. Balancing cell adhesion and Wnt signaling, the key role of beta-catenin [J]. Curr Opin Genet Dev, 2006, 16(1): 51-59.
Electromagneticstimulationonproliferationanddifferentiationofspinalcordneuralstemcells
FENGFeng,MUXiang,YUANHua,WANGBingshui,LIUWei
DepartmentofPhysiotherapy,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032, China
ObjectiveThe study aims to investigate the effects of electromagnetic stimulation on proliferation and differentiation of rat spinal cord neural stem cells (NSCs) and the possible mechanisms.MethodsNSCs were isolated from the spinal cord of embryonic 14 d (E14 d) Wistar rats, and cultured in serum-free medium for two weeks. Then they were divided into the experiment and control groups. NSCs of experimental group were exposed in 0.1 Hz, 4T high-intensity pulsed electromagnetic field for 8 times, each 20 ms pulse discharge, and NSCs of control group were given sham stimulation. On the first day after intervention, 10% fetal bovine serum was used to induce adherence and differentiation; protein immunoblotting (Western Blot) was used to detect β-catenin protein expression one week after adherence, and NCSs could differentiate into MAP2 positive neurons by immunofluorescence staining two weeks later. Neuronal spontaneous discharge case was recorded by infrared visual patch clamp after two weeks.ResultsAfter the intervention, immunofluorescence staining revealed that the MAP2 positive cells of electromagnetic stimulation group was 45.4% ± 3.1%, which was significantly increased compared with 38.3%±6.0% of the control group (Plt;0.05). Western Blot showed that 7 days after the intervention the β-catenin protein level in electromagnetic stimulation group was higher than that of the control group. Spontaneous neuronal discharge which was recorded by patch clamp at 14th day after induction showed its physiological function.ConclusionHigh-intensity pulsed electromagnetic stimulation can promote the rat spinal cord neural stem cells to proliferate and differentiate into functional neurons.
Spinal cord; Neural stem cells; Electromagnetic stimulation; Cell proliferation
1671-2897(2017)16-035-04
R 34.1
A
国家国际合作基金资助项目(2013DFA32610);陕西省国际科技合作与交流计划资助项目(2015KW-035)
冯枫,主治医师,E-mail: 6762270 @qq.com
*通讯作者: 牟翔,教授、主任医师,E-mail: pro.mu@fmmu.edu.cn
2016-09-23;
2016-12-15)
