腹腔镜下微波消融治疗肝恶性肿瘤的效果分析
2017-11-22安东均赵维安
安东均, 安 琳, 张 成, 赵维安, 韩 立
(1 南方医科大学附属咸阳市中心医院 a. 肝胆外科; b. 超声介入科, 陕西 咸阳 712000;2 西安财经学院 统计学院, 西安 710100)
腹腔镜下微波消融治疗肝恶性肿瘤的效果分析
安东均1a, 安 琳2, 张 成1a, 赵维安1b, 韩 立1a
(1 南方医科大学附属咸阳市中心医院 a. 肝胆外科; b. 超声介入科, 陕西 咸阳 712000;2 西安财经学院 统计学院, 西安 710100)
目的探讨腹腔镜下微波消融(MWA)治疗肝恶性肿瘤的局部疗效和安全性。方法回顾性分析2014年6月-2016年5月南方医科大学附属咸阳市中心医院采用微波消融治疗的肝恶性肿瘤患者105例。按照MWA的入路分为超声引导下经皮肝穿刺MWA组(A组)55例和腹腔镜下MWA组(B组)50例。采用Kaplan-Meier法计算平均无瘤生存时间。计数资料组间比较比较采用χ2检验,正态分布的计量资料组间比较采用t检验。结果所有患者术后症状均有改善,肝区疼痛明显减轻,食欲增进。A、B组MWA并发症发生率分别为27.3%和8.0%,差异有统计学意义(χ2=6.144,P<0.05);一次性完全消融率分别为74.5%和92.0%,差异有统计学意义(χ2=5.162,P<0.05);术后1个月肝功能Child-Pugh分级评价比较差异有统计学意义(χ2=2.135,P<0.05);平均住院费用B组高于A组,(t=3.612,P<0.05);2组患者平均住院时间、平均无瘤生存时间及1年无瘤生存率无明显差异(P值均>0.05);术后2年及3年无瘤生存率比较B组优于A组,(χ2=6.426、3.162,P值均<0.05);结论经腹腔镜途径扩大和优化了肝肿瘤微波治疗适应证范围,疗效好,并发症少,是对肝恶性肿瘤微波治疗的拓展、完善和优化。
肝肿瘤; 导管消融术; 腹腔镜; 治疗结果
微波消融(microwave ablation,MWA)治疗肝恶性肿瘤具有简便有效、创伤小、安全可靠、适应证广的优势[1-2]。近年来经皮MWA在肝肿瘤的治疗中得到广泛应用,同时也应用于肝癌经肝动脉栓塞化疗后的加强治疗以及开腹手术难以完全切除的肝肿瘤治疗[3]。经皮MWA相关死亡率仅为0.1%~1.0%,对于早期肝癌可获得与手术切除相近的生存率[4]。通过对本院采用MWA治疗肝恶性肿瘤的病例资料进行回顾性分析,探讨腹腔镜MWA治疗肝恶性肿瘤的局部疗效和安全性。
1 资料与方法
1.1 研究对象 收集2014年6月-2016年5月南方医科大学附属咸阳市中心医院肝胆外科采用MWA治疗肝恶性肿瘤105例患者的临床资料。治疗前经B超、CT及AFP检测,确诊为原发性肝癌74例,转移性肝癌31例。肿瘤直径3~15 cm(中位值7.3 cm),其中直径≤4 cm者35例。单个肿瘤结节者42例,≥2个肿瘤结节者63例。按照入路不同分为超声引导下经皮肝穿刺MWA组(A组)55例和腹腔镜下MWA组(B组)50例。
1.2 纳入标准 (1)不愿接受开腹手术的小肝癌患者;(2)年老体弱无法耐受手术切除的肝转移癌或复发癌患者;(3)腹腔镜肝叶切除术中主瘤切除后无法实施子灶切除的患者;(4)经评估需要多次经皮肝穿刺MWA治疗的大肝癌或多发肝癌患者,可在腹腔镜下一次治疗纳入B组;(5)毗邻重要脏器的近肝表面肿瘤患者,不愿接受开腹手术的纳入腹腔镜治疗。
1.3 仪器与设备 (1)IE-8M型冷循环微波聚能手术治疗系统:微波频率2450 MHz,最大输出功率80 W;(2)冷基循环微波聚能刀(MD-16MCBL-10/160):前端裸露长度18 mm,直径1.6 mm;(3)日本ProSound SSD-3500超声仪:配备凸阵变频探头,探头频率315~510 MHz,并配有相应的穿刺导向固定支架;(4)以色列Sharplan腹腔镜超声(laparoscopic ultrasound,LUS)成像系统(由数字式视频摄像系统、数字式双图像显示系统和腹腔镜高分辨超声系统组成):配备小凸阵探头,频率8.0 MHz,轴直径10 mm,长度310 mm;(5)奥林巴斯电子腹腔镜系统:配备A50012A主机,PE300BF光源,全自动40 L气腹机。在常规腹腔镜手术器械的基础上配置腹腔镜下肿瘤手术专用微波消融针。
1.4 手术方法 A组在局麻和静脉复合麻醉超声引导下,选择合适的经皮穿刺点及进针入路。常规消毒铺巾,取14 G引导针穿刺至肿瘤部位;导入微波聚能刀,输出功率60~80 W,消融时间依肿瘤大小而定,一般为10 min左右,开启同时蠕动泵冷循环降温。治疗时B超影像显示局部回声增强,随着时间延长,强回声区范围逐渐扩大至距肿瘤边缘0.5~1.0 cm正常肝组织。治疗结束后拔出微波天线和套管,无菌敷料包扎伤口。B组应用气管内插管全麻下建立气腹,脐上缘戳孔放置腹腔镜行腹腔内全方位扫描,在LUS配合下参照术前肝脏三维CT扫描结果,进一步明确病灶部位、大小、数量以及肿瘤腹腔内转移情况。准确判断后制定腹腔镜下MWA的确切方案:是否行单纯MWA治疗;是否需与腹腔镜肝癌切除联合进行;确定腹腔镜监视下的消融针经皮入路还是用腹腔镜专用微波消融针腹腔内入路。选好利于操作的位置后,戳孔置入相应器械及消融针,在LUS配合腹腔镜直视下穿刺肿瘤至中心部位行MWA。
1.5 MWA术后管理 肝肿瘤行MWA治疗后可发生微波热损伤、消融针所致的器械性损伤及腹腔镜手术相关性并发症,严重时可危及患者生命,必须严密观察。术后超声监测有无肝包膜下血肿及胸腔、腹腔积液,密切观察Hb水平的变化;术后体温≥38 ℃时,超声或CT判断有无肝脓肿发生;依据胸腹部体征变化及时摄X线片,以判断有无血气胸、空腔脏器穿孔、胆漏等,及时发现和处理。
1.6 疗效判定 依据改良实体肿瘤治疗疗效判定标准,MWA术后1个月增强CT检查,肿瘤部位呈完全低密度无增强,判定为完全消融,否则为消融不完全。完全消融率为完全消融例数/可评价例数×100%。随诊期间,完全消融后的病灶又发强化灶,或发现新病灶及AFP重新升高,判定为复发。同时术后1个月随访肝功能Child-Pugh分级情况。随访1~3年,观察统计各组完全消融患者的平均无瘤生存时间。

2 结果
2.1 一般资料 2组患者术前一般情况的比较差异无统计学意义(P值均>0.05),具有可比性(表1)。
2.2 疗效及预后 所有患者术后症状均有改善,肝区疼痛明显减轻,食欲增进。2组患者MWA并发症发生率分别为27.3%和8.0%,差异有统计学意义(χ2=6.144,P<0.05)。A组发生腹腔内出血2例,致循环不稳,经扩容、输血纠正休克后,立即在全麻下经腹腔镜探查,行微波或电凝止血后出院。术后2 d发生肺梗塞1例,及时给予低分子肝素钙治疗后痊愈。A组发生胆漏2例,B组1例,术后均在B超引导下穿刺置管引流痊愈(表2)。
A、B组患者一次性完全消融率分别为74.5%和92.0%,差异有统计学意义(χ2=5.162,P<0.05);术后1个月肝功能Child-Pugh分级评价比较差异有统计学意义(χ2=2.135,P<0.05);平均住院费用B组高于A组,差异有统计学意义(t=3.612,P<0.05);2组患者平均住院时间、平均无瘤生存时间及1年无瘤生存率无明显差异(t=0.628,χ2=0.562、0.288,P值均>0.05);术后2年及3年无瘤生存率比较B组优于A组,差异均有统计学意义(χ2=6.426、3.162,P值均<0.05)(表3,4)。
综上所述,帕金森病患者的运动并发症的发病机制非常复杂,对患者的正常生活造成巨大影响,目前虽然已经有很多的治疗方案,但其治疗的效率并不理想,在临床治疗中存在很多问题,这些问题目前还没有找到最好的解决方法。对帕金森病运动并发症的临床研究过程中,开始尝试非多巴胺系统的临床研究,为治疗帕金森病提供了新的药物研制方式,但是,对不同类型帕金森病治疗药物的具体作用与治疗效果之间的关系没有明确的界定,因此,对帕金森病运动并发症的研究依然是目前我国医疗界的主要研究工作。

表1 2组患者MWA术前一般资料比较

表2 2组患者MWA术后并发症比较(例)

表3 2组患者MWA局部疗效、术后1个月肝功能比较
表4 2组中完全消融患者的平均无瘤生存时间及术后1、2、3年的无瘤生存率比较
3 讨论
采用MWA治疗肝肿瘤是通过插入肿瘤病灶的微波聚能针头释放的微波,产生高能聚焦热量,使肿瘤中心的温度上升至65 ℃以上,从而使肿瘤组织发生凝固性坏死。同时灭活的肿瘤组织可产生热休克蛋白,刺激机体的免疫系统,提高免疫功能,发挥限制肿瘤细胞扩散的作用[5]。此外,高能微波热量还可导致p53等基因改变,从而诱导肿瘤细胞凋亡。MWA的侵袭性低,对机体功能影响小、适应证广且简便有效。
位于肝脏表面的肿瘤大多临近膈肌或胃肠道等重要脏器,对于肿瘤部位特殊、肝硬化程度重、合并其他系统疾病的肝肿瘤患者,若不愿接受开腹手术治疗,行经皮MWA治疗的风险亦较大[6],易导致毗邻脏器器械性损伤和微波热损伤。本研究中,1例行经皮肝穿刺患者的转移性肝癌位于肝左叶,与结肠存在黏连,由于MWA用时过长,术后2周出现结肠瘘。此外,经皮MWA由于受到肺或消化道气体干扰,超声下病灶定位困难,消融针穿刺较难到达理想位置,影响完全消融效果。即便穿刺到位,为避免损伤毗邻脏器,MWA的工作时间及微波功率均可能被术者顾忌而使肝边缘肿瘤组织消融不完全,导致MWA治疗后肿瘤复发。
针对特殊部位的肝肿瘤,腹腔镜下MWA能够克服经皮治疗的诸多困难。对位于膈顶部的肿瘤,超声引导下穿刺胸腔置入导管后注入适量5%葡萄糖液造成人工胸水,使肺上抬可避开穿刺路径。同时腹腔镜下人工气腹使膈肌抬高,能够使近膈肌部肿瘤显示清晰(图1a),可避免超声引导经皮置入消融针时造成肺部损伤及消融导致的膈肌烧灼伤,安全实施近膈顶部肿瘤MWA。对于临近胃肠道的肝肿瘤,可变换手术体位并采用腹腔镜器械将临近肝脏的脏器拨开或置入隔热纱布,使毗邻脏器远离肝脏,然后在超声和腹腔镜下行MWA(图1b)。如果腹腔镜下经皮穿刺消融难以实施,可在LUS的引导下应用腹腔镜腔内消融针行穿刺消融。
对紧邻肝内较大血管及胆管的肿瘤,消融针穿刺应在LUS监视下进行,并充分规划MWA范围。除避免大血管或胆管损伤引发出血和胆漏以外,微波热损伤也会引起相关静脉血栓形成,导致肺梗塞的发生,且易被忽视。本研究中,1例行经皮MWA患者术后2 d发生肺梗塞,因发现及时给予低分子肝素钙治疗痊愈。近年来随着腹腔镜肝切除广泛开展,联合腹腔镜下MWA治疗也得到推广应用[7]。毗邻肝表面或大管道的肿瘤较易在腹腔镜下切除,对于主瘤切除后难以切除的子瘤则可同时行腹腔镜下MWA治疗,从而扩大了腹腔镜肝肿瘤切除的适应证。本研究中,6例腹腔镜下MWA患者在施行肝切除过程中同时行MWA,取得了良好的治疗效果。
腹腔镜和LUS同期实时监控,能够使术者确切观察到包括肿瘤及其周围0.5~1 cm的肝组织消融范围。腹腔镜下可用器械或涤纶带关闭肝十二指肠韧带,施行入肝血流阻断(图1c),避免肝血流带走过多热量,从而提高MWA的疗效,减少出血并发症的发生。此外,在腹腔镜下经皮肝穿刺消融近膈顶部位肝肿瘤时,人工胸水虽可避免肺部损伤,但穿刺针对于膈肌的器械性损伤及热损伤仍需特别注意,此时应尽量降低人工气腹的压力,待消融完毕解除人工气腹后再拔除消融针,以免腹腔内高压气体通过膈肌穿刺部位漏气造成严重气胸。当肿瘤毗邻胆囊时,为避免胆囊损伤,同时兼顾肿瘤的完全消融,可在腹腔镜下先行胆囊切除术,而后再行MWA治疗。这些措施在保证治疗效果满意的同时,可显著减少并发症的发生。本研究结果显示,腹腔镜下MWA肿瘤完全消融率优于超声引导下经皮肝穿刺MWA。


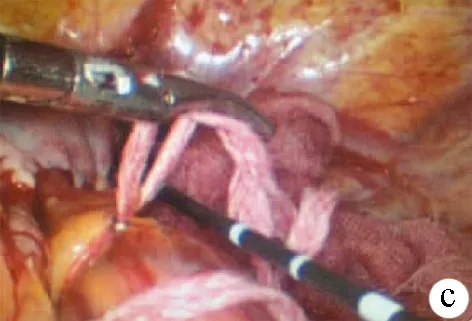
图1 MWA术中操作a: 腹腔镜下人工气腹使膈肌抬高,近膈部肝肿瘤显示清晰;b: 腹腔镜下拨开毗邻胃肠道肝肿瘤的临近脏器,置入隔热纱布行MWA;c: 腹腔镜下涤纶带关闭肝十二指肠韧带阻断入肝血流
腹腔镜下MWA治疗肝恶性肿瘤具有创伤小、痛苦少、适应证广、疗效好及安全可靠、并发症少的优点。腹腔镜下MWA治疗肝肿瘤是微波治疗的进针途径之一,是对肝恶性肿瘤微波治疗的拓展、完善和优化。
[1] TIAN WS, KUANG M, LYU MD, et al. A randomised comparative trial on liver tumors treated with ultrasound-guided percutaneous radiofrequency versus microwave ablation[J]. Chin J Hepatobiliary Surg, 2014, 20(2):119-122. (in Chinese)
田文硕, 匡铭, 吕明德, 等. 超声引导经皮射频消融与微波消融治疗肝脏肿瘤的随机对照研究[J].中华肝胆外科杂志, 2014, 20(2): 119-122.
[2] LIU P, WEI ZB, YU JY, et al. Clinical efficacy of microwave ablation and surgical resection for the treatment of early hepatocellular carcinoma: a Meta analysis[J]. Chin J Dig Surg, 2015, 14(12): 1031-1037. (in Chinese)
刘平, 魏子白, 于俊岩, 等. 微波消融与手术切除治疗早期原发性肝癌临床疗效的Meta分析[J]. 中华消化外科杂志, 2015, 14(12): 1031-1037.
[3] AN DJ, ZHENG XY, ZHANG C. A clinical study of complications arising from microwave ablation for 358 liver tumors[J]. J Hepatobiliary Surg, 2015, 23(1): 24-26. (in Chinese)
安东均, 郑晓燕, 张成. 358例肝肿瘤微波消融并发症的临床分析[J]. 肝胆外科杂志,2015, 23(1): 24-26.
[4] LIU LN, XU HX, LU MD,et al. Percutaneous Ultrasound -guided thermal ablation liver tumor with artificial pleural effusion or ascites[J]. Chin J Cancer, 2010, 29(9): 830-835.
[5] HUANG QS. Chang in immune function after microware ablation for liver cancer[J]. Diagn Imag Interv Radiol, 2015, 24(4): 330-334. (in Chinese)
黄巧胜. 肝癌微波消融后的机体免疫功能变化[J]. 影像诊断与介入放射学, 2015, 24(4): 330-334.
[6] LI XH, FENG ZQ, ZHANG HY, et al. Severe complications after ultrasound-guided percutaneous microwave coagulation therapy for primary hepatic car-cinoma[J]. J Clin Hepatol, 2016, 32(1): 72-75. (in Chinese)
李新慧, 冯志强, 张洪义, 等. 原发性肝癌患者行超声引导下经皮微波消融术后相关并发症的发生情况[J]. 临床肝胆病杂志, 2016, 32(1): 72-75.
[7] LIU B, LI WG, CHEN FZ. Laparoscopic hepatectomy: the choice in the era of minimally invasive surgery[J]. J Clin Hepatol, 2017, 33(4): 643-646.(in Chinese)
刘斌, 李文岗, 陈福真. 腹腔镜肝切除术——微创外科时代的选择[J]. 临床肝胆病杂志, 2017, 33(4): 643-646.
引证本文:AN DJ, AN L, ZHANG C, et al. Efficacy of laparoscopic microwave ablation in treatment of malignant liver tumors[J]. J Clin Hepatol, 2017, 33(11): 2158-2161. (in Chinese)
安东均, 安琳, 张成, 等. 腹腔镜下微波消融治疗肝恶性肿瘤的效果分析[J]. 临床肝胆病杂志, 2017, 33(11): 2158-2161.
(本文编辑:邢翔宇)
Efficacyoflaparoscopicmicrowaveablationintreatmentofmalignantlivertumors
ANDongjun,ANLin,ZHANGCheng,etal.
(DepartmentofHepatobiliarySurgery,XianyangCentralHospital,SouthernMedicalUniversity,Xianyang,Shaanxi712000,China)
ObjectiveTo investigate the local efficacy and safety of laparoscopic microwave ablation (MWA) in the treatment of malignant liver tumors.MethodsA retrospective analysis was performed for the clinical data of 105 patients with malignant liver tumors who were admitted to Xianyang Central Hospital, Southern Medical University, from June 2014 to May 2016 and treated by MWA. According to the surgical approach of MWA, these patients were divided into ultrasound-guided percutaneous microwave coagulation therapy group (group A) with 55 patients and laparoscopic MWA group (group B) with 50 patients. The Kaplan-Meier method was used to calculate mean disease-free survival. As for the data of postoperative complications, local efficacy of MWA, liver function at 1 month after surgery, mean disease-free survival time, and 1-, 2-, and 3-year disease-free survival rates after surgery, the chi-square test was used for the comparison of categorical data between groups; the normally distributed continuous data were expressed as mean±SD, and thet-test was used for comparison.ResultsAll patients had improvements in the symptoms after surgery, marked alleviation of liver pain, and increased appetite. There were significant differences between group A and group B in the incidence rate of complications (27.3% vs 8.0%,χ2=6.144,P<0.05), one-time complete ablation rate (74.5% vs 92.0%,χ2=5.162,P<0.05), and Child-Pugh class of liver function at 1 month after surgery (χ2=2.135,P<0.05). Group B had significantly higher mean hospital costs than group A (t=3.612,P<0.05). There were no significant differences between the two groups in mean hospital stay, mean disease-free survival time, and 1-year disease-free survival rate (t=0.628,χ2=0.562 and 0.288, allP>0.05). Compared with group A, group B had significantly higher 2- and 3-year disease-free survival rates (χ2=6.426 and 3.162, bothP<0.05).ConclusionThe laparoscopic approach expands and optimizes the range of the indications for microwave therapy for liver tumors and has good efficacy and few complications.
liver malignant tumors; catheter ablation; laparoscopes; treatment outcome
R735.7
A
1001-5256(2017)11-2158-04
10.3969/j.issn.1001-5256.2017.11.021
2017-06-07;
2017-07-07。
安东均(1958-),男,主任医师,主要从事肝胆胰外科的临床与基础研究。
