自身免疫性肝炎-原发性胆汁性胆管炎重叠综合征的临床及病理学特征分析
2017-11-22王婷婷鲁昌立凡小丽
王婷婷, 鲁昌立, 凡小丽, 杨 丽
(四川大学华西医院 消化内科, 成都 610041)
自身免疫性肝炎-原发性胆汁性胆管炎重叠综合征的临床及病理学特征分析
王婷婷, 鲁昌立, 凡小丽, 杨 丽
(四川大学华西医院 消化内科, 成都 610041)
目的自身免疫性肝炎-原发性胆汁性胆管炎重叠综合征(AIH-PBC OS)的诊断仍然是目前尚未解决的难点,对AIH-PBC OS与AIH的临床与病理特征进行比较分析,以加强对AIH-PBC OS的认识,提高AIH-PBC OS的早期诊断率。方法前瞻性收集2015年1月20日-2016年11月28日于四川大学华西医院就诊且经肝穿刺确诊的AIH-PBC OS患者(50例)和单纯AIH患者(57例)的临床特征、生化免疫学指标、自身抗体和肝组织病理学表现等方面,比较AIH-PBC OS与AIH的不同特点。实验室指标等计量资料2组间比较采用非参数秩和检验;临床特征、肝组织病理学表现等计数资料2组间比较采用χ2检验。结果AIH-PBC OS组发病年龄低于AIH组(Z=-1.975,P=0.048),男女性别比无明显差异。AIH-PBC OS患者较AIH患者更易出现瘙痒症状(22.0% vs 7.0%,χ2=4.960,P=0.026)。AIH-PBC OS组ALP、GGT和IgM水平以及AMA的阳性率均高于AIH组(Z=-6.250、-4.789、-5.407、χ2=26.811,P值均<0.001),而血清ALT、AST和IgG的水平则低于AIH组(Z=-2.916、-3.381、-2.285,P=0.004、0.001、0.022)。肝穿刺活组织检查AIH-PBC OS组患者胆管损伤、胆管缺失、肉芽肿样病变和胆汁淤积的发生率均高于AIH组(χ2=25.612、15.953、6.490、10.042,P<0.001、<0.001、0.001、0.002)。结论AIH-PBC OS虽然同时具备AIH和PBC的特点,但并非AIH与PBC的简单叠加。瘙痒,ALP、GGT、IgM水平显著升高,AMA阳性,病理学表现出的炎症性胆管病变和胆汁淤积均对AIH-PBC OS的诊断有提示作用。由于AIH-PBC OS的肝脏炎症损伤程度和自身免疫异常程度总体可能较AIH轻,故在AIH-PBC OS诊断时应考虑适当放宽巴黎标准中ALT、IgG的水平,以防因漏诊而影响治疗方案的选择和患者预后。
肝炎, 自身免疫性; 胆管炎, 硬化性; 病理学, 临床; 疾病特征
在自身免疫性肝病患者中,部分患者可能会同时或先后出现2种典型自身免疫性肝病特征,如自身免疫性肝炎(AIH)、原发性胆汁性胆管炎(PBC)和(或)原发性硬化性胆管炎,通常将这种情况称为“重叠综合征”[1-4],其中以AIH重叠PBC最为常见[5]。AIH是一种由针对肝细胞的自身免疫反应所导致的肝实质炎症,以血清自身抗体阳性、高IgG和(或)高γ-球蛋白血症、肝组织学上存在界面性肝炎、免疫抑制剂治疗有效为特点,如不治疗常可导致肝硬化、肝衰竭[6]。PBC是一种慢性肝内胆汁淤积性疾病,以血清抗线粒体抗体(AMA)阳性、病理呈进行性非化脓性破坏性肝内小胆管炎为特点,最终亦可发展至肝硬化和肝衰竭,熊去氧胆酸(UDCA)、奥贝胆酸为公认的有效治疗药物[7]。
迄今为止,重叠综合征的发病机制仍不清楚,且尚无足够的证据证明此类疾病是一种独立的疾病[8]。巴黎标准是目前国内外推荐且最常用的AIH-PBC重叠综合征(AIH-PBC overlap syndrome,AIH-PBC OS)的诊断标准,其诊断AIH-PBC OS的特异性和敏感性分别为92%和97%[9]。但由于尚缺乏统一的、国际认可的诊断标准,因此对此类疾病的诊断仍一直存在较大的争议。同时,对AIH-PBC OS及时和正确的诊断与治疗及预后密切相关,故正确认知AIH-PBC OS的特征具有极其重要的临床意义。
AIH-PBC OS的起病形式多样、临床表现缺乏特异性,AIH-PBC OS可在疾病初期就表现为同时具有AIH和PBC的特征,也可在典型的AIH或PBC的基础上发展而成[10-11],故本研究连续性地选取了经肝穿刺确诊的50例AIH-PBC OS和57例AIH患者,对其临床特征、血清学和组织病理学表现进行比较、分析和总结,以期能找到AIH-PBC OS与单纯AIH的不同之处,从而丰富临床医生对该类疾病的认识,并为AIH-PBC OS的临床诊断提供参考。
1 资料与方法
1.1 研究对象 选取2015年1月20日-2016年11月28日于四川大学华西医院住院治疗且均进行了肝穿刺活组织检查,经病理科专家读片评判后再综合临床诊断,符合巴黎诊断标准的AIH-PBC OS患者50例和AIH患者57例。
1.2 诊断标准 AIH-PBC OS的诊断参照1998年Chazouillères等[1]提出的巴黎标准,即AIH和PBC的3项诊断标准中的各3项同时或相继出现,其中AIH诊断标准包括:(1)ALT≥5×ULN;(2)IgG≥2×ULN 或平滑肌抗体阳性;(3)肝组织学提示中重度界面性肝炎(此条为必须);PBC诊断标准包括:(1)ALP≥2×ULN或GGT≥5×ULN;(2)AMA或AMA-M2阳性;(3)肝组织学表现为非化脓性破坏性胆管炎。AIH的诊断参照2010年美国肝病学会AIH诊断与治疗指南及评分诊断标准[12-13]。
1.3 观察指标
1.3.1 临床特征 包括一般情况(性别、年龄)、临床症状(黄疸、乏力、瘙痒等)、合并肝外自身免疫性疾病(干燥综合征、桥本氏甲状腺炎等)的情况以及是否已发展为肝硬化(影像学或活组织检查提示肝硬化)。
1.3.2 实验室指标 (1)肝生化指标:TBil、DBil,Alb、Glo、ALT、AST、ALP、GGT;(2)免疫球蛋白:IgG、IgM。(3)自身抗体:抗核抗体(ANA)、AMA、抗可溶性肝抗原抗体(SLA)、抗肝肾微粒体抗体(LKM)、抗1型肝细胞溶质抗原抗体(LC-1)。
1.3.3 肝穿刺活组织病理学表现 从界面性肝炎、淋巴浆细胞浸润、小叶炎、肝细胞玫瑰花环、桥接坏死、胆管损伤、胆管缺失、胆管增生、肉芽肿样变和胆汁淤积等方面进行比较。
1.4 统计学方法 采用SPSS19.0统计软件进行数据分析。实验室指标等计量资料以中位数和四分位数间距[M(P25~P75)]表示,2组间比较采用非参数秩和检验;临床特征等计数资料2组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
2.1.1 一般资料 AIH-PBC OS组的年龄明显低于AIH组(Z=-1.975,P=0.048),2组在性别上的差异无统计学意义(P>0.05)(表1)。
2.1.2 临床症状 AIH-PBC OS组与AIH组患者的临床症状均缺乏特异性,黄疸、乏力和纳差为2组患者最常见的症状。AIH-PBC OS组与AIH组相比,表现出瘙痒症状的患者更多(χ2=4.960,P=0.026)。而其他如乏力、厌油、纳差、腹痛、腹胀等症状的发生情况相比均无统计学差异(P值均>0.05)(表1)。
2.1.3 合并肝外自身免疫性疾病 AIH-PBC OS组共有12例患者合并肝外自身免疫性疾病,其中合并干燥综合征(sicca syndrome,SS)8例,合并类风湿性关节炎(rheumatoid arthritis,RA)2例、合并自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)2例。AIH组有14例患者合并肝外自身免疫性疾病,其中合并SS 5例,合并AITD 5例,合并RA 2例,合并系统性红斑狼疮(systemic lupus erythematosus,SLE)1例,合并RA+AITD 1例。2组在合并肝外自身免疫性疾病方面差异无统计学意义(P>0.05)(表1)。
2.1.4 合并肝硬化 AIH-PBC OS组和AIH组各有30例(60.0%)和34例(68.0%)患者在初诊时即存在肝硬化,其中失代偿期患者为23例(76.7%)和24例(70.6%),但2组差异无统计学意义(P>0.05)(表1)。
2.2 实验室指标
2.2.1 肝生化指标 AIH-PBC OS组血清ALP、GGT水平显著高于AIH组(371.5 U/L vs 171.0 U/L、308.5 U/L vs 142.0 U/L),差异有统计学意义(Z值分别为-6.250、-4.789,P值均<0.001),而血清ALT、AST水平则低于AIH组(185.5 U/L vs 303.0 U/L,185.0 U/L vs 345.0 U/L),差异有统计学意义(Z值分别为-2.916、-3.381,P值均<0.05)。其余肝生化指标TBil、DBil、Alb、Glo在2组间比较差异无统计学意义(P值均>0.05)(图1,表2)。
2.2.2 免疫球蛋白 AIH-PBC OS组IgG水平明显低于AIH组(23.5 g/L vs 26.6 g/L),IgM水平明显高于AIH组(3910.0 mg/L vs 1930.0 mg/L),差异均有统计学意义(Z值分别为-2.285、-5.407,P值均<0.05)(图2,表2)。
2.2.3 自身抗体 AIH-PBC OS组的AMA阳性率显著高于AIH组(60.0% vs 12.3%,χ2=26.811,P<0.001)。AIH-PBC OS组与AIH组相比,ANA、SLA、LKM的阳性率差异均无统计学意义(P值均>0.05)(表3),2组均未检测到LC-1阳性。
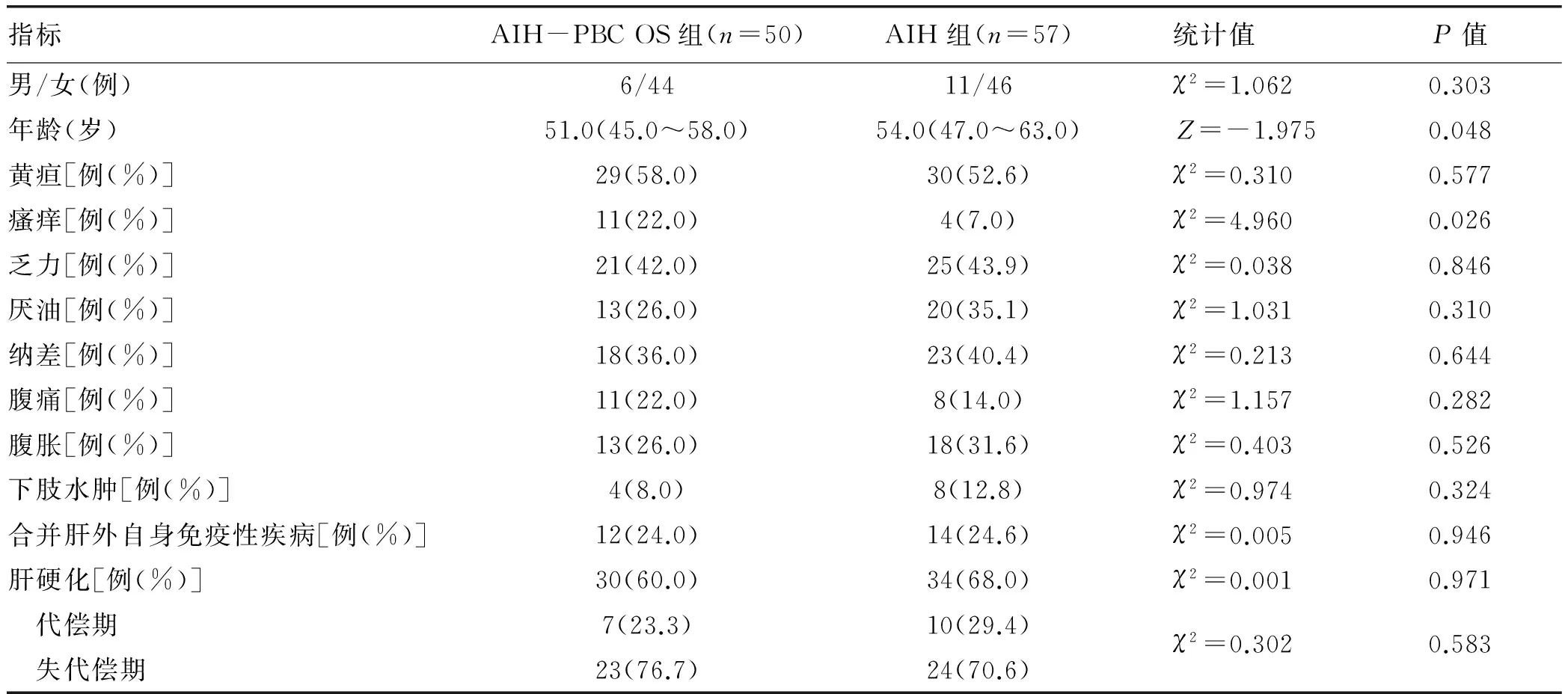
表1 AIH-PBC OS组和AIH组患者的临床特征比较

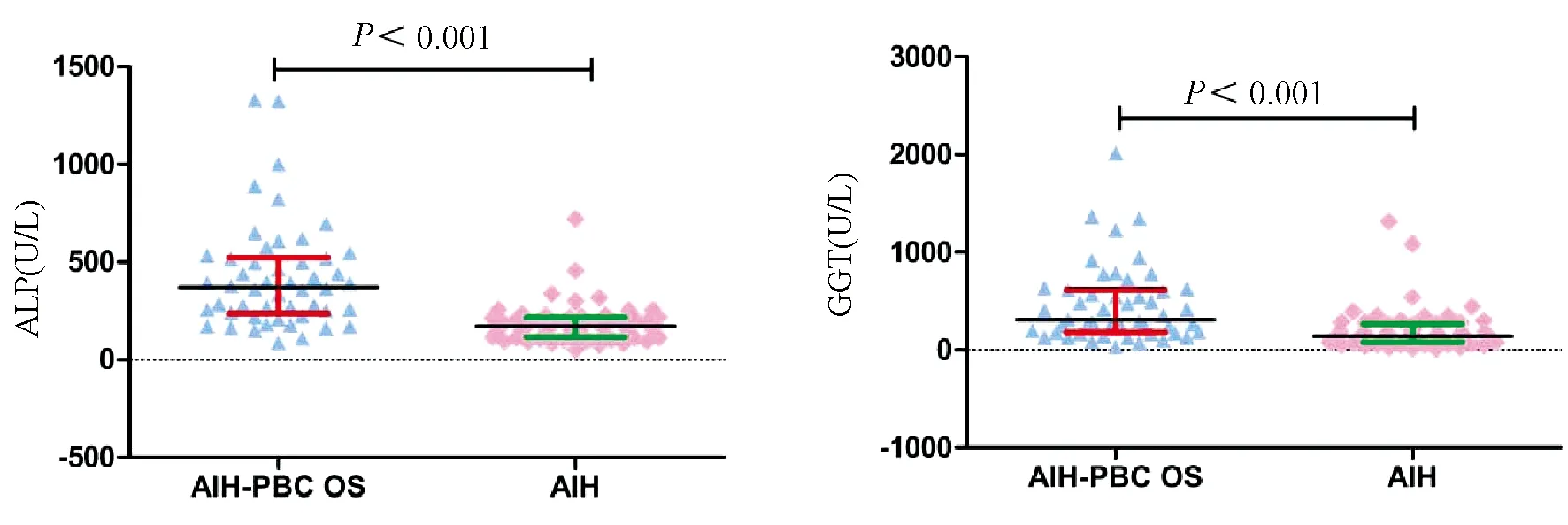
图1 2组患者各项肝生化指标水平比较
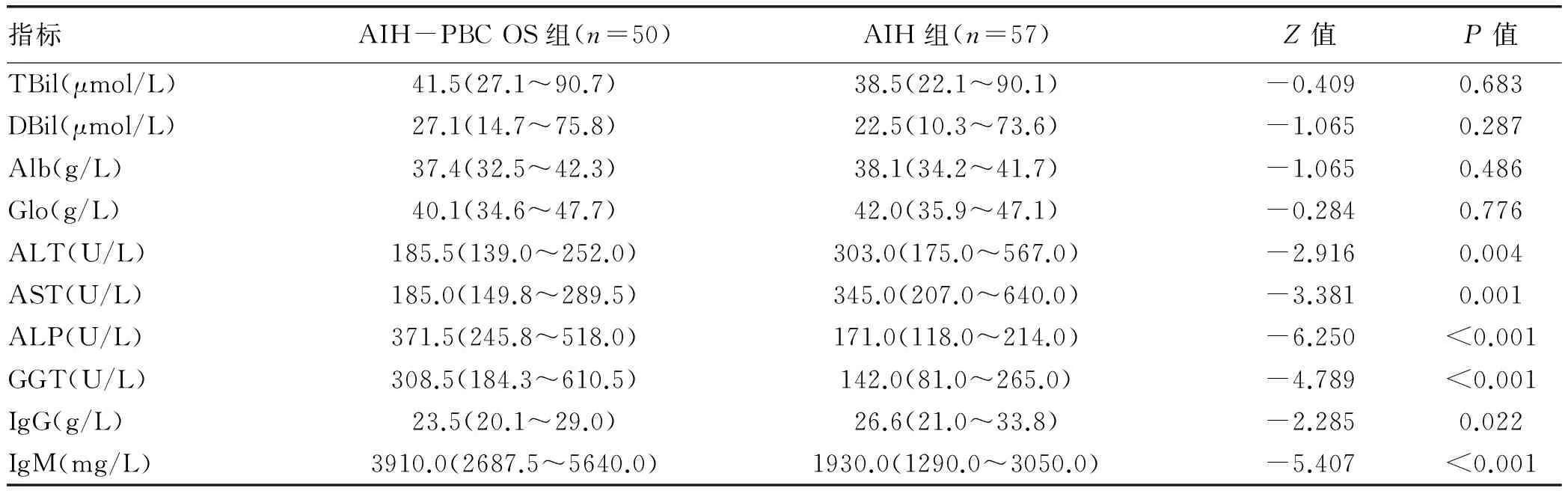
指标AIH-PBCOS组(n=50)AIH组(n=57)Z值P值TBil(μmol/L)41.5(27.1~90.7)38.5(22.1~90.1)-0.4090.683DBil(μmol/L)27.1(14.7~75.8)22.5(10.3~73.6)-1.0650.287Alb(g/L)37.4(32.5~42.3)38.1(34.2~41.7)-1.0650.486Glo(g/L)40.1(34.6~47.7)42.0(35.9~47.1)-0.2840.776ALT(U/L)185.5(139.0~252.0)303.0(175.0~567.0)-2.9160.004AST(U/L)185.0(149.8~289.5)345.0(207.0~640.0)-3.3810.001ALP(U/L)371.5(245.8~518.0)171.0(118.0~214.0)-6.250<0.001GGT(U/L)308.5(184.3~610.5)142.0(81.0~265.0)-4.789<0.001IgG(g/L)23.5(20.1~29.0)26.6(21.0~33.8)-2.2850.022IgM(mg/L)3910.0(2687.5~5640.0)1930.0(1290.0~3050.0)-5.407<0.001


图2 2组患者血清免疫球蛋白水平比较
2.3 肝组织病理学表现 AIH-PBC OS组胆管损伤、胆管缺失、胆汁淤积和肉芽肿样变的发生率明显高于AIH组,差异均有统计学意义(P值均<0.05)(表4)。其他如界面性肝炎、肝小叶内炎症、淋巴浆细胞浸润、肝细胞玫瑰花环、桥接坏死、胆管增生等病理表现,2组间比较差异均无统计学意义(P值均>0.05)(表4)。典型的肝组织病理表现见图3。
3 讨论
本研究中,AIH-PBC OS组及AIH组患者均以50岁左右的中老年女性居多,AIH-PBC OS组的发病年龄稍低于AIH组,男女性别比无显著差异,与国内外相关研究结果一致[14-16],2组患者最常见的症状均为黄疸和乏力,提示仅仅依靠年龄、性别和早期的临床症状很难作出鉴别诊断。但值得注意的是,AIH-PBC OS组较AIH组发生瘙痒的患者所占比例更高,同时结合肝生化指标的比较发现,AIH-PBC OS组患者血清ALP、GGT水平显著高于AIH组,胆红素水平虽与AIH组相比并无统计学差异,但亦较AIH组高,且以DBil增高为主,以上结果均可提示AIH-PBC OS的患者同时有肝脏炎症和肝内胆汁淤积,随后在对肝组织病理表现进行比较后也发现AIH-PBC OS组胆汁淤积的比例显著大于AIH组,再次验证了这一结论。因此,瘙痒虽为非特异性的临床症状,但是对AIH-PBC OS的早期诊断以及在与AIH的鉴别诊断中均具有一定的提示作用。

表4 AIH-PBC OS组和AIH组肝组织病理学特征比较[例(%)]
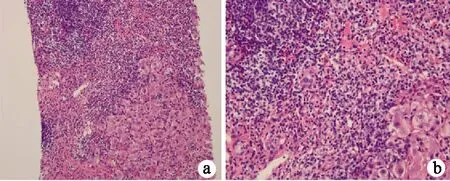
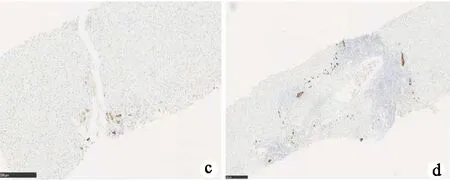
图3典型的肝组织病理学表现a,b: 汇管区大量淋巴浆细胞浸润,重度界面性肝炎以及明显的肝细胞玫瑰花环(HE染色;a:×200; b:×400); c,d: 典型的胆管病变, 胆管消失, 汇管区可见胆小管反应(细胞角蛋白染色;c:×40; d:×25)
AIH-PBC OS组与AIH组的病理特征比较结果显示,2组界面性肝炎无明显差异。一种可能性是AIH-PBC OS与AIH相比,其界面性肝炎的程度确无明显区别;另一种可能性是AIH-PBC OS与AIH的界面性肝炎的程度存在区别,但由于本研究所纳入的AIH-PBC OS的患者是严格按照巴黎标准进行筛选的,其中AIH部分的诊断标准明确说明中重度界面性肝炎为AIH-PBC OS诊断所必须,而AIH组的诊断则是按美国肝病学会指南中的AIH评分标准进行筛选的,对界面性肝炎的程度要求不如AIH-PBC OS的诊断严格,因此最终纳入的2组患者间界面性肝炎的比较结果也许并不能真实地反映出AIH-PBC OS与AIH间界面性肝炎程度的真实差异。此外,2组患者桥接坏死的差异虽无统计学意义,但从2组桥接坏死的患者比例(8.0% vs 21.1%)可以推测,AIH患者较AIH-PBC OS患者更易出现桥接坏死,且这一趋势或许能通过扩大样本量得以证实。同时,AIH-PBC OS患者的血清ALT、AST水平明显低于AIH组,可以推测AIH-PBC OS患者的肝细胞炎症损伤程度可能较AIH轻。另一方面,从IgG的水平来看,AIH-PBC OS组低于AIH组,说明AIH-PBC OS患者自身免疫反应的程度也较AIH轻。综上分析提示,完全依照巴黎标准进行AIH-PBC OS的诊断很有可能造成漏诊,结合临床实际发现,有较大比例的、未达到AIH-PBC OS巴黎诊断标准的PBC患者,在加用免疫抑制剂治疗之后往往能取得比单用UDCA更好的疗效。因此,可否考虑适当放宽AIH-PBC OS的巴黎诊断标准,抑或制订适用于我国的AIH-PBC OS诊断新标准值得商榷。
从合并肝外自身免疫性疾病的情况来看,AIH-PBC OS组与AIH组无明显差异,可看出AIH-PBC OS仍具有AIH易伴发肝外自身免疫性疾病的特征。初诊时AIH-PBC OS、AIH组中有肝硬化表现的患者各占60.0%和68.0%,AIH-PBC OS组处于肝硬化失代偿期的患者比例高于AIH组,虽差异无统计学意义,但基于既往有文献[17-18]指出AIH-PBC OS患者具有发生肝硬化和其并发症的高风险,且比单纯AIH或PBC的患者进展为肝硬化的速度更快[19],结合本研究的数据分析,可看出AIH-PBC OS相对于单纯AIH,可能更易出现肝硬化进展,这一结论仍需更大样本量以及多中心的临床研究结果予以证实。
自身抗体对自身免疫性肝病的诊断及鉴别诊断具有重要意义。临床上,约70%~80%的AIH患者呈ANA阳性[16],约95%的PBC患者呈AMA阳性[20]。本研究显示,AIH-PBC OS组AMA阳性率显著高于AIH组,ANA阳性率无显著差异,表明AIH-PBC OS患者同时具有AIH和PBC的免疫学特征。这一结果亦提示,如果在AIH患者中检出AMA阳性,应高度怀疑其合并有PBC,而ANA对AIH-PBC OS和AIH的鉴别诊断意义不大。
肝活组织检查对自身免疫性肝病的诊断具有确诊价值[21-22]。通过对本研究中的107例AIH-PBC OS和AIH患者的肝穿刺活组织检查结果进行分析发现,AIH组主要呈以界面性肝炎、淋巴浆细胞浸润、肝细胞玫瑰花环样改变等反映肝细胞炎症损伤为主的病理表现,AIH-PBC OS组患者则表现出不同程度的肝脏炎症损伤和胆管损伤(如胆管损伤、胆管缺失、胆管增生、肉芽肿样变等)。小叶间胆管病变的存在与血清IgM水平的升高有密切关联[10],AIH-PBC OS组IgM水平显著高于AIH组,与AIH-PBC OS患者肝组织病理表现中胆管病变发生率高于AIH组的结果相一致,2项结果共同说明了AIH-PBC OS较AIH而言,更易发生胆管病变,且IgM水平对AIH-PBC OS的诊断具有提示作用。
综上所述,AIH-PBC OS同时具备AIH和PBC的特点,但并非二者的简单叠加。对于伴有黄疸和瘙痒症状的中年女性患者,若出现血清ALT和AST以及ALP和GGT水平的同时或相继升高,应高度怀疑AIH-PBC OS,并进行免疫相关的检查(IgG、IgM、AMA)和肝穿刺活组织检查。若IgG和(或)IgM水平升高且AMA阳性,肝组织病理表现为明显的界面性肝炎和炎症性胆管损伤、胆汁淤积等典型的胆管病变,即可诊断为AIH-PBC OS。AIH-PBC OS的肝脏炎症损伤程度和自身免疫程度总体可能较AIH轻,故可在进行AIH-PBC OS诊断时考虑适当放宽巴黎标准,以防漏诊以及影响治疗方案的选择和患者预后。由于本研究并未涉及治疗情况的比较且样本量相对较小,故仍需进一步深入的、更大样本量的研究来探索AIH-PBC OS与单纯AIH之间具有诊断意义和治疗指导意义的不同之处,从而帮助临床医生及时、准确地对AIH-PBC OS作出诊断。
[1] CHAZOUILLERES O, WENDUM D, SERFATY L, et al. Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy[J]. Hepatology, 1998, 28(2): 296.
[2] WOODWARD, NEUBERGER J. Autoimmune overlap syndromes[J]. Hepatology, 2001, 33(4): 994.
[3] SCHRAMM C, LOHSE AW. Overlap syndromes of cholestatic liver diseases and auto-immune hepatitis[J]. Clin Rev Allergy Immunol, 2005, 28(2): 105-114.
[4] European Association for the Study of the Liver. EASL clinical practice guidelines: management of cholestatic liver diseases[J]. J Hepatol, 2009, 51(2): 237-267.
[5] BUNCHORNTAVAKUL C, REDDY KR. Diagnosis and management of overlap syndromes[J]. Clin Liver Dis, 2015, 19(1): 81-97.
[6] KRAWITT EL. Autoimmune hepatitis[J]. N EngI J Med, 2006, 354(1): 54-66.
[7] CHEN CW, CHENG J, DOU XG, et al. Consensus on the diagnosis and management of primary biliary cirrhosis (cholangitis)(2015)[J]. J Clin Hepatol, 2015, 20(12): 960-968.(in Chinese)
陈成伟, 成军, 窦晓光, 等.原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)[J].临床肝胆病杂志, 2015, 20(12): 960-968.
[8] BOBERG KM, CHAPMAN RW, HIRSCHFIELD GM, et al. International Autoimmune Hepatitis Group. Overlap syndromes: the international autoimmune hepatitis group(IAIHG) position statement on a controversial issue[J]. J Hepatol, 2011, 54(2): 374-385.
[9] KUIPER EM, ZONDERVAN PE, van BUUREN HR. Paris criteria are effective in diagnosis of primary biliary cirrhosis and autoimmune hepatitis overlap syndrome[J]. Clin Gastroenterol Hepatol, 2010, 8(6): 530-534.
[10] POUPON R, CHAZOUILLERES O, CORPECHOT C, et al. Development of autoimmune hepatitis in patients with typical primary biliary cirrhosis[J]. Hepatology, 2006, 44(1): 85.
[11] SASAKI R, AKIYAMA M, TAKESHITA S, et al. A case of PBC-AIH overlap syndrome who developed AIH 8 years after diagnosis of typical PBC[J]. Kanzo, 2009, 50(50): 445-450.
[12] MANNS MP, CZAJA A J, GORHAM JD, et al. AASLD Practice Guidelines. Diagnosis and management of autoimmune hepatitis[J]. Hepatology, 2010, 51(6): 2193-2213.
[13] HENNES EM, ZENIYA M, CZAJA AJ, et al. Simplified criteria for the diagnosis of autoimmune hepatitis[J]. Hepatology, 2008, 48(1): 169.
[14] CZAJKOWSKI MA, KINGHAM J GC. 636 Prevalence and characteristics of overlap syndromes in autoimmune liver disease (AILD), a twenty-year cohort from a defined community in South Wales[J]. J Hepatol, 2006, 44(Suppl 2): s236.
[15] PARK Y, CHO Y, CHO EJ, et al. Retrospective analysis of autoimmune hepatitis-primary biliary cirrhosis overlap syndrome in Korea: characteristics, treatments, and outcomes[J].Clin Mol Hepatol, 2015, 21(2): 150-157.
[16] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Gastroenterology, Chinese Medical Association; Chinese Society of Infectious Diseases, ChineseMedicalAssociation. Chinese consensus on the diagnosis and management of autoimmune hepatitis (2015)[J]. J Clin Hepatol, 2016, 32(1): 9-22.(in Chinese)
中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 自身免疫性肝炎诊断和治疗共识(2015)[J]. 临床肝胆病杂志, 2016, 32(1): 9-22.
[17] VILLAMIL AG, WELZ G, BANDI JC, et al. 556 Overlap syndrome PBC/AIH: prevalence, long term evolution and prognostic factors[J].J Hepatol, 2004, 40(4): 163.
[18] OWENDUM C. Long term outcome and response to therapy of primary biliary cirrhosis-autoimmune hepatitis overlap syndrome[J]. J Hepatol, 2006, 44(2): 400-406.
[19] DEGOTT C, ZAFRANI ES, CALLARD P, et al. Histopathological study of primary biliary cirrhosis and the effect of ursodeoxycholic acid treatment on histology progression[J]. Hepatology, 1999, 29(4): 1007-1012.
[20] LINDOR KD, GERSHWIN ME, POUPON R, et al. Primary biliary cirrhosis[J]. Hepatology, 2009, 50(1): 291-308.
[21] HEURGUE A, VITRY F, DIEBOLD MD, et al. Overlap syndrome of primary biliary cirrhosis and autoimmune hepatitis: a retrospective study of 115 cases of autoimmune liver disease[J]. Gastroenterol Clin Biol, 2007, 31(1): 17-25.
[22] MIAO Q, MA X . Significance of clinical pathology in diagnosis and treatment of autoimmune liver diseases[J]. J Clin Hepatol, 2014, 30(5): 385-389.(in Chinese)
苗琪, 马雄. 临床病理学在自身免疫性肝病诊治中的重要性[J]. 临床肝胆病杂志, 2014, 30(5): 385-389.
引证本文:WANG TT, LU CL, FAN XL, et al. Clinical and pathological features of autoimmune hepatitis-primary biliary cholangitis overlap syndrome versus autoimmune hepatitis: an analysis of 107 patients undergoing liver biopsy[J]. J Clin Hepatol, 2017, 33(11): 2179-2185. (in Chinese)
王婷婷, 鲁昌立, 凡小丽, 等. 自身免疫性肝炎-原发性胆汁性胆管炎重叠综合征的临床及病理学特征分析[J]. 临床肝胆病杂志, 2017, 33(11): 2179-2185.
(本文编辑:邢翔宇)
Clinicalandpathologicalfeaturesofautoimmunehepatitis-primarybiliarycholangitisoverlapsyndromeversusautoimmunehepatitis
WANGTingting,LUChangli,FANXiaoli,etal.
(DepartmentofGastroenterology,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
ObjectiveTo investigate the clinical and pathological features of autoimmune hepatitis (AIH)-primary biliary cholangitis (PBC) overlap syndrome (AIH-PBC OS) versus AIH, since it is still difficult to diagnose AIH-PBC OS in clinical practice, and to enhance the knowledge of AIH-PBC OS and improve its early diagnostic rate.MethodsA prospective study was performed for the clinical data, biochemical and immunological markers, autoantibody, and liver pathology of 50 patients with AIH-PBC OS confirmed by liver biopsy who visited West China Hospital, Sichuan University, from January 20, 2015 to November 28, 2016 and 57 patients with AIH alone, in order to compare the features of AIH-PBC OS and AIH. Continuous data such as laboratory markers were expressed as median M (inter-quartile range) and the nonparametric rank sum test was used for comparison of these data between two groups; categorical data including clinical features、histopathological manifestations were expressed as rates and the chi-square test was used for comparison of these data between two groups.ResultsThe AIH-PBC OS group had a significantly lower age of onset than the AIH group (Z=-1.975,P=0.048), while there was no significant difference in male/female sex ratio between the two groups. The AIH-PBC OS group had a significantly higher proportion of patients with pruritus than the AIH group (22.0% vs 7.0%,χ2=4.960,P=0.026). Compared with the AIH group, the AIH-PBC OS group had significantly higher levels of alkaline phosphatase (ALP), gamma-glutamyl transpeptidase (GGT), and immunoglobulin M (IgM) (Z=-6.250, -4.789, and -5.407, allP<0.001), a significantly higher positive rate of antimitochondrial antibody (AMA) (χ2=26.811,P<0.001), and significantly lower serum levels of alanine aminotransferase (ALT), aspartate aminotransferase, and immunoglobulin G (IgG) (Z=-2.916, -3.381, and -2.285,P=0.004, 0.001, and 0.022). The AIH-PBC OS group had significantly higher incidence rates of bile duct injury, bile duct loss, granulomatous disease, and cholestasis than the AIH group (χ2=25.612, 15.953, 6.490, and 10.042,P<0.001, <0.001, 0.001, and 0.002).ConclusionAlthough AIH-PBC OS has the features of both AIH and PBC, it is not a simple overlap between AIH and PBC. Pruritus, significant increases in the levels of ALP, GGT, and IgM, positive AMA, and inflammatory bile duct disease and cholestasis may have implications for the diagnos of AIH-PBC OS. Since AIH-PBC OS may have milder liver inflammatory injury and autoimmune abnormalities than AIH, the levels of ALT and IgG in Paris criteria can be broadened during the diagnosis of AIH-PBC OS, in order to prevent missed diagnosis and avoid affecting the selection of treatment regimen and patients′ prognosis.
hepatitis, autoimmune; cholangitis, sclerosing; pathology, clinical; disease attributes
R575.2
A
1001-5256(2017)11-2179-07
10.3969/j.issn.1001-5256.2017.11.026
2017-05-02;
2017-05-18。
四川省科技厅支撑计划(2016FZ0062)
王婷婷(1993-),女,主要从事自身免疫性肝病方面的研究。
杨丽,电子信箱:yangli_hx@scu.edu.cn。
