难治性原发性胆汁性胆管炎的治疗新进展
2017-11-22凡小丽文茂瑶
倪 萍, 凡小丽, 文茂瑶, 杨 丽
(四川大学华西医院 消化内科, 成都 610041)
难治性原发性胆汁性胆管炎的治疗新进展
倪 萍, 凡小丽, 文茂瑶, 杨 丽
(四川大学华西医院 消化内科, 成都 610041)
原发性胆汁性胆管炎(PBC)是一种以小胆管损伤为特点的自身免疫性肝病。熊去氧胆酸(UDCA)是治疗本病的主要药物,但约40%的PBC患者对UDCA生化应答欠佳,预后较差。总结了难治性PBC患者的治疗新选择。2017年,奥贝胆酸已被欧洲肝病学会推荐作为UDCA应答不佳PBC的二线治疗药物。贝特类药物或布地奈德联合UDCA治疗难治性PBC的相关研究也取得了一定进展,但其疗效与安全性仍需大样本随机双盲对照试验进一步验证。单克隆抗体、改变胆汁酸生成或重吸收药物等尚处于实验阶段。目前,肝移植仍然是延长终末期PBC患者生存期的唯一治疗方法。
肝硬化, 胆汁性; 治疗; 综述
1 PBC的概况
原发性胆汁性胆管炎(PBC)既往又称原发性胆汁性肝硬化[1],是一种慢性进展的自身免疫性肝病[2]。PBC的发病机制尚不清楚,其发病率和患病率分别为0.3/10万~5.8/10万人和1.9/10万~40.2/10万人[3]。其发病率与性别、地域相关,多见于中年女性(既往认为在欧美PBC患者中男女比例为1∶10,但最近发表的流行病学研究[4-5]显示欧洲部分地区PBC患者男女比例为1∶1.6)。抗线粒体抗体(AMA)是该病重要的血清学标志物,约95%患者表现为AMA阳性。多数PBC患者肝生化指标异常,主要表现为ALP升高。其组织学特征为非化脓性破坏性胆管炎,进行性胆管损伤导致肝内小胆管减少,通常伴有严重的胆汁淤积,发展为门管区纤维化最终导致胆汁淤积性肝硬化。疲乏、瘙痒是PBC的最常见症状[2,6]。
对于PBC的治疗,目前认为熊去氧胆酸(UDCA)是有效的药物,推荐剂量13~15 mg·kg-1·d-1,终生服用[7]。UDCA可改善肝生化指标,延缓组织学进展,延缓门静脉高压的发生、发展以及延长无肝移植生存时间[8-9],但约40%的PBC患者对UDCA不完全应答[2,10]。
2 难治性PBC的定义
使用UDCA治疗一定时间后,ALP等指标未达到生化应答标准者称为不完全应答,将这类不完全应答的PBC称为难治性PBC。难治性PBC患者病程进展快,其肝移植和死亡的相对危险度是对UDCA应答良好患者的5.51倍(95%可信区间:1.70~15.99)[9]。因此,对服用UDCA的PBC患者进行应答评估非常重要,常用的生化应答标准见表1。其中巴黎Ⅰ标准被认为能够较好地预测预后的风险分层指数标准[11],巴黎Ⅱ标准适用于早期PBC患者[12]。最近,UDCA治疗1年后的相关指标与基线时的部分指标结合的连续评分系统(UK-PBC风险评分、GLOBE评分)也已经显示出优势(表2)[13-14]。
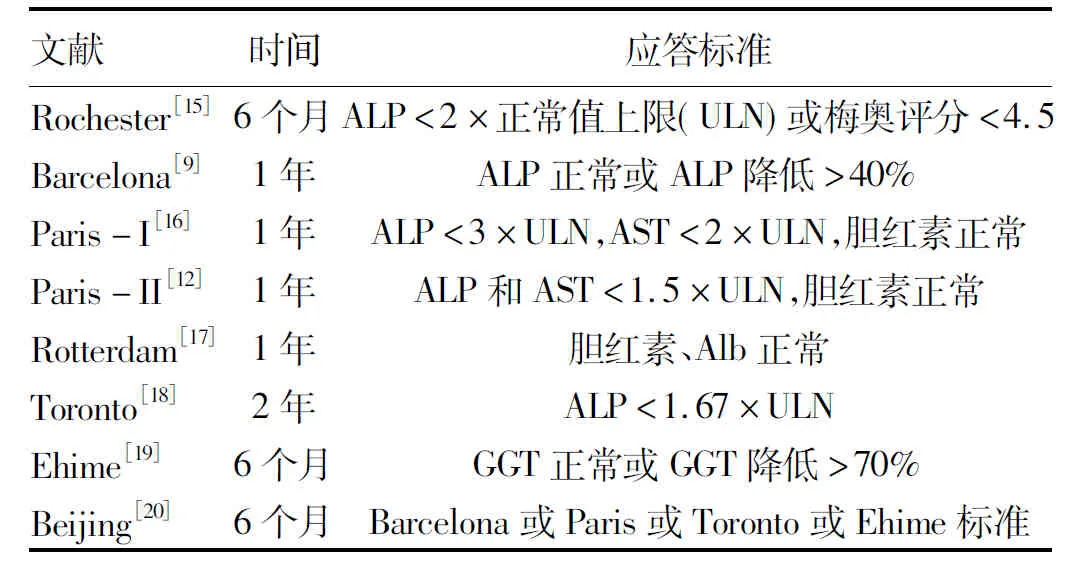
表1 PBC对UDCA应答的生化标准

表2 连续评分系统
注:UK-PBC风险评分=0.0287854×(治疗随访1年后ALP ULN的倍数-1.722136304)-0.0422873×[(治疗随访1年以后AST/ALT ULN的倍数/10)- 1-8.675729006)+1.4199×LN(治疗随访1年后胆红素 ULN的倍数/10)+2.709607778]-1.960303×(治疗随访1年后Alb ULN的倍数-1.17673001) - 0.4161954×(治疗随访1年后PTL ULN的倍数-1.873564875);GLOBE评分=0.044378×开始UDCA治疗时的年龄+0.93982×LN(治疗随访1年以后胆红素ULN的倍数)+0.335648×LN(治疗随访1年后ALP ULN的倍数)-2.266708×治疗随访1年后Alb ULN的倍数-0.002581×治疗随访1年后的每109/L的PLT+1.216865
3 难治性PBC的治疗
3.1 奥贝胆酸 最近研究发现胆汁酸除了有溶解脂质的作用,还可作为信号分子与法尼酯X受体(farnesoid X receptor,FXR)结合,对胆汁酸的生成与肠肝循环起重要的调节作用。奥贝胆酸是人初级胆汁酸鹅去氧胆酸的一种衍生物,为法尼酯X受体的配体。奥贝胆酸作为FXR配体的活性是鹅去氧胆酸的100倍,有极高的选择性[21-22]。FXR的激活可减少胆汁酸的合成与肠肝循环,还可能有抗肝纤维化及逆转门静脉高压的作用,目前已在胆汁淤积的动物模型中得到证实[23-24]。奥贝胆酸已经被证明对肝功能指标有积极作用,目前已经进行了3期临床实验,最近被美国FDA批准用于治疗PBC。
Ⅰ期临床试验主要研究奥贝胆酸单剂量及复合剂量的药代动力学、安全性和耐受性。令人遗憾的是,研究人员未公布该实验的具体结果。
Ⅱ期临床试验Hirschfield研究[25]中,评估了奥贝胆酸用于对UDCA不完全应答的PBC患者的疗效和安全性。该试验对165例ALP>1.5~10×ULN的PBC患者进行随机双盲试验。将患者随机分配到10 mg/d、25 mg/d、50 mg/d的奥贝胆酸组或安慰剂组,试验进行3个月,患者在整个研究中维持其现有剂量的UDCA。3个月后,奥贝胆酸组与安慰剂组相比,各组ALP、GGT、ALT水平均显著降低。奥贝胆酸10 mg/d组中瘙痒的发病率最低。在另一项研究[26]中,59例PBC患者被分配到安慰剂组或奥贝胆酸(10 mg/d,50 mg/d)组中,试验持续12周。12周后,奥贝胆酸组与安慰剂组相比,ALP、GGT、ALT水平均显著降低。但瘙痒症状更常见于奥贝胆酸组,其发病率与严重程度和服用奥贝胆酸的剂量相关,呈明显剂量依赖关系。
Ⅲ期临床试验是为期12个月的随机双盲安慰剂对照试验[27],将217例对UDCA不完全应答或不能耐受UDCA的PBC患者随机分配到安慰剂组和奥贝胆酸(10 mg/d、5 mg/d滴定至10 mg/d)组中。在该研究中,93%的患者仍有接受UDCA作为基本治疗,试验的主要终点为12个月后实现以下目标:ALP<1.67×ULN或ALP降低至少15%,同时TBil在正常范围内。12个月后,达到终点的患者百分比分别为: 5~10 mg组(46%)和10 mg组(47%)高于安慰剂组(10%)(P<0.001)。奥贝胆酸组与安慰剂组的非侵入性肝纤维化测量变化未见明显差异。与安慰剂组相比,瘙痒症状在奥贝胆酸组中更常见(5~10 mg组56%,10 mg组68%,安慰剂组38%)。严重不良事件发生率在5~10 mg组为16%,10 mg组为11%,安慰剂组为4%。奥贝胆酸联合UDCA或作为单药治疗的PBC患者的ALP和TBil较基线水平降低程度和安慰剂组相比均有显著不同。
综上,奥贝胆酸是一种有希望的新疗法,为难治性PBC提供了新的治疗方案。2017年欧洲肝病学会关于PBC诊断和治疗指南[3]建议:奥贝胆酸联合UDCA可用于对UDCA应答不佳的PBC患者或作为单药治疗对UDCA不耐受的PBC患者,其初始剂量为5 mg,根据患者耐受性在6个月内剂量滴定至10 mg。但加入奥贝胆酸与UDCA单药治疗PBC相比,瘙痒症状更常见。
3.2 贝特类药物 贝特类药物,主要包括苯扎贝特和非诺贝特,与肝相关生化酶的降低有关[28]。贝特类药物主要通过激活过氧化物酶体增殖物激活受体α和γ,甚至还可能激活孕烷X 受体发挥抗胆汁酸、抗炎及抗纤维化的作用[29-30]。
近年来已经有多项研究评估了贝特类药物联合UDCA治疗对UDCA应答不佳的PBC患者的疗效,证明了贝特类药物治疗对UDCA应答不佳的PBC患者耐受性良好,并且可以改善其肝生化指标与瘙痒症状。但上述研究都不是双盲随机对照实验,且多为小样本短期随访研究。在日本的一项研究[29]中,19例对UDCA(600 mg/d)单药治疗呈现不完全应答(定义为ALP或GGT高于ULN)的患者予苯扎贝特(400 mg/d)+UDCA(600 mg /d)治疗3个月。3个月后,与UDCA单药治疗组相比,联合治疗组不仅进一步降低ALT、GGT、ALP和IgM的血清水平,还降低总胆固醇、低密度脂蛋白、甘油三酯的血清浓度。在另一项西班牙的研究[31]中,30例对UDCA缺乏生化应答的女性PBC患者予苯扎贝特(400 mg/d)治疗1年(2例患者中途退出研究)。1年后,13例患者的ALP水平降至正常范围,另4例患者的ALP血清浓度也降至1.5×ULN以下,GGT、ALT、胆固醇和甘油三酯水平也明显降低。最近,一项非双盲的前瞻性随机对照研究[32]报道,接受UDCA+苯扎贝特联合治疗(100~120个月)的27例PBC患者血清ALP水平、梅奥风险评分显著降低。除此之外,一项包括102例PBC患者的荟萃分析[33]也支持非诺贝特(100~200 mg/d)作为对UDCA缺乏生化应答或应答不佳PBC患者的辅助治疗是有效的。但该荟萃分析的局限在于其纳入的研究均为小样本短期试验,缺乏真实病例对照。
贝特类药物是否可以提高无肝移植的PBC患者的生存率仍有争议。在这些研究中均未报道来自贝特类联合治疗的严重不良反应发生,只有少数患者出现胃灼烧、恶心、肌肉疼痛的副作用。贝特类药物治疗PBC的疗效与安全性仍需大样本、多中心临床试验验证。目前,苯扎贝特的Ⅲ期临床试验(NCT01654731)已完成,但结果尚未发表。
3.3 糖皮质激素 早期有研究[34]证明泼尼松龙单药治疗PBC患者与其肝生化指标和组织学改善相关,但该项研究在晚期PBC患者中进行,导致严重骨质减少,有严重的副作用。布地奈德是一种合成的皮质类固醇激素,90%通过肝首过代谢,其与糖皮质激素受体结合活性比泼尼松龙高15~20倍。2项随机对照试验[35-36]表明,布地奈德(9 mg/d)与UDCA联合使用较UDCA单独使用可更有效地改善非肝硬化PBC患者的肝生化指标和组织学进展,其中一项研究[36]的对象为对UDCA治疗缺乏生化应答的难治性PBC患者。在随后的一项为期3年的前瞻性随机开放多中心研究[37]中,77例PBC患者被随机分到联合治疗组(n=41,布地奈德 6 mg/d+UDCA 15 mg·kg-1·d-1)和对照组(n=36,UDCA 15 mg·kg-1·d-1)中。3年后,2组患者的血清ALP、ALT和GGT水平均有所下降,组织学分期在联合治疗组中改善但在UDCA单药组中恶化。联合治疗组中的患者使用布地奈德2年后出现糖皮质激素相关副作用,如痤疮、多毛、体质量增加等,但均不严重,并且不需要任何其他治疗或因此改变布地奈德剂量。值得一提的是,布地奈德因其90%在肝首过代谢,所以对病理分期为Ⅲ、Ⅳ期的PBC患者疗效并不理想。
因此,尽管现有数据支持布地奈德和UDCA联合治疗难治性PBC的疗效,但其有效性和耐受性仍需要更大样本随机双盲对照试验来验证。评估UDCA+布地奈德与UDCA+安慰剂治疗PBC患者的临床Ⅲ期双盲随机对照试验(Eudra CT号2007-004040-70)正在进行中,结果尚未发布。
3.4 利妥昔单抗 利妥昔单抗是一种抗CD20单克隆抗体,可选择性地消耗B淋巴细胞。B淋巴细胞是产生自身抗体的浆细胞的前体,可使相关自身抗体的产生明显减少,因此有学者[38]推断利妥昔单抗可能对自身免疫介导的肝脏疾病起作用。一项非双盲研究中[39],6例对UDCA不完全应答的PBC患者,每周注射1000 mg利妥昔单抗连续2周,随访52周(2例患者因伴随病毒感染仅接受了1周剂量的利妥昔单抗治疗)。52周后,2例患者的IgG、IgM和IgA以及AMA的血清水平降至正常,同时血清ALP水平也显著降低。在另一项研究[38]中,14例对UDCA不完全应答的PBC患者接受2次利妥昔单抗输注(1000 mg),每次间隔2周,随访12个月。12个月后,60%患者的瘙痒症状得到了改善,血清ALP较基线水平明显改善,但未降至正常范围内。由此可见,利妥昔单抗治疗对UDCA不完全应答的PBC患者,虽然可使其自身抗体明显减少,但其改善肝生化指标的效果有限。目前,关于利妥昔单抗治疗难治性PBC患者的研究有限,其疗效及安全性需要大样本随机双盲对照研究进一步探索。
3.5 间充质干细胞(mesenchymal stem cells,MSC)移植 MSC移植是一种潜在的PBC治疗方法。其基本原理是利用MSC对免疫调节的特性,包括抑制T淋巴细胞的增殖能力,改变树突状细胞、辅助性T淋巴细胞和自然杀伤细胞的细胞因子分泌谱,增加调节性T淋巴细胞的比例和抗炎表型[40]等。一项临床试验[41]表明,脐带血源性间充质干细胞(UC-MSC)移植治疗对UDCA不完全应答PBC患者的疗效和耐受性良好,不但能够明显降低ALP和GGT血清水平,还能够改善疲乏、瘙痒症状。另外,同种异体骨髓MSC移植对UDCA不完全应答PBC患者的抗组织纤维化和改善肝功能作用已经在另一项研究[42]中被证实。尽管如此,UC-MSC移植治疗难治性PBC患者的疗效与安全性仍然需要大样本随机双盲对照实验来验证。
3.6 成纤维细胞生长因子(fibroblast growth factors,FGF)19类似物 FGF-19是一种由肠上皮分泌的激素,是人类胆汁酸生物合成的重要调节剂。FGF-19主要通过与FGF受体4(FGFR4)结合产生作用。FGF受体激活后可表达胆汁酸合成中的限速酶——胆固醇7-羟化酶,抑制胆汁酸生物合成使胆汁酸生成量减少。因此,靶向FGF-19/FGFR4途径可能通过减少胆汁酸生物合成使胆汁酸总量减少,从而减轻胆汁酸对肝组织的毒性作用,达到治疗胆汁淤积性肝病的效果。NGM282作为FGF-19类似物是一种人工合成的蛋白质,在胆汁淤积的动物模型中,该类似物可减少肝酶[43]。此外,一项包括45例UDCA应答不佳PBC患者的初步研究[44]表明,使用NGM282治疗PBC患者可使血清ALP水平降低,其降低程度具有显著的剂量依赖性,但瘙痒症状无明显改善。该制剂的安全性和耐受性良好,只有少数人出现腹泻和恶心。虽然目前这些数据支持该种FGF-19类似物对难治性PBC患者的潜在有利作用,但这类药物的疗效有待相关大样本随机双盲对照试验进一步验证。
3.7 抗病毒药物 有研究[45]提出PBC与感染某种逆转录病毒相关,一项随机双盲多中心试验[46]中,抗病毒组应用齐多夫定和拉米夫定+UDCA,安慰剂组应用安慰剂+UDCA治疗PBC患者。抗病毒组与安慰剂组的患者相比,虽未见生化指标降至正常,但其ALP、转氨酶水平及临床评分均有所改善。该研究表明逆转录病毒的感染可能是PBC触发因素中的一种,但并不能证明所有PBC患者都有逆转录病毒感染。因此,抗病毒剂治疗PBC患者的疗效和安全性尚未确定,需要进一步研究。恩曲他滨+替诺福韦和洛匹那韦+利托那韦治疗PBC患者的随机对照试验(NCT01614405)已经完成,结果尚未发表。
3.8 G蛋白偶联胆汁酸膜受体(gprotein-coupledreceptorforbileacids,TGR)5激动剂 TGR5是一种针对胆汁酸的特异性G-蛋偶白联受体,在肝Kupffer细胞、窦状内皮细胞、胆管细胞和胆囊上皮细胞上均有表达。TGF5活化可减轻炎症反应并刺激胆汁上皮分泌碳酸氢盐和产生NO。此外,TGF5通过控制胆汁酸和细胞因子的分泌来保护肝脏,减轻疏水性胆汁酸对肝的损伤,可能对免疫相关的炎症性肝病产生疗效[47-48]。但这些数据均来自动物实验,需要临床试验来研究TGR5激动剂是否对PBC患者有效。
4 总结
随着对PBC研究的深入,大量关于难治性PBC的药物研究不断涌现。奥贝胆酸已被2017年欧洲肝病学会关于PBC诊断和治疗指南推荐作为二线药物治疗对UDCA应答不佳的PBC患者。贝特类药物或布地奈德联合UDCA治疗难治性PBC患者的相关研究取得了一定进展,但其疗效与安全性仍需要大样本随机双盲对照试验进一步验证。肝移植仍然是延长终末期PBC患者寿命的唯一治疗方法。关于难治性PBC患者新的治疗方法,如单克隆抗体、改变胆汁酸生成或重吸收药物等目前仍在研究中。
[1] TANAKA A, TAKIKAWA H, MOCHIDA S, et al. Changing nomenclature for PBC from “primary biliary cirrhosis” to “primary biliary cholangitis”[J]. J Gastroenterol, 2016, 51(7): 748-749.
[2] CAREY EJ, ALI AH, LINDOR KD. Primary biliary cirrhosis[J]. The Lancet, 2015, 386(10003): 1565-1575.
[3] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: the diagnosis and management of patients with primary biliary cholangitis[J]. J Hepatol, 2017, 67(1): 145-172.
[4] GRIFFITHS L, DYSON JK, JONES DEJ. The new epidemiology of primary biliary cirrhosis[J]. Semin Liver Dis, 2014, 34(3): 318-328.
[5] LLEO A, JEPSEN P, MORENGHI E, et al. Evolving trends in female to male incidence and male mortality of primary biliary cholangitis[J]. Sci Rep, 2016, 6: 25906.
[6] JONES DE. Pathogenesis of primary biliary cirrhosis[J]. Postgrad Med J, 2008, 84(987): 23-33.
[7] European Association for the Study of the Liver . EASL Clinical Practice Guidelines: management of cholestatic liver diseases[J]. J Hepatol, 2009, 51(2): 237-267.
[8] TERBORG PC, SCHALM SW, HANSEN BE, et al. Prognosis of ursodeoxycholic acid-treated patients with primary biliary cirrhosis. Results of a 10-year cohort study involving 297 patients[J]. Am J Gastroenterol, 2006, 101(9): 2044-2050.
[9] PARES A, CABALLERIA L, RODES J. Excellent long-term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic acid[J]. Gastroenterology, 2006, 130(3): 715-720.
[10] DUAN WJ, TIAN QJ, YOU H, et al. Research advances in primary biliary cholangitis[J]. J Clin Hepatol, 2016, 32(11): 2062-2065. (in Chinese)
段维佳, 田秋菊, 尤红, 等. 原发性胆汁性胆管炎的研究进展[J]. 临床肝胆病杂志, 2016, 32(11): 2062-2065.
[11] CARBONE M, MELLS GF, PELLS G, et al. Sex and age are determinants of the clinical phenotype of primary biliary cirrhosis and response to ursodeoxycholic acid[J]. Gastroenterology, 2013, 144(3): 560-569. e7.
[12] CORPECHOT C, CHAZOUILLERES O, POUPON R. Early primary biliary cirrhosis: biochemical response to treatment and prediction of long-term outcome[J]. J Hepatol, 2011, 55(6): 1361-1367.
[13] CARBONE M, SHARP SJ, FLACK S, et al. The UK-PBC risk scores: derivation and validation of a scoring system for long-term prediction of end-stage liver disease in primary biliary cholangitis[J]. Hepatology, 2016, 63(3): 930-950.
[14] LAMMERS WJ, HIRSCHFIELD GM, CORPECHOT C, et al. Development and validation of a scoring system to predict outcomes of patients with primary biliary cirrhosis receiving ursodeoxycholic acid therapy[J]. Gastroenterology, 2015,149(7): 1804-1812.e4.
[15] ANGULO P, LINDOR KD, THERNEAU TM, et al. Utilization of the Mayo risk score in patients with primary biliary cirrhosis receiving ursodeoxycholic acid[J]. Liver, 1999, 19(2): 115-121.
[16] CORPECHOT C, ABENAVOLI L, RABAHI N, et al. Biochemical response to ursodeoxycholic acid and long-term prognosis in primary biliary cirrhosis[J]. Hepatology, 2008,48(3): 871-877.
[17] KUIPER EM, HANSEN BE, de VRIES RA, et al. Improved prognosis of patients with primary biliary cirrhosis that have a biochemical response to ursodeoxycholic acid[J]. Gastroenterology, 2009,136(4): 1281-1287.
[18] KUMAGI T, GUINDI M, FISCHER SE, et al. Baseline ductopenia and treatment response predict long-term histological progression in primary biliary cirrhosis[J]. Am J Gastroenterol, 2010,105(10): 2186-2194.
[19] AZEMOTO N, KUMAGI T, ABE M, et al. Biochemical response to ursodeoxycholic acid predicts long-term outcome in Japanese patients with primary biliary cirrhosis[J]. Hepatol Res, 2011, 41(4): 310-317.
[20] ZHANG LN, SHI TY, SHI XH, et al. Early biochemical response to ursodeoxycholic acid and long-term prognosis of primary biliary cirrhosis: results of a 14-year cohort study[J]. Hepatology, 2013, 58(1): 264-272.
[21] LINDOR KD. Farnesoid X receptor agonists for primary biliary cirrhosis[J]. Curr Opin Gastroenterol, 2011, 27(3): 285-288.
[22] ZHAO J, LI W, YAO DK. Role of farnesoid X receptor in treatment of primary biliary cholangitis[J]. Chin J Gastroenterol, 2017, 22(2): 109-111. (in Chinese)
赵健, 李伟, 姚定康. 法尼醇X受体在原发性胆汁性胆管炎治疗中的作用[J]. 胃肠病学, 2017, 22(2): 109-111.
[23] FIORUCCI S, ANTONELLI E, RIZZO G, et al. The nuclear receptor SHP mediates inhibition of hepatic stellate cells by FXR and protects against liver fibrosis[J]. Gastroenterology, 2004, 127(5): 1497-1512.
[24] VERBEKE L, FARRE R, TREBICKA J, et al. Obeticholic acid, a farnesoid X receptor agonist, improves portal hypertension by two distinct pathways in cirrhotic rats[J]. Hepatology, 2014, 59(6): 2286-2298.
[25] HIRSCHFIELD GM, MASON A, LUKETIC V, et al. Efficacy of obeticholic acid in patients with primary biliary cirrhosis and inadequate response to ursodeoxycholic acid[J]. Gastroenterology, 2015, 148(4): 751-761. e8.
[26] KOWDLEY KV, JONES D, LUKETIC V, et al. An international study evaluating the farnesoid X receptor agonist obeticholic acid as monotherapy in PBC[J]. J Hepatol, 2011, 54(9): s13.
[27] NEVENS F, ANDREONE P, MAZZELLA G, et al. A placebo-controlled trial of obeticholic acid in primary biliary cholangitis[J]. N Engl J Med, 2016, 375(7): 631-643.
[28] TANAKA A, HIROHARA J, NAKANUMA Y, et al. Biochemical responses to bezafibrate improve long-term outcome in asymptomatic patients with primary biliary cirrhosis refractory to UDCA[J]. J Gastroenterol, 2015, 50(6): 675-682.
[29] HONDA A, IKEGAMI T, NAKAMUTA M, et al. Anticholestatic effects of bezafibrate in patients with primary biliary cirrhosis treated with ursodeoxycholic acid[J]. Hepatology, 2013, 57(5): 1931-1941.
[30] WU LH, HAN Y. Application and role of fibrates in treatment of primary biliary cholangitis and related mechanisms [J]. J Clin Hepatol, 2016, 32(12): 2403-2406. (in Chinese)
武李红, 韩英. 贝特类药物在原发性胆汁性胆管炎中的应用及作用机制.[J]. 临床肝胆病杂志, 2016, 32(12): 2403-2406.
[31] LENS S, LEOZ M, NAZAL L, et al. Bezafibrate normalizes alkaline phosphatase in primary biliary cirrhosis patients with incomplete response to ursodeoxycholic acid[J]. Liver Int, 2014, 34(2): 197-203.
[32] HOSONUMA K, SATO K, YAMAZAKI Y, et al. A prospective randomized controlled study of long-term combination therapy using ursodeoxycholic acid and bezafibrate in patients with primary biliary cirrhosis and dyslipidemia[J]. Am J Gastroenterol, 2015, 110(3): 423-431.
[33] GRIGORIAN AY, MARDINI HE, CORPECHOT C, et al. Fenofibrate is effective adjunctive therapy in the treatment of primary biliary cirrhosis: a meta-analysis[J]. Clin Res Hepatol Gastroenterol, 2015, 39(3): 296-306.
[34] LEUSCHNER M, GULDUTUNA S, YOU T, et al. Ursodeoxycholic acid and prednisolone versus ursodeoxycholic acid and placebo in the treatment of early stages of primary biliary cirrhosis[J]. J Hepatol, 1996, 25(1): 49-57.
[35] LEUSCHNER M, MAIER KP, SCHLICHTING J, et al. Oral budesonide and ursodeoxycholic acid for treatment of primary biliary cirrhosis: results of a prospective double-blind trial[J]. Gastroenterology, 1999, 117(4): 918-925.
[36] ANGULO P, JORGENSEN RA, KEACH JC, et al. Oral budesonide in the treatment of patients with primary biliary cirrhosis with a suboptimal response to ursodeoxycholic acid[J]. Hepatology, 2000, 31(2): 318-323.
[37] RAUTIAINEN H, KARKKAINEN P, KARVONEN AL, et al. Budesonide combined with UDCA to improve liver histology in primary biliary cirrhosis: a three-year randomized trial[J]. Hepatology, 2005, 41(4): 747-752.
[38] MYERS RP, SWAIN MG, LEE SS, et al. B-cell depletion with rituximab in patients with primary biliary cirrhosis refractory to ursodeoxycholic acid[J]. Am J Gastroenterol, 2013,108(6): 933-941.
[39] TSUDA M, MORITOKI Y, LIAN ZX, et al. Biochemical and immunologic effects of rituximab in patients with primary biliary cirrhosis and an incomplete response to ursodeoxycholic acid[J]. Hepatology, 2012, 55(2): 512-521.
[40] WANG D, ZHANG H, LIANG J, et al. Effect of allogeneic bone marrow-derived mesenchymal stem cells transplantation in a polyI: C-induced primary biliary cirrhosis mouse model[J]. Clin Exp Med, 2011,11(1): 25-32.
[41] WANG L, LI J, LIU H, et al. Pilot study of umbilical cord-derived mesenchymal stem cell transfusion in patients with primary biliary cirrhosis[J]. J Gastroenterol Hepatol, 2013,28(Suppl 1): 85-92.
[42] WANG L, HAN Q, CHEN H, et al. Allogeneic bone marrow mesenchymal stem cell transplantation in patients with UDCA-resistant primary biliary cirrhosis[J]. Stem Cells Dev, 2014, 23(20): 2482-2489.
[43] ZHOU M, LEARNED RM, ROSSI SJ, et al. Engineered fibroblast growth factor 19 reduces liver injury and resolves sclerosing cholangitis in Mdr2-deficient mice[J]. Hepatology, 2016, 63(3): 914-929.
[44] MAYO M,WIGG A, ROBERTS S, et al. NGM282, a novel variant of FGF- 19, demonstrates biologic activity in primary biliary cirrhosis patients with an incomplete response to ursodeoxycholic acid: results of a phase 2 multicenter, randomized, double blinded,placebo controlled trial[J]. Hepatology, 2015, 62(10): 263A.
[45] XU L, SHEN Z, GUO L, et al. Does a betaretrovirus infection trigger primary biliary cirrhosis?[J]. Proc Natl Acad Sci U S A, 2003, 100(14): 8454-8459.
[46] MASON AL, LINDOR KD, BACON BR, et al. Clinical trial: randomized controlled study of zidovudine and lamivudine for patients with primary biliary cirrhosis stabilized on ursodiol[J]. Aliment Pharmacol Ther, 2008, 28(7): 886-894.
[47] KAWAMATA Y, FUJII R, HOSOYA M, et al. A G protein-coupled receptor responsive to bile acids[J]. J Biol Chem, 2003, 278(11): 9435-9440.
[48] WANG YD, CHEN WD, YU D, et al. The G-protein-coupled bile acid receptor, Gpbar1 (TGR5), negatively regulates hepatic inflammatory response through antagonizing nuclear factor kappa light-chain enhancer of activated B cells (NF-kappaB) in mice[J]. Hepatology, 2011, 54(4): 1421-1432.
引证本文:NI P, FAN XL, WEN MY, et al. New advances in the treatment of refractory primary biliary cholangitis[J]. J Clin Hepatol, 2017, 33(11): 2230-2234. (in Chinese)
倪萍, 凡小丽, 文茂瑶, 等. 难治性原发性胆汁性胆管炎的治疗新进展[J]. 临床肝胆病杂志, 2017, 33(11): 2230-2234.
(本文编辑:邢翔宇)
Newadvancesinthetreatmentofrefractoryprimarybiliarycholangitis
NIPing,FANXiaoli,WENMaoyao,etal.
(DepartmentofGastroenterology,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
Primary biliary cholangitis (PBC) is an autoimmune liver disease characterized by small bile duct injury. Ursodeoxycholic acid (UDCA) is often used for the treatment of this disease; however, about 40% of PBC patients do not respond adequately to UDCA and often have poor prognosis. This article summarizes the new therapeutic options for such patients. In 2017, obeticholic acid has been recommended as the second-line therapeutic drug for PBC patients with suboptimal response to UDCA by European Association for the Study of the Liver. Some achievements have been made in the research on fibrates and budesonide administered alone or in combination for the treatment of refractory PBC, but their efficacy and safety need to be further confirmed by large-sample, double-blind, randomized controlled trials. Monoclonal antibody, change in the production of bile acid, and drug reabsorption are still under experiment. At present, liver transplantation remains the only therapeutic method for patients with end-stage PBC.
liver cirrhosis, biliary; therapy; review
R575.2
A
1001-5256(2017)11-2230-05
10.3969/j.issn.1001-5256.2017.11.040
2017-06-26;
2017-07-10。
四川省科技厅应用基础项目(2017JY0071)
倪萍(1993-),女,主要从事慢性肝病方面的研究。
杨丽,电子信箱:yangli_hx@scu.edu.cn。
