子宫颈癌中SIX1的表达及其与细胞增殖的关系
2017-11-20黄江梅陈艳昕
黄江梅,肖 芳,陈艳昕,李 桃,周 颖,赵 敏,张 辉
子宫颈癌中SIX1的表达及其与细胞增殖的关系
黄江梅,肖 芳,陈艳昕,李 桃,周 颖,赵 敏,张 辉
目的探讨SIX1在子宫颈癌组织中的表达以及生物学作用。方法采用免疫组化EliVision两步法检测35例子宫颈癌、42例子宫颈上皮内病变(cervical intraepithelial neoplasia, CIN)及15例正常子宫颈组织中SIX1的表达及Ki-67增殖指数。应用RNA干扰技术,采用SIX1-siRNA表达质粒转染子宫颈癌Hela细胞,检测转染后子宫颈癌Hela细胞SIX1的mRNA和蛋白表达水平;应用MTT检测Hela细胞的增殖能力。结果子宫颈癌组织中SIX1阳性率高于CIN组织及正常子宫颈组织(P<0.05),且与Ki-67增殖指数呈正相关(P<0.05)。RT-PCR和Western blot检测显示转染SIX1-siRNA子宫颈癌Hela细胞中SIX1在mRNA和蛋白水平均显著下调;Hela细胞生长速度减慢。结论SIX1可能通过促进子宫颈癌细胞的增殖,在子宫颈癌的发生、发展过程中发挥重要作用。
子宫颈肿瘤;子宫颈上皮内病变;SIX1;Ki-67
子宫颈癌是女性最常见的恶性肿瘤之一,严重威胁身体健康[1]。同源盒基因是一类能够特异性调节基因表达的转录调控因子,在细胞生长、增殖、迁移等过程中发挥重要作用,SIX1基因是新近发现的同源盒基因,在肿瘤发生和转移中发挥关键作用[2]。近年研究显示SIX1在多种恶性肿瘤中呈高表达[3],但在子宫颈癌中表达的报道较少。本文检测SIX1在子宫颈癌中的表达及对子宫颈癌细胞增殖的影响,探讨SIX1在子宫颈癌发生、发展中的作用。
1 材料与方法
1.1材料收集2015年10月~2016年10月秦皇岛市第一医院经病理确诊的子宫颈癌35例,子宫颈上皮内病变(cervical intraepithelial neoplasia, CIN)42例和正常子宫颈15例,所有患者术前均未行放、化疗。Lipofectamine 2000转染试剂购自美国Invitrogen公司,RT-PCR试剂盒购自Takara公司,SIX1-siRNA质粒载体购自上海吉玛公司,SIX1(C104244,工作浓度1 ∶150)抗体购自SIGMA公司,Ki-67抗体及DAB试剂盒购自福州迈新公司。子宫颈癌Hela购自北京协和细胞资源中心,在含10%胎牛血清的DMEM(NEAA)培养基中培养。
1.2免疫组化
1.2.1免疫组化检测 采用免疫组化EliVision两步法染色,具体操作步骤按试剂盒说明书进行。切片常规脱蜡至水,EDTA(pH 8.0)抗原修复液高压修复1.5 min,0.3%双氧水封闭10 min,一抗4 ℃过夜,用PBS代替一抗做阴性对照,二抗室温30 min,DAB显色后苏木精复染,中性树胶封固。
1.2.2免疫组化判断标准 SIX1阳性染色呈棕黄色颗粒,主要定位于细胞核,阳性细胞≥10%为阳性;Ki-67以细胞核呈棕黄色染色为阳性,高倍镜下计数100个肿瘤细胞中阳性细胞数所占的百分比,随机计数5个高倍镜视野,以平均数作为细胞增殖指数。在正常子宫颈组织和CIN组织中,SIX1及Ki-67阳性表达主要定位于基底层以上鳞状上皮细胞,仅局限于基底层细胞着色则判为阴性。
1.3SIX1-siRNA表达质粒转染Hela细胞在GenBank中检索SIX1的全长序列,针对目的基因SIX1设置4个靶点,构建4套SIX1-siRNA重组质粒,分别标记为SIX1-siRNAa、SIX1-siRNAb、SIX1-siRNAc、SIX1-siRNAd以及非特异对照质粒(contral-siRNA),其含有一段与目的基因序列无同源性的siRNA。细胞转染采用阳离子脂质体Lipofectamine 2000介导,具体操作步骤按试剂盒说明书进行。实验分为5组:实验组a、b、c、d和非特异性质粒转染组,siRNA的最佳转染浓度为50 nmol/L,常规转染后48 h提取细胞总RNA,转染后72 h提取细胞总蛋白,用RT-PCR和Western blot分别进行检测。
1.4RT-PCR检测Hela细胞中SIX1的mRNA表达用Trizol试剂提取细胞的总RNA,具体操作步骤按试剂盒说明书进行,以等量RNA作为起始模板,逆转录反应合成cDNA。按SYBR Green PCR试剂盒在定量PCR仪上进行RT-PCR检测,反应体系94 ℃预变性15 min,94 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次。
1.5Westernblot检测Hela细胞中SIX1蛋白的表达提取4个实验组和非特异性质粒转染组的蛋白,BCA法蛋白定量试剂盒定量,每孔加样50 μg蛋白,按《分子克隆实验指南》操作,以10%SDS-PAGE电泳分离蛋白,电泳完成后转移至PVDF膜上,5%脱脂牛奶室温下孵育封闭1 h,1 ∶100稀释一抗,4 ℃孵育过夜,TBST洗去一抗,加入HRP标记的二抗,在室温下孵育1 h,TBST洗涤3次,ECL试剂盒显影,以β-actin作为内参。
1.6MTT检测子宫颈癌细胞增殖能力采用MTT法将转染后的转染组和对照组细胞分别接种于3块96孔板,接种密度为每孔5×103个细胞,分别于1、3、5天取1板进行MTT反应,测定490 nm吸光度值,比较转染组细胞与对照组细胞的生长增殖情况。
1.7统计学方法两组定量数据的比较采用独立样本t检验;三组符合正态分布的定量数据采用单因素方差分析法,三组之间两两比较采用SNK-q检验法,两组定性数据的比较采用χ2检验;三组定性数据的比较采用χ2检验,三组之间两两比较采用P值修正法,即P=0.016 7为差异有统计学意义。
2 结果
2.1SIX1蛋白表达与子宫颈癌临床病理特征的关系子宫颈癌组织中SIX1呈弥漫性分布,并突破基底层,阳性率为68.5%,在CIN组织其散在分布于上皮层中,阳性率为11.9%,在正常子宫上皮组织中SIX1不表达,仅在基底层细胞中有个别表达。子宫颈癌组SIX1阳性率高于CIN组及正常子宫颈组(P<0.01)。CIN组与正常子宫颈组比较,差异有统计学意义(P<0.01);且SIX1在子宫颈癌组织中的表达与患者年龄无关(P>0.05);与肿瘤分化程度、浸润深度和淋巴结转移有关(P<0.05,表1,图1~3)。
2.2Ki-67表达与子宫颈癌临床病理特征的关系子宫颈癌组织中Ki-67增殖指数为(53.2±9.28)%,CIN组织中Ki-67增殖指数为(5.4±1.14)%,正常子宫上皮组织中Ki-67增殖指数为0。
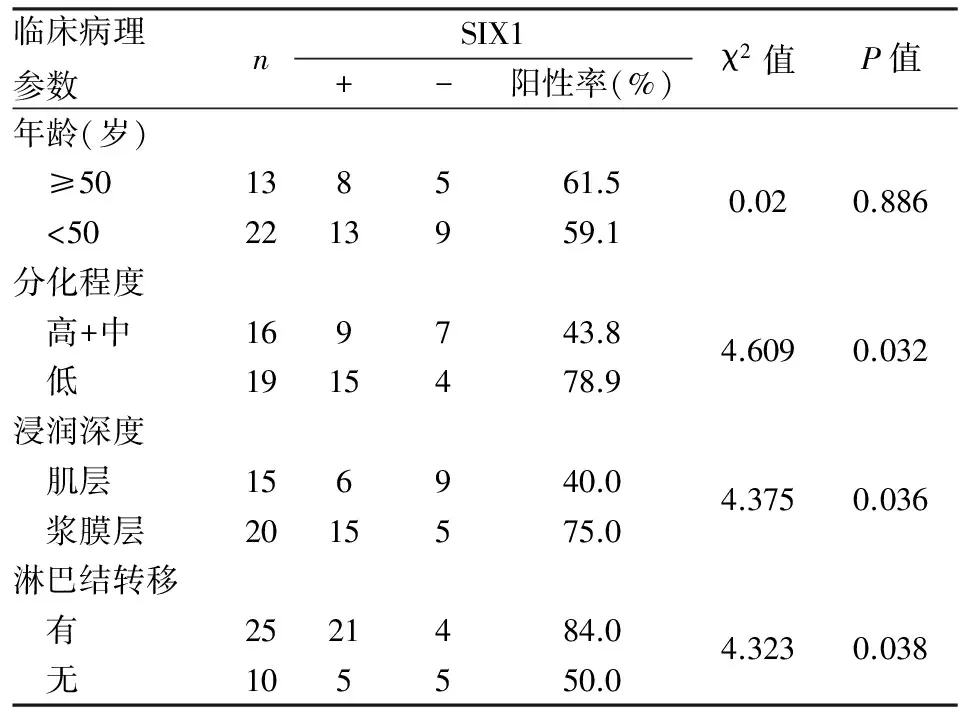
表1 SIX1表达与子宫颈癌临床病理特征的关系
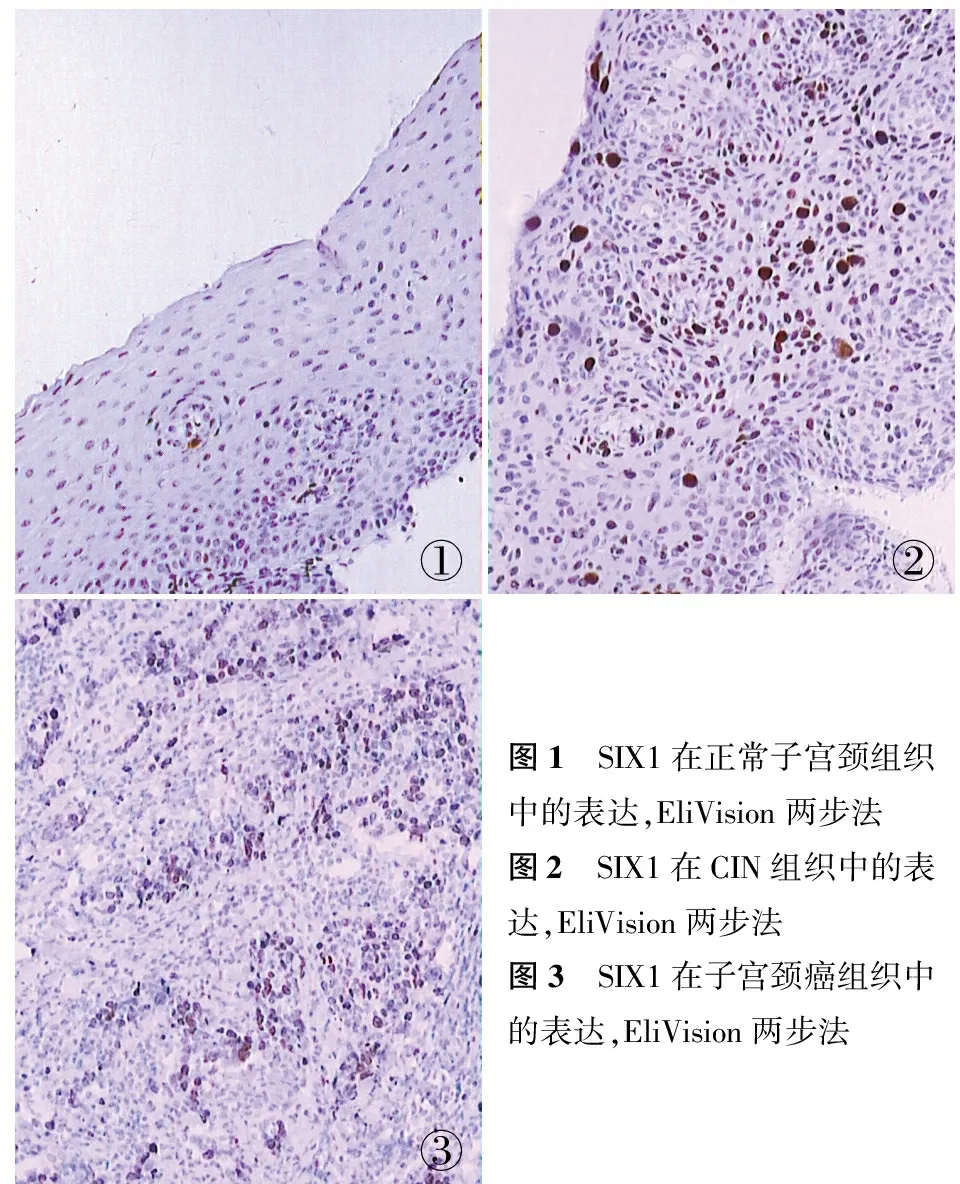
①②③图1 SIX1在正常子宫颈组织中的表达,EliVision两步法图2 SIX1在CIN组织中的表达,EliVision两步法图3 SIX1在子宫颈癌组织中的表达,EliVision两步法
子宫颈癌组中Ki-67的增殖指数高于CIN组及正常子宫颈上皮组,差异有统计学意义(P<0.01),CIN组与正常子宫颈组相比,差异有统计学意义(P<0.01)。
2.3SIX1和Ki-67表达的相关性Spearman等级相关分析显示:在子宫颈各组织中SIX1和Ki-67的表达呈正相关(表2)。
2.4RT-PCR测定SIX1mRNA水平计算方法如下:ΔCt=Ct(SIX1)-Ct(β-actin) ;ΔΔCt=ΔCt(SIX1-siRNA)-ΔCt (control-siRNA) ;抑制率=( 1-2-ΔΔCt) ×100%。RT-PCR的实验表明,转染SIX1-siRNA表达质粒能够有效下调子宫颈癌细胞的mRNA水平,4个实验组中SIX1基因在转录水平被不同程度抑制,其中SIX1-siRNAc对SIX1基因的抑制效果最佳,沉默效果最好(表3)。

表2 SIX1和Ki-67在子宫颈各组织中的表达

表3 转染48 h后Hela细胞中SIX1 mRNA的表达
2.5Westernblot法检测SIX1-siRNA表达质粒对Hela细胞SIX1蛋白表达的影响Western blot实验结果显示,SIX1-siRNA重组质粒转染组(SIX1-siRNA/Hela)的SIX1蛋白表达水平均低于control-siRNA/Hela。统计分析结果表明,4个实验组Hela细胞中SIX1蛋白表达较阴性对照组均有一定程度的降低,差异有统计学意义(P均<0.01)。4个实验组SIX1蛋白表达量各不相同,差异有统计学意义(P均<0.01);其中实验组SIX1-siRNAc的蛋白表达量低于其他实验组(表4,图4)。

图4 SIX1蛋白在各组Hela细胞中的表达
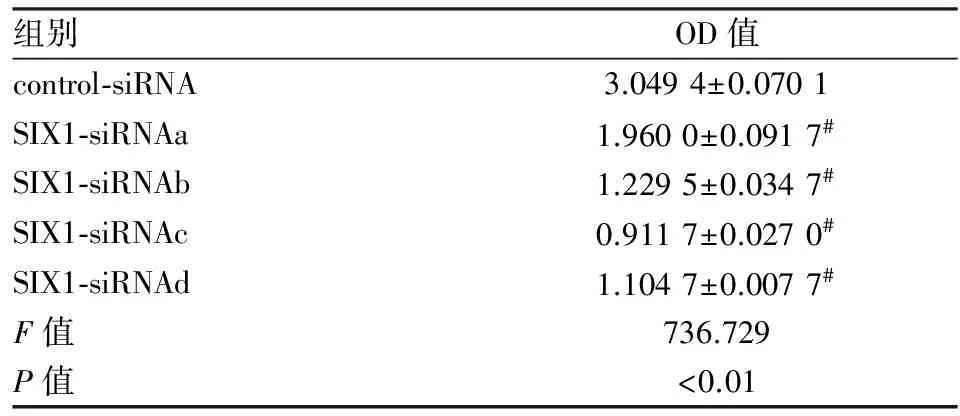
表4 转染72 h后Hela细胞中SIX1蛋白表达(n=5)
与control-siRNA相比,#P<0.01
2.6MTT法检测细胞的生长与增殖由MTT法检测细胞吸光度值,结果显示第1、3、5天转染细胞的OD值与对照组比较,两者差异有统计学意义(P均<0.05,表5)。
3 讨论
同源盒基因是一类特殊的转录调控因子,能够特异性调控基因表达,SIX1是同源盒基因家族的重要成员,近年研究表明SIX1在细胞的增殖、分化、凋亡及细胞形态、细胞黏附和迁移中均发挥关键作用[4-6],在肿瘤发生、发展过程中能诱导癌细胞的增殖和侵袭[7],是重要的癌基因。
SIX1基因定位在人染色体14q23上,其产物SIX1蛋白是由1个高度保守的同源异型结构域(homeodomain,61个氨基酸)的N-末端和SIX结构域(SIXdomain,110~115个氨基酸)组成的复合结构,该复合结构通过与DNA 特定结合调控下游基因的表达,在细胞增殖和组织发育中起关键作用[8]。以往研究显示SIX1是E2F1的转录靶基因,其转录活性一般维持在G1/S期到有丝分裂早期,在有丝分裂的后期由蛋白水解降解。因此,SIX1可作为细胞周期调节器,活化细胞周期调节因子,促进细胞分化、增殖;SIX1的过表达则削弱该作用,相反其加速细胞周期进程,造成细胞无限增殖,导致肿瘤的发生。
近年研究表明,SIX1在多种恶性肿瘤中过表达,Coletta等[9]发现SIX1在早期和转移性乳腺癌中过表达。SIX1在晚期卵巢癌的表达水平是早期卵巢癌的3倍[10]。SIX1在肝细胞癌患者的非肿瘤组织和正常人肝组织中不表达,而在肝细胞癌的肿瘤组织中SIX1 mRNA和蛋白过表达,且过表达与肿瘤转移相关[11]。众多研究显示过表达SIX1表现促进肿瘤生长和转移的作用。
肿瘤细胞增殖与肿瘤发生、浸润和转移过程密切相关,是反映肿瘤良恶性以及恶性程度的重要指标,恶性增殖是肿瘤的重要特征。因此评价细胞的增殖状态,对分析肿瘤的生物学行为具有重要意义[12]。Ki-67作为细胞增殖的标志物,能有效反应细胞增殖的活跃程度[13]。我们通过检测SIX1和Ki-67在子宫颈癌及CIN和正常子宫颈组中的表达,发现SIX1在正常子宫颈黏膜上皮中几乎不表达,仅在基底层细胞中有个别呈弱阳性,与王彤等[8]报道(阳性率15.6%)不一致,可能与本组样本数较少及抗体的差异性有关。SIX1在CIN组中阳性细胞数增多,分布增广;在子宫颈癌组织中的表达明显增强,阳性细胞呈弥漫性分布,三者比较差异有显著性。SIX1在子宫颈癌组织中的表达差异与肿瘤分化程度、浸润深度及淋巴结转移有关(P均<0.05),与患者年龄无关(P>0.05)。Ki-67在正常子宫颈上皮不表达,但有1~2层基底层细胞表达,CIN组和子宫颈癌组上皮细胞增殖明显,阳性率逐次增强,差异有统计学意义。SIX1的表达和Ki-67增殖指数呈明显正相关,SIX1表达在一定程度上较好的反映子宫颈上皮不同阶段细胞增殖活性的变化。同时我们利用RNA干扰技术抑制子宫颈癌Hela细胞的SIX1基因表达,发现下调Hela细胞SIX1的mRNA和蛋白表达水平后,Hela细胞的增殖能力降低,进一步证实SIX1可能与子宫颈癌细胞增殖有关。SIX1的表达可能具有促进癌细胞增殖的作用,与子宫颈癌的发生、发展密切相关,有望成为子宫颈癌的重要分子标志物。

表5 转染第1、3、5天 Hela细胞的增殖
[1] 张丽杰,马 冬,周秀敏,等. KLF5和MMP-1在宫颈癌中的表达及其临床意义[J]. 中国妇幼保健, 2017,32(2):383-387.
[2] Li X, Oghi K A, Zhang J,etal. Eya protein phosphatase activity regulates Six1-Dach-Eya transcriptional effects in mammalian organogenesis[J]. Nature, 2003,426(6964):247-254.
[3] 金爱花,金海燕. Six1蛋白在恶性肿瘤中的研究进展[J]. 临床与实验病理学杂志, 2014,30(4):437-440.
[4] Pearson J C, Lemons D, McGinnis W. Modulating hox gene functions during animal body patterning[J]. Nat Rev Genet, 2005,6(12):893-904.
[5] Kumar J P. The sine oculis homeobox ( SIX) family of transcription factors as regulators of development and disease[J]. Cell Mol Life Sci, 2009,66(4):565-583.
[6] Wu W, Huang R, Wu Q,etal. The role of Six1 in the genesis of muscle cell and skeletal muscle development[J]. Int J Biol Sci, 2014,10(9):983-989.
[7] Xin X, Li Y, Yang H. SIX1 is overexpressed in endometrial carcinoma and promotes the malignant behavior of cancer cells through ERK and AKT signaling[J]. Oncol Lett, 2016,12(5):3435-3440.
[8] 王 彤,朴龙镇,崔雪莲,等. Six1在宫颈癌组织中的表达及意义[J]. 天津医药, 2015,43(3):249-251.
[9] Coletta R D, McCoy E L, Burns V,etal. Characterization of the six1 homeobox gene in normal mammary gland morphogenesis[J]. BMC Dev Biol, 2010,10(1):4.
[10] Behbakht K, Qamar L, Aldridge C S,etal. Six1 overexpression in ovarian carcinoma causes resistance to TRAIL-mediated apoptosis and is associated with poor survival[J]. Cancer Res, 2007,67(7):3036-3042.
[11] Ng K T, Man K, Sun C K,etal. Clinicopathaloeal significance of homeoprotein Six1 in hepatocellular carcinoma[J]. Br J Cancer, 2006,95(8):1050-1055.
[12] 陈 玮,赵 涌. MCM5和Ki-67在宫颈上皮内瘤变及宫颈癌组织中表达及意义[J]. 第三军医大学学报, 2007,29(14):1436-1439.
[13] Wong F W. Immunohistochemical antibody Ki-67[J]. Gynecol Obster, 1994,37(2):123.
ExpressionofSIX1incervicalcancerandrelationshipwithcervicalcancercellproliferation
HUANG Jiang-mei, XIAO Fang, CHEN Yan-xin, LI Tao, ZHOU Ying, ZHAO Min, ZHANG Hui
(DepartmentofPathology,theFirstHospitalofQinhuangdao,Qinhuangdao066000,China)
PurposeTo investigate the expression of SIX1 in cervical cancer and its biological function.MethodsThe expression of SIX1 and Ki-67 in 35 cervical cancer tissues, 42 cervical intraepithelial neoplasia (CIN) tissues and 15 normal cervical tissues was detected by immunohistochemical of EliVision two-step staining. A plasmid vector expressing SIX1 siRNA was constructed and then stably transfected into Hela cells. The expression of SIX1 mRNA and protein was examined by RT-PCR and Western blot method respectively. The proliferation was examined by MTT.ResultsThe positive rate of SIX1 in cervical cancer was significantly higher than that of CIN and normal cervical tissues and was positively correlation with the proliferation index of Ki-67. After RNAi treatment, the mRNA and protein levels of SIX1 was down-regulated in Hela cells and the proliferation of Hela cells was inhibited.ConclusionSIX1 may play an important role in the occurrence and development process of cervical cancer by promoting cervical cancer cell proliferation.
cervical neoplasm;cervical intraepithelial neoplasia; SIX1; Ki-67
时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.004.html
R 737.33
A
1001-7399(2017)09-0959-05
10.13315/j.cnki.cjcep.2017.09.004
接受日期:2017-07-24
秦皇岛市第一医院病理科 066000
黄江梅,女,硕士,副主任医师。E-mail: 402281091@qq.com
