子宫内膜癌组织Septin- 9表达变化及其意义
2017-11-16杨爱萍
杨爱萍
(青海红十字医院,西宁810000)
子宫内膜癌组织Septin- 9表达变化及其意义
杨爱萍
(青海红十字医院,西宁810000)
目的探讨子宫内膜癌组织Septin- 9 mRNA表达变化及其临床意义。方法选择子宫内膜癌患者120例(子宫内膜癌组)、子宫内膜不典型增生患者63例(不典型增生组)、子宫肌瘤患者70例(子宫肌瘤组),分别取手术切除的子宫内膜癌组织、子宫内膜不典型增生组织、正常子宫内膜组织,采用qRT- PCR法检测各子宫内膜组织Septin- 9 mRNA表达。同时分析子宫内膜癌组织Septin- 9 mRNA表达与患者临床病理参数及预后的关系。结果子宫内膜癌组、不典型增生组、子宫肌瘤组Septin- 9 mRNA相对表达量分别为1.98±0.51、1.64±0.23、1.00±0.00,组间两两比较P均<0.05。子宫内膜癌组Septin- 9 mRNA表达与淋巴结转移、肌层浸润和FIGO分期有关(P均<0.05),与患者年龄、绝经状态、病理类型及病理分级无关(P均>0.05)。以子宫内膜癌组Septin- 9 mRNA相对表达量的下四分位数为界值,将子宫内膜癌患者分为Septin- 9 mRNA低表达者和Septin- 9 mRNA高表达者。Septin- 9 mRNA高表达者术后5年生存率及总生存时间均低于Septin- 9 mRNA低表达者(P均<0.05)。结论子宫内膜癌组织Septin- 9 mRNA表达升高,其表达变化可能有助于子宫内膜癌诊断、病情评估及预后预测。
子宫内膜癌;Septin- 9;实时荧光定量PCR;临床病理特征;预后
子宫内膜癌是女性常见的三大恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%,近年来其发病率有升高趋势[1]。Septin- 9蛋白是细胞骨架GTP结合蛋白家族的重要成员之一,广泛存在于真核生物中,与细胞骨架重构、囊泡运输以及细胞质分裂等多种生理过程密切相关[2]。近年研究表明,Septin- 9可参与多种恶性肿瘤的发生、发展,如乳腺癌[3]、直肠癌[4]、胃癌[5]等。但Septin- 9与子宫内膜癌发生、发展的关系鲜有报道[6]。本研究分析子宫内膜癌组织Septin- 9表达变化及其与患者临床病理参数和预后的关系。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 研究对象为2008年1月~2012年1月在青海红十字医院行手术收治的子宫疾病患者253例,其病例资料完整。其中,子宫内膜癌患者120例(子宫内膜癌组),年龄38~75(54.98±10.75)岁,术前未行任何抗肿瘤治疗;子宫内膜不典型增生患者63例(不典型增生组),年龄36~72(57.47±13.62)岁;子宫肌瘤患者70例(子宫肌瘤组),年龄36~80(53.54±12.17)岁。所有患者经术后组织病理检查明确诊断。三组年龄具有可比性。本研究经青海红十字医院医学伦理委员会批准,患者均知情同意。
1.2 子宫内膜组织Septin- 9 mRNA表达检测 采用qRT- PCR法。取三组手术切除的子宫内膜组织,采用TRIzol抽提试剂盒提取组织总RNA,紫外分光光度计检测总RNA浓度和纯度,采用逆转录试剂盒将总RNA逆转录为cDNA,然后进行PCR扩增。引物序列由上海英骏生物技术有限公司设计合成。引物序列:Septin- 9上游引物:5′- CAGAGCGGCTTGGGTAAATCC- 3′,下游引物: 5′- CTCCTCAATATCGTGC-GTGATGG- 3′;GAPDH上游引物:5′- ACAACTTTGGTATCGTGGAAGG- 3′,下游引物:5′- GCCATCACGCCACAGTTTC- 3′。PCR反应体系共20 μL,反应条件:50 ℃孵育2 min,95 ℃ Taq酶活化10 min,95 ℃ 15 s、60 ℃ 1 min共40个循环。所有操作在荧光定量PCR扩增仪(ABI PRISM® 7300,美国ABI公司)上进行。以GAPDH为内参,采用2-ΔΔCt法计算Septin- 9 mRNA相对表达量。
1.3 子宫内膜癌组织Septin- 9 mRNA表达与患者临床病理参数关系分析 收集子宫内膜癌患者临床病理参数,包括年龄、绝经状态、组织学类型、病理分级、FIGO分期、肌层浸润、淋巴结转移等,分析子宫内膜癌组织Septin- 9 mRNA表达与患者临床病理参数的关系。
1.4 子宫内膜癌组织Septin- 9 mRNA表达与患者预后关系分析 收集子宫内膜癌患者随访资料。以子宫内膜癌患者Septin- 9 mRNA相对表达量的下四分位数为界值,将子宫内膜癌组分为Septin- 9 mRNA低表达者(Septin- 9 mRNA相对表达量低于下四分位数)和Septin- 9 mRNA高表达者(Septin- 9 mRNA相对表达量等于或高于下四分位数),绘制其Kaplan- Meier生存曲线,比较其术后5年生存率和总生存时间。

2 结果
2.1 各组Septin- 9 mRNA相对表达量比较 子宫内膜癌组、不典型增生组、子宫肌瘤组Septin- 9 mRNA相对表达量分别为1.98±0.51、1.64±0.23、1.00±0.00,组间两两比较P均<0.05。
2.2 子宫内膜癌组织Septin- 9 mRNA表达与患者临床病理参数的关系 子宫内膜癌组织Septin- 9 mRNA表达与淋巴结转移、肌层浸润和FIGO分期有关(P均<0.05),与患者年龄、绝经状态、组织学类型及病理分级无关(P均>0.05)。见表1。
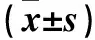
表1 子宫内膜癌组织Septin- 9 mRNA表达 与患者临床病理参数的关系
2.3 子宫内膜癌组织Septin- 9表达与患者预后的关系 随访3~60个月,子宫内膜癌组死亡78例。Septin- 9 mRNA高表达者与Septin- 9 mRNA低表达者术后5年生存率分别为18.75%(12/64)、53.57%(30/56),总生存时间分别为(33.67±2.59)、(50.55±2.35)个月,Septin- 9 mRNA高表达者术后5年生存率及总生存时间均低于Septin- 9 mRNA低表达者(P均<0.05)。
3 讨论
子宫内膜癌属于上皮性恶性肿瘤,以来源于子宫内膜腺体的腺癌最常见,是女性生殖系统的三大恶性肿瘤之一,其病因迄今尚不明确[7]。手术联合放化疗为目前子宫内膜癌的首选治疗方法[8],但患者预后并不乐观。故寻求新的治疗和预测预后的靶标是临床研究的热点[9]。
Septin- 9基因是Septin- 9蛋白的编码基因,位于染色体17q25.3,其转录产物可产生18种变异剪切体,编码15种多肽[10]。Septin- 9变异剪切体之间具有一定的核苷酸相似性和氨基酸一致性[11],且他们的分布具有组织特异性,如Septin- 9 v1分布于除脑和胸腺外的组织[12],Septin- 9 v2、Septin- 9 v3、Septin- 9 v4多在胎儿组织中表达[13]。Scholz等[14]研究证实,siRNA技术干扰Septin- 9表达可使细胞分裂不完整;Fukushige等[15]研究表明,Septin- 9异常表达可导致细胞极性丢失,从而使细胞癌变的发生风险增加。
本研究结果显示,子宫内膜癌组Septin- 9 mRNA表达显著高于不典型增生组和子宫肌瘤组,且不典型增生组Septin- 9 mRNA相对表达量显著高于子宫肌瘤组。提示随着正常子宫内膜组织向子宫内膜癌组织进展,Septin- 9 mRNA表达逐渐升高,Septin- 9在子宫内膜癌发生、发展过程中可能具有癌基因作用。本研究还发现,子宫内膜癌组织Septin- 9 mRNA表达与患者年龄、绝经状态、组织学类型和病理分级无关,而与淋巴结转移、肌层浸润和FIGO分期有关,且存在淋巴结转移、肌层浸润深、FIGO分期高的子宫内膜癌患者Septin- 9 mRNA表达相对较高,提示Septin- 9可能与子宫内膜癌的侵袭和转移有关,检测癌组织Septin- 9 mRNA表达有助于判断病情。林春燕等[16]研究发现,Septin- 9能够抑制HIF- 1α蛋白降解,增加血管内皮生长因子的表达,从而促进肿瘤血管形成。这可能是Septin- 9参与子宫内膜癌发生、发展的具体机制。
本研究结果显示,Septin- 9 mRNA高表达者总生存时间较Septin- 9 mRNA低表达者明显缩短,术后5年生存率亦明显降低。提示子宫内膜癌组织Septin- 9 mRNA表达变化可影响患者预后,Septin- 9 mRNA高表达提示患者预后不良;检测子宫内膜癌组织Septin- 9 mRNA表达将有助于评估子宫内膜癌患者预后。
[1] 刘妮,闫雅欣,钱延玲,等.子宫内膜癌的治疗进展[J].医药前沿,2016,6(11):5- 7.
[2] Dolat L, Hu Q, Spiliotis ET. Septin functions in organ system physiology and pathology[J]. Biol Chem, 2014,395(2):123- 141.
[3] Connolly D, Yang Z, Castaldi M, et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression[J]. Breast Cancer Res, 2011,13(4):R76.
[4] Molnár B, Tóth K, Barták BK, et al. Plasma methylated septin 9: a colorectal cancer screening marker[J]. Expert Rev Mol Diagn, 2015,15(2):171- 184.
[5] 李楠,王贺玲,梁晓平,等.SEPTIN 9在胃癌组织中的表达及临床意义[J].中国微创外科杂志,2014,14(12):1125- 1127.
[6] 吕讷男,姚洪文,肖汀,等.卵巢上皮性癌患者外周血中septin- 9和clusterin蛋白的表达及其意义[J].中华妇产科杂志,2015,50(9):679- 684.
[7] Stubert J, Gerber B. Current issues in the diagnosis and treatment of endometrial carcinoma[J]. Geburtshilfe Frauenheilkd, 2016,76(2):170- 175.
[8] Loukovaara M, Luomaranta A, Leminen A. Treatment of endometrial carcinoma[J]. Duodecim, 2014,130(22- 23):2348- 2355.
[9] Liu LC, Lai HC, Chou YC, et al. Paired boxed gene 1 expression: a single potential biomarker for differentiating endometrial lesions associated with favorable outcomes in patients with endometrial carcinoma[J]. J Obstet Gynaecol Res, 2016,42(9):1159- 1167.
[10] Mostowy S, Cossart P. Septins: the fourth component of the cytoskeleton[J]. Nat Rev Mol Cell Biol, 2012,13(3):183- 194.
[11] 马强.Septin9蛋白与人类疾病[J].读写算(教育教学研究),2015,4(17):150.
[12] Mao H, Liu J, Shi W, et al. The expression patterns of Septin- 9 after traumatic brain injury in rat brain[J]. J Mol Neurosci, 2013,51(2):558- 566.
[13] Bridges AA, Gladfelter AS. Septin Form and Function at the Cell Cortex[J]. J Biol Chem, 2015,290(28):17173- 17180.
[14] Scholz R, Imami K, Scott NE, et al. Novel host proteins and signaling pathways in enteropathogenic E. coli pathogenesis identified by global phosphoproteome analysis[J]. Mol Cell Proteomics, 2015,14(7):1927- 1945.
[15] Fukushige S, Horii A. DNA methylation in cancer: a gene silencing mechanism and the clinical potential of its biomarkers[J]. Tohoku J Exp Med, 2013,229(3):173- 185.
[16] 林春燕,税青林.SEPT9与恶性肿瘤的研究进展[J].泸州医学院学报,2013,36(2):186- 188.
10.3969/j.issn.1002- 266X.2017.36.027
R737.33
B
1002- 266X(2017)36- 0082- 03
2017- 05- 05)
