USP39、EZH2及Sox17在乳腺癌组织中的表达及其临床意义
2017-08-28戈瑶
戈瑶
(乐山职业技术学院 病理研究室,四川 乐山 614000)
USP39、EZH2及Sox17在乳腺癌组织中的表达及其临床意义
戈瑶
(乐山职业技术学院 病理研究室,四川 乐山 614000)
目的 探讨USP39、EZH2和Sox17在乳腺癌组织中的表达及其临床意义。方法 选取90例乳腺癌患者根据临床病理特征不同,分为原位癌34例、早期浸润癌41例和浸润癌15例。采用逆转录-聚合酶链反应(RT-PCR)测定3组患者的肿瘤组织中USP39、EZH2和Sox17,microRNA自噬基因表达差异。结果 浸润癌组患者的的肿瘤组织中USP39、EZH2信使核糖核酸(mRNA)表达量高于原位癌组及早期浸润癌组患者,Sox17 mRNA表达量低于原位癌组及早期浸润癌组患者;miR-29a、miR-149表达量高于原位癌组及早期浸润癌组患者,miR-125b、miR-21和miRNA-26a表达量低于原位癌组及早期浸润癌组患者;自噬基因LC3 mRNA表达量高于原位癌组及早期浸润癌组患者,Beclin1、ATG2B和ATG4G mRNA表达量低于原位癌组及早期浸润癌组患者。乳腺癌患者肿瘤组织USP39、EZH2和Sox17 mRNA表达量与相关microRNA表达量、自噬基因表达量存在直接相关关系。结论 乳腺癌组织中USP39、EZH2表达升高,Sox17表达量降低且与乳腺癌细胞的增殖、凋亡有关。
乳腺癌;USP39;EZH2;Sox17;自噬
乳腺癌目前在国内发病率增高,早期确诊疾病并选择合理治疗方案是优化治疗结局的关键所在,较多基因异常表达参与乳腺癌的发生,其中USP39、EZH2和Sox17是目前较受关注的3种乳腺癌早期诊断相关基因[1]。国内外研究报道,USP39、EZH2和Sox17异常表达在乳腺癌的发生、发展中扮演重要角色,且原位癌患者也可出现表达量改变,故有学者提出可以将USP39、EZH2和Sox17基因联合检测作为乳腺癌早期筛查的新手段[2-3]。本研究选取不同病理特性的乳腺癌患者作为研究对象,通过检测肿瘤组织USP39、EZH2和Sox17基因表达量,以及乳腺癌病情相关基因表达情况,以期明确上述3种基因在判断乳腺癌病情方面的意义。
1 资料与方法
1.1 一般资料
选取2015年5月-2016年5月在确认乳腺癌并接受手术治疗的患者。纳入标准:①均经病理活检确诊乳腺癌;②原发性乳腺癌;③既往未接受放化疗;④患者知情同意。排除标准:①伴其他脏器原发性恶性肿瘤性疾病;②乳腺癌发生全身转移;③妊娠或者哺乳期妇女;④临床资料不完整。
90例乳腺癌患者符合以上入组标准,根据具体术中病理报告分为原位癌34例、早期浸润癌41例、浸润癌15例。原位癌组患者年龄42~72岁,平均(58.93±8.12)岁;病灶大小 8~59 mm,平均(23.71±7.09)mm;月经状态:绝经21例、未绝经13例。早期浸润癌组患者年龄40~76岁,平均(53.76±8.09)岁;病灶大小 7~62 mm,平均(23.98±7.24)mm,月经状态:绝经25例、未绝经16例。浸润癌组患者年龄41~75岁,平均(56.59±8.11)岁;病灶大小 10~67 mm,平均(25.59±7.48)mm,月经状态:绝经 9例、未绝经6例。3组患者的年龄、肿瘤直径和绝经状态分布差异无统计学意义(年龄:F=0.395,P=0.184;肿瘤直径:F=0.193,P=0.129;绝经状态:χ2=0.582,P=0.106),具有可比性。
1.2 实验材料
Trizol试剂(美国赛默飞世尔科技公司),逆转录试剂盒以及聚合酶链反应(polymerase chain reaction,PCR)master mix荧光反应液(浙江省杭州主诺生物技术有限公司),PCR引物由上海生物工程技术有限公司合成。
1.3 实时荧光定量PCR
采用实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)法测定患者手术所得病灶组织中各基因的表达量,具体方法如下:①总核糖核酸(ribonucleic acid,RNA)提取、逆转录。取10 mg乳腺癌肿瘤组织样本,碾磨并用Trizol试剂提取总RNA。通过分光光度计检测提取总RNA的浓度、纯度,取吸光度位于1.8~2.1的样本进入后续试验。取3 μg上述总RNA,采用逆转录试剂盒说明书进行逆转录,将互补脱氧核糖核酸 (complementary deoxyribonucleic acid,cDNA)样本置于-20℃冰箱冷冻保存。②qRT-PCR。设计目标基因引物后,进行基因扩增。反应体系:PCR master mix 荧光反应液 10 μl、specific primer set 0.25 μl和cDNA模板2 μl,用去离子水补足至20 μl。PCR反应条件:95℃预变性 3 min,95℃变性 12 s,62℃退火35 s,共40个循环,用仪器自带软件对溶解曲线进行分析,以actin为内参,计算目标基因(USP39、EZH2、Sox17、miR-29a、miR-125b、miR-149、miR-218、miRNA-26a、LC3、Beclin1、ATG2B 和 ATG4G)表达量。以原位癌组患者的目的基因mRNA表达量为100,计算早期浸润癌组、浸润癌组的相应目的基因mRNA表达量。
1.4 统计学方法
数据分析采用SPSS 23.0统计软件,计量资料以均数±标准差(±s)表示,用方差分析,相关性分析用Pearson检验,P<0.05为差异有统计学意义。
2 结果
2.1 USP39、EZH2和Sox17表达
早期浸润癌组患者的肿瘤组织中USP39和EZH2的mRNA表达量高于原位癌组患者,Sox17 mRNA表达量低于原位癌组患者;浸润癌组患者的的肿瘤组织中USP39和EZH2的mRNA表达量高于原位癌组及早期浸润癌组患者,Sox17 mRNA表达量低于原位癌组及早期浸润癌组患者。3组患者的肿瘤组织USP39、EZH2和Sox17 mRNA表达量差异有统计学意义(USP39:F3组间=9.385、P3组间=0.000,t原位癌组vs早期浸润癌组=8.281、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=11.284、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=6.978、P早期浸润癌组vs浸润癌组=0.004;EZH2:F3组间=12.581、P3组间=0.000,t原位癌组vs早期浸润癌组=9.392、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=15.028、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=7.393、P早期浸润癌组vs浸润癌组=0.001;Sox17:F3组间=16.312、P3组间=0.000),t原位癌组vs早期浸润癌组=13.282、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=18.958、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=9.172、P早期浸润癌组vs浸润癌组=0.000。见表 1。
表1 3组患者的肿瘤组织USP39、EZH2和Sox17 mRNA表达量比较 (±s)

表1 3组患者的肿瘤组织USP39、EZH2和Sox17 mRNA表达量比较 (±s)
注:1)早期浸润癌组与原位癌组比较,P<0.05;2)浸润癌组与早期浸润癌组比较,P<0.05
组别Sox17原位癌组 34 100±10.17 100±10.54 100±9.37早期浸润癌组 41 143.25±17.041)154.69±18.151)54.37±6.921)浸润癌组 15 173.28±20.151)2)214.37±25.731)2)21.83±2.091)2)例数USP39EZH2
2.2 miRNA表达
早期浸润癌组患者的肿瘤组织中miR-29a、miR-149表达量高于原位癌组患者,miR-125b、miR-218和miRNA-26a表达量低于原位癌组患者;浸润癌组患者的肿瘤组织中miR-29a、miR-149表达量高于原位癌组及早期浸润癌组患者,miR-125b、miR-218和miRNA-26a表达量低于原位癌组及早期浸润癌组患者。3组患者的肿瘤组织miR-29a、miR-149、miR-125b、miR-218 和 miRNA-26a 表达量差异有统计学意义(miR29a:F3组间=13.028、P3组间=0.000,t原位癌组vs早期浸润癌组=10.398、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=14.592、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=8.182、P早期浸润癌组vs浸润癌组=0.000;miR-149:F3组间=9.116、P3组间=0.000,t原位癌组vs早期浸润癌组=8.384、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=12.183、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=7.201、P早期浸润癌组vs浸润癌组=0.001;miR-125b:F3组间=10.983、P3组间=0.000,t原位癌组vs早期浸润癌组=8.398、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=13.029、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=7.482、P早期浸润癌组vs浸润癌组=0.001;mi-218:F3组间=14.284、P3组间=0.000,t原位癌组vs早期浸润癌组=11.384、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=17.402、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=8.693、P早期浸润癌组vs浸润癌组=0.000;miR-26a:F3组间=11.352、P=0.000,t原位癌组vs早期浸润癌组=9.394、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=14.293、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=8.119、P早期浸润癌组vs浸润癌组=0.000)。见表 2。
2.3 自噬基因表达
早期浸润癌组患者的肿瘤组织中LC3 mRNA表达量高于原位癌组患者,Beclin1、ATG2B和ATG4G mRNA表达量低于原位癌组患者;浸润癌组患者的的肿瘤组织中LC3 mRNA表达量高于原位癌组及早期浸润癌组患者,Beclin1、ATG2B和ATG4G mRNA表达量低于原位癌组及早期浸润癌组患者。3组患者的肿瘤组织LC3、Beclin1、ATG2B和ATG4G mRNA表达量差异有统计学意义(LC3:F3组间=8.938、P3组间=0.003,t原位癌组vs早期浸润癌组=7.985、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=11.039、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=7.119、P早期浸润癌组vs浸润癌组=0.001;Becllin1:F3组间=12.833、P3组间=0.000,t原位癌组vs早期浸润癌组=10.283、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=15.298、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=8.382、P早期浸润癌组vs浸润癌组=0.000;ATG2B:F3组间=10.385、P=0.000,t原位癌组vs早期浸润癌组=9.228、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=12.856、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=8.172、P早期浸润癌组vs浸润癌组=0.000;ATG4G:F3组间=14.582、P3组间=0.000,t原位癌组vs早期浸润癌组=12.383、P原位癌组vs早期浸润癌组=0.000,t原位癌组vs浸润癌组=17.583、P原位癌组vs浸润癌组=0.000,t早期浸润癌组vs浸润癌组=10.282、P早期浸润癌组vs浸润癌组=0.000)。见表 3。
表2 3组患者的肿瘤组织USP39、EZH2和Sox17 mRNA表达量比较 (±s)

表2 3组患者的肿瘤组织USP39、EZH2和Sox17 mRNA表达量比较 (±s)
注:1)早期浸润癌组与原位癌组比较,P<0.05;2)浸润癌组与早期浸润癌组比较,P<0.05
组别miRNA-26a原位癌组 34 100±9.32 100±12.18 100±10.73 100±9.74 100±10.56早期浸润癌组 41 173.25±19.141) 76.51±8.071) 153.62±18.761) 65.38±7.011) 78.34±8.121)浸润癌组 15 241.28±30.671)2) 34.09±4.121)2) 209.31±22.171)2) 37.94±4.521)2) 40.89±5.481)2)例数miR-29a miR-125b miR-149miR-218
2.4 USP39、EZH2和Sox17与乳腺癌病情的相关性
乳腺癌患者肿瘤组织中USP39、EZH2和Sox17基因表达量与 microRNA(miR-29a、miR-125b、miR-149、miR-218、miRNA-26a)、自噬基因(LC3、Beclin1、ATG2B、ATG4G)表达量呈直接相关性(P<0.05)。见表4。
表3 3组患者的肿瘤组织自噬基因mRNA表达量比较 (±s)
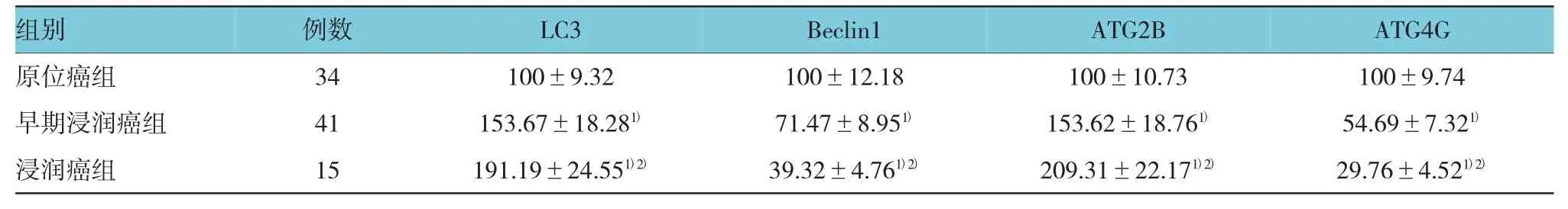
表3 3组患者的肿瘤组织自噬基因mRNA表达量比较 (±s)
注:1)与原位癌组比较,P <0.05;2)与早期浸润癌组比较,P<0.05
组别ATG4G原位癌组 34 100±9.32 100±12.18 100±10.73 100±9.74早期浸润癌组 41 153.67±18.281) 71.47±8.951) 153.62±18.761) 54.69±7.321)浸润癌组 15 191.19±24.551)2) 39.32±4.761)2) 209.31±22.171)2) 29.76±4.521)2)例数LC3Beclin1ATG2B

表4 USP39、EZH2、Sox17与乳腺癌病情的相关性
3 讨论
不同病理特征的乳腺癌生物学特性、肿瘤发展和治疗具有均相差甚远,早期判断肿瘤分型并制定合理的治疗方案是优化临床治疗结局的关键所在。随着对恶性肿瘤的研究深入,较多研究发现肿瘤组织中存在信号转导通路及相关因子的异常表达,直接参与肿瘤细胞增殖、侵袭、转移活性的改变,早期发现此类因子并检测其表达改变成为肿瘤治疗指导、预后判断的新方式。USP39可以促进乳腺癌肿瘤细胞增殖、侵袭等恶性生物学行为,最新研究更是发现USP39可能与恶性肿瘤治疗过程中的多重耐药发生相关。汪小霞[4]已经证实,在乳腺癌组织中EZH2表达量增加,在乳腺癌组织中的阳性表达率为57%左右。Sox17因子是新发现的抑癌基因,较多文献报道该因子通过抑制Wnt信号传导通路而参与肿瘤发生[5]。在肿瘤发生初期,Sox17发挥拮抗细胞恶性转化的作用,随着Sox17逐步被甲基化,Wnt通路被活化而促使肿瘤进展[6]。本研究首先对上述3种新型基因表达量进行研究,发现随着乳腺癌细胞浸润深入增加,肿瘤组织中USP39、EZH2 mRNA表达量增加,Sox17 mRNA表达量降低,提示Sox17基因抑癌作用的降低,USP39、EZH2基因促肿瘤进展的作用增强是乳腺癌发生及浸润转移的重要机制,也与既往文献报道3种基因的作用基本一致。
鉴于USP39、EZH2、Sox17在乳腺癌组织中的表达异常,较多学者认为可以通过3种基因的联合检测来作为早期明确肿瘤分期、制定治疗方案的基础,但是目前关于USP39、EZH2、Sox17基因表达对于乳腺癌发展的意义研究仍不多。多种microRNA(mRNA)被发现直接参与乳腺癌发生,通过与靶mRNA特定序列结合、诱导靶mRNA剪切,实现对靶基因的调控并影响肿瘤发展[7]。miR-29a、miR-149、miR-125b、miR-218和miRNA-26a是目前已在国外文献中报道过,与乳腺癌发生、发展有密切联系mRNA,miR-29a、miR-149在乳腺癌组织中存在表达上调,而转染该基因后乳腺癌细胞的增殖及迁移能力均下降[8]。miR-125b在乳腺癌细胞中的表达被一致认为是下调的,扮演抑癌基因角色。miR-218被发现在鼻咽癌中呈低表达,同时可以抑制食管癌细胞的增殖,目前多数学者认为,其在乳腺癌中也呈低表达[9]。miR-26a可下调环氧化酶-2的表达并实现对乳腺癌细胞增殖的抑制,低表达的mRNA-26a提示乳腺癌细胞侵袭性较强[10-11]。本研究发现,浸润癌组患者的肿瘤组织中 miR-29a、miR-149表达量高于其他2组,miR-125b、miR-218和 mRNA-26a表达量低于其他2组,这与既往文献报道结果相符,说明具有抑癌作用的mRNA表达量下降、促癌mRNA表达量上升是乳腺癌发生及持续进展的重要原因。
自噬在细胞成分更新、细胞生长分化等多个生理过程中扮演重要角色,是机体在损伤导致微环境改变时的一种防御机制,同时目前多种研究发现细胞自噬活性与肿瘤发生密切相关,自噬成为当下肿瘤学研究的热点[12]。LC3被认为是自噬的标志分子,目前,发现在大肠癌、口腔鳞状细胞癌中呈高表达,同时在闫红[13]的研究中也发现,乳腺癌组织中LC3高表达率高达84.2%。在动物研究中发现,Beclin1基因敲除大鼠的癌症罹患率大幅高于正常者;有学者发现,在细胞中增强ATG及其辅助因子表达可造成细胞死亡[14-15]。本研究对自噬相关基因LC3、Beclin1、ATG2B和ATG4GmRNA表达量进行检测,发现浸润性乳腺癌患者的肿瘤组织中LC3呈高表达,Beclin1、ATG2B和ATG4G mRNA呈低表达,与其他肿瘤中上述基因的表达情况一致,说明自噬基因的异常表达也参与乳腺癌进程中。
为明确USP39、EZH2和Sox17对乳腺癌诊断的价值,本研究最后对USP39、EZH2和Sox17 mRNA表达量与mRNA、自噬基因表达量进行相关性分析,发现乳腺癌患者的USP39、EZH2和Sox17 mRNA表达量 与 miR-29a、miR-125b、miR-149、miR-218、miR-26a、LC3、Beclin1、ATG2B 和 ATG4G mRNA 表达量存在直接相关性。提示乳腺癌组织中的USP39、EZH2和Sox17基因表达量可以作为患者整体病情严重程度评估,预后判断的可靠手段。
综上所述,得出以下结论:乳腺癌患者的肿瘤组织USP39、EZH2和Sox17 mRNA表达与具体病情及预后有密切联系,是乳腺癌标志性基因,有望为日后乳腺癌的诊断、治疗服务。
[1]符德元,任传利,谭好升,等.乳腺癌患者血浆循环DNA中Sox17基因甲基化检测的临床意义[J].中国癌症杂志,2014,24(11):808-811.
[2]FU D Y,TANH S,WEI J L,et al.Decreased expression of SOX17 is associated with tumor progression and poor prognosis in breast cancer[J].Tumor Biology,2015,36(10):8025-8034.
[3]NEUSQUEN L P,FILASSI J R,FRISTACHI C E,et al.EZH2 protein expression and tumor response to neoadjuvant chemotherapy in locally advanced breast cancer[J].Rev Bras Ginecol Obstet.2016,38(6):280-286.
[4]汪小霞,孟刚,李丽,等.乳腺癌中EZH2和p53蛋白表达及其临床意义[J].临床与实验病理学杂志,2015,31(3):273-276.
[5]柳杨,段丽君,万素芳.卵巢癌组织中Wnt信号通路活性检测及肿瘤恶性生物学行为的评估[J].海南医学院学报,2015,21(6):724-727.
[6]程海东,莎仁高娃,陈凛.以铂类为基础的新辅助化疗疗效与胃癌临床病理特征及泛素特异性蛋白酶39的相关性研究[J].中国全科医学,2016,19(3):277-280.
[7]NOGALES-CADENAS R,CAI Y,LIN J R,et al.MicroRNA expression and gene regulation drive breast cancer progression and metastasis in PyMT mice[J].Breast Cancer Research,2016,18(1):75.
[8]刘奎,孔繁九,杜善梅,等.miR-29a在乳腺癌组织中的表达及其对乳腺癌细胞增殖和迁移的影响[J].临床检验杂志,2015,33(11):818-821.
[9]周恩相,肖溪,李静,等.miR-125b与浸润性乳腺癌研究进展[J].中国现代医学杂志,2015,25(13):48-51.
[10]胡纲.miRNA-26a下调COX-2的表达对乳腺癌细胞增殖和侵袭的影响[J].肿瘤防治研究,2015,42(12):1183-1186.
[11]LI M Y,PAN S R,QIU A Y.Roles of microRNA-221/222 in type 2 diabetic patients with post-menopausal breast cancer[J].Genetics&Molecular Research,2016,15(2):15027259.
[12]张雪梅,李宏江,王达,等.自噬相关基因 ATG2B、ATG4D、ATG9B在浸润性乳腺癌中的表达及临床意义[J].四川大学学报(医学版),2016,47(2):184-188.
[13]闫红,吴正升,江冬瑞,等.乳腺癌中自噬相关基因LC3与凋亡相关基因XIAP的表达及意义[J].临床与实验病理学杂志,2016,32(4):409-411.
[14]洪湘隆,陈岳峰,马萍璇.黄芩苷对大鼠脑缺血损伤自噬的发生及Beclin-1因子表达的影响[J].海南医学院学报,2016,22(14):1473-1475.
[15]YEO S K,WEN J,CHEN S,et al.Autophagy differentially regulates distinct breast cancer stem-like cells in murine models via EGFR/Stat3 and Tgf β/smad signaling[J].Cancer Research,2016,76(11):3397-3410.
Expression of USP39,EZH2 and Sox17 in breast cancer tissue and its significance
Yao Ge
(Pathology Laboratory,Leshan Vocational&Technical College,Leshan,Sichuan 614000,China)
ObjectiveTo study the expression of USP39,EZH2 and Sox17 in breast cancer tissue and its significance.MethodsA total of 90 patients with breast cancer were divided into three groups according to different clinical features,34 cases with carcinoma in situ,41 cases with early invasive carcinoma and 15 cases with invasive carcinoma.RT-PCR was used to determine the differences in USP39,EZH2,Sox17,microRNA and autophagy gene expression in tumor tissue of three groups of patients.ResultsUSP39 and EZH2 mRNA expression levels in tumor tissue of patients with invasive carcinoma were higher than those of patients with carcinoma in situ and early invasive carcinoma.Sox17 mRNA expression level was lower than those of patients with carcinoma in situ and early invasive carcinoma.MiR-29a and miR-149 expression levels were higher than those of patients with carcinoma in situ and early invasive carcinoma while miR-125b,miR-218 and miRNA-26a expression levels were lower than those of patients with carcinoma in situ and early invasive carcinoma.Autophagy gene LC3 mRNA expression level was higher than those of patients with carcinoma in situ and early invasive carcinoma while Beclin1,ATG2B and ATG4G mRNA expression levels were lower than those of patients with carcinoma in situ and early invasive carcinoma.USP39,EZH2 and Sox17 mRNA expression levels in tumor tissue of patients with breast cancer were directly correlated with the expression levels of related microRNA and autophagy genes.ConclusionsUSP39,EZH2 and Sox17 mRNA expression intumor tissue of patients with breast cancer are closely related to the specific illness and prognosis,and are the marker genes of breast cancer.
breast cancer;USP39;EZH2;Sox17;autophagy
R737.9
A
10.3969/j.issn.1005-8982.2017.11.011
1005-8982(2017)11-0054-05
2017-12-27
