长链非编码RNA Linc00152与恶性肿瘤发生、发展关系的研究进展
2017-11-16张滕刘芳腾郭武华周为民
张滕,刘芳腾,郭武华,周为民
(南昌大学第二附属医院,南昌330006)
长链非编码RNA Linc00152与恶性肿瘤发生、发展关系的研究进展
张滕,刘芳腾,郭武华,周为民
(南昌大学第二附属医院,南昌330006)
Linc00152属于长链非编码RNA的一种,是一类长度为828个核苷酸、无编码功能的RNA分子。Linc00152在人类多种肿瘤组织尤其是消化系统恶性肿瘤组织中异常表达,其通过影响肿瘤细胞增殖、凋亡、侵袭及转移等参与肿瘤的发生、发展。近年随着研究的不断深入发现,Linc00152可用于肿瘤诊断、靶向治疗及预后评估等,有望成为新型肿瘤分子生物学标志物。
恶性肿瘤;长链非编码RNA;Linc00152
长链非编码RNA(LncRNA)是一类长度大于200个核苷酸的RNA分子,因其不直接编码蛋白,起初被认为是转录产物的“噪声”[1]。随着研究的深入发现,LncRNA虽然不直接参与蛋白质的编码,但可通过基因印记、染色质修饰、转录激活与干扰、核内运输等多种方式,在表观遗传学、转录及转录后等多个层面调控细胞生长发育相关的靶基因表达[2]。LncRNA表达异常与包括肿瘤在内的多种疾病联系密切。Linc00152属于LncRNA的一种,可在多种肿瘤组织尤其是消化系统恶性肿瘤组织中表达失控,与肿瘤发生、发展及转移等高度相关[3,4]。本研究对Linc00152与恶性肿瘤发生、发展关系的研究进展作一综述。
1 Linc00152概述
根据LncRNA与邻近蛋白编码基因的位置和亲和性可将其分为5类[5],即正义LncRNA、反义LncRNA、双向LncRNA、基因内LncRNA、基因间LncRNA(LincRNA)。LincRNA是LncRNA的主要成员之一,参与细胞周期调控、免疫监视、胚胎干细胞多能性分化等多种生物学过程[6]。目前在人类基因组中已发现3 300多种LincRNA,Linc00152为其中一种,其基因位于染色体2p11.2,由2个具有编码功能基因间的区域转录,是一类长度为828个核苷酸的非编码RNA。研究显示,Linc00152主要作为分子指示剂调控下游基因转录,其涉及的细胞信号通路有表皮生长因子受体(EGFR)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)、雷帕霉素靶蛋白(mTOR)等,调控相关靶基因表达;可通过募集组蛋白赖氨酸甲基转移酶(EZH2)介导组蛋白H3氨基末端第27位赖氨酸发生甲基化修饰,进而在表观遗传学水平调控基因表达;还可作为竞争性内源RNA(ceRNA),与微小RNA(miRNA)竞争性结合,调节编码基因蛋白质水平,参与调控细胞的生物学行为。目前关于Linc00152的研究尚处于起步阶段,只有小部分功能被确认,其参与众多肿瘤的具体分子机制尚不明确。
2 Linc00152与人类肿瘤的关系
近年来,Linc00152已成为肿瘤领域的研究热点,其在胃癌、肝癌、结肠癌、肾透明细胞癌、肺癌等多种肿瘤组织中异常表达,参与肿瘤的发生、发展。
2.1 Linc00152与消化系统肿瘤
2.1.1 Linc00152与胃癌 Cao等[7]经基因芯片分析88例份胃癌组织及其配对的癌旁正常组织LncRNA差异表达谱,检测出80种差异表达的LncRNA,其中Linc00152表达上调尤为显著。随后有学者通过qRT- PCR法证实,胃癌细胞中Linc00152过表达,且其表达水平与肿瘤细胞的侵袭力呈正相关;采用小干扰RNA技术沉默Linc00152表达后,胃癌细胞生长减慢、周期停滞、凋亡增加、侵袭和转移能力均下降;在患者胃液中亦发现Linc00152表达上调;提示Linc00152参与胃癌的发生、发展,可作为胃癌早期筛查的指标[8,9]。Zhou等[10]在大量胃癌组织样本中检测证实Linc00152高表达,其表达量与肿瘤体积有关;在探讨Linc00152与胃癌发生机制关系时发现,Linc00152可特异性识别表皮生长因子受体蛋白(EGFR)结合位点,进而激活PI3K/AKT信号通路,促进胃癌细胞增殖。p15、p21是调控细胞周期的重要抑癌因子,Linc00152可下调p15、p21蛋白表达,导致细胞周期失控[11]。可见,Linc00152可通过调控细胞增殖和细胞周期相关信号通路,参与胃癌的发生、发展过程。最新研究发现,Linc00152过表达可增加幽门螺旋杆菌感染患者发生癌变的风险,进一步提示Linc00152与胃癌的发生密切相关[12]。以上研究结果提示,Linc00152参与胃癌细胞的增殖、凋亡、侵袭及转移等生物学过程,并极有可能作为胃癌的特异性诊断、治疗及疗效评估的分子生物学标志物。
2.1.2 Linc00152与肝癌 目前,诊断肝癌最常用的肿瘤标志物是甲胎蛋白(AFP),但其灵敏度较低,对于早期肝癌检出率较低。Li等[3]在肝癌患者外周血中检测到表达增高的Linc00152,且其表达水平与肿瘤大小、分化程度、荚膜侵袭性及TNM分期关系密切,提示Linc00152参与肝癌的发生、发展。此外,血液中Linc00152与AFP两种标志物联合检测可提高早期肝癌检出率。Ji等[13]报道,肝癌组织和细胞系中均检测到Linc00152过表达,其表达量与肿瘤大小、埃德蒙森病理分级等有关,但对于肿瘤细胞侵袭和凋亡影响不大。经功能获得型及缺失型模型分析表明,在体内外实验中过表达的Linc00152均可促进肝癌细胞增殖和小鼠移植瘤生长;其作用机制可能与上皮细胞黏附分子启动子相互作用后激活mTOR信号通路有关。上述研究结果提示,Linc00152是调节肝癌进展的重要因子,在肝癌的诊断及治疗中均具有潜在的临床应用价值。
2.1.3 Linc00152与结肠癌 在结肠癌组织中Linc00152表达量高于正常组织,且其高表达与临床分期及淋巴结转移呈正相关[14]。功能试验发现,Linc00152能促进细胞增殖,并与化疗药物抵抗性有关,作用机制可能是Linc00152作为竞争ceRNA与miR- 193a- 3p结合,上调人表皮生长因子受体4表达,继而激活AKT信号通路,最终增强肿瘤细胞的耐药性[15]。多因素分析结果提示,Linc00152可作为结肠癌患者预后的独立影响因素,其高表达患者生存率低、预后差。Zhang等[4]报道,在结肠癌组织和细胞系中Linc00152表达均低于正常组织和细胞;转染Linc00152基因后,结肠癌细胞活性降低、凋亡增加。深入研究发现,癌组织形成的低氧微环境可促进miR- 376c- 3p水平升高,后者可负调控Linc00152表达,进而作用于其靶基因(如ki- 67、Bcl- 2、Fas),激活相关细胞凋亡通路,促进细胞凋亡。由此可见,Linc00152在结肠癌中可能具有促癌基因及抑癌基因的双重作用[16,17]。
2.1.4 Linc00152与食管癌 Hu等[18]通过生物信息学方法研究发现,食管鳞状细胞癌和发育不良的食管组织Linc00152表达均明显高于正常食管组织,且其表达水平与食管鳞状细胞癌患者预后不良相关;进一步经风险评分公式得知,Linc00152可作为早期预测食管鳞状细胞癌的潜在分子生物学标志物。近年来越来越多的证据表明,LncRNA与miRNA及其下游靶基因之间的相互调控模式与肿瘤的发生、发展等密切相关。Yang等[19]在食管癌组织和细胞中发现,miR- 17- 92和miR- 15a/16- 1作为转录后的重要调控因子,其活性可被Linc00152调控,进而上调EGFR的表达水平,促进肿瘤细胞增殖与分化。因此,抑制Linc00152活性有可能成为食管癌的治疗策略之一。
2.1.5 Linc00152与胆囊癌 Cai等[20]报道,Linc00152在胆囊癌和细胞系中均过表达,且其表达量与肿瘤进展、淋巴结转移、TNM分期呈正相关;体内外实验发现,过表达Linc00152可促进胆囊癌细胞增殖、转移及小鼠移植瘤的生长,同时逃逸细胞凋亡。转录因子SP1是肿瘤生长与分化过程中的重要影响因子。研究发现,SP1可特异性识别Linc00152的启动子核心区域,进而激活PI3K/AKT信号通路,促进胆囊癌细胞增殖、分化等生物学行为。将胆囊癌细胞中的Linc00152敲除,细胞侵袭和转移过程可明显受到抑制,小鼠体内肿瘤腹膜转移显著减少,表明Linc00152是促进胆囊癌发生、发展及转移的关键因素。进一步探讨其机制发现,Linc00152可作为“miRNA- 海绵”吸附miR- 138,进而上调缺氧诱导因子1α表达,促进肿瘤细胞侵袭及转移过程[21],故Linc00152有望成为胆囊癌诊断及治疗的新靶点。
2.2 Linc00152与肾透明细胞癌 在肾透明细胞癌中Linc00152表达明显高于其配对的癌旁正常组织,且高表达的Linc00152与TNM分期相关;多元变量分析结果显示,Linc00152可作为肾透明细胞癌患者预后的独立影响因素,高表达Linc00152患者预后不佳。下调Linc00152表达后,肾透明细胞癌细胞增殖及侵袭明显延缓,细胞凋亡加速,提示Linc00152与肾透明细胞癌的发生、发展有关,但Linc00152调控肿瘤细胞增殖与侵袭的作用机制有待进一步研究[22]。
2.3 Linc00152与肺癌 Chen等[23]采用RT- PCR技术检测60例肺癌组织标本,发现肿瘤组织中Linc00152表达明显高于正常肺组织,且肺癌组织中Linc00152表达水平与肿瘤体积、淋巴结转移及患者生存期相关;体外研究证实,Linc00152过表达可促进肺癌细胞增殖,抑制细胞凋亡,其机制可能是Linc00152与EZH2结合,负性调控IL- 24转录,从而抑制肿瘤细胞凋亡。上述结果提示,Linc00152可能是肺癌治疗的潜在靶标。
2.4 Linc00152与婴儿血管瘤 Linc00152过表达不仅与恶性肿瘤关系密切,在良性肿瘤形成中亦发挥重要调控作用。Liu等[24]通过LncRNA芯片和高通量测序分析技术发现,婴儿血管瘤组织中存在大量表达异常的LncRNA,其中Linc00152的表达量高于正常血管组织7.84倍;通过基因本体数据库证实,过表达的Linc00152与血管新生相关通路有关。以上研究提示,Linc00152可能与婴儿血管瘤的发生有关。
综上所述,Linc00152在多种肿瘤组织中异常表达,其表达变化与肿瘤细胞增殖、侵袭、转移、凋亡及化疗耐药关系密切,通过相关技术干扰Linc00152表达影响肿瘤生物学行为,可为肿瘤诊断、靶向治疗及疗效评估提供新思路。但目前对于Linc00152的研究大多仅限于消化系统肿瘤及其初级功能阶段,Linc00152与其他类型肿瘤的关系以及在肿瘤中的具体调控机制尚不十分清楚,其是否通过与其他LncRNA、miRNA共同调节肿瘤的发生、发展尚不明确。随着新技术的不断应用、多相关学科的联合发展,对Linc00152的认识会越来越完整、准确,有望成为一种新型的肿瘤分子生物学标志物。
[1] Ma L, Bajic VB, Zhang Z. On the classification of long non coding RNAs[J]. RNA Biology, 2013,10(6):925- 934.
[2] Xiao QH, Dan DL, Juan W. Long non- coding RNAs in plant[J]. Yi Chuan, 2015,37(4):344- 359.
[3] Li J, Wang XC, Tang JW, et al. HULC and Linc00152 act as novel biomarkers in predicting diagnosis of hepatocellular carcinoma[J]. Cell Physiol Biochem, 2015,37(2):687- 696.
[4] Zhang YH, Fu J, Zhang ZJ, et al. LncRNA- LINC00152 down- regula- ated by miR- 376c- 3p restricts viability and promotes apopto- sis of colorectal cancer cells[J]. Am J Transl Res, 2016,8(12):5286- 5297.
[5]Liu Y, Ferguson JF, Xue C, et al. Tissue- specific RNA- Seq in human evoked inflammation identifies blood and adipose LincRNA signatures of cardiometabolic diseases[J]. Arterioscler Thromb Vasc Biol, 2014,34(4):902- 912.
[6]Khalil AM, Guttman M, Huarte M, et al. Many human large intergenic noncoding RNAs associate with chromatin- modifying complexes and affect gene expression[J]. Proc Natl Acad Sci U S A, 2009,106(28):11667- 11672.
[7] Cao WJ, Wu HL, He BS, et al. Analysis of long non- coding RNA expression profiles in gastric cancer[J]. World J Gastroenterol, 2013,19(23):3658- 3664.
[8] Zhao J, Liu YC, Zhang WH, et al. Long non- coding RNA Linc00152 is involvedin cell cycle arrest, apoptosis, epithelial tomesenchymal transition, cell migration and invasion in gastric cancer[J]. Cell Cycle, 2015,14(19):3112- 3123.
[9] Pang Q, Ge J, Shao Y, et al. Increased expression of long intergenic non- coding RNA LINC00152 in gastric cancer and its clinical significance[J].Tumour Biol, 2014,35(6):5441- 5447.
[10] Zhou JP, Zhi XF, Wang LJ, et al. Linc00152 promotes prolifera- tion in gastric cancer through the EGFR- dependent pathway[J]. J Exp Clin Canc Res, 2016,9(35):30.
[11]Chen WM, Huang MD, Sun DP, et al. Long intergenic non- coding RNA 00152 promotes tumor cellcycle progression by binding to EZH2 and repressing p15 and p21 in gastric cancer[J]. Oncotarget, 2016,7(9):9773- 9787.
[12] Yang T, Zeng HM, Chen WQ, et al. Helicobacter pylori infection, H19 and LINC00152 expression in serum and risk of gastric cancer in a Chinese population[J]. Cancer Epidemiology, 2016(44):147- 153.
[13] Ji J, Tang JW, Deng L, et al. LINC00152 promotes proliferation in hepatocellular carcinoma by targeting EpCAM via the mTOR signaling pathway[J]. Oncotarget, 2015,6(40):42813- 42824.
[14] 张新丽,朱燕,李淑娜,等.长链非编码RNA LINC00152在结肠癌组织中的表达及临床意义[J].临床检验杂志,2015,33(5):354- 358.
[15] Yue B, Cai DL, Liu CC, et al. Linc00152 functions as a competing endogenoud RNA to confer oxaliplatin resistance and holds prognostic values in colon cancer[J]. Mol Ther, 2016,24(12):2064- 2077.
[16] 邱华,单人锋,时军.长链非编码RNA H19与肿瘤性疾病关系的研究进展[J].山东医药,2017,57(4):104- 107.
[17] 龚艳清,韩涛,章坤,等.长链非编码RNA在肝癌中的研究进展[J].山东医药,2016,56(10):96- 98.
[18] Hu HB, Jie YH, Zhang XX, et al. Three circulating LncRNA predict early progress of esophageal squamous cell carcinoma[J]. Cell Physiol Biochem, 2016,40(1- 2):117- 125.
[19]Yang S, Ning QQ, Zhang QB, et al. Construction of differential mRNA- lncRNA crosstalk networks based on ceRNA hypothesis uncover key roles of lncRNAs implicated in esophageal squamous cell carcinoma[J]. Oncotarget, 2016,7(52):85728- 85740.
[20] Cai Q, Wang ZQ, Wang SH, et al. Upregulation of long noncoding RNA LINC00152 by SP1 contributes to gallbladder cancer cell growth and tumor metastasis via PI3K/AKT pathway[J]. Am J Transl Res, 2016,8(10):4068- 4081.
[21] Cai Q, Wang ZQ, Wang SH, et al. Long non- coding RNA LINC00152 promotes gallbladder cancer metastasis and epithelial- mesenchymal transition by regulating HIF- 1αvia miR- 138[J]. Open Biol, 2017,7(1):160247.
[22] Wu Y, Tan C, Weng WW, et al. Long non- coding RNA Linc00152 is a positive prognostic factor for and demonstrates malignant biological behavior in clear cell renal cell carcinoma[J]. Am J Cancer Res, 2016,6(2):285- 299.
[23] Chen QN, Chen X, Chen ZY, et al. Long intergenic non- coding RNA 00152 promotes lung adenocarcinoma proliferation via interacting with EZH2 and repressing IL24 expression[J]. Mol Cancer, 2017,16(1):17.
[24] Liu XW, Lv RJ, Zhang LF, et al. Long noncoding RNA expression profile of infantile hemangioma identified by microarray analysis[J]. Tumor Biol, 2016,37(12):15977- 15987.
国家自然科学基金资助项目(81260360、13006809)。
周为民(E- mail:drzwm@sina.com)
10.3969/j.issn.1002- 266X.2017.36.037
R730.2
A
1002- 266X(2017)36- 0110- 03
2017- 02- 13)
迷迭香酸对鼻咽癌细胞增殖、凋亡的影响及其作用机制
(见正文3页)
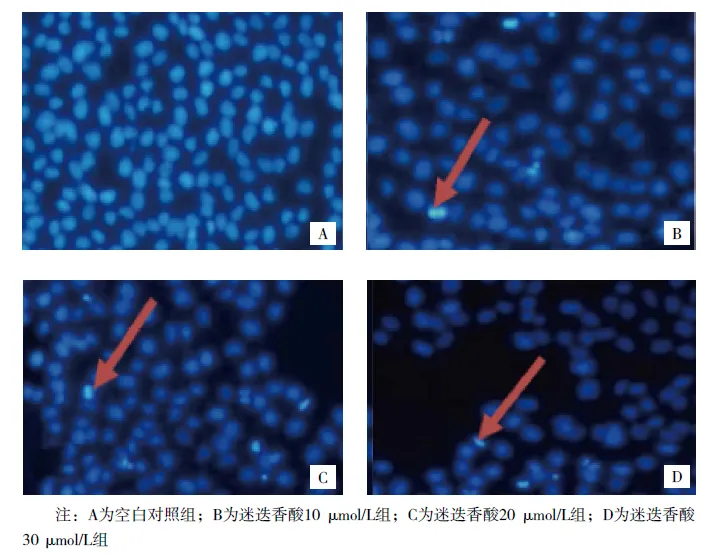
图1 各组作用48 h细胞形态变化(Hoechst 33258染色,×400)
WIC评分预测心肺复苏后自主循环恢复患者预后的价值
(见正文27页)
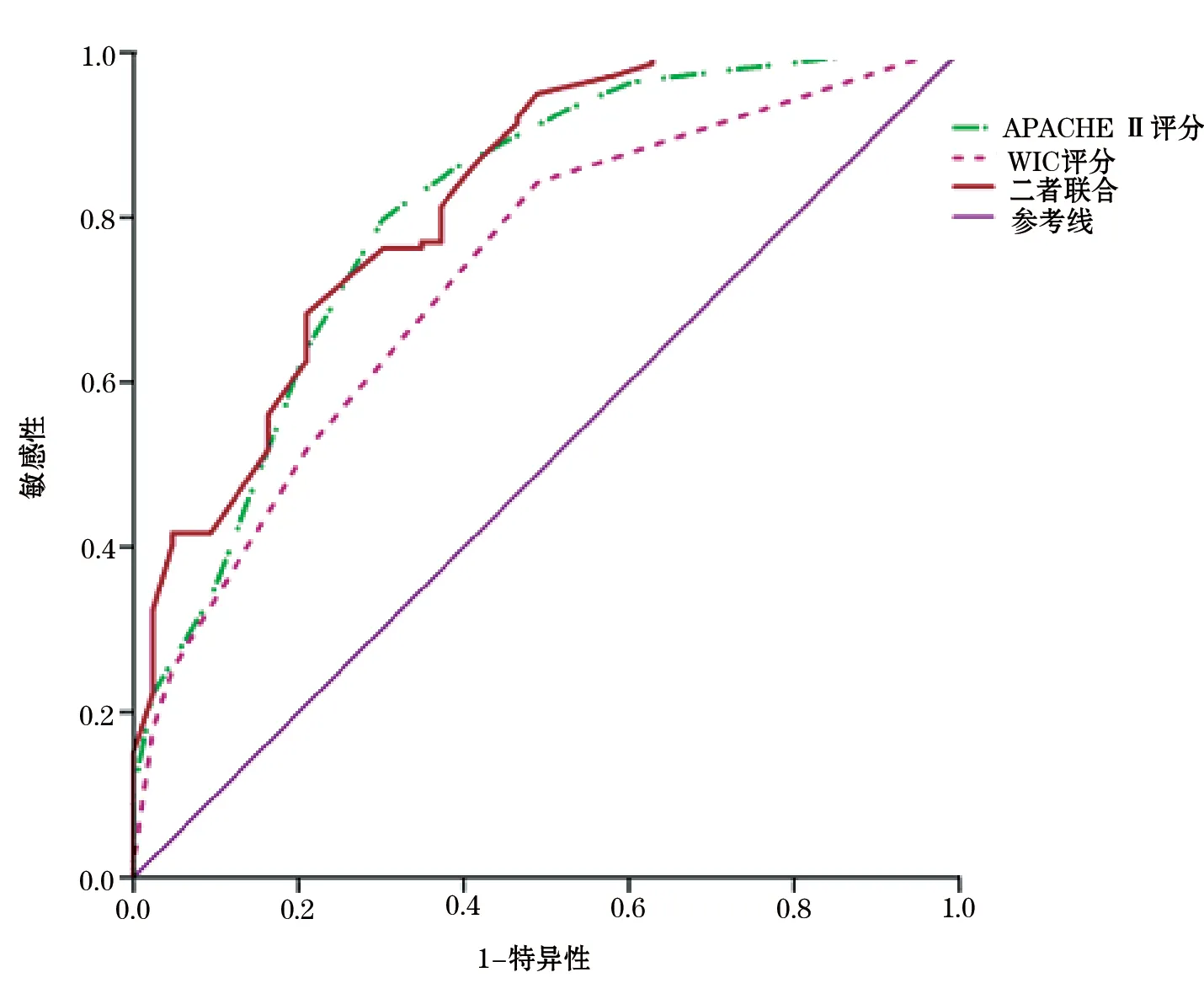
图2 WIC评分、APACHE Ⅱ评分以及二者联合预测患者预后的ROC曲线
兔眼视网膜神经上皮层下内界膜移植转归观察
(见正文32页)
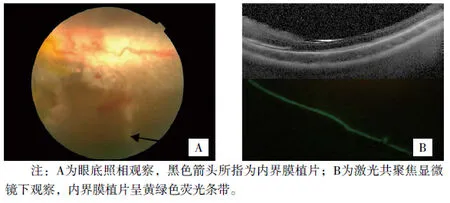
图3 术后3天内界膜植片表现
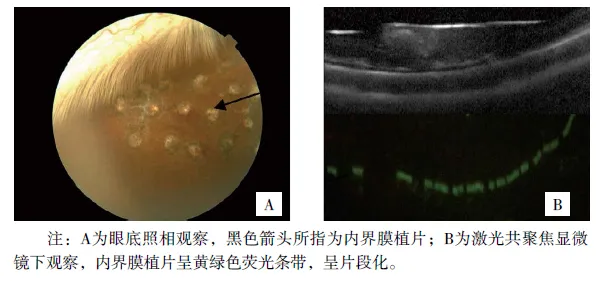
图4 术后10天内界膜植片表现
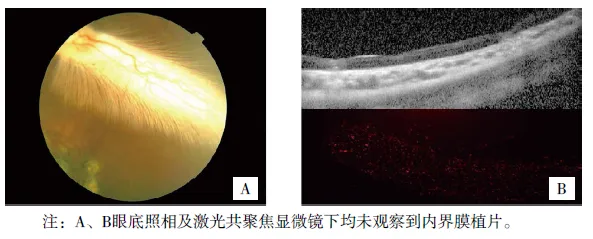
图5 术后30天内界膜植片表现
外源性甲状腺素对胎儿酒精效果模型仔鼠生长及神经系统发育的影响
(见正文41页)
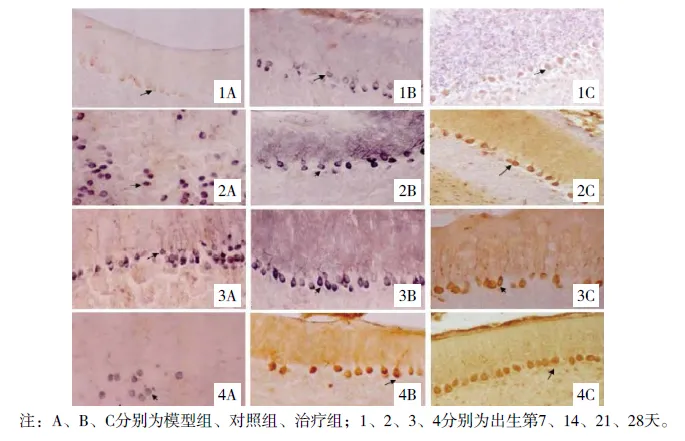
图6 各组小脑脑皮质神经细胞BDNF阳性表达(IHC染色,×100)
