霉豆瓣中优势微生物蛋白酶活性测定
2017-11-03梅源唐佳颖何惠容敖晓琳
梅源,唐佳颖,何惠容,敖晓琳
(四川农业大学 食品学院,四川 雅安,625014)
霉豆瓣中优势微生物蛋白酶活性测定
梅源,唐佳颖,何惠容,敖晓琳*
(四川农业大学 食品学院,四川 雅安,625014)
选择市售的2种霉豆瓣为研究对象,分离出其中的微生物,通过回接发酵实验,筛选出能发酵霉豆瓣的优势菌株M1、M2和M3。经鉴定M1为黑曲霉(Aspergillusniger)、M2为米曲霉(Aspergillusoryzae)、M3为雅致放射毛霉(Actinomucorelegant)。对优势菌株进行蛋白酶活力及氨基酸态氮含量测定。结果表明,米曲霉的中性蛋白酶和碱性蛋白酶活力最高,分别为632 U/g和416 U/g。黑曲霉产酸性蛋白酶活力及氨基酸态氮能力远高于米曲霉和毛霉,酸性蛋白酶高达872 U/g,氨基酸态氮含量高达0.997 5 g/100 g。而毛霉产的3种蛋白酶活力均在中间值,可起到一定的补充作用。
霉豆瓣;微生物;分离及筛选;蛋白酶活力
豆瓣酱是由各种微生物相互作用,产生复杂生化反应酿造出来的一种调味料,能助消化,开口味,深受消费者欢迎[1]。四川豆瓣更是具有二百余年悠久历史,可直接佐餐,亦是川菜烹调中必不可少的调味品[2]。蚕豆的发酵是酿制豆瓣酱过程中的一道关键步骤,它的发酵产物霉豆瓣的品质将直接影响豆瓣酱的质量。然而霉豆瓣的品质很大程度上受到其中微生物的影响。
研究发现,豆瓣自然发酵过程中,从酱曲中分离所得到的霉菌是在制曲过程中起主要作用的功能菌种。霉菌经鉴定最主要的是米曲霉,其次是酱油曲霉、高大毛霉及黑曲霉等[3]。
蛋白酶是各类霉菌尤其是米曲霉所产酶系中最重要的酶之一,直接影响原料的蛋白质利用率和最终产品的风味[4]。其中,中性蛋白酶是一类在中性pH条件下作用于蛋白质肽键的蛋白酶,可将蛋白质水解成多肽或游离氨基酸[5]。酸性蛋白酶有利于提高氨基酸生成率,增加风味。碱性蛋白酶对底物蛋白的水解程度、对水解物产生的独特风味和脱苦味起着关键作用[6]。蛋白酶可将豆类中的蛋白质降解成多肽、氨基酸等可溶性氮物,对产品的产率和风味起着重要的作用。提高蛋白酶活力,可以提高原料的利用率,降低生产周期,降低成本[7]。氨基酸态氮(amino acid nitrogen ,AN)是蛋白质的分解产物,是评价调味食品的质量及营养价值的一项主要指标,在发酵性食品的分析中有重要意义[8]。
本实验通过对霉豆瓣中微生物的分离、筛选,得到品质优良的微生物菌株,对其进行形态和分子生物学鉴定,并对优势菌株进行蛋白酶活力及氨基酸态氮含量测定。
1 材料与方法
1.1材料与试剂
1.1.1 主要材料
市售霉豆瓣(2种,5月份购买,取样1 kg,-20 ℃保藏)、干蚕豆颗粒、干麸皮。
1.1.2 主要试剂
36%甲醛溶液;0.05、0.1 mol/L NaOH溶液;生理盐水;福林-酚试剂;0.4 mol/L三氯乙酸(TCA)溶液;0.4 mol/L Na2CO3溶液;pH 7.5的磷酸缓冲液;pH 3.0的乳酸-乳酸钠缓冲液;pH 10.5的硼砂-氢氧化钠缓冲液;2%酪蛋白底物缓冲液;100 μg/mL酪氨酸溶液。以上试剂均为实验室自配,分析纯。
1.2主要培养基
孟加拉红(虎红)培养基:杭州微生物试剂有限公司;营养琼脂(NA)培养基:蛋白胨10 g、牛肉粉3 g、氯化钠5 g、琼脂15 g、蒸馏水1 000 mL。以上所涉及生化试剂均为分析纯。
1.3仪器与设备
SW-CJ-1F超净工作台,苏州净化设备有限公司;SNH-160生化培养箱,上海三发科学仪器有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;DNP-9162电热恒温培养箱,上海精宏实验设备有限公司;SYQ-DSX-280B手提式不锈钢压力蒸汽灭菌器,上海申安医疗器械厂;JM-B10002电子天平,诸暨市超泽衡器设备有限公司;BCD-216TXN电冰箱,青岛海尔股份有限公司;TGL16M高速冷冻离心机,长沙湘南离心机;752型紫外分光光度计,上海分析仪器厂;DZKW-5-4电热恒温水浴锅,北京市永光明医疗仪器有限公司;CX21FS1光学显微镜,日本奥林巴斯公司;85-2恒温磁力搅拌器,江苏金坛市双捷实验仪器厂;pHS-4C+型酸度计,成都世纪方舟科技公司。
1.4试验方法
1.4.1 菌株的分离、纯化
取10 g预处理的霉豆瓣样品,加入到90 mL已灭菌的生理盐水中,制成1∶10的均匀稀释液,再依次进行10倍递增稀释,稀释至10-6后,取不同稀释度的液体均匀涂布于虎红培养基和NA培养基中,分离其中的真菌和细菌。放入30 ℃恒温培养箱中培养48 h。待出现单菌落后,进行菌种扩大培养,反复2~3次,获得单菌种的纯培养基。
1.4.2 发酵剂的制备
从菌种的纯化培养基中取2~3环霉菌孢子接种到灭菌的麸皮(10 g麸皮、10 mL蒸馏水)中,置于不同温度的恒温培养箱内培养,米曲霉、黑曲霉于30 ℃培养48 h,毛霉于20 ℃培养60 h,期间扣瓶1次,待其长满孢子后,用牛皮纸包好整块麸皮置于45~50 ℃的烘箱中烘干24 h,即可制得霉菌发酵剂[9]。
在每次使用发酵剂前均需要使用血球计数板法计算霉菌孢子数。使用时采用称重方式确定接种量。
1.4.3 优势菌株的筛选
回接实验:干蚕豆→清洗→浸泡→灭菌→接种供试菌株→发酵→结果观察和记录。
工艺要点:浸泡时按照干蚕豆10 g,蒸馏水10 mL进行。
在30 ℃下恒温培养,每隔6 h进行拍照,测定其感官指标,以未接种指示菌的样品作为对照,取综合评分高者为优势菌株。
感官指标的检测包括色泽、气味、组织形态。霉豆瓣的感官评价标准目前没有行业通用标准,故本实验采用市售品质最优的成熟霉豆瓣(米曲霉为主要发酵菌种)作为参照制定评分标准。
霉豆瓣的感官要求应符合表1标准。

表1 霉豆瓣感官评价标准
1.4.4 优势菌株的分子生物学鉴定
通过试剂盒法来提取微生物基因组DNA[10-12],用1.0%琼脂糖凝胶电泳(180 V,20 min)检测后,在PCR反应体系(如表2所示)扩增,空白对照不加入模板。

表2 PCR反应体系
细菌16S rDNA序列的扩增正向引物为27f(5’-AGAGTTTGATCCTGGCTCAG-3’),反向引物为1492r(5’-GGTTACCTTGTTACGACTT-3’);真菌18SrDNA序列的扩增正向引物为EF-3(5’-GGAAGGG(G/A)TGTATTTATTAG-3’),反向引物为EF-4(5’-TCCT(A/C)TAAATGACCAAGTTTG-3’)。
PCR反应体系30 μL:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1.5 min,72 ℃延伸2 min,30个循环;72 ℃最终延伸10 min;PCR产物4 ℃保存,用1.0%琼脂糖凝胶电泳检测(180 V,20 min)后送检测序。
将测定结果在GeneBank中通过Blast进行基因对比,获得相似度最高的序列进行序列相似性分析[13],再将检测送回的碱基序列转化为文本格式文件后,用软件MEGA7.0构建系统发育树。
1.4.5 不同温度下接种不同微生物对霉豆瓣蛋白酶活性的测定
设置15、20、25、30、35、40 ℃等间隔温度梯度,每隔6 h对加入优势菌株发酵剂的霉豆瓣进行感官测评并拍照记录(培养至216 h)。培养完毕后,对不同霉豆瓣样品进行蛋白酶活力及氨基酸态氮含量测定。以确定不同微生物蛋白酶活性最佳的温度条件。
1.4.6 30 ℃恒温条件下接种不同微生物对霉豆瓣蛋白酶活性的测定
经查找文献,本实验采用30 ℃作为培养温度。大部分资料显示,该温度为豆瓣的工业制曲的常用温度。对30 ℃下培养30、36、42、48、54、60 h的优势菌株进行蛋白酶活力及氨基酸态氮含量测定。
1.5分析检测方法
1.5.1 蛋白酶活力测定
粗酶液制备:取1 g霉豆瓣样品,加入20 mL缓冲液,于40 ℃水浴浸提1 h,后于4 000 r/min,25 ℃条件下离心10 min,取上清液待用。
其中,酸性蛋白酶应采用pH 3.0的乳酸-乳酸钠缓冲液;中性蛋白酶采用pH 7.5的磷酸缓冲液;碱性蛋白酶则采用pH 10.5的硼砂-氢氧化钠缓冲液。缓冲液用于浸提蛋白酶和后续蛋白酶活力的测定。
酶活测定法:采用福林酚法测定样品霉豆瓣中的中性、酸性及碱性蛋白酶活力[14],在40 ℃条件下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位(U/g)。
1.5.2 氨基酸态氮含量测定
样品制备:取5 g霉豆瓣样品,加入30 mL蒸馏水,煮沸2~3 min,后定容至100 mL,放置待用。
检测方法:采用甲醛滴定法测定样品霉豆瓣中的氨基酸态氮含量[15]。
1.5.3 孢子数含量测定
血球计数板法[16]。称取发酵剂0.04 g,加入5 mL 95%乙醇溶液,再加入10 mL 1∶10稀硫酸,最后加入20 mL蒸馏水,摇匀。用磁力搅拌器搅拌30 min以上,直至样品溶于水,定容至250 mL。后调试显微镜,将盖玻片盖在计数板上,向盖玻片上侧(即计数板磨砂处)滴加试样液体。待试样润湿整个计数板,将计数板放置于显微镜下,从低倍至高倍调节清晰程度,至能看清计数板每个线条。记录5个中格即左上、左下、右上、右下和中间的孢子数。重复2次取平均值,即得到发酵剂的孢子数含量。孢子数计算公式(1)如下:
(1)
式中:N表示5个中格内的孢子数总和,个;n表示稀释倍数。
2 结果与讨论
2.1优势菌株的分离
从霉豆瓣样品中分离出5种微生物,编号为M1~M5。分离情况见图1。
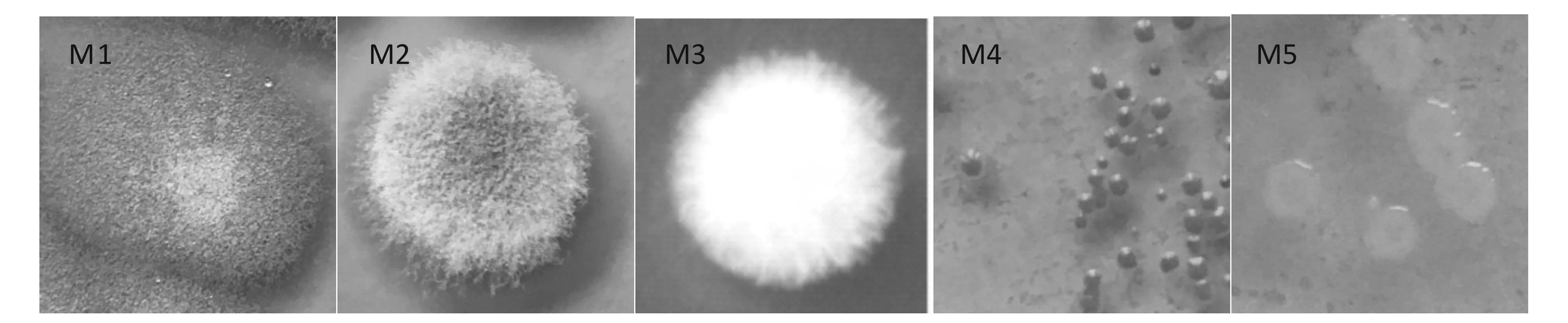
图1 霉豆瓣样品中微生物的分离情况Fig.1 Separation of the microorganisms from moldy bean samples
2.2优势菌株的筛选
将M1~M5分别回接至豆瓣上发酵,进行感官评定。感官评分结果如表3。

表3 感官评分结果
续表3

编号色泽气味组织形态感官评分M38262660M458518M544412
本实验所采用的感官评分表主要参考市场上普遍采用的感官评价标准。该标准是以米曲霉作为主要发酵菌种而设计的。通过感官评分结果可以得出,M1、M2、M3为霉豆瓣中的优势菌株。M1呈黑色,回接到蚕豆上经发酵后所得霉豆瓣为黑褐色,色泽均匀,有一定发酵香味,组织均匀。M2呈黄绿色,回接到蚕豆上经发酵后所得霉豆瓣也呈黄绿色,色泽均匀,有特定香味,组织均匀较硬。M3呈白色,回接到蚕豆上经发酵后所得霉豆瓣呈白色略带灰色,色泽均匀无杂色,有一定香味,组织均匀较硬,蚕豆粒不太松散。图2为霉豆瓣中优势菌株的回接情况。
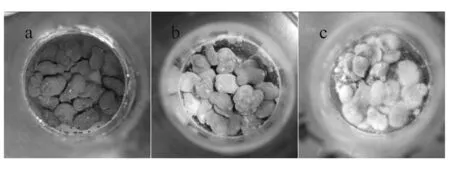
a-M1; b-M2; c-M3图2 优势菌株的回接情况Fig.2 Tieback of the dominant strains
2.3优势菌株的分子生物学鉴定
在液体PDA培养基培养待提取总DNA的菌株24 h,将试剂盒提取好的总DNA进行凝胶电泳,进行PCR扩增(注:M1、M2和M3三种优势菌株总DNA进行18rDNA扩增,扩增正向引物为EF-3,反向引物为EF-4),扩增后的PCR产物进行凝胶电泳,在凝胶成像仪中进行观察。
得到M1、M2和M3的18rDNA序列后,通过clustalx2.1软件与标准菌株进行比对分析,比对结果应用MEGA7.0软件构建系统发育树。图3清晰的展示了M1、M2和M3的分子鉴定结果,M2、M3和M1
分别与米曲霉(Aspergillusoryzae)、雅致放射毛霉(Actinomucorelegant)和黑曲霉(Aspergillusniger)聚成在同一个分支上,由此确定M1、M2和M3分别为黑曲霉(Aspergillusniger)、米曲霉(Aspergillusoryzae)和雅致放射毛霉(Actinomucorelegant)。
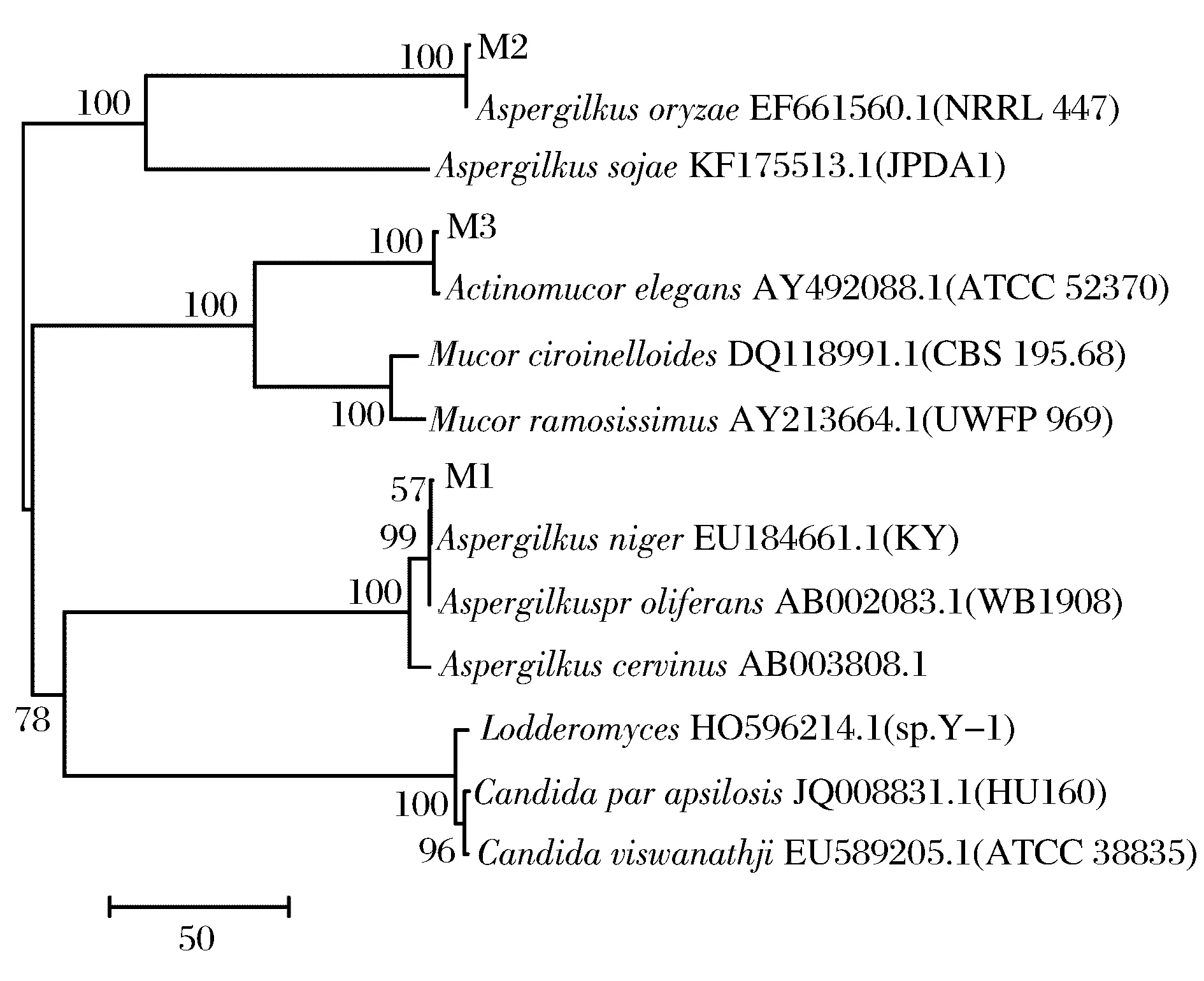
图3 系统发育树Fig.3 The phylogenetic tree
2.4优势菌株的理化指标测定
2.4.1 不同温度下霉豆瓣蛋白酶活力及氨基酸态氮含量变化
2.4.1.1 蛋白酶活力
在霉豆瓣的制作过程中,菌株的各类蛋白酶产生能力是影响霉豆瓣生产的重要条件之一。本实验考察了15、20、25、30、35、40 ℃ 6个温度梯度下接种不同微生物的霉豆瓣成熟时间及成熟霉豆瓣酸性、中性及碱性蛋白酶的活力。结果见表4、表5、表6。
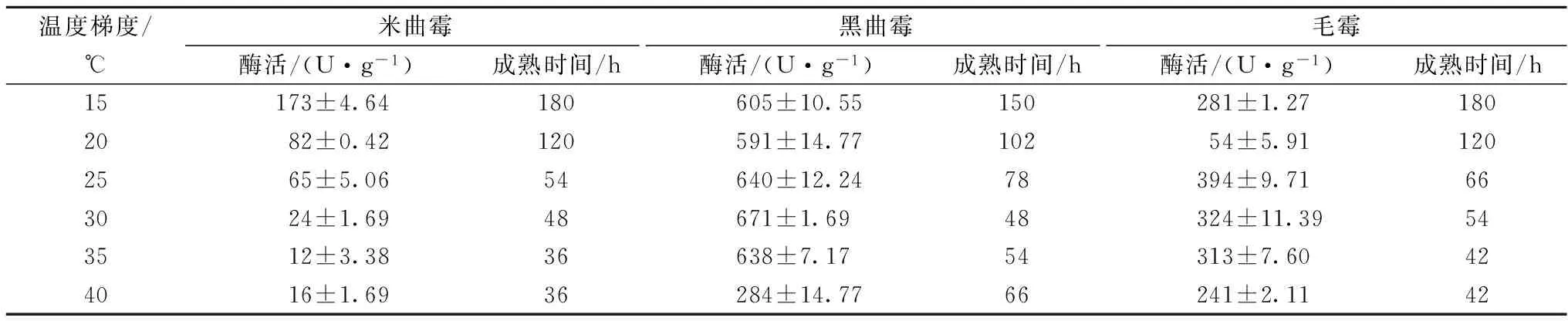
表4 不同温度梯度下接种不同霉菌霉豆瓣成熟时间及其酸性蛋白酶活力
从表4可看出,黑曲霉产酸性蛋白酶活力最高,为671 U/g,最高时可达毛霉的2倍和米曲霉的4倍左右,其达到成熟的时间较短,仅有48 h。毛霉产酸性蛋白酶活力位居第2,为394 U/g,发酵时间达到66 h;米曲霉产酸性蛋白酶活力最低,在发酵108 h后才达到其最高值173 U/g。
从表5可看出,3种曲霉发酵过程中,产中性蛋白酶活力最高为米曲霉,最高在15 ℃时可达987 U/g,但其达到成熟的时间较长,足有180 h。其次产中性蛋白酶活较高的是毛霉,最高为325 U/g,最后是黑曲霉,93 U/g。毛霉和黑曲霉达到最大值所需要的发酵时间也分别达到了66 h与102 h。
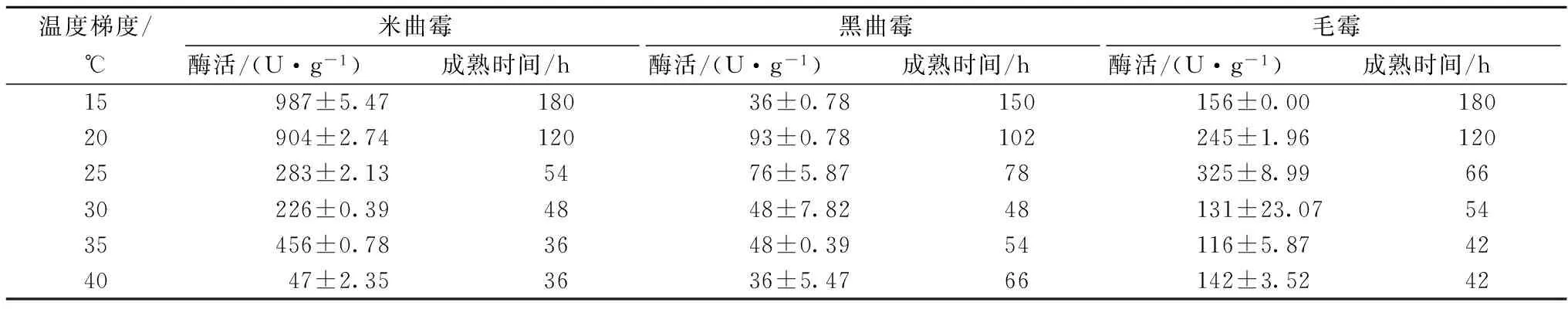
表5 不同温度梯度下接种不同霉菌霉豆瓣成熟时间及其中性蛋白酶活力
从表6可看出,米曲霉最高产碱性蛋白酶活力为626 U/g,发酵时间长达180 h。黑曲霉和毛霉几乎不产或产量偏低。
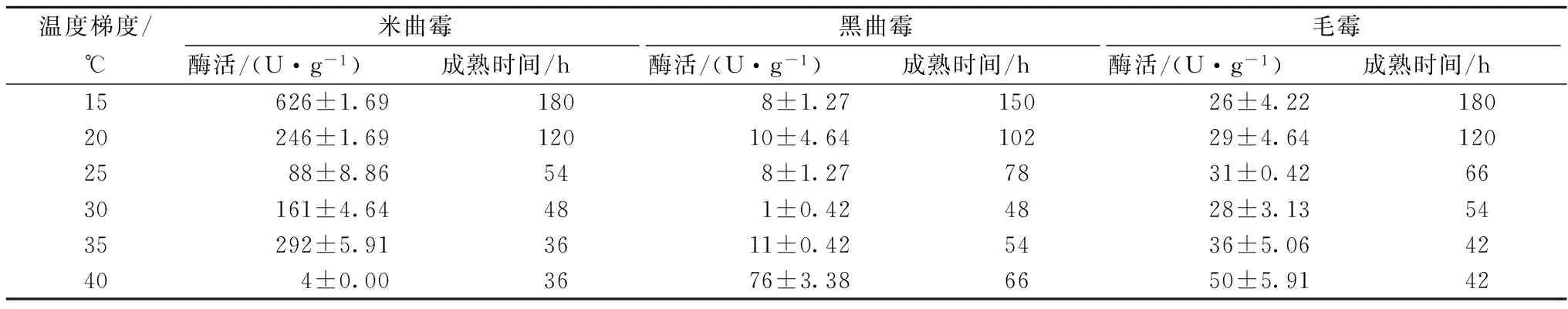
表6 不同温度梯度下接种不同霉菌霉豆瓣成熟时间及其碱性蛋白酶活力
综上,上述所得霉豆瓣成熟时间可作为工业生产达到发酵终点时的参考时间。同样,从数据中看出,米曲霉主要产生中性蛋白酶和碱性蛋白酶,酸性蛋白酶活力较低。而黑曲霉产酸性蛋白酶活力很高,毛霉产生的各类蛋白酶活力均处于中间值,可有很好的补充作用。由于产生各类酶活最高值所需要的发酵温度大多都偏低,发酵时间较长,不太符合工业快速生产的需要;而发酵温度过高则会使发酵好的霉豆瓣在较短的时间内产生品质劣变,不利于生产控制,故综合起来选择在30 ℃对不同发酵时间的霉豆瓣进行蛋白酶活力和氨基酸态氮含量测定。
2.4.1.2 氨基酸态氮含量
本实验考察了3种曲霉在15、20、25、30、35、40 ℃这6个温度梯度下进行培养,霉豆瓣成熟时的氨基酸态氮含量(图4)。
3种曲霉在发酵过程中,黑曲霉产生氨基酸态氮的量最大,在35 ℃时可达1.078 g/100g;米曲霉与毛霉产生氨基酸态氮的量相对黑曲霉低些,两者产生氨基酸态氮的量相近,米曲霉在20 ℃时最高,为0.507 5 g/100 g,毛霉在35 ℃时最高,为0.511 7 g/100 g;黑曲霉在产量最高时,可达米曲霉与毛霉产量的2倍左右。
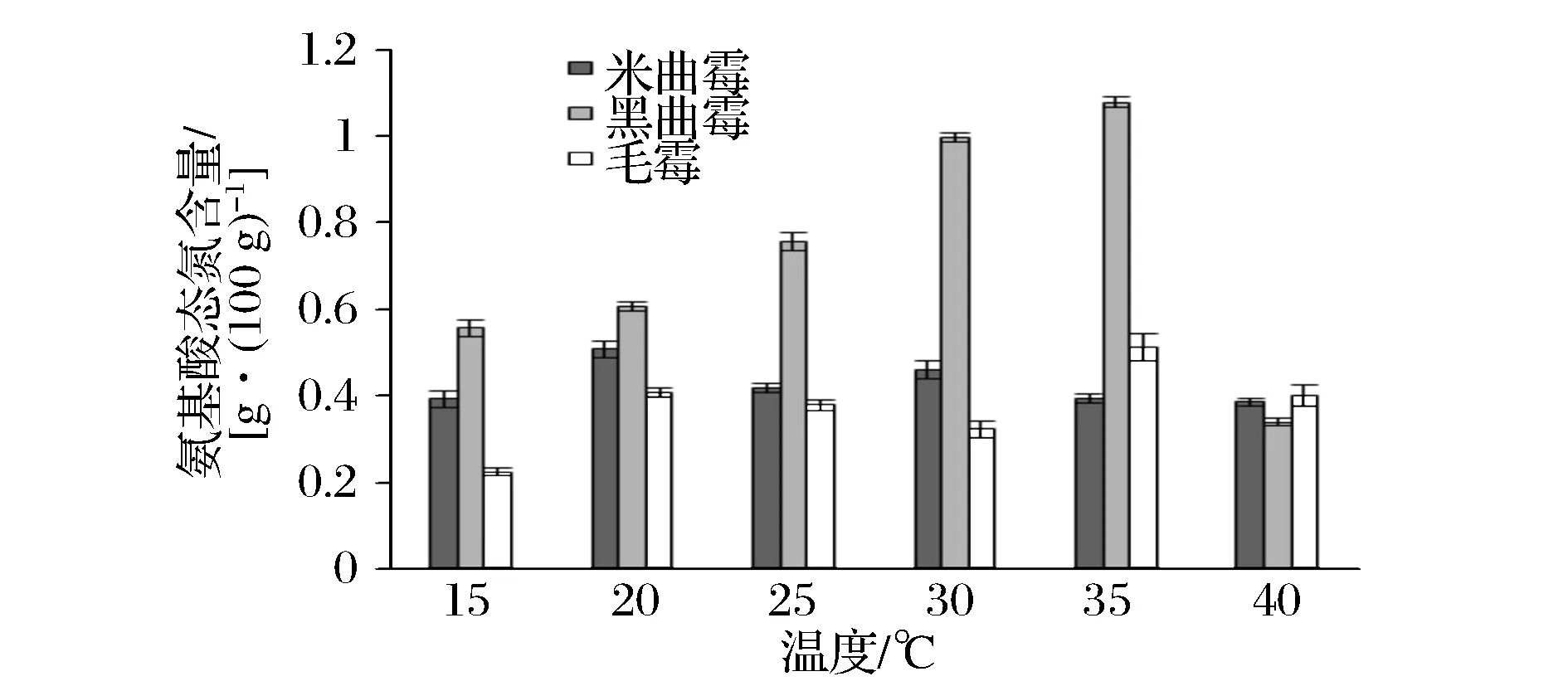
图4 不同温度梯度下的氨基酸态氮含量Fig.4 Amino acid nitrogen content under different temperature gradient
2.4.2 30 ℃恒温条件下霉豆瓣蛋白酶活力及氨基酸态氮含量变化
2.4.2.1 蛋白酶活力
本实验考察了3种曲霉在30 ℃恒温培养下,因培养时间的延长而产生的酸性、中性和碱性蛋白酶活力变化情况。结果见图5、图6和图7。
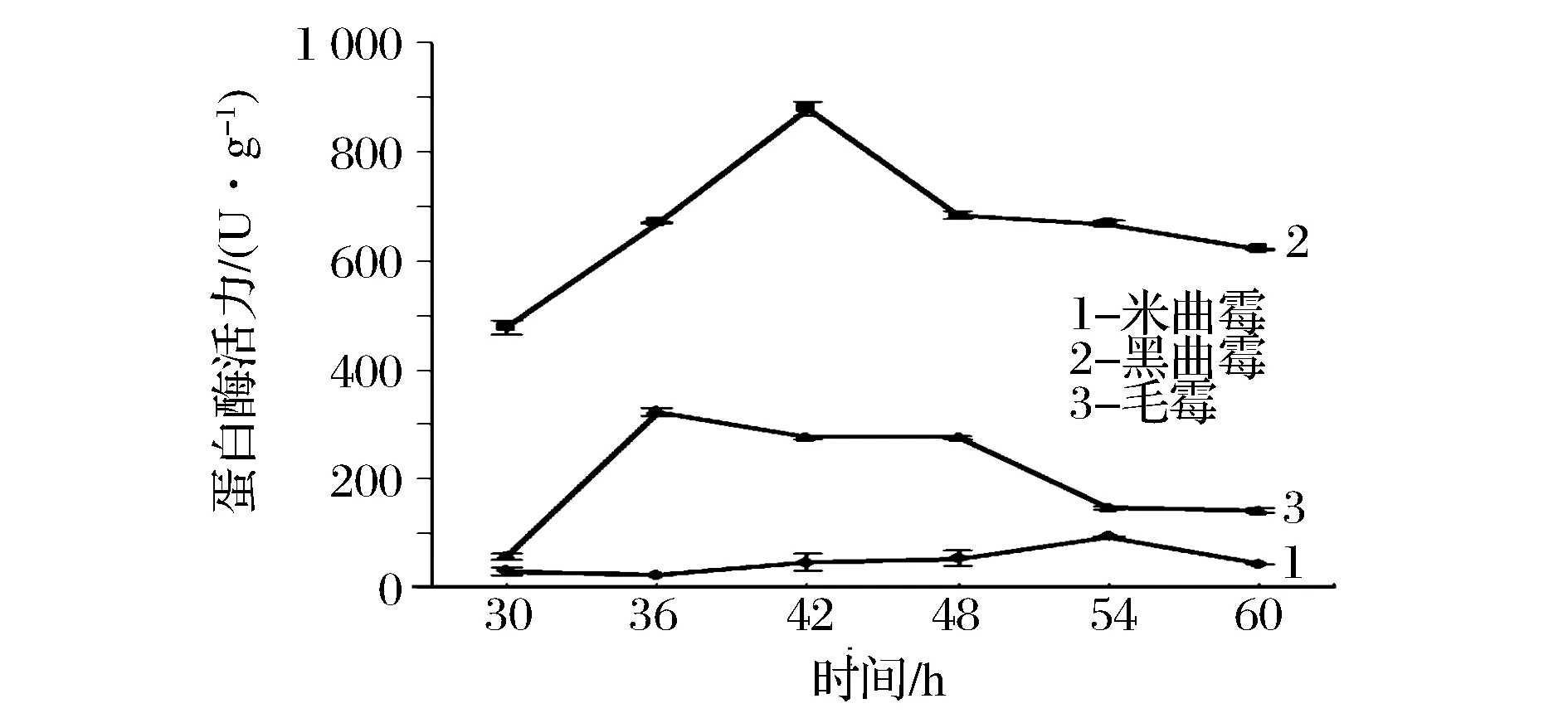
图5 酸性蛋白酶活力变化Fig.5 Change of acidic protease activity
从图5看出,黑曲霉产酸性蛋白酶活力较高,产酶高峰在36~48 h,在42 h出现最高值,酶活量高达872 U/g。其次产酸性蛋白酶活力较高的为毛霉,产酶高峰在36~48 h,于36 h出现高峰值,其酶活量约为黑曲霉的一半,而米曲霉产酸性蛋白酶酶活最低,并在54 h才达到峰值。
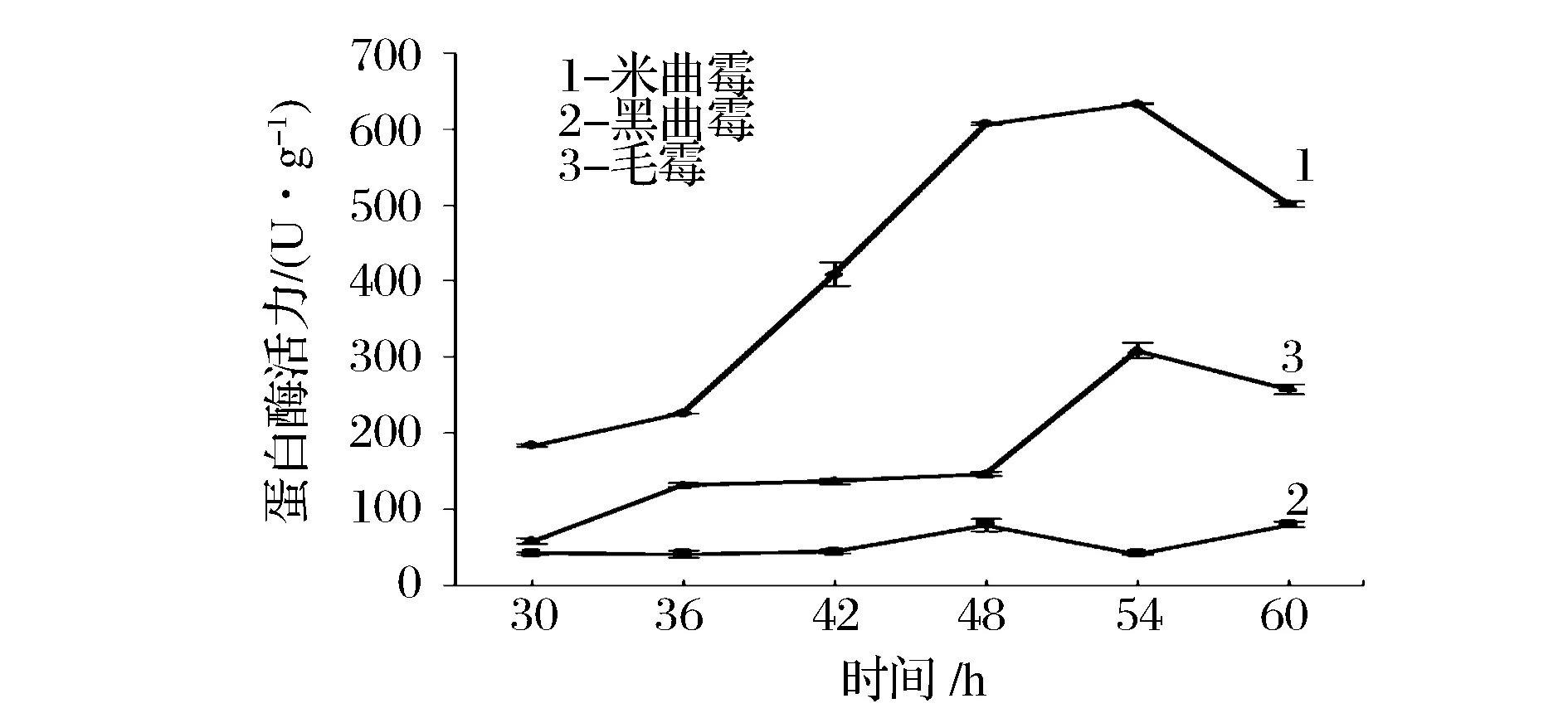
图6 中性蛋白酶活力变化Fig.6 Change of neutral protease activity
从图6可看出,米曲霉产中性蛋白酶活力最高,并在54 h时出现最高值,产酶高峰在48~54 h,中性蛋白酶最高达632 U/g。毛霉产中性蛋白酶活力相比米曲霉较低,产酶高峰在50~60 h,同样在54 h时出现最高值,蛋白酶活达到304 U/g,其活力为米曲霉的一半。黑曲霉产中性蛋白酶的酶活最少,产酶高峰在42~54 h,在48 h出现最高值。
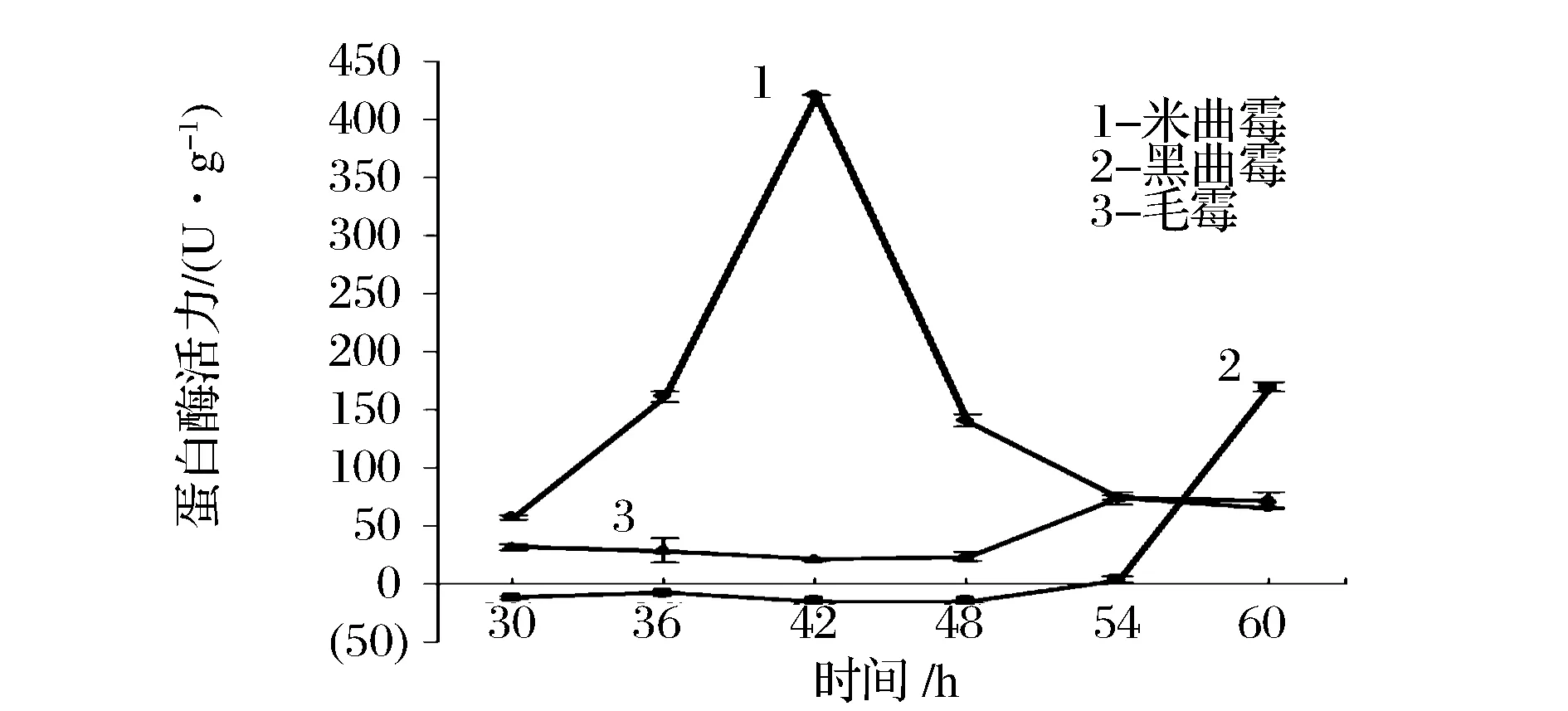
图7 碱性蛋白酶活力变化Fig.7 Change of alkaline protease activity
由图7的碱性蛋白酶的酶活曲线可看出,米曲霉的酶活最高(416 U/g),且其产酶高峰在36~48 h,后随时间的增加产碱性蛋白酶活力逐渐降低,产酸性蛋白酶活力逐渐升高。黑曲霉产碱性蛋白酶活力在30~54 h的发酵时间内极低,超过54 h后随着时间的增加,碱性蛋白酶活力增加,此时黑曲霉产酸性蛋白酶活力下降。所测得黑曲霉碱性蛋白酶活力为负值可能是由于样品中碱性蛋白酶活力过低,没有进行适当的浓缩,而杂质氨基酸较高,酶水解的酪蛋白可以忽略,导致测定值为负值。毛霉产生的3种蛋白酶活力均在中间值,其产酸性和中性蛋白酶活力曲线与米曲霉类似,产碱性蛋白酶活力曲线与黑曲霉类似。
2.4.2.2 氨基酸态氮含量
本实验考察了3种曲霉在30 ℃恒温培养下,因培养时间的延长而产生的氨基酸态氮含量变化情况。
从图8可以看出,随着培养时间的延长,3种曲霉产生氨基酸态氮的量逐渐增大,黑曲霉、米曲霉、毛霉3者达到峰值的时间(氨基酸态氮含量)分别为48 h(0.997 5 g/100 g)、54 h(0.458 5 g/100 g)、54 h(0.322 0 g/100 g);继续延长培养时间,氨基酸态氮含量逐渐降低;氨基酸态氮含量最高的是黑曲霉,其次为米曲霉和毛霉,在48 h时,黑曲霉的氨基酸态氮含量(0.997 5 g/100 g)最高,是米曲霉(0.331 1 g/100 g)和毛霉(0.311 5 g/100 g)的3倍左右。
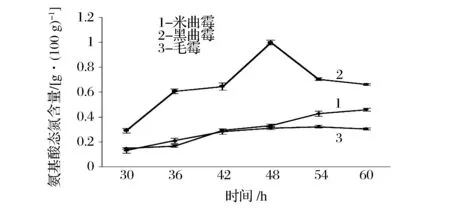
图8 氨基酸态氮含量变化Fig.8 Change of amino acid nitrogen content
一般来讲,霉豆瓣中蛋白质含量越高,蛋白酶的活性越高,蛋白质利用率就越高,产生的氨基酸态氮的含量也越高。其中黑曲霉酸性蛋白酶活力整体高于米曲霉和毛霉,在42 h有最大值,因此产生氨基酸态氮的含量也高于其余二者,且在48 h有最大值。
3 结论
将市售霉豆瓣中的微生物进行分离筛选所得的米曲霉、黑曲霉和毛霉进行单菌种回接,在不同温度和同温度不同时间下进行恒温发酵,对霉豆瓣蛋白酶活力和氨基酸态氮含量进行分析。其中蛋白酶活力方面,黑曲霉产酸性蛋白酶活力远高于米曲霉和毛霉,酸性蛋白酶高达872 U/g。而米曲霉的中性蛋白酶和碱性蛋白酶活力最高,分别为632、416 U/g。而毛霉产的3种蛋白酶活力均在中间值。氨基酸态氮含量方面,黑曲霉发酵产的氨基酸态氮含量最高,最高可达0.997 5 g/100g,而米曲霉和毛霉产氨基酸态氮曲线相近,量差不大。
综上,米曲霉作为主要发酵菌种,产中性及碱性蛋白酶能力强;黑曲霉产酸性蛋白酶和氨基酸态氮含量远高于其余二者,有补足酶系不全及风味不足的作用。毛霉产蛋白酶活力均衡,酸性、中性及碱性蛋白酶活力处于中间值,产氨基酸态氮能力虽没有黑曲霉强,但胜在稳定,可起到一定的补充作用。3种菌对豆瓣的发酵均有增益作用,通过对理化指标的检测,结合感官评价,可为下一步复合菌发酵、克服单菌株发酵酶系不均衡问题提供一定的基础,可进一步进行实验。
[1] 李红玫,刘忠华.豆瓣酱发酵工艺的优化[J].中国调味品,2012,37(6):65-70.
[2] 高岭.郫县豆瓣的生产工艺改进[J].中国调味品,2006,3l(5):34-39.
[3] 贡汉坤,王海鸥.传统酱类自然发酵的发酵动态分析[J].食品科技,2003,24(9):54-59.
[4] 贾瑞博,胡荣康,周文斌,等.米曲霉(Aspergillus oryzae FAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业,20016,42(11):71-76.
[5] 王俊,苏国万,赵谋明.产中性蛋白酶种曲培养基的优化及酶学特性研究[J].现代食品科技,2012,28(8):1 002-1 006;1 007.
[6] 柯野,陈丹,李家洲,等.米曲霉碱性蛋白酶基因的克隆表达及水解特性[J].华南理工大学学报(自然科学版),2012,40(8):88-94.
[7] 林祖申.UE336-2米曲霉应用于酱油生产的研究[J].中国酿造,2003,22(4):24-26.
[8] 杜善良,张文德.一种快速测定调味品中氨基酸态氮的新方法[J].中国调味品,1998,23(1):30-31.
[9] 刘莹,胡茂丰,刘素纯,等.不同菌种发酵制备蚕豆酱的研究[J].中国酿造,2014,33(10):58-62.
[10] JOHN J W.Rapid procedure for the extraction of DNA from fungal spores and Mycelia[J].Fungal Genetics Newsletter,1997,44:60-63.
[11] NAQARAI S,SRIPATHY M H.Development and evaluation of a novel combinatorial selective enrichment and multiplex PCR technique for molecular detection of major virulence-associated genes of enterotoxigenicStaphylococcusaureusin food samples[J].Journal of Applied Microbiology,2014,116(2):435-446.
[12] JOHN M B.Advanced topics in forensic DNA typing[M].San Diego:Academic Press,2012:29-48.
[13] TAMURA K,DUDLEY J,NEI M,et al.MEGA4:Molecular evolutionary genetics analysis (MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1 596-1 599.
[14] 全国食品工业标准化技术委员会.蛋白酶制剂GB/T 23527—2009[S].北京:中国标准出版社,2009.
[15] 卫生部.酱油卫生标准的分析方法GB/T 5009.39—2003[S].北京:中国标准出版社,2003.
[16] 徐高丹,蒋予箭,于佳清,等.pH值及乳酸菌对米曲霉固态制曲过程的影响[J].食品与发酵工业,2011,37(7):73-76.
Determinationofproteaseactivityofdominantmicroorganismfrommoldybean
MEI Yuan,TANG Jia-ying,HE Hui-rong,AO Xiao-lin*
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
Selecting 2 kinds of moldy bean commercially available as the research objects to isolate the microorganisms, according to the tieback fermentation experiment, the dominant strains M1(Aspergillusniger), M2(Aspergillusoryzae), and M3(Actinomucorelegant) were screened out. Then protease activity and amino acid nitrogen content of excellent strains were determined. Results showed thatAspergillusoryzaehad the highest activity of neutral and alkaline protease, which was 632 and 416 U/g respectively. Acidic protease activity and amino acid nitrogen content inAspergillusnigerwere much higher than those inAspergillusoryzaeandActinomucorelegant, which were 872 U/g and 0.997 5g/100g, respectively. AndActinomucoreleganthad balanced ability to produce these 3 proteases, which could play a supplementary role.
moldy bean; microorganism; isolation and screening; protease activity
大学本科(敖晓琳副教授为通讯作者,E-mail:huavslin@163.com)。
国家大学生创新创业训练计划项目(201510626032)
2017-04-12,改回日期:2017-05-16
10.13995/j.cnki.11-1802/ts.014512
