右美托咪啶对肺缺血/再灌注损伤大鼠促炎介质IL-1β、TNF-α水平的影响及其机制*
2017-11-01项冰倩何金波罗梓垠戴雍月王万铁
项冰倩, 何金波, 高 慧, 罗梓垠, 戴雍月△, 王万铁△
(1. 温州医科大学缺血/再灌注损伤研究所, 浙江温州 325035; 2. 十堰市太和医院, 湖北十堰 442000)
右美托咪啶对肺缺血/再灌注损伤大鼠促炎介质IL-1β、TNF-α水平的影响及其机制*
项冰倩1, 何金波2, 高 慧1, 罗梓垠1, 戴雍月1△, 王万铁1△
(1. 温州医科大学缺血/再灌注损伤研究所, 浙江温州 325035; 2. 十堰市太和医院, 湖北十堰 442000)
目的评价右美托咪啶对大鼠肺缺血/再灌注损伤时促炎介质肿瘤坏死因子-α(TNF-α)、白介素1β(IL-1β)的影响及机制。方法雄性健康SPF级SD大鼠50只,体重250~310 g,8~12周龄,采用随机数字表法分为5组(n=10):假手术组(sham组)、缺血/再灌注损伤组(I/R组)、右美托咪啶组(Dex组)、阿替美唑组(Atip组)、右美托咪啶+阿替美唑组(Dex+Atip组)。采用大鼠在体左侧肺门夹闭30 min再灌注2 h制备缺血/再灌注(I/R)模型,Dex组、Atip组、Dex+Atip组分别在肺门阻断前30 min腹腔注射右美托咪啶(20 μg/kg)、阿替美唑(250 μg/kg)、右美托咪啶(20 μg/kg)和阿替美唑(250 μg/kg),其余处理同I/R组。实验结束后留取左肺检测肺湿干重比 (W/D)和肺水含量 (TLW) ;光、电镜观察肺组织形态结构变化;ELISA检测血浆中IL-1β及TNF-α的水平。结果与sham组相比,其余各组W/D、TLW、IL-1β和TNF-α的水平明显升高(P<0.05,P<0.01),光、电镜均显示肺组织结构出现明显损伤性变化;与 I/R组、Atip组、Dex+Atip组相比,Dex组W/D、TLW、IL-1β及TNF-α的含量下降(P<0.05,P<0.01),光、电镜下肺组织损伤减轻;I/R组、Atip组、Dex+Atip组两两比较,以上各指标均无统计学差异。结论右美托咪啶通过降低促炎介质IL-1β、TNF-α浓度减轻大鼠肺缺血/再灌注损伤,其机制可能与激动α2-肾上腺素受体有关。
右美托咪啶;缺血/再灌注损伤;促炎介质;IL-1β;TNF-α;大鼠
缺血/再灌注损伤(ischemia/reperfusion injury,I/RI)是指当缺血组织重新获得血流后,不但不能减轻或恢复组织缺血性损害,反而加重缺血性损伤。随着肺移植等治疗方式在临床上的大量应用,越来越多的研究发现,尽管移植手术很成功,但临床上最终治疗效果及预后却不容乐观,最重要的原因是肺移植术后发生的肺缺血/再灌注损伤(pulmonary ischemia/reperfusion injury,PI/RI)。有研究表明,肺移植手术过程中发生缺血/再灌注损伤的几率高达25%[1],最严重的可继发急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。PI/RI的病理过程很复杂,具体发病机制至今不明,研究发现其与氧自由基的释放、钙稳态的失衡以及脂质过氧化、炎性因子的释放增多有密切相关[2,3]。
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素1β(interleukin 1 beta ,IL-1β)是最常见的促炎细胞因子,也是重要的前炎症细胞因子。TNF-α是一种主要由巨噬细胞和单核细胞产生的促炎细胞因子,对正常细胞无明显损伤作用,但能在体内外直接杀死肿瘤细胞或抑制细胞增殖。IL-1β主要由活化的单核巨噬细胞产生,被认为是最经典的炎症调节剂,是调节炎症的始动因素。右美托咪啶是新型α2受体激动药,具有镇静、镇痛、抑制交感活性等作用。已有研究表明[4-6],右美托咪啶对脑、心、肺缺血/再灌注损伤具有保护作用,但具体作用机制尚未进一步阐明。本研究拟评价右美托咪啶对大鼠PI/RI时促炎介质IL-1β和TNF-α的影响及其机制,为明确其减轻PI/RI的机制提供理论依据。
1 材料与方法
1.1 实验动物
雄性健康SPF级SD大鼠50只,体重250 g~310 g,8~12周龄,由温州医科大学实验动物中心提供【SYXK(浙)2010-0150】。
1.2 药品与试剂
20%乌拉坦(生工生物工程股份有限公司,中国);右美托咪啶、阿替美唑(江苏恒瑞制药有限公司,中国);BCA试剂盒(碧云天生物技术研究所,中国);IL-1β、TNF-α ELISA试剂盒(上海西唐生物科技有限公司,中国)。
1.3 实验分组
实验动物按随机数字表法分为5组(n=10):假手术组(sham组)、缺血/再灌注损伤组( I/R组)、右美托咪啶组(Dex组)、阿替美唑(atipamezole,Atip)组(Atip组)、右美托咪啶+阿替美唑组(Dex+Atip组)。Dex组、Atip组、Dex+Atip组分别在手术前30 min腹腔注射右美托咪啶(20 μg/kg)、阿替美唑(250 μg/kg)、右美托咪啶(20 μg/kg)和阿替美唑(250 μg/kg)。实验结束后留取左肺组织。
1.4 模型制作
依据文献采用SD大鼠在体左侧肺门夹闭制备I/R模型[7]。20%乌拉坦(7 ml/kg)腹腔注射麻醉,消毒胸颈部皮肤后切开并分离皮下组织和肌肉,暴露气管T型切开,气管插管后接呼吸机行机械通气,呼吸机参数为:吸呼比为3∶4,呼吸频率为70次/分,100%氧浓度,潮气量30 ml/kg。于左胸部3-5肋间处开胸并游离左侧肺门,肝素50 U/kg静脉注射5 min后动脉夹阻断左肺门30 min,30 min后恢复血流再灌注2 h。实验结束后采集血样,留取左肺组织。sham组仅开胸不夹闭肺门,机械通气150 min;其余4组行左肺门阻断30 min,再灌注2 h;Dex组、Atip组、Dex+Atip组分别在肺门阻断前30 min腹腔注射右美托咪啶(20 μg/kg)、特异性α2-肾上腺素受体阻滞剂阿替美唑(250 μg/kg)、右美托咪啶(20 μg/kg)和阿替美唑(250 μg/kg)。
1.5 肺 W/D 和TLW检测
左肺上叶组织经生理盐水漂洗干净后用滤纸吸干残留水分,称取的重量为湿重( wet weight,W);在干燥箱烘干24 h后称重,为干重( dry weight,D),肺干湿比(wet weight to dry/weight of lung tissue,W/D)为两者之比。肺水含量(total lung water content,TLW)的公式为TLW=(W-D)/D 。
1.6光镜下肺组织形态学观察及肺泡损伤定量评估
取左肺下叶约0.5cm3组织若干块,经4%多聚甲醛固定数天后石蜡包埋切片,HE染色后光镜下观察组织学改变。高倍镜(×400)下每组切片随机观察10个视野,计数每个视野下损伤肺泡数及总肺泡数。肺泡内有渗出液或超过2个肺泡内含红细胞或白细胞均判为损伤肺泡,肺泡损伤评估指数(index of quantitative assessment,IQA)为损伤肺泡数占总肺泡数百分比。
1.7 扫描电镜观察肺组织的变化
再灌注结束后迅速在左肺门处取出肺组织,放置于蜡板上,滴上2.5%戊二醛固定液,用双刀切割法切取约1 mm3大小若干块,再浸入装有2.5%戊二醛固定液的标本瓶内,并放置于4℃冰箱内固定2 h以上,依次经1% 锇酸后固定,1%醋酸铀块染,丙酮梯度脱水,环氧树脂包埋剂包埋聚合,半薄切片定位肺泡上皮细胞后并超薄切片,醋酸铀-柠檬酸铅双重染色后H-7500透射电镜下观察并拍照。
1.8 ELISA检测TNF-α和IL-1β浓度变化
各组SD大鼠分别于再灌注结束时右心房取血3 ml,待血液凝固后离心3 000 r/min (4℃),15 min,取上清液用BCA试剂盒进行蛋白定量,分别用大鼠TNF-α和IL-1β ELISA试剂盒进行TNF-α和IL-1β浓度检测。酶标仪检测OD值并计算总蛋白浓度、TNF-α和IL-1β浓度。IL-1β与总蛋白浓度比为IL-1β的相对浓度,以TNF-α浓度与总蛋白浓度比值表示TNF-α的相对浓度。
1.9 统计学分析

2 结果
2.1 各组肺T LW和W/D的比较
与sham组相比,其余各组肺组织水肿明显加重,TLW和W/D值升高明显(P< 0.05,P<0.01);与I/R、Atip、Dex+Atip组相比, Dex组肺组织水肿改善明显,TLW、W/D亦有下降, 差异有统计学意义(P<0.01);Atip组、Dex+Atip组、I/R组两两比较,差异无统计学意义(表1)。
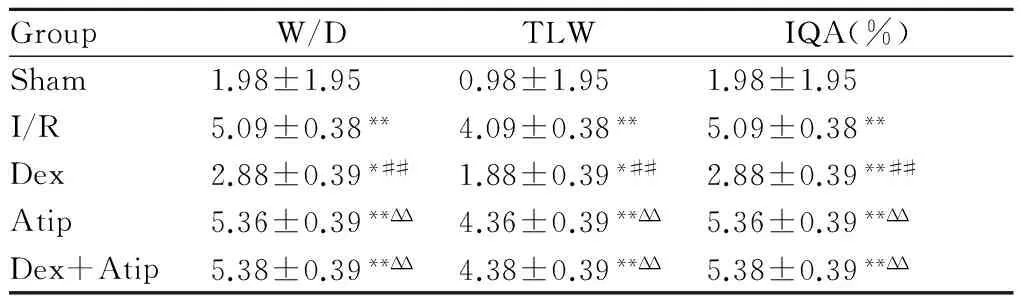
GroupW/DTLWIQA(%)Sham1.98±1.950.98±1.951.98±1.95I/R5.09±0.38**4.09±0.38**5.09±0.38**Dex2.88±0.39*##1.88±0.39*##2.88±0.39**##Atip5.36±0.39**ΔΔ4.36±0.39**ΔΔ5.36±0.39**ΔΔDex+Atip5.38±0.39**ΔΔ4.38±0.39**ΔΔ5.38±0.39**ΔΔ
W/D: Wet/Dry weight; TLW: Total lung water content; IQA: Index of quantitative assessment; I/R: Ischemia/reperfusion injury; Dex: Dexmedetomidine; Atip: Atipamezole; Dex+Atip: Dexmedetomidine + Atipamezole
*P<0.05,**P<0.01vssham group;##P<0.01vsI/R group;ΔΔP<0.01vsDex group
2.2光镜下各组肺组织形态学和肺泡损伤评估指数的比较
Sham组肺间质与肺泡完整,无明显损伤,炎症细胞无浸润,IQA较低;I/R组、Atip组、Dex+Atip组肺泡结构紊乱,间质和肺泡壁均出现水肿增厚,肺泡内可见红细胞漏出或渗出液。三组IQA两两比较,差异无统计学意义;与I/R组相比,Dex组肺组织损伤明显减轻,肺泡结构较完整,肺泡内炎症细胞减少,水肿减轻,IQA值下降明显,差异有统计学意义(P<0.01,表1,图1)。
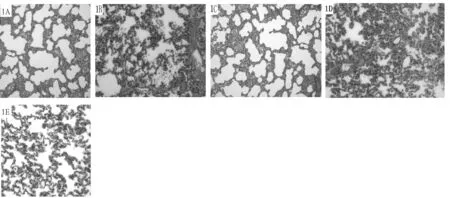
Fig.1Histological changes of left lung tissues in each group (HE ×400)
A: Sham group; B: Ischemia/reperfusion injury group; C: Dexmedetomidine group; D: Atipamezole group; E: Dexmedetomidine + Atipamezole group
2.3 电镜下各组肺组织超微结构的比较
Sham组肺泡II型上皮细胞结构基本完整,线粒体嵴清晰可见,板层小体未见异常,微绒毛排列整齐;I/R组肺泡II型上皮细胞结构紊乱,线粒体高度水肿,线粒体嵴消失,板层小体出现严重空泡化,微绒毛结构消失,出现核固缩、溶解; Dex组较I/R组肺泡II型上皮细胞损伤减轻,板层小体数目较多,未见空泡化,线粒体结构相对完整,线粒体嵴清晰,微绒毛结构可见;Atip组和Dex+Atip组肺泡II型上皮细胞结构也出现严重损害,线粒体水肿,嵴消失,板层小体减少并空泡化,核碎裂,损伤程度与I/R组相当(图2)。
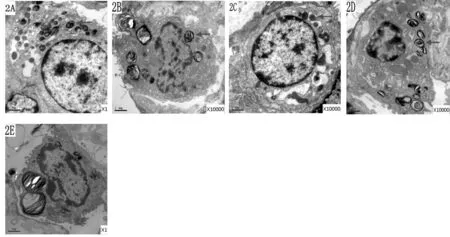
Fig.2Ultrastructure changes of left lung tissue in each group(×10 000)
A: Sham group; B: Ischemia/reperfusion injury group; C: Dexmedetomidine group; D: Atipamezole group; E: Dexmedetomidine + Atipamezole group
2.4各组大鼠血浆中TNF-α和IL-1β浓度的比较
与sham组相比,其余4组大鼠血浆中TNF-α和IL-1β的浓度有明显上升(P< 0.01);Dex组大鼠血浆中TNF-α、IL-1β的浓度与I/R组相比明显降低(P<0.01),I/R、Atip、Dex+Atip组两两比较,差异均无统计学意义;与Dex组相比,Atip、Dex+Atip组血浆TNF-α和IL-1β浓度上升明显,差异有统计学意义(P< 0.01,表2)。
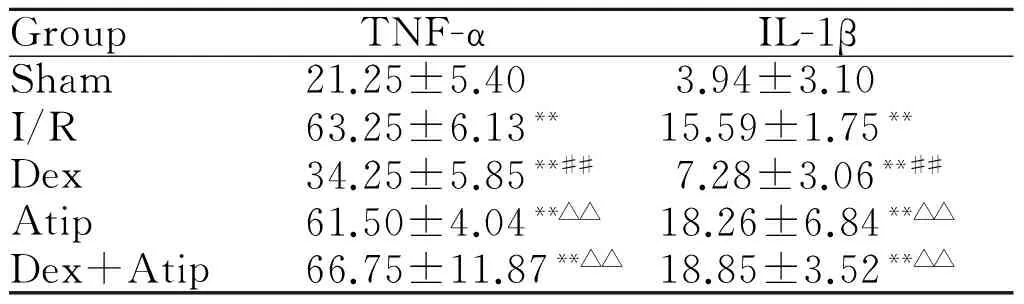
GroupTNF-αIL-1βSham21.25±5.403.94±3.10I/R63.25±6.13**15.59±1.75**Dex34.25±5.85**##7.28±3.06**##Atip61.50±4.04**△△18.26±6.84**△△Dex+Atip66.75±11.87**△△18.85±3.52**△△
TNF-α: Tumor necrosis factor-α; IL-1β: Interleukin-1β; Sham: Sham group; I/R: Ischemia/ reperfusion injury group; Dex: Dexmedetomidine group; Atip: Atipamezole group; Dex+Atip: Dexmedetomidine + Atipamezole group
**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsDex group
3 讨论
右美托咪啶是高选择性α2受体激动药,能够作用于中枢神经系统的α2肾上腺素能受体,对中枢α2肾上腺素受体激动的选择性比美托咪啶更强,与可乐定相比,对α2肾上腺素受体的亲和力是其8倍。右美托咪啶主要是作用于蓝斑核、脊髓后角突触前和中间神经元突触后膜的α2肾上腺素能受体,使细胞产生超极化,进而抑制神经元的放电,阻断了疼痛信号向大脑传导,产生镇静、镇痛、抗焦虑和抑制交感活动的效应,其它作用还包括抗寒战、止涎和利尿等[8]。同时,右美托咪啶还能激活胆碱能抗炎通路,具有抗炎、器官保护作用[9]。实验研究结果表明,右美托咪啶做为术中用药有很好的围术期器官保护作用,能有效改善术中缺血对器官的损伤[10]。
本实验结果提示右美托咪啶可减轻大鼠肺缺血/再灌注损伤。在炎症反应相关检测中,本实验选择了TNF-α和IL-1β作为检测指标。它们在炎症反应中被认为是最重要的因子之一[11-13]。除TNF-α外,IL-1家族在免疫炎症的机制中也起着重要的调节作用。本实验结果发现Dex组血浆中IL-1β与TNF -α的浓度较I/R组有明显降低,提示右美托咪啶预处理能使炎症反应减轻,证明右美托咪啶对缺血/再灌注损伤肺的保护作用与其降低促炎介质IL-1β、TNF-α有关,其机制可能是通过抑制TLR4 / NF-κB通路的活化[14-19]。
同时提示右美托咪啶保护再灌注损伤肺作用可能与激动α2-肾上腺素能受体有关。右美托咪啶通过激动突触前膜α2受体,抑制了去甲肾上腺素的释放,使突触后膜的兴奋性降低并阻断了疼痛信号的传导;通过作用于突触后膜α2受体,能使交感神经的活性显著抑制,增强迷走神经兴奋性,减少去甲肾上腺素的释放,降低血浆中儿茶酚胺的水平,从而引起血压和心律的降低,降低心肌氧耗,减少手术期间多种刺激;用于联合麻醉时能显著降低其余麻醉药的用量,同时还能改善血流动力学稳定,降低心肌缺血的发生率,具有心血管保护作用[20]。
综上所述,炎症反应在肺缺血/再灌注损伤发生发展过程中发挥着关键的作用,右美托咪啶可通过降低促炎介质IL-1β、TNF-α水平减轻大鼠肺缺血/再灌注损伤,其机制可能与激动α2-肾上腺素能受体有关。右美托咪啶作为新型麻醉药在临床上广泛使用,其对围手术期的器官保护作用是临床医师的关注热点。本研究通过右美托咪啶对模型的干预和特异性α2-肾上腺素受体阻滞剂阿替美唑的拮抗,进一步阐述右美托咪啶对再灌注损伤肺发挥保护作用的机制,为围术期间麻醉药的选择以及新药的临床运用开发提供科学依据。
[1] 刘 备, 唐冬梅, 杜 宁, 等. 七氟烷预处理联合后处理对肺缺血再灌注损伤大鼠的保护作用及机制[J]. 山东医药, 2015, 55(17): 17-19.
[2] 倪程耀, 陈 新, 吴胜军. 免疫因素在大鼠肺缺血再灌注损伤中的作用[J]. 中国老年学杂志, 2014, 34(18): 5192-5193.
[3] 王 赫, 李晓倩, 马 虹, 等. 鞘内注射右美托咪啶预处理在兔脊髓缺血再灌注损伤的保护作用[J]. 中国医师杂志, 2013, 15(8): 1032-1036.
[4] Bagcik E, Ozkardesler S, Boztas N,etal. Effects of dexmedetomidine in conjunction with remote ischemic preconditioning on renal ischemia-reperfusion injury in rats[J].RevBrasAnestesiol, 2014, 64(6): 382-390.
[5] Sahin T,Begec Z,Toprak HI,etal. The effects of dexmedetomidine on liver ischemia-reperfusion injury in rats[J].JSurgRes, 2013, 183(1): 385-390.
[6] 罗梓垠, 郭长满, 项冰倩, 等. 右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子Caspase-12表达的影响[J]. 中国应用生理学杂志, 2016, 32(2): 164-168.
[7] Mantz J, Josserand J, Hamada S. Dexmedetomidine:new insights[J].EurJAnaesthesiol, 2011, 28(1): 3-6.
[8] 崔云凤, 宋智敏, 周 姝, 等. 右美托咪定辅舒芬太尼用于全麻病人的术后镇痛[J].中国实验诊断学, 2013, 17(2): 321-323.
[9] Luan HF, Zhao ZB, Feng JY,etal. Prevention of etomidate-induced myoclonus during anesthetic induction by pretreatment with dexmedetomidine[J].BrazJMedBiolRes, 2015, 48(2): 186-190.
[10]何金波, 宋 冬, 罗梓垠, 等. 右美托咪定对大鼠I/R损伤肺组织TLR4表达及保护作用的影响[J]. 中国应用生理学杂志, 2016, 32(4): 356-360.
[11]常春荣, 韩 东, 孙尚敏, 等. 牙周基础治疗对慢性牙周炎患者龈沟液白细胞介素6、肿瘤坏死因子α及血清高敏C反应蛋白的影响[J]. 中国医科大学学报, 2013, 42(2): 135-137.
[12]付 锐, 项和平, 杨硎琦, 等. 降钙素原、C反应蛋白、肿瘤坏死因子、游离DNA对多发伤患者发生多器官功能障碍综合征的预测价值[J]. 中华急诊医学杂志, 2013, 22(8): 850-854.
[13]袁艳平, 李长贵. 痛风性关节炎患者血清白细胞介素-1β、肿瘤坏死因子-α环氧化酶-2水平的动态变化研究[J]. 中华风湿病学杂志, 2013, 17(12): 818-822.
[14]Manøek-Keber M, Jerala R. Postulates for validating TLR4 agonists[J].EurJImmunol, 2015, 45(2): 356-370.
[15]黄翠源, 潘灵辉, 林 飞, 等. 肺泡巨噬细胞TLR4/MyD88信号通路参与并介导了机械通气所致的肺损伤[J]. 细胞与分子免疫学杂志, 2015, 31(2): 182-185.
[16]刘亚坤, 何金波, 陈海娥, 等. 血必净注射液对缺氧/复氧大鼠心肌TLR4—NF-κB—TNF-α通路的影响[J]. 中国中西医结合杂志, 2014, 34(12): 1463-1468.
[17]Xing B, Chen H, Wang L,etal. Ozone oxidative preconditioning protects the rat kidney from reperfusion injury via modulation of the TLR4-NF-κB pathway[J].ActaCirBras, 2015, 30(1): 60-66.
[18]何金波, 包财盈, 叶玉柱, 等. 缺氧-复氧大鼠心肌中IL-1β浓度的动态变化及意义[J]. 中国应用生理学杂志, 2015, 31(1): 27-30.
[19]Hua F, Tang H, Wang J,etal. TAK-242, an antagonist for Toll-like receptor 4, protects against acute cerebral ischemia/reperfusion injury in mice[J].JCerebBloodFlowMetab, 2015, 35(4): 536-42.
[20]尹 红, 吴 健, 陈卫民. 小剂量右美托咪定持续输注对全麻高血压患者血流动力学的影响[J]. 临床麻醉学杂志, 2013, 29(12): 1181-1183.
EffectsofDexmedetomidineonthelevelsofproinflammatorymediatorsIL-1βandTNF-αinpulmonaryischemia/reperfusioninjuryratsandthemechanisms
XIANG Bing-qian1, HE Jin-bo2, GAO Hui1, LUO Zi-yin1, DAI Yong-yue1△, WANG Wan-tie1△
(1. Institute of Ischemia/Reperfusion Injury, Wenzhou Medical University, Wenzhou 325035; 2. Shiyan Taihe Hospital, Shiyan 442000, China)
Objective: To evaluate the effects and mechanism of the Dexmedetomidine on the levels of proinflammatory mediators interleukin 1 beta (IL-1β) and tumor necrosis factor-α(TNF-α) in ischemia/reperfusion(I/R)rats.MethodsFifty healthy SPF male SD rats, 250~310 g,8~12 weeks,were randomly divided into five groups(n=10):sham operation group(sham group),I/R group, dexmedetomidine group(Dex group), atipamezole group(Atip group), dexmedetomidine plus atipamezole(Dex+Atip group). The I/R model was established by clipping hilus of left lung for 30 min and then reperfusion for 2 h. Dex group, Atip group and Dex + Atip group were performed by intraperitoneal injection dexmedetomidine(20 μg/kg),atipamezole(250 μg/kg),Dexmedetomidine(20 μg/kg)+atipamezole(250 μg/kg)respectively 30 min in advance before hilus of left lung was clipped, the rest of the process was the same with I/R group. After the experiment the rats were killed and the left lung tissues to determine the lung wet/dry weight(W/D) and total lung water content(TLW); Ultra structure of lung tissues were observed under light microscope and electron microscope; IL-1β and TNF-α levels were determined by using ELISA.ResultsCompared with the sham group, the W/D、TLW、IL-1β and TNF-α in other groups were increased significantly (P<0.05). The structure damages of lung tissues observed under light microscope and electron microscope in other groups were more serious than that of sham group. Compared with I/R、Atip、Dex+Atip group, the levels of W/D、TLW,IL-1β and TNF-α in Dex group were lower (P<0.05), the structure damages of lung tissues observed under light microscopy and electron microscope in Dex group were slighter . There was no significant difference of the above parameters among I/R、Atip、Dex+Atip group.ConclusionDexmedetomidine can alleviate ischemia/reperfusion injury in rat lung through lowering the level of proinflammatory mediators IL-1β and TNF-α,the possible mechanism may be through stimulation of α2adrenaline receptors.
dexmedetomidine; ischemia/reperfusion injury; proinflammatory mediators; IL-1β; TNF-α; rats
R363
A
1000-6834(2017)05-415-05
10.12047/j.cjap.5526.2017.100
浙江省公益技术应用研究项目(2013C33168);浙江省新苗人才计划项目(2014R413043);温州市公益性科技计划项目(20140652)
2016-11-24
2017-06-23
△
Tel: 0577-86689817; E-mail: wwt@wmu.edu.cn
