甘草内生菌发酵物对痰浊阻肺大鼠炎症相关因子、水通道蛋白的影响*
2017-11-01杨志军杨秀娟
杨志军, 邓 毅△, 曼 琼, 王 勇, 杨秀娟, 赵 妮, 刘 靓
(1. 甘肃中医药大学中药教研室, 2. 教学实验中心, 兰州 730000)
甘草内生菌发酵物对痰浊阻肺大鼠炎症相关因子、水通道蛋白的影响*
杨志军1, 邓 毅1△, 曼 琼1, 王 勇2, 杨秀娟1, 赵 妮1, 刘 靓2
(1. 甘肃中医药大学中药教研室, 2. 教学实验中心, 兰州 730000)
目的筛选具有祛痰作用的甘草内生菌菌株发酵物。方法Wistar大鼠90只,雌雄各半,随机分为9组(n=10):即空白组、模型组、阳性对照组、甘草水煎液组、甘草内生菌发酵物5组(JTZB005、JTZB006、JTZB043、JTZB060、JTZB063)。采用SO2烟薰30 min、低温兼冷风刺激10 min诱导痰浊阻肺大鼠模型,每天2次,连续10 d。造模10 d后,空白组、模型组给予生理盐水10 ml/kg灌胃,阳性组给予复方贝母氯化铵片0.08 g/kg灌胃,水煎液组给予甘草水煎液0.95 g/kg,内生菌各组给予甘草内生菌发酵液蒸干粉末0.95 g/kg,每天灌胃给药1次,连续7 d,观察大鼠一般情况。第7天,灌胃给药2 h后,断颈处死大鼠,取右肺上叶,4%戊二醛固定,HE染色切片,光镜下观察肺组织病理形态学变化,免疫组化染色切片,检测水通道蛋白1、5(AQP1、AQP5)的分布及表达。硝酸还原酶法测定肺组织一氧化氮(NO)含量,ELISA检测大鼠肺组织肿瘤坏死因子-α(TNF-α)、细胞间粘附分子-1(ICAM-1)的含量及环氧化酶-2(COX-2)的浓度。结果与空白组比较,模型组大鼠肺组织中NO、TNF-α、ICAM-1的含量及COX-2的浓度显著升高,而水通道蛋白AQP1、AQP5的表达显著降低(P<0.01)。与模型组比较,水煎液组、JTZB005、JTZB006、JTZB063组肺组织NO、TNF-α、ICAM-1的含量及COX-2的浓度均显著降低,AQP1、AQP5的表达水平显著升高(P<0.05,P<0.01)。结论筛选出JTZB005、JTZB006、JTZB063等3株具有祛痰作用的甘草内生菌有效菌株。
甘草内生菌;祛痰;大鼠;炎症因子;水通道蛋白
近年来,为了拓宽药用植物资源,寻找有效的替代品,对药用植物内生菌的研究取得了一定进展。研究证实,内生菌与宿主植物在长期共生的过程中,可获得宿主植物的部分基因,产生与宿主植物相同或相似的生物活性物质[1,2]。甘草能祛痰止咳,善治咳嗽有痰之症,但甘草内生菌的体内药效学报道鲜见。本课题通过研究甘草内生菌对痰浊阻肺模型大鼠肺组织形态、炎症相关因子、水通道蛋白(AQP1、AQP5)表达的影响,筛选出具有祛痰作用的甘草内生菌菌株。
1 材料与方法
1.1 材料
1.1.1 动物 3月龄Wistar大鼠,SPF级,雌雄各半,体质量(200±20)g,由甘肃中医药大学动物实验中心提供(合格证号:SCXK(甘)2015-0002)。自由摄食、饮水,喂标准饲料;饲养温度:20℃~24℃,相对湿度:40%~50%。
1.1.2 受试药物 甘草内生菌发酵液的制备:前期体外抑菌实验筛选出5株甘草内生菌有效菌株,分别为:JTZB005、JTZB006、JTZB043、JTZB060、JTZB063。经鉴定,以上5株均为甘草内生细菌。在250 ml锥形瓶中加入100 ml营养肉汤培养基(NA),分装5瓶,121℃灭菌20 min。在双人净化工作台上用接种环分别挑取10环活化的JTZB005、JTZB006、JTZB043、JTZB060、JTZB063菌种,接种于灭菌的NA培养基中,放置于摇床,在25℃、200 r/min条件下培养4d,最后将发酵液在4℃、3 000 r/min离心15 min,过滤上清液,60℃烘干备用。采用紫外分光光度法检测,甘草内生菌发酵液干燥粉末中均含有总黄酮、总皂苷。甘草水提液的制备:11月初在甘肃省金塔县采集栽培的乌拉尔甘草,经甘肃中医药大学生药实验中心高级实验师林丽鉴定为3年生甘草Glycyrrhiza uralensis Fisch.的根及根茎。将甘草洗净,切厚片,将适量蜂蜜用开水稀释后,淋入甘草片中拌匀闷润,文火加热,炒至黄色、不粘手时,取出晾凉,即为炙甘草。取适量炙甘草,加10倍量水,煎煮40 min,过滤,再加8倍量水,煎煮30 min,过滤,合并两次滤液,水浴浓缩至含生药45 mg/ml的浓缩液,高压灭菌,4℃储存。复方贝母氯化铵片,西安利君制药有限责任公司,批号1506390。
1.1.3 主要试剂与仪器 一氧化氮(NO)试剂盒,南京建成生物工程研究所,批号20160308;肿瘤坏死因子-α(tumor necrosis factor ,TNF-α)ELISA试剂盒,欣博盛生物科技有限公司,批号:R160506-102a;细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1或CD54)ELISA试剂盒,批号:AK0016MAY 05001,还氧化酶-2(cyclooxygenase -2,COX-2)ELISA试剂盒,批号:AK0016MAY05002,武汉伊莱瑞特生物科技有限公司;兔抗大鼠水通道蛋白-1(aquaporins-1,AQP1),批号:bS-1506R,兔抗大鼠水通道蛋白-5(AQP5),批号:bS-1554R,北京博奥森生物技术有限公司。
HJ-CJ-2D双人净化工作台,上海苏静实业有限公司;DHP-927电热恒温培养箱,上海一恒科学仪器有限公司;GFL3033型气浴恒温摇床,北京博励行仪器公司;MODEL680-酶标仪,美国伯乐公司。
1.2 方法
1.2.1 分组、造模、给药 Wistar大鼠90只,随机分为9组(n=10):空白组、模型组、阳性对照组、甘草水提液组、甘草内生菌各组(JTZB005、JTZB006、JTZB043、JTZB060、JTZB063)。根据参考文献及预试验建立痰浊阻肺大鼠模型[3]。空白组大鼠置于正常环境中饲养,其余各组大鼠采用SO2烟薰30 min(将3 g 硫磺粉均匀洒布于清艾条中点燃),再放置于人工气候箱中,10℃并冷风刺激10 min,每天2次,连续10 d。第11天,空白组、模型组均给予生理盐水10 ml/kg灌胃,阳性组给予复方贝母氯化铵片0.08 g/kg灌胃,水煎液组给予甘草水煎液0.95 g/kg,甘草内生菌各组给予甘草内生菌发酵液蒸干粉末0.95 g/kg。各组药物均用蒸馏水稀释,与空白组等容积灌胃,1 count/d,连续7 d。第7天,灌胃给药2 h后,断颈处死大鼠,取右肺上叶,4%戊二醛固定。取右肺中叶肺组织,准确称取,加入生理盐水,冰浴下按两者重量体积比制成10%的肺组织匀浆,3 000 r/min离心10 min,取上清液备用。
1.2.2 证候学观察 观察各组大鼠的精神状态,活动,进食量,口鼻分泌物,呼吸状况等症状、体征。
1.2.3 肺组织形态学 HE染色,光学显微镜下观察肺组织形态学变化。
1.2.4 肺组织炎症相关因子含量测定 取上清液,硝酸还原酶化学比色法测定NO含量,严格按ELISA试剂盒说明书检测TNF-α、ICAM-1的含量及COX-2的浓度。
1.2.5 水通道蛋白AQP1、AQP5的分布及表达 免疫组化染色切片,在光学显微镜下选择阳性细胞(棕黄色颗粒)较多的区域采集5个光镜视野,拍照,并输入到成都泰盟BI-2000医学图像分析系统,用灰度值代表染色强度表达,在统一的背底、倍数条件下以灰度均值为参数,计算机定量检测AQP1、AQP5在肺组织的表达。
1.3 统计学处理
2 结果
2.1 证候学变化
空白组大鼠反应灵活,呼吸自如,食欲旺盛,毛发光泽,体重持续上升。模型组大鼠普遍食少,消瘦,毛发枯槁,精神倦怠,可闻及明显的痰鸣音,呼吸喘促,时有咳嗽,口鼻分泌物增多。各药物组大鼠饮食基本正常,皮毛较有光泽,较活泼,体重缓慢增加,痰鸣音逐渐减轻,偶有咳嗽。
2.2 各组大鼠肺组织形态变化
空白组大鼠肺泡结构完整,未见明显扩张,支气管粘膜上皮完整,管壁未增厚,管腔内纤毛排列整齐,无明显的炎性渗出。模型组大鼠肺泡壁变薄,部分断裂,肺泡腔增大,个别肺泡融合成肺大泡,肺间质可见大量炎细胞,支气管粘膜上皮脱落,不完整,纤毛缺失,管壁增厚,杯状细胞增多,粘膜层及粘膜下层有大量炎细胞浸润。阳性组、水煎液组、JTZB005、JTZB006、JTZB063组均可见支气管上皮较完整,支气管管壁略增厚,纤毛较模型组多,粘膜下及间质炎细胞浸润较模型组轻,肺泡腔轻度扩大。JTZB043、JTZB060组与模型组所见基本一致(图1)。
Fig.1Pathologic morphology in lung tissues(HE×100)
A: Normal control group; B: Model group; C: Positive control group; D: Glycyrrhiza decoction group; E: JTZB005 group; F: JTZB006 group: G: JTZB043 group; H: JTZB060 group; I: JTZB063 group
2.3各组药物对大鼠肺组织中炎症相关因子的影响
与空白组比较,模型组大鼠肺组织中NO、TNF-α、ICAM-1的含量及COX-2的浓度显著升高(P<0.01);与模型组比较,阳性组、水煎液组、JTZB005、JTZB006、JTZB063组NO含量显著降低,除JTZB043组,其余各药物组TNF-α、ICAM-1的含量及COX-2的浓度均显著降低(P<0.05,P<0.01);药物组间比较,JTZB043组各指标、JTZB060组TNF-α的含量、COX-2的浓度均显著高于水煎液组(P<0.05,P<0.01,表1)。
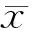
Tab. 1 Levels of inflammation-associated factors in lung tissue(±s,n=10)
NO: Nitric oxide; TNF-α: Tumor necrosis factor-α; ICAM-1: Intercellular adhesion molecule 1; COX-2: Cyclooxygenase-2
**P<0.01vsnomal control group;#P<0.05,##P<0.01vsmodel group;△P<0.05,△△P<0.01vsglycyrrhiza decoction group
2.4各组大鼠水通道蛋白AQP1、AQP5的分布与表达
与空白组比较,模型组AQP1 、AQP5的阳性细胞数均显著减少(P<0.01);与模型组比较,阳性组、水煎液组、JTZB005组、JTZB006组、JTZB063组AQP1 、AQP5的阳性细胞数显著增加(P<0.05);药物组间比较,JTZB043、JTZB060组AQP5阳性细胞数显著低于水煎液组(P<0.05,图2、图3,表2)。

Fig.2Distribution and expression of aquaporin 1(AQP1)in lung(SP ×400)
A: Normal control group; B. Model group; C: Positive control group; D: Glycyrrhiza decoction group; E: JTZB005 group; F: JTZB006 group; G: JTZB043 group; H: JTZB060 group; I: JTZB063 group

Fig.3Distribution and expression of aquaporin 5(AQP5)in lung(SP ×400)
A: Normal control group; B: Model group; C: Positive control group; D: Glycyrrhiza decoction group; E: JTZB005 group; F: JTZB006 group; G: JTZB043 group; H: JTZB060 group; I: JTZB063 group
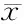

GroupDosage(g/kg)AQP1AQP5Nomalcontrol—145.40±26.84150.35±30.58Model—95.27±23.85**96.44±25.20**Positivecontrol0.08128.74±32.10#130.28±22.43#Glycyrrhizadecoction0.95118.50±20.30#126.80±26.35#JTZB0050.95120.36±23.52#124.66±30.26#JTZB0060.95123.04±24.88#128.30±31.78#JTZB0430.95100.08±33.4599.28±28.64△JTZB0600.95105.89±30.4196.05±28.35△JTZB0630.95124.58±22.75#129.62±25.44#
AQP: Aquaporin
**P<0.01vsnomal control group;#P<0.05vsmodel group;△P<0.05vsglycyrrhiza decoction group
3 讨论
植物内生菌是宝贵的微生物资源,是存在于活体植物健康组织或细胞内并且不引起宿主植物组织发病的一类微生物群,包括内生真菌、细菌、放线菌。目前,诸多研究者已从甘草根、茎、叶中分离出不同种属的甘草内生菌[4,5]。
本课题对栽培乌拉尔甘草中分离出的5株甘草内生菌进行分子生物学鉴定,JTZB005、JTZB060属于枯草芽孢杆菌(Bacillussubtilis),JTZB006属于萎缩芽孢杆菌(Bacillusatrophaeus),JTZB043属于漠海威芽孢杆菌(Bacillusmojavensis),JTZB063属于索诺拉沙漠芽孢杆菌(Bacillussonorensis),且同源性均为100%。张敏等[6]研究证实,甘草内生细菌的主要优势菌群为芽孢杆菌属,与本鉴定结果一致。
痰浊阻肺多由风寒邪气外侵,导致肺的宣降功能失常,继而输布津液失司,导致水液停滞,聚而成痰。因此,本课题采用低温兼冷风刺激结合SO2烟薰诱导痰浊阻肺大鼠模型。结果显示:模型组大鼠普遍出现呼吸喘促,可闻及咳嗽、气道痰鸣音,且口鼻分泌物增多。模型组病理切片可见支气管管壁增厚、杯状细胞增多、大量炎细胞浸润,支气管粘膜上皮不完整、脱落、肺泡壁变薄、肺泡腔增大等变化,表明模型复制成功。
现代研究认为,中医学“痰证”是机体在有害因素的作用下,上呼吸道或肺部炎症的表现,与机体细胞因子的表达水平密切相关[7]。一氧化氮(NO)是机体巨噬细胞、中性粒细胞等被激活释放的炎症介质,NO能引起血管扩张,气道充血,导致气道的炎症和水肿,高浓度NO有细胞毒作用,造成气道组织坏死脱落,气道炎症损害加剧。同时,NO能促进肺部巨噬细胞等释放TNF-α、IL-1等大量炎症介质[8]。TNF-α诱导中性粒细胞及炎性细胞活化,产生多种致损物质,并能直接损伤肺血管内皮细胞,增高内皮细胞通透性,还可刺激血管内皮细胞表达ICAM-1等多种粘附分子,刺激单核-巨噬细胞聚集,分泌趋化性细胞因子等[9],TNF-α释放过多时,会引起肺部一系列炎性损害。ICAM-1通过与血管内皮细胞表面上的特异性受体结合,促进T细胞活化,并使白细胞、炎症细胞与内皮细胞间的黏附作用增强,促进白细胞从血管内向炎症部位浸润,参与炎症[10]。肺部炎症时,NO、TNF-α、ICAM-1等含量升高,这些因子作为诱导剂,导致COX-2表达水平上调,其将花生四烯酸代谢成各种前列腺素产物,增加血管渗透性、促进单核细胞粘附、刺激炎性细胞因子产生等,从而导致一系列炎症反应[11]。结果显示:JTZB005、JTZB006、JTZB063组大鼠肺组织NO、TNF-α、ICAM-1的含量及COX-2的浓度均显著降低,表明甘草内生细菌发酵物能通过抑制炎症相关因子活性,从而减少呼吸道黏液分泌发挥祛痰作用。
祖国医学认为,“痰”为机体水液代谢异常的病理产物。在肺组织,肺泡内液体的转运主要有两种方式:一是伴随Na+的主动转运机制,二是经肺泡上皮的水通道。水通道蛋白(AQPs)是一组介导水分子转运的跨膜糖蛋白家族,在调控水的跨膜转运及维持水液代谢平衡等方面发挥作用,可实现水液在不同渗透压梯度间的转运[12]。AQP1主要分布在细支气管和肺泡毛细血管内皮细胞及成纤维细胞,可以清除支气管和微血管周围的液体,而AQP5主要分布在Ⅰ型肺泡上皮细胞,能清除肺泡腔内液体[13]。AQP的表达水平受炎性细胞因子和其他多种因素的调节,林阳生等研究证实急性冷暴露后AQP-5的基因和蛋白表达显著降低[14]。AQP1及AQP5的异常表达与肺组织水液代谢失衡、气道黏液高分泌等有密切联系[15]。结果显示,JTZB005、JTZB006、JTZB063组大鼠肺组织AQP1 、AQP5的表达水平显著升高,表明甘草内生细菌发酵物能增强水通道蛋白AQP1 、AQP5的表达,改善肺组织水液代谢,发挥祛痰作用。
综上所述,筛选出JTZB005、JTZB006、JTZB063等3株具有祛痰作用的甘草内生菌。
[1] Puri SC, Nazir A, Chawla R,etal. The endophytic fungus Trametes hirsuta as a novel alternative source of podo-phyllo-toxin and related aryl tetralin lignans [J].JBiotechnol, 2006, 122(4): 494-510.
[2] 李文军, 郑素慧, 毛培宏, 等. 新疆胀果甘草内生菌的分离及产甘草酸菌株的筛选[J]. 生物技术, 2008, 18(5): 28-31.
[3] 李小兵, 沈丽萍, 刘小虹, 等. 补肺化痰方对肺虚痰阻证模型大鼠Na+-K+-ATP酶活性的影响[J]. 中医杂志, 2010, 51(7): 648-650.
[4] 邓 毅, 王 艳, 丁仁伟, 等. 甘肃甘草内生菌次生代谢产物抑菌活性初步研究[J]. 中药材, 2013, 36(2): 181-184.
[5] 宋素琴, 欧提库尔·玛合木提, 张志东, 等. 新疆胀果甘草内生菌的分离和鉴定[J]. 微生物学通报, 2007, 34(5): 867-869.
[6] 张 敏, 沈德龙, 饶小莉, 等. 甘草内生细菌多样性研究[J]. 微生物学通报, 2008, 35(4): 524-528.
[7] 王 剑, 严 灿, 邓中炎, 等. 从黏附分子代谢失常探讨痰证机理[J]. 中国中西医结合杂志, 2000, 20(4): 296-297.
[8] Cuzzocrea S, Zingarelli B, Gilad E,etal. Protective effect of metatonin in carrageenan-induced models of local inflammation: relationship to its inhibitory effect on nitric oxide produetion and its peroxynitrite scavenging activity[J].JPinealRes, 1997, 23(2): 106-116.
[9] 孙卫民. 细胞因子研究方法学[M]. 北京: 人民卫生出版社, 1999: 469-470.
[10]Hopkins AM, Barid AW, Nusrat A. ICAM-1:targe-ted docking for exogenous as well as endogenous ligands[J].AdvDrugDelivRev, 2004, 56(6): 763-778.
[11]Dannenberg AJ, Altorki NK, Boyle JO,etal. Cyclo-oxygenase 2:a pharmacological target for the prevention of cancer[J].LancetOncol, 2001, 2(9): 544-551.
[12]Song Y, Yang B, Matthay MA,etal. Role of aquaporin water channels in pleural fluid dynamics[J].AmJPhysiolCellPhysiol, 2000, 279(6): C1744-1745.
[13]李 波, 陈 东, 王桂芳, 等. 水通道蛋白1、3、4、5在内毒素性急性肺损伤小鼠肺组织中的表达[J]. 第二军医大学学报, 2008, 29(2): 131-135.
[14]林阳生, 张 莉, 杨 华, 等. 急性冷暴露对大鼠肺组织中水通道蛋白AQP-1 和 AQP-5 表达的影响[J]. 中国应用生理学杂志, 2016, 32(3): 234-237.
[15]Dong C, Wang G, Li B,etal. Antiasthmatic agents alleviate pulumonary edema by upregulating AQP1 and AQP5 expression in the lungs of mice with OVA-induced asthma[J].RespirPhysiolNeurobiol, 2012, 181(1): 21-28.
EffectsofthefermentationproductsofendophytesfromGlycyrrhizauralensisoninflammation-associatedfactorsandAquaporininratmodelswithphlegmblockinginlung
YANG Zhi-jun1, DENG Yi1△, MAN Qiong1, WANG Yong2, YANG Xiu-juan1, ZHAO Ni1, LIU Liang2
(1. Traditonal Chinese Pharmacology Teaching Research Section, Gansu University of Chinese Medicine,2. The Experimental Teaching Center, Lanzhou 30000, China)
Objective: To filtrate the effective fermentation products of endophytes from Glycyrrhiza uralensis by comparing expectorant effects.MethodsNinety Wistar rats with half males and half females were randomly divided into 9 groups(n=10): including normal control group, model group, positive control group, Glycyrrhiza decoction group, 5 groups of the fermentation products of endophytes(JTZB005,JTZB006,JTZB043,JTZB060,JTZB063). The model of phlegm blocking in lung was induced by inhaling SO2for 30 minutes and cold wind for 10 minutes twice per day for ten days. Ten days later, 10 ml/kg normal saline was administrated in normal control group and model group, 0.08 mg/kg Fufang Beimu Lvhuaan tablets was administrated in positive control group, 0.95 g/kg Glycyrrhiza water decoction and the fermentation products of endophytes were respectively administrated in Glycyrrhiza decoction group and 5 groups of the fermentation products of endophytes. All groups were given the corresponding dose by intragastric administration once a day for seven days. The changes of rats’ general activities were observed during the experimental time. Two hours after the last gavage, rats were sacrificed. The upper lobe of the right lung was removed for HE and immunohistochemical staining. Pathological of lung tissues and the expressions of aquaporin-1(AQP1)and aquaporin-5(AQP5) in lung tissue were measured. In addition, the lung tissue of middle lobe of right lung were accurately weighed, and 10% homogenate were made. The supernatant was removed by centrifugation at 3 000 r/min for ten minutes. The levels of nitric oxide (NO) was determined by nitric acid reductase method. The content of tumor necrosis factor(TNF-α) and intercellular adhesion molecule 1(ICAM-1) and the concentration of cyclooxygenase-2(COX-2) in lung tissue were measured by enzyme-linked immunosorbent(ELISA) method.ResultsAfter modeling,the levels of NO, TNF-α, ICAM-1, and the concentration of COX-2 in lung tissue were increased significantly, the expressions of AQP1 and AQP5 were decreased significantly (P<0.01) . Compared with the model group, the levels of NO,TNF-α,ICAM-1 and the concentration of COX-2 in lung tissue were decreased significantly, and the expressions of AQP1 and AQP5 were increased significantly in Glycyrrhiza decoction group, JTZB005,JTZB006 and JTZB063 group(P<0.05,P<0.01).ConclusionBy filtrating, JTZB005、JTZB006、JTZB063 have expectorant effects.
endophytes from Glycyrrhiza uralensis; expectorant; inflammation-associated factors; Aquaporin; rat
R285.5
A
1000-6834(2017)05-410-05
10.12047/j.cjap.5495.2017.099
国家自然科学基金项目(81360633)
2016-12-09
2017-06-22
△
Tel: 13919289773; E-mail: dengyi@gszy.edu.cn
