小剂量肝素对小鼠淹溺肺损伤SOD、MPO活性和MDA水平的影响*
2017-11-01温媛婷陈俊良唐筛娣孙洁芸庞庆丰
杜 斌, 朱 丹, 温媛婷, 陈俊良, 唐筛娣, 孙洁芸, 陈 炜, 庞庆丰△
(1. 江南大学无锡医学院, 江苏 无锡 214122; 2. 无锡市第三人民医学院急诊科, 江苏 无锡 214041)
小剂量肝素对小鼠淹溺肺损伤SOD、MPO活性和MDA水平的影响*
杜 斌1, 朱 丹1, 温媛婷1, 陈俊良1, 唐筛娣1, 孙洁芸1, 陈 炜2, 庞庆丰1△
(1. 江南大学无锡医学院, 江苏 无锡 214122; 2. 无锡市第三人民医学院急诊科, 江苏 无锡 214041)
目的探讨小剂量肝素对淹溺诱导的小鼠急性肺损伤的保护作用。方法60只小鼠随机分为正常组、溺亡组和小剂量肝素组,每组各20只。肝素组在游泳前30 min腹腔注射肝素0.1 U/g。将小鼠放入内壁光滑的离心管内置入水中让其自由游泳建立小鼠淡水淹溺肺损伤模型。正常组小鼠采用脊椎脱臼法处死,溺亡组和小剂量肝素组溺亡小鼠溺亡9 min后,取肺组织。称重肺组织计算肺指数及肺湿/干重比;HE染色观察小鼠肺组织的病理变化;取肺组织检测肺组织丙二醛(MDA)、肺组织髓过氧化物酶(MPO),超氧化物歧化酶(SOD)活性。结果与正常组相比,溺亡组小鼠肺指数增加,湿干重比 (W/D)比值增高;肺组织病理形态学炎症明显加重;肺组织匀浆SOD活性明显降低,MDA含量、MPO活性升高(P<0.05,P<0.01)。与溺亡组相比,肝素组小鼠肺指数降低,湿干重比 (W/D)比值降低;肺组织病理形态学炎症明显减轻;肺组织匀浆SOD活性明显升高,MDA含量、MPO活性降低(P<0.05,P<0.01)。结论小剂量肝素可以发挥抗炎和抗氧化作用,减轻淹溺诱导的小鼠急性肺损伤。
肝素; 淹溺; 肺损伤; 小鼠
heparin; drowning; lung injury; mice
淹溺是意外死亡的重要原因之一,每年全球发生淹溺死亡约40万人[1]。淡水淹溺对肺的损伤是多方面的。淡水进入肺部后,肺顺应性降低,肺泡表面活性物质被稀释,病理学上主要表现为明显的肺泡间质水肿、肺泡壁破裂,大量蛋白与红细胞渗出。研究发现,肝素具有抗炎和抗氧化、改善微循环调节凝血功能紊乱等多种作用[2, 3],对多种原因引起的肺损伤均有较好的治疗效果[4, 5], 然而不同剂量肝素抗凝作用是否伴有出血倾向,选用小剂量肝素0.1 U/g能否治疗淡水淹溺肺损伤炎症[6]尚不得知。故本实验通过建立淡水淹溺肺损伤模型,观察肺组织形态学变化以及丙二醛(malondialdehyde, MDA)含量、超氧化物歧化酶(superoxide
dismutase, SOD)、髓过氧化物酶(myeloperoxidase, MPO)活性,探讨小剂量肝素对淡水淹溺引起的急性肺损伤保护作用,为肝素临床治疗溺水患者提供实验依据。
1 材料与方法
1.1 仪器与试剂
RM2135石蜡切片机(德国徕卡微系统有限公司);80i正置荧光显微镜(日本尼康公司); ELX800全自动酶标仪(美国伯腾仪器有限公司)。MDA试剂盒(批号:20141202)、SOD试剂盒(批号:20141201), MPO试剂盒(批号:20141128)、 考马斯亮兰(批号:20150109)试剂盒(南京建成生物工程研究所),肝素注射液(批号:1406112),其他试剂为国产分析纯。
1.2 实验动物与分组
ICR 小鼠60 只,SPF 级,体质量(20±2) g,上海斯莱克实验动物有限责任公司提供(合格证编号2007000564424),许可证号码SCXK(沪)2012-0002。将实验小鼠随机分为3组(n=20):正常组、溺亡组和小剂量肝素组。实验前一天小鼠禁食,自由饮水。肝素组在游泳前30 min腹腔注射肝素0.1 U/g[6]。
1.3 模型制备
将小鼠放入1个内壁光滑的离心管内(要求:离心管两端有孔,将小鼠放置于管内并充满水,此步骤在充满水的桶内操作。水面高度与离心管上缘距离为10 cm),让其自由游泳并仔细观察,其第1次呛水时按秒表计时,直至小鼠溺死。溺死后即可将小鼠完全从水中取出,建立小鼠溺亡模型[7]。小鼠溺死指征:口唇黏膜苍白明显,躯干强直,四肢无游泳动作,头部不能浮出水面,随后身体逐渐下沉至容器底部,抓取时无任何反抗动作。
1.4 肺指数及肺湿/干重比 (W/D)检测
正常组小鼠采用脊椎脱臼法处死,溺亡组和肝素组溺亡小鼠溺亡9 min后,取肺组织进行磷酸盐缓冲液漂洗后电子天平称湿质量,将肺湿质量/小鼠体重,计算肺指数;然后将其置于75℃烤箱内烘烤72 h至恒重后称干质量,计算肺组织W/D重比。
1.5 病理学检测
将小鼠左侧肺组织置于10%的中性甲醛固定液中固定24 h,石蜡包埋,4 μm切片,HE染色,镜下观察。
1.6 肺组织氧化应激指标测定
取右肺下叶肺组织制成肺组织匀浆(肺组织∶生理盐水=1∶10),严格按照试剂盒说明书检测MDA、SOD、MPO含量及活性。
1.7 统计学处理
2 结果
2.1 各组小鼠肺指数的变化
Drown组和Heparin组小鼠肺指数明显高于Control组(P<0.05,P<0.01),Heparin组小鼠肺指数低于Drown组(P<0.05, 表1)。Drown组和Heparin组小鼠肺W/D比值明显高于Control组(P<0.05,P<0.01),Heparin组小鼠肺W/D比值低于Drown组(P<0.05, 表1)。
2.2肝素对小鼠淹溺肺损伤的病理组织学影响
正常组肺组织结构完整,肺泡腔清晰,未见炎症细胞浸润,肺泡无水肿。溺亡组肺组织损伤严重,肺泡破裂,肺间质和肺泡水肿,肺泡壁增厚,肺组织灶性出血, 并有以中性粒细胞为主的炎性细胞浸润;在给与肝素治疗后,溺亡所引起的肺损伤炎症减轻,肺泡壁虽有水肿增厚,但肺组织未见出血(图1)。
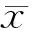

GroupLung/bodyindexW/DratioControl0.0079±0.00075.26±0.43Drown0.0115±0.0018*7.56±1.08*Heparin0.0096±0.0009##6.45±0.64##
*P<0.05vscontrol group;##P<0.01vsdrown group

Fig.1Histologic changes of mice lung tissues (HE staining)
A: Control group; B: Drown group; C: Heparin group
2.3 小鼠肺组织中MDA含量、MPO、SOD活性测定
与Control组相比,Drown组和Heparin组MDA含量、MPO活力显著升高,SOD活性显著降低(P<0.01);与Drown组相比,Heparin组MDA含量、MPO活力显著降低(P<0.01),SOD活性显著升高(P<0.01,表2)。
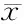

GroupMPO(U/g)MDA(nmol/mg.prot)SOD(U/mg.prot)Control2.11±0.151.19±0.0885.93±2.28Drown4.23±0.20**2.15±0.09**53.18±1.76**Heparin3.76±0.11**##1.74±0.07**##56.54±2.71**##
MPO: Myeloperoxidase; MDA: Malondialdehyde; SOD: Superoxide dismutase
**P<0.01vscontrol group;##P<0.01vsdrown group
3 讨论
淹溺性肺损伤是一种特殊病因引起的肺部疾病。目前认为淹溺性肺损伤是一个复杂的病理过程,炎症反应和氧化应激在淹溺性肺损伤的作用逐渐受到重视[8,9]。炎症反应在淹溺性肺损伤发生过程中有重要作用,有效抑制炎症反应有利于减轻淹溺性肺损伤[10]。小剂量肝素可减轻氧化应激反应,抑制促炎细胞因子TNF-α和IL-1β释放[11]。本研究发现本实验中,与溺亡组相比,小剂量肝素组的小鼠肺组织中MPO活性降低,提示小剂量肝素能够减轻小鼠淹溺性肺损伤的炎症。溺水可以引起严重低氧血症,氧代谢障碍必然会引起氧化应激损伤。氧自由基可破坏表面活性物质,又可损伤肺毛细血管内皮细胞,增加微血管通透性[12]。本研究发现溺水可引起小鼠肺组织SOD活性降低和MDA及MPO含量增高;肺指数和肺W/D比值明显增高;肺泡破裂、肺间质和肺泡水肿、肺泡壁增厚等病理形态学变化,而肝素治疗能够逆转上述的异常变化和减轻肺组织损伤程度,提示小剂量肝素可以通过抗氧化机制保护小鼠淹溺性肺损伤。
综上所述,本研究提示小剂量肝素可以通过抗炎和抗氧化作用,减轻淹溺诱导的小鼠急性肺损伤。但是肝素对淹溺性肺损伤的保护作用的分子机制有待进一步研究,且由于其抗凝作用有出血的风险,因此不同剂量肝素对于小鼠淹溺性肺损伤的影响机制以及其是否会有出血风险还有待进一步深入研究。
[1] Szpilman D, Bierens JJ, Handley AJ,etal. Drowning[J].NEnglJMed, 2012, 366(22): 2102-2110.
[2] Li Q, Lei RX, Zhou XD,etal. Regulation of PMA-induced MUC5AC expression by heparin in human bronchial epithelial cells[J].MolCellBiochem, 2012, 360(1-2): 383-391.
[3] Makino-Okamura C, Niki Y, Takeuchi S,etal. Heparin inhibits melanosome uptake and inflammatory response coupled with phagocytosis through blocking PI3k/Akt and MEK/ERK signaling pathways in human epidermal keratinocytes[J].PigmentCellMelanomaRes, 2014, 27(6): 1063-1074.
[4] Dixon B, Smith R, Santamaria JD,etal. A trial of nebulised heparin to limit lung injury following cardiac surgery[J].AnaesthIntensiveCare, 2016, 44(1): 28-33.
[5] Ning F, Wang X, Shang L,etal. Low molecular weight heparin may prevent acute lung injury induced by sepsis in rats[J].Gene, 2015, 557(1): 88-91.
[6] 马 建, 宋 艳, 李长龄. 低分子量肝素对小鼠凝血时间及大鼠静脉血栓形成的影响[J]. 中国新药杂志, 1999, 8(7): 456-458.
[7] 马艳艳, 刘 昕, 李玉湘. 溺水大鼠动物模型的建立及观察[J]. 郑州大学学报(医学版), 2008, 43(2): 359-362.
[8] Ji MH, Tong JH, Tan YH,etal. Erythropoietin pretreatment attenuates seawater aspiration-induced acute lung injury in rats[J].Inflammation, 2016, 39(1): 447-456.
[9] Ma L, Zhao Y, Li B,etal. 3,5,4'-Tri-O-acetylresveratrol attenuates seawater aspiration-induced lung injury by inhibiting activation of nuclear factor-kappa B and hypoxia-inducible factor-1alpha[J].RespirPhysiolNeurobiol, 2013, 185(3): 608-614.
[10]Ma L, Chen X, Wang R,etal. 3,5,4'-Tri-O-acetylresveratrol decreases seawater inhalation-induced acute lung injury by interfering with the NF-kappaB and i-NOS pathways[J].IntJMolMed, 2016, 37(1): 165-172.
[11]汪 洋, 王方岩, 潘 湛, 等. 氨溴索与肝素联合应用对急性肺损伤兔TNF-α和IL-1β的影响[J]. 中国应用生理学杂志, 2011,27(2): 231-235.
[12]张敏华, 董文度, 袁驾南, 等. 海水淹溺肺水肿兔血浆丙二醛和超氧化物歧化酶的变化研究[J]. 中国急救医学, 2000, 20(2): 83.
R965.1
A
1000-6834(2017)05-469-03
10.12047/j.cjap.5510.2017.112
国家自然科学基金项目(81270126)
2016-10-13
2017-05-19
△
Tel: 0510-85917007; E-mail: qfpang@jiangnan.edu.cn
