双氢青蒿素对Raji细胞放射敏感性的影响*
2017-11-01程龙球吕林林刘革修
张 雷, 程龙球, 周 兆, 吕林林, 刘革修△
(1. 暨南大学医学院血液研究所, 2. 暨南大学生物工程学系,3. 暨南大学再生医学教育部重点实验室, 广东 广州 510632)
双氢青蒿素对Raji细胞放射敏感性的影响*
张 雷2, 程龙球2, 周 兆3, 吕林林1, 刘革修1△
(1. 暨南大学医学院血液研究所, 2. 暨南大学生物工程学系,3. 暨南大学再生医学教育部重点实验室, 广东 广州 510632)
目的研究双氢青蒿素(DHA)对Raji细胞放射敏感性的影响并探讨其作用机制。方法CCK8测定DHA对Raji细胞活力的影响,流式细胞术检测细胞凋亡、胞内ROS及线粒体膜电位,Western blot检测AKT、p-AKT、Bcl-2、Bax和Cleaved-Caspase-3蛋白表达量。结果实验分为对照组、DHA组(5 μmol/L DHA)、放射组(4 Gy γ射线)、联合放射组(5 μmol/L DHA和4 Gy γ射线),与其他3组相比,联合放射组Raji细胞的线粒体膜电位显著降低(P<0.01),胞内ROS含量和凋亡率显著升高(P<0.01);此外,Raji细胞AKT表达量与其他3组相比无明显差异,但AKT的磷酸化受到抑制;Bcl-2表达量显著降低,而Bax、Cleaved-Caspase-3表达量显著升高。结论DHA可能通过抑制磷酸肌醇3-激酶(PI3K-AKT)信号通路及激活了Raji细胞的线粒体凋亡途径,引起氧化应激反应,从而增加Raji细胞对放射的敏感性。
双氢青蒿素;Raji细胞;线粒体凋亡途径;PI3K-AKT信号通路
随着成像和辐射等技术的发展,放射治疗与化疗的联合方案已普遍应用于早期的各种淋巴瘤的治疗。而且国际淋巴瘤放射肿瘤学组督导委员会(ILROG)通过现有的临床资料研究及国际会议已制定了各种类型淋巴瘤辐射治疗指南[1]。放疗不仅是淋巴瘤化疗后的一种有效的辅助治疗,也是救命治疗的重要组成部分[2]。但是放疗在淋巴瘤中的应用仍有一些争论,如辐射耐药、二次肿瘤以及对正常
组织的损伤等。多年来科学家一直在寻找增加肿瘤细胞辐射敏感性药物,为临床辐射治疗提供基础。研究发现,青蒿素及其衍生物(青蒿琥酯、蒿甲醚、双青蒿素)具有抗肿瘤活性及放射增敏作用,可通过增加活性氧、抑制缺氧相关的诱导因子,影响线粒体膜电位、诱导细胞凋亡而实现抗肿瘤作用;研究表明青蒿琥酯通过抑制Hela细胞的G2期检查点而增加其放射敏感性[3-5]。双氢青蒿素(dihydroartemisinin,DHA)是青蒿素的一种衍生物,其比青蒿素有更好的水溶性和抗疟疾作用。DHA对Raji细胞的放射增敏效果及其作用机制尚未见报道,本研究观察了DHA对淋巴瘤细胞株Raji细胞的辐射敏感性的作用,为伯基特淋巴瘤(Burkitt lymphoma,BL)的放射治疗(radiation therapy,RT)提供基础。
1 材料与方法
1.1 材料
Raji细胞株购于上海中国科学院细胞库,DHA(普菲德,成都,纯度>98.0%),1640培养基(GIBCO,美国),胎牛血清(四季青,杭州),CCK8(同仁,日本),DAPI试剂盒和细胞凋亡试剂盒(凯基,南京),ROS试剂盒和线粒体膜电位试剂盒(BD,美国),鼠抗人GAPDH单抗、鼠抗人p-AKT单抗以及兔抗人Bcl-2单抗、兔抗人Bax单抗、兔抗人Cleaved-Caspase-3单抗和兔抗人AKT单抗(CST,美国)。
1.2 细胞培养及分组
Raji细胞用含10%胎牛血清的1640培养基,在5%CO2、37℃的培养箱中培养,取对数期细胞进行实验,实验分为4个组,对照(Control)组、辐射(irradiation, IR)组、双氢青蒿素(DHA)组、双氢青蒿素联合辐射(DHA+IR)组。
1.3 CCK8法检测细胞增殖
取对数期细胞制成单细胞悬液,按4×103个/孔的密度接种到96孔板,培养12 h后加入DHA,使其终浓度分别为0、2.5、5、10、20、40、60、80和100 μmol/L。DHA母液浓度为100 mmol/L,用倍比稀释法,稀释8个梯度,每孔分别加入不同浓度的稀释液10 μl。分别处理24 h和48 h后,加入CCK8试剂,培养箱中避光孵育2 h,酶标仪(450 nm)测定OD值。
1.4 辐照条件
取对数期细胞制成单细胞悬液,按1×106个/孔的密度接种到6孔板,12 h后用60 Coγ射线(剂量率为1 Gy/min)照射细胞,辐射剂量分组为0、2、4、6、8、10和12 Gy,培养24 h后应用流式细胞术检测细胞凋亡率。
1.5 DAPI染色细胞核检测凋亡
取对数期细胞制成单细胞悬液,按1×106个/孔的密度接种于6孔板,培养12 h,加入1 mmol/L DHA 10 μl使其终浓度为5 μmol/L。预处理6 h后对IR组和DHA+IR组进行辐射处理,剂量为4 Gy,培养24 h后收集细胞。接着进行DAPI染色,染色方法参照试剂盒,然后在荧光显微镜(340/380紫外光激发)下观察拍照。
1.6流式细胞术检测细胞凋亡、ROS和线粒体膜电位
取对数期细胞制成单细胞悬液,按每孔1×106个接种于6孔板中,培养12 h,加入DHA使其终浓度为5 μmol/L,预处理6 h后对IR组和DHA+IR组进行辐射处理,剂量为4Gy,培养(线粒体膜电位6 h、ROS 9 h、凋亡24 h)后1 000 r/min,离心5 min收集细胞。然后对收集的细胞分别进行凋亡染色(Annexin V-FITC+PI染液)、ROS染色(DCFH-DA染液)和线粒体膜电位染色(JC-1染液),染色方法参照试剂盒,然后在流式细胞仪(BD,美国)上检测。
1.7Westernblot检测AKT、p-AKT、Bcl-2、Bax、Cleaved-Caspase-3蛋白表达量
提取细胞总蛋白,BCA试剂盒定量,100℃变性5 min后上样,SDS-PAGE电泳60 V,30 min后,改为110 V,60 min,转至PVDF膜上,TBST漂洗后,5%W/V脱脂奶粉封闭1 h,孵一抗过夜,TBST漂洗3次,二抗摇床孵育1 h,TBST漂洗3次,ECL试剂盒显色,曝光,采集图片。
1.8 统计学处理
2 结果
2.1 DHA对Raji细胞活力的影响
经过不同浓度的DHA处理后Raji细胞的存活率如表1所示。与对照组相比,当DHA浓度为2.5 μmol/L时,差异不显著(P>0.05);当DHA浓度大于等于5 μmol/L时,随着浓度增加,细胞存活率降低。当DHA浓度为2.5 μmol/L时,处理48 h与处理24 h细胞存活率无显著差异,当DHA浓度大于等于5 μmol/L时,同一浓度DHA处理的Raji细胞的存活率随着时间的延长而降低。为了研究DHA影响Raji细胞对放射的敏化能力,本研究使用将细胞活力降低至约90%的低毒性剂量:当DHA的浓度为5 μmol/L,处理时间为24 h时,细胞存活率为89.18%±3.40%(P<0.05),对细胞的生长抑制率比较小,因此本实验选取的药物浓度为5 μmol/L。
Tab.1Viability of Raji cells treated with different concentrations of dihydroartemisinin(DHA) for 24 h and 48 h (n=3)

Concentration(μmol/L)Cellviabilityrate(%)24h48h0103.20±8.80100.00±4.302.594.97±6.5098.97±6.40589.18±3.40**73.89±3.80**#1067.00±7.50**54.21±5.40**#2056.58±6.60**42.07±5.70**#4045.70±3.90**35.09±2.80**#6034.65±4.40**16.72±0.40**#8017.64±1.10**8.81±0.30**#10012.20±0.80**4.78±1.20**#
**P<0.01vscontrol;#P<0.05vs48 h
2.2 辐射对Raji细胞增殖的影响
用不同剂量的γ射线处理Raji细胞后,细胞凋亡情况见图1。由辐射剂量-细胞存活率曲线可知,随着辐射剂量的加大,细胞凋亡率增加。为了研究DHA对Raji细胞的辐射增敏作用,应选取凋亡率较低的辐射剂量:当辐射剂量为4 Gy时,细胞凋亡率为13.32%±0.59%,故本实验选取的放射剂量为4 Gy。
2.3 DHA对辐射诱导Raji细胞凋亡的影响
经5 μmol/L DHA预处理6 h,4 Gy γ射线处理后并培养24 h,Raji细胞凋亡情况如图2所示。与对照组(凋亡率为6.49%±1.15%)相比,DHA组凋亡率为15.45%±1.82%(P<0.05),IR组凋亡率为11.57%±2.51%(P<0.05),DHA+IR组凋亡率为45.15%±2.67%(P<0.01),表明DHA可增加Raji细胞对放射的敏感性。
细胞经DAPI染色后,细胞核的形态如图3所示。对照组(图3A)细胞核的形态呈现圆形,染色均匀,DHA组(图3 B)和单纯辐射组(图3C)小部分细胞的细胞核出现固缩、核分散、边缘不清晰和荧光加强的现象,而DHA+IR组(图3D),大量细胞的细胞核固缩,核小体碎片化,强蓝光着色,这表明细胞凋亡比率明显增加。

Fig.1Effects of different doses of irradiation on Raji cells (n=3)
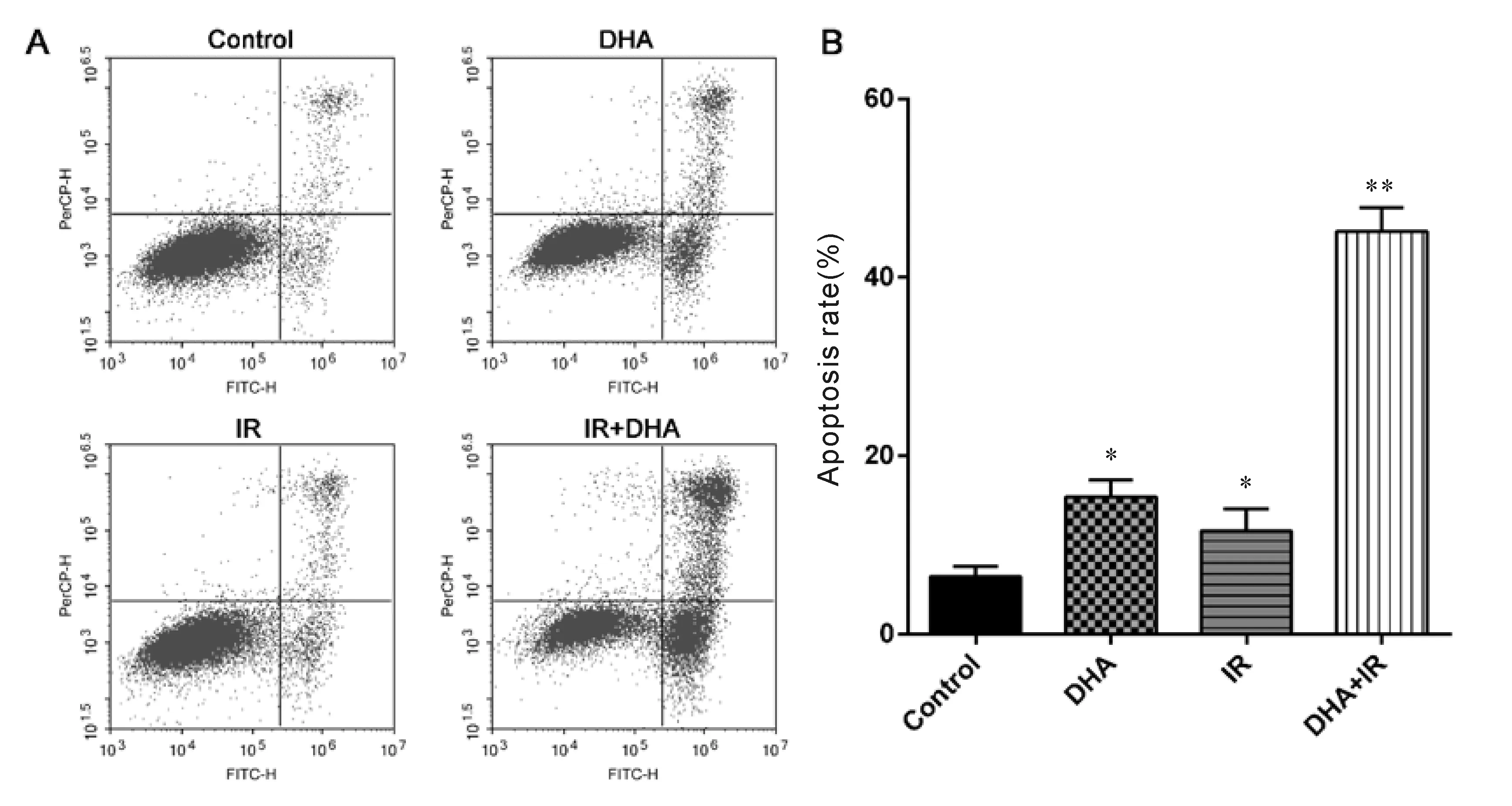
Fig.2Effects of DHA and irradiation on apoptosis of Raji cells(n=3)
*P<0.05,**P<0.01vscontrol

Fig.3Effects of DHA and irradiation on Raji cells by DAPI stain(×400)
A: Control group; B: DHA (5 μmol/L) treated group; C: IR(4 Gy)treated group; D: DHA(5 μmol/L) and IR(4 Gy)treated group
2.4 不同处理对Raji细胞线粒体膜电位的影响
由图4可知,与对照组相比其他3组线粒体膜电位均不同程度降低。对照组红色荧光强度和绿色荧光强度比值为1.158±0.078,DHA组比值为0.760±0.034(P<0.01),IR组比值为0.830±0.105(P<0.01),DHA+IR组比值为0.127±0.010(P<0.01),表明DHA与IR联合作用可显著降低Raji细胞的线粒体膜电位。
2.5 不同处理对Raji细胞内ROS的影响
各组Raji细胞内ROS的含量如图5所示,与对照组(ROS含量为1172.33±58.05)相比,DHA组ROS含量为3374±119.66(P<0.01),IR组ROS含量为2695±132.25(P<0.01),DHA+IR组ROS含量为7097±287.51(P<0.01),这些结果表明DHA联合放射可显著增加Raji细胞胞内ROS含量。
2.6WB检测不同处理对AKT、p-AKT、Bcl-2、Bax和Cleaved-Caspase-3蛋白表达量的影响
由图6可知,与对照组相比,3个实验组的AKT蛋白表达量并无差异,但是p-AKT和Bcl-2蛋白表达量降低,且DHA+IR组降低的更加明显;DHA组和IR组Bax、Caspase-3蛋白的表达量增加,DHA+ IR组表达水平明显高于DHA组和IR组。
3 讨论
作为具有良好的药物安全性和有效性的抗疟疾药物,青蒿素及其活性成分一直作为抗癌药物候选者而被研究改造[6]。Raji淋巴瘤是高发性癌症,虽然目前有放疗等各种治疗手段,但至今无法根治。本研究发现,DHA可促进Raji细胞的凋亡,且具有剂量和时间的依赖性,同时DHA可增加Raji细胞对辐射的敏感性。
细胞凋亡是一个精细的过程,通过复杂的基因编码的分子网络来调控正常组织的生长和体内平衡来参与凋亡,包括死亡受体介导的胞外途径和线粒体介导的胞内途径[7-9]。有研究指出调节肿瘤细胞的独特的氧化还原调控系统可能是一个清除这些细胞的有效方法[10],活性氧簇ROS是该系统中一个重要的氧化还原信号因子,而线粒体是ROS的潜在来源,同时线粒体也是ROS攻击的首要靶点[11,12]。本研究发现与IR组相比,DHA联合γ射线,可显著降低Raji细胞的线粒体膜电位,同时增加胞内ROS的含量。由此得出推论:DHA激活了线粒体凋亡途径,提高胞内ROS水平,从而诱导Raji细胞的凋亡,增强γ射线抗肿瘤功效。
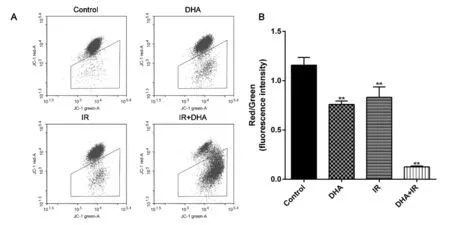
Fig.4Effects of DHA and irradiation on cell mitochondrial membrane potential of Raji cells(n=3)
**P<0.01vscontrol
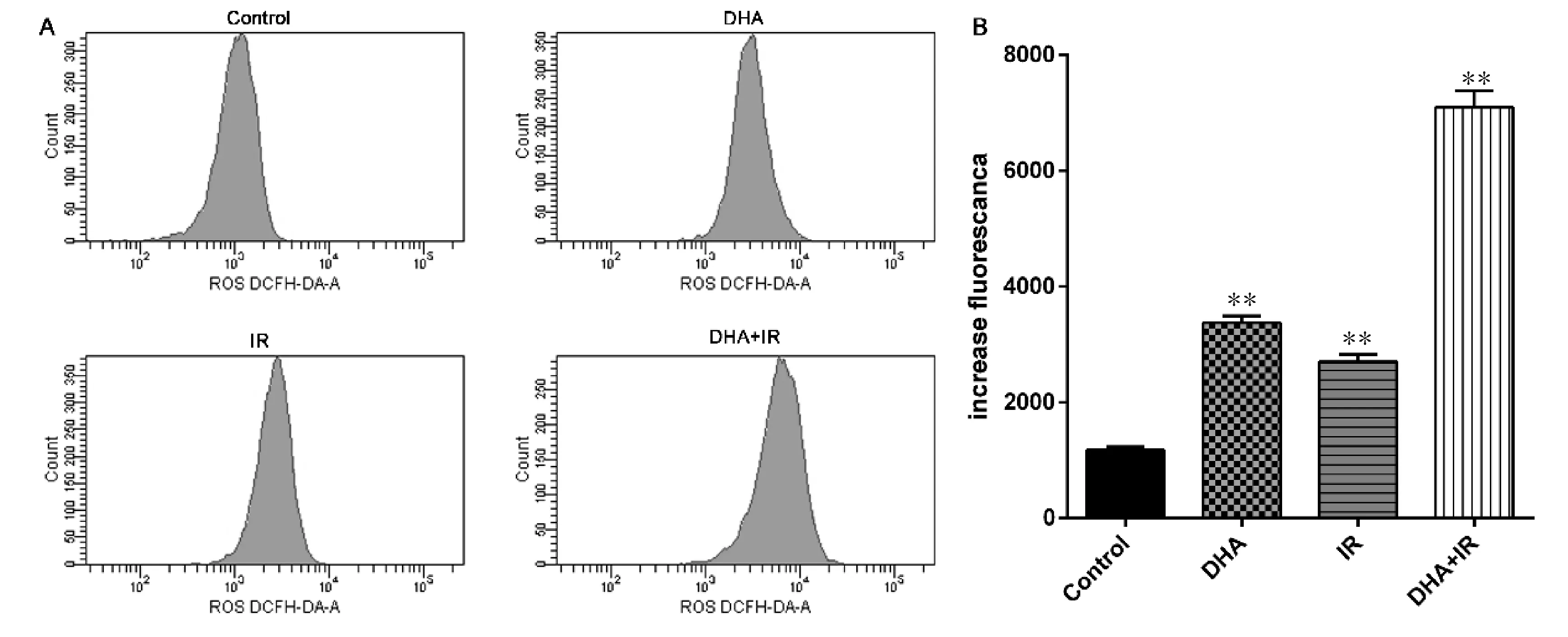
Fig.5Effects of DHA and irradiation on ROS of Raji cells(n=3)
**P<0.01vscontrol
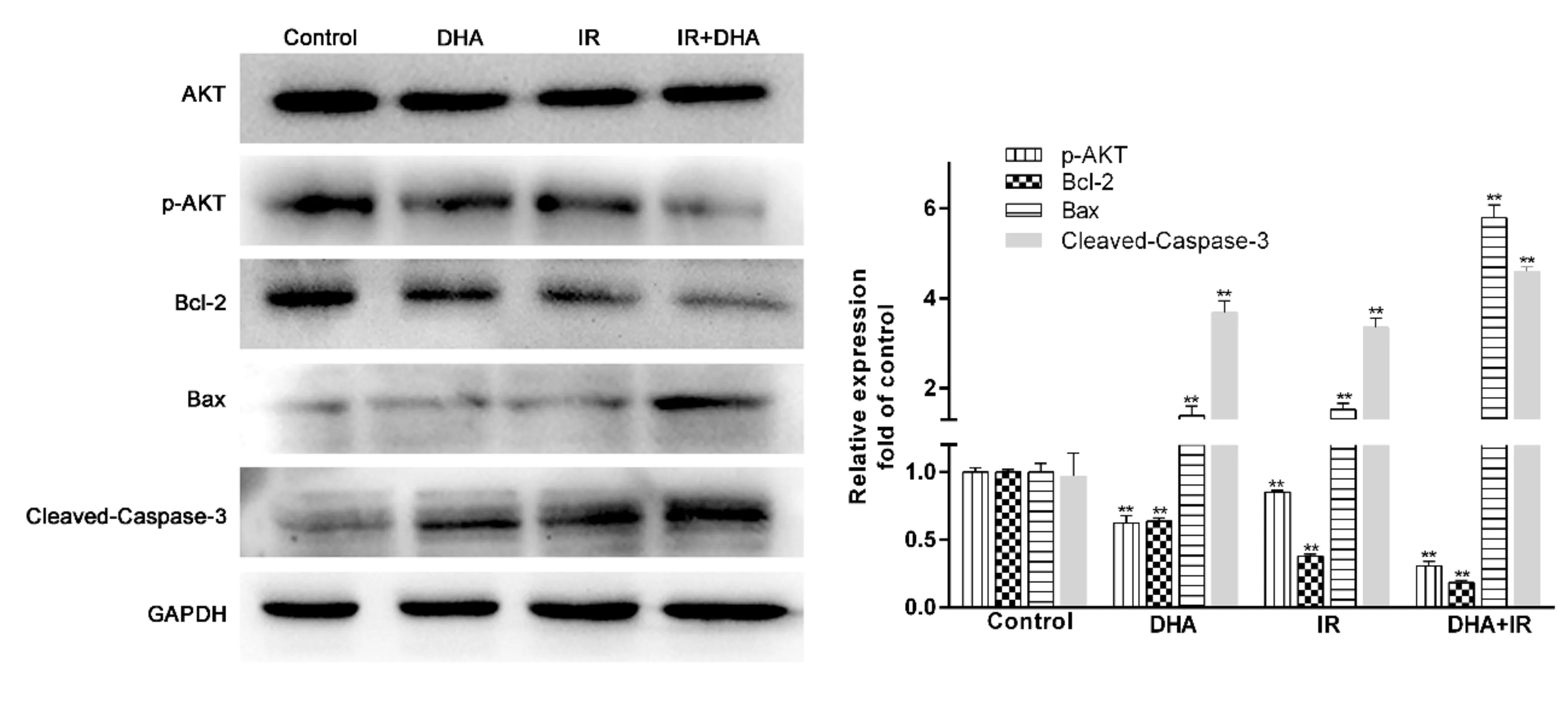
Fig.6The protein expressions of Raji cells in different groups(n=3)
**P<0.01vscontrol
Bcl-2家族通过对Bax、Bak和BH3等凋亡基因以及Bcl-2、Bcl-W和Mcl-1等抗凋亡基因的调节在细胞凋亡中发挥着核心作用[13]。同时,Bcl-2家族蛋白可调节线粒体凋亡通路,整合死亡和生存信号,最终激活半胱天冬氨酸酶的级联反应,是线粒体的完整性和线粒体触发Caspase活化的一个主要的调节者[14]。本研究发现,与IR组相比,DHA和IR联合处理显著降低Bcl-2蛋白的表达量,并增加了Bax和Cleaved-Caspase-3的表达量,这提示线粒体凋亡途径参与了DHA对Raji细胞的辐射增敏作用。此外,磷酸肌醇3-激酶(PI3K-AKT)通路在细胞调节中发挥关键作用,除了调控增殖和凋亡,这个信号途径和各种生理条件下的线粒体凋亡相关。本研究发现,与IR相比DHA+IR组的p-AKT蛋白表达量显著降低,因此推论DHA通过抑制PI3K-AKT信号通路,从而增加Raji细胞对放射的敏感性,这类似于PI3K-AKT途径在不同类型细胞凋亡中的作用[15, 16]。
总之,本研究表明DHA通过诱导细胞凋亡来增加Raji细胞对γ射线的放射敏感性,其作用机制可能是DHA通过抑制PI3K-AKT信号通路并激活了Raji细胞的线粒体凋亡途径,并且引起氧化应激反应。这体现出其作为癌症治疗中的有效放射增敏剂的巨大潜力,这种抗疟疾药物的临床应用可能拓展为淋巴瘤放射治疗辅助药物,对于寻找低毒、高效和价廉的放射增敏剂具有深远的临床价值和研究意义。此外,DHA对Raji细胞的放射增敏作用的体内实验有待进一步验证。
[1] Specht L, Dabaja B, Illidge T,etal. Modern radiation therapy for primary cutaneous lymphomas: field and dose guidelines from the International Lymphoma Radiation Oncology Group [J].IntJRadiatOncolBiolPhys, 2015, 92(1): 32-39.
[2] Specht L, Yahalom J, Illidge T,etal. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the international lymphoma radiation oncology group (ILROG) [J].IntJRadiatOncolBiolPhys, 2014, 89(4): 854-862.
[3] Efferth T. Willmar Schwabe Award 2006: antiplasmodial and antitumor activity of artemisinin--from bench to bedside [J].PlantaMed, 2007, 73(4): 299-309.
[4] Luo J, Zhu W, Tang Y,etal. Artemisinin derivative artesunate induces radiosensitivity in cervical cancer cells in vitro and in vivo [J].RadiatOncol, 2014, 9: 84.
[5] Yamachika E, Habte T, Oda D. Artemisinin: an alternative treatment for oral squamous cell carcinoma [J].AnticancerRes, 2004, 24(4): 2153-2160.
[6] Button RW, Lin F, Ercolano E,etal. Artesunate induces necrotic cell death in schwannoma cells [J].CellDeathDis, 2014, 5: e1466.
[7] Kim BM, Chung HW. Hypoxia/reoxygenation induces apoptosis through a ROS-mediated caspase-8/Bid/Bax pathway in human lymphocytes [J].BiochemBiophysResCommun, 2007, 363(3): 745-750.
[8] Putcha GV, Harris CA, Moulder KL,etal. Intrinsic and extrinsic pathway signaling during neuronal apoptosis: lessons from the analysis of mutant mice [J].JCellBiol, 2002, 157(3): 441-453.
[9] Tait SW, Green DR. Mitochondria and cell death: outer membrane permeabilization and beyond [J].NatRevMolCellBiol, 2010, 11(9): 621-632.
[10]Trachootham D, Alexandre J, Huang P. Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic approach[J].NatRevDrugDiscov, 2009, 8(7): 579-591.
[11]Hamacher-Brady A, Stein HA, Turschner S,etal. Artesunate activates mitochondrial apoptosis in breast cancer cellsviairon-catalyzed lysosomal reactive oxygen species production [J].JBiolChem, 2011, 286(8): 6587-6601.
[12]曹延萍, 王 莎, 刘 杰, 等. 线粒体凋亡途径在高糖刺激的小鼠足细胞凋亡中的作用[J]. 中国应用生理学杂志, 2013, 29(3): 244-246.
[13]Scarfo L, Ghia P. Reprogramming cell death: BCL2 family inhibition in hematological malignancies [J].ImmunolLett, 2013, 155(1-2): 36-39.
[14]Fani S, Kamalidehghan B, Lo KM,etal. Anticancer activity of a monobenzyltin complex C1 against MDA-MB-231 cells through induction of apoptosis and inhibition of breast cancer stem cells [J].SciRep, 2016, 6: 38992.
[15]Chen Q, Chen L, Wu X,etal. Dihydroartemisinin prevents liver fibrosis in bile duct ligated rats by inducing hepatic stellate cell apoptosis through modulating the PI3K/Akt pathway [J].IUBMBLife, 2016, 68(3): 220-231.
[16]李秀娟, 李玉珍, 金春婷, 等. 姜黄素作用PTEN/P13K/AKT通路诱导食管癌ECl09细胞凋亡[J]. 中国应用生理学杂志, 2015, 31(2): 174-177.
EffectsofdihydroartemisininonradiosensitivityofRajicells
ZHANG Lei2, CHENG Long-qiu2, ZHOU Zhao3, Lv Lin-lin1, LIU Ge-xiu1△
(1. Insitute of Hematology, 2. Department of Bioengineering,3. Key Laboratory for Regenerative Medicine of Ministry of Education, Jinan University, Guangzhou 510632, China)
Objective: To study the effects of dihydroartemisinin (DHA) on radiation sensitivity of Raji cells, and explore its mechanisms.MethodsCCK8 was used to determine the effect of DHA on cell viability of Raji cells; apoptosis, intracellular reactive oxygen speies(ROS) and mitochondrial membrane potential of Raji cells were detected by flow cytometry; and the protein expressions of protein kinase B(AKT), phospho-rylated-protein kinase B(p-AKT), Bcl-2 and Bax were determined by Western blot.ResultsThe cells were randomly divided into four groups: control group, DHA(5μmol/L DHA), irradiation(IR, 4 Gy), IR+DHA group (4 Gy IR+5 μmol/L DHA). Compared with the other three groups, cells in DHA+IR group exhibited lower mitochondrial membrane potential (P<0.01). While the intracellular ROS content and apoptosis rate of Raji cells in DHA+IR group were increased significantly(P<0.01). In addition, compared with the other three groups, there was no significant difference in the expression of AKT, but the phosphorylation of AKT protein were significantly inhibited and the expression of Bcl-2 protein was markedly decreased. However, the expressions of Bax and Cleaved-Caspase-3 protein were markedly increased.ConclusionDHA might activate the mitochondrial apoptotic signalviainhibiting phosphoinositide 3-kinase (PI3K/AKT) pathway and increase oxidative stress to enhance the radiosensitivity of Raji cells.
dihydroartemisinin; Raji cells; mitochondrial apoptotic signal; PI3K-AKT signal pathway
R734.2
A
1000-6834(2017)05-385-06
10.12047/j.cjap.5565.2017.093
国家自然科学基金资助项目(81270568)
2017-02-13
2017-05-31
△
Tel: 020-85220262; E-mail: tliugx@jnu.edu.cn
