慢性应激抑郁状态对大鼠外周神经内分泌因子生物节律的影响*
2017-11-01赵燕,付玉
赵 燕, 付 玉
(成都体育学院运动医学与健康学院, 四川 成都 610041)
慢性应激抑郁状态对大鼠外周神经内分泌因子生物节律的影响*
赵 燕△, 付 玉
(成都体育学院运动医学与健康学院, 四川 成都 610041)
目的探讨慢性不可预见性应激状态下大鼠外周神经内分泌因子昼夜节律的表达特点。方法成年雄性SD大鼠60只,随机分为模型组和对照组(n=30),采用束缚、摇晃、鼠笼倾斜、湿垫料、冷刺激 、拥挤(整夜)、断食或断水、夹尾、昼/夜颠倒等慢性不可预知性温和刺激结合孤养方式,每天暴露于2种应激原中饲养21 d,建立抑郁症模型。测定应激前后大鼠糖水偏爱、旷场行为及高架十字迷宫行为学变化。连续24 h分6个时间点(ZT1、ZT5、ZT9、ZT13、ZT17、ZT21)处死动物取血,每个时间点处死5只大鼠。放免法测定6个时间点血清促肾上腺皮质激素(ACTH)含量,ELISA法测定6个相同时间点血浆皮质酮(CORT)、褪黑素(MT)、血管活性肠肽(VIP)含量,采用单一余弦法比较2组大鼠上述各指标的节律周期、振幅、峰值相位、中值的变化特点。结果与对照组相比,模型大鼠体重增加值明显降低(P<0.01),各项行为学评分均显著减少(P<0.01)。慢性应激至抑郁样行为充分表达后,血浆ACTH、CORT的相位完全相反,时相大幅度提前,含量波动幅度减小,昼夜分泌节律紊乱;MT的24 h分泌节律完全丧失且整体水平下降,表达量显著降低;VIP虽仍存在24 h节律,但振幅明显降低,峰相位也延迟6 h,且表达量显著提高。结论慢性应激抑郁状态可导致大鼠外周神经内分泌激素的近日节律非同步于SCN,表现为昼夜节律性和激素分泌量的异常。
慢性不可预知性应激;抑郁样行为;神经内分泌因子;生物节律
哺乳动物的生理功能受内源性生物钟产生的近日节律(circadian rhythm)影响。这个生物钟以丘脑下部的视交叉上核(suprachiasmatic nucleus,SCN)作为主起搏器,产生与周围环境同步化的近日节律[1]。近日节律钟(circadian clock)系统由一系列具有正向或负向调节功能的钟基因及其产物构成复杂的反馈网络,并以近日基因转录/翻译调控所形成的分子振荡为机制,参与调控近日节律的生理和行为[2]。SCN主要接受来自视网膜的光信息经视网膜-下丘脑路径控制绝大多数外周节奏,其主要授时因子或同步器为光-暗周期。机体的生理功能、生化代谢、行为改变均表现出稳定的昼夜节律现象,包括睡眠-觉醒交替、体温节律及激素的分泌节律等。生物节律能保证人体更好地适应外在环境的变化,如果发生紊乱,可能诱发多种生理性和精神性疾病。研究发现人体生物周期节律的紊乱与抑郁症的发生关系密切[3,4]。抑郁症患者和动物模型均有明显的近日节律改变,主要表现为睡眠障碍,情绪日夜变化,核心体温的改变,以及激素、神经递质等的合成、分泌和代谢也存在昼夜节律的失调,特别是褪黑素及下丘脑-垂体-肾上腺(HPA)轴的时相及分泌模式的异常[5,6]。本实验就慢性应激抑郁状态下大鼠外周神经内分泌激素昼夜节律表达变化的特点进行了研究与探讨。
1 材料与方法
1.1 材料
SD雄性大鼠60只(由四川大学实验动物中心提供),研究开始时体重220±20 g;大鼠血清皮质酮(corticosterone,CORT)、褪黑素(melatonin,MT)及血管活性肠肽(vasoactive intestinal peptide,VIP)酶联免疫试剂盒均购自美国Rapid bio生物公司;大鼠血清促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)放免分析试剂盒由北京北方生物技术研究所提供;全自动多功能酶标仪(MULTISKAN MK3,Thermo,USA);电热恒温培养箱(DH4000A,天津泰斯特);漩涡振荡器MINI shaker(MH-1,kylin-Bell Lab Instruments QILINBEIER);半自动洗板机(Wellwash 4Mk2,Thermo,USA)。
1.2 方法
1.2.1 大鼠饲养及造模 60只雄性SD大鼠自由饮食,光/暗周期为12 h/12 h(ZT0,开灯时间8:00 am;ZT12,关灯时间8:00 pm),温度20℃±2℃,湿度40%~50%。实验前用旷场分析法对每只大鼠进行行为学评分,选择各项行为学指标得分相近的大鼠适应性饲养3 d后,随机分为对照组(control)及模型组(Model)(n=30),模型组单笼饲养。采用慢性温和不可预知性应激[7]方式建立抑郁模型。此方法由以下不同应激原组成,包括束缚(1 h),摇晃(130 r/min,2 h),鼠笼倾斜(整夜),湿垫料(24 h),冷刺激 (4℃,1 h),拥挤(整夜),断食或断水(24 h),夹尾(3 min),昼/夜颠倒(24 h),大鼠每天暴露于2种应激原中,顺序随机,共21 d,每组分别饲养于独立房间,避免组间干扰。
1.2.2 体重增加量测定 分别测量记录大鼠实验前1 d和行为学测试后体重,然后计算比较各组大鼠体重增长量。
1.2.3 糖水消耗实验 实验前48 h,训练大鼠适应1%蔗糖水,然后断水4 h,所有大鼠单笼放置,同时给予事先称重的两瓶水,分别为1%蔗糖水和纯水。测定1 h糖水和纯水消耗量,计算糖水引用百分比。
1.2.4 旷场实验 实验装置为一灰色、顶部无盖、内壁均为黑色的木制敞箱,大小约100 cm×100 cm×50 cm,底面划分成25个方格(20 cm×20 cm)。实验时将大鼠轻置于敞箱中心方格内,观察5 min内活动情况。观察指标包括水平运动即穿越格数(4爪均进入方格);垂直运动即后肢直立次数(两前爪腾空或攀附墙壁);中央格停留时间:从放入开场试验箱中心开始至大鼠进入外围格的时间。一次实验完成后彻底清洁敞箱再进行下一只大鼠观察。
1.2.5 高架十字迷宫实验 迷宫由4个臂组成,两个相反方向的开放臂50×10 cm,两个相反方向的封闭臂50×10×40 cm,顶部敞开,开放臂与封闭臂交叉处有一10×10 cm的中央敞开部,封闭臂和开放臂的底部离地面50 cm。将实验大鼠放于迷宫中央,面向一个开放臂,记录5 min内大鼠的活动情况。观察指标包括5 min内四肢全部进入开放臂(open-arms)或闭臂(enclosed-arms)的次数,及在两臂停留时间。计算大鼠进入开臂的次数(open-arms entries, OE)和在开臂滞留时间(open-arms time, OT)分别占两臂总次数(total entries, TE)和总时间(total time, TT)的百分比。实验完成后将小鼠取出,将两臂清理干净,喷洒酒精除去气味,再进行下1只大鼠测试。
1.2.6 标本制备及指标检测 行为学检测结束后第2天,连续24 h分6个时间点(ZT1、ZT5、ZT9、ZT13、ZT17、ZT21)断头处死大鼠,每个时间点处死5只,取血收集于EDTA处理的塑料管中,室温静置10 min,2 500 r/min离心10 min后吸取上层血清,分装放入-80℃低温冰箱保存备用。放射免疫法检测6个时间点血清ACTH含量;ELISA法检测6个相同时间点血清CORT、MT、VIP含量,具体操作按试剂盒说明书所述步骤进行。
1.3 统计学处理
2 结果
2.1 CUMS对大鼠体重的影响
造模前2组大鼠体质量无明显差异。CUMS造模后模型组大鼠体质量及其增长值明显下降 (P<0.01,表1)。
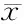

GroupPre-modelingPost-modelingWeightgainControl233.65±13.53312.29±15.4278.42±11.16Model230.33±16.21205.63±24.09**-25.20±17.34**
**P<0.01vscontrol group
2.2 CUMS对大鼠行为学的影响
与对照组比较,模型组大鼠糖水偏好度明显降低(P<0.01),水平运动和垂直运动评分及中央格停留时间均显著下降(P<0.01);高架十字迷宫结果显示,模型大鼠在OE、OT、TE和TT的百分比方面均显著低于对照组(P<0.01,表2、表3)。
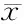

GroupSucrosepreference(%)Open-FieldScoreHorizontalmovementVerticalmovementTimeincentralgrid(s)Control80.28±15.77106.13±16.8616.58±5.320.9±0.84Model51.64±19.26**61.81±20.38**8.9±4.33**0.25±1.03**
**P<0.01vscontrol group
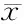

GroupOE(time)OT(s)OE/TE(%)OT/TT(%)Control1.63±0.5128.99±4.6624.57±6.3313.26±4.51Model0.8±0.74**13.07±6.45**12.41±5.27**4.70±3.32**
OE: Open-arms entries; OT: Open-arms time; TE: Total entries; TT: Total entries
**P<0.01vscontrol group
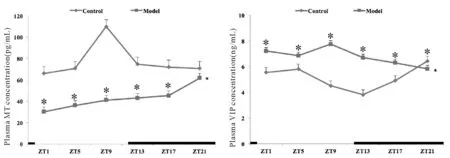
2.32组大鼠不同时间点血清ACTH、CORT、MT、VIP含量及昼夜节律参数特征比较
对照组大鼠血清中ACTH、CORT、MT、VIP含量具有明显的昼夜节律。慢性应激至抑郁样行为充分表达后,模型大鼠血清ACTH、CORT的昼夜节律紊乱,峰相位与对照组完全相反,时相大幅度提前,且振幅降低。MT的24 h分泌节律也完全丧失,表达量显著降低,峰相位大幅提前14 h,且振幅减小,整体水平下调。血清VIP的24 h表达量显著高于对照组,虽仍存在昼夜节律,但节律振幅降低,峰相位也延迟6 h(表4、表5,图1、图2)。
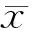

GroupACTHCORTControl89.461±2.47477.365±4.225Model96.949±2.23183.918±3.025
ACTH: Adrenocorticotropic hormone; CORT: Glucocorticoid
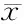

GroupMTVIPControl5.769±0.16764.420±1.823Model2.773±0.15881.120±2.055
MT: Melatonin; VIP: Vasoactive intestinal peptide

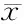
ZT: Zeitgeber time; ACTH: Adrenocorticotropic hormone; CORT: Glucocorticoid
*P<0.05vscontrol group
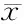
ZT: Zeitgeber time; MT: Melatonin; VIP: Vasoactive intestinal peptide
*P<0.05vscontrol group
3 讨论
CUMS是一种被广泛认可的抑郁症动物模型,具有良好的外观效应、预测性和建构效度。本研究采用CUMS结合孤养的方法建立慢性应激抑郁大鼠模型,观察大鼠抑郁样行为,并使用糖水实验、开场实验和高架十字迷宫进行抑郁模型动物的行为学评价。在糖水消耗实验中,与对照组比较,21 d CUMS处理的模型大鼠糖水消耗量及偏爱度均显著下降,表明CUMS应激后的大鼠表现出快感缺失,提示其出现抑郁样的典型症状。旷场实验中,水平和直立运动可以反映动物的探究性行为,中央格停留时间的长短可衡量大鼠的焦虑情绪,与对照组相比,21 d CUMS刺激后,模型组大鼠活动力明显降低,表现为水平运动、直立运动及中央格停留时间均显著下降。本研究还采用高架十字迷宫来测试大鼠情绪的变化。结果显示,模型大鼠在OE、OT分别占TE和TT的百分比方面显著低于对照组,说明CUMS慢性刺激对大鼠的焦虑情绪有明显影响。以上行为学改变与抑郁症患者所表现的精神运动改变、兴趣减退及快感丧失有一定程度的相似性,表明CUMS致大鼠出现抑郁样行为。
研究发现,抑郁症发病常伴有神经内分泌功能的改变,特别是褪黑素及HPA轴的异常。MT是松果体分泌的神经内分泌激素,其生物学作用涉及镇静、睡眠-觉醒周期、体温调节、情绪性行为调节及内分泌、免疫系统等多个方面[8]。生理状态下褪黑素与生物节律调节密切相关。作为一种重要的内分泌输出信号,MT被认为是机体生物钟的内源性同步器,可在昼夜节律中同步化SCN和外周组织[9]。MT将松果腺感受的光-暗信号传递到SCN,与SCN上的受体结合,通过受体后机制发挥对生物节律的动态调节。MT的分泌存在明显的昼夜节律,能够稳定和加强昼夜节律并保持相互的相位关系[10]。研究显示MT与抑郁症密切相关:抑郁症患者血浆褪黑素及其代谢产物水平明显低下,皮质醇/MT比值增高;抑郁发作时MT分泌量、分泌节律位相及幅度均异常;一般认为,发作期间MT分泌下降,缓解后MT分泌再度上升[11,12]。本实验通过对大鼠血清MT昼夜含量的测定及halberg余弦分析,结果发现对照组大鼠血浆褪黑素水平显示了强大的昼夜节律。21 d的CUMS刺激后,模型大鼠MT的24 h分泌节律完全丧失,表达量显著降低,整体水平下调,且波动幅度减少;MT的昼夜节律亦紊乱,表现为振幅减小,峰相位提前14 h,这种由CUMS诱导的血浆褪黑素水平的降低与以往关于抑郁症患者的临床报道相一致[13]。
HPA轴是人体应对应激的重要神经内分泌系统,其在个体面对压力源时, 可以通过一系列途径使激素水平升高,从而使人体产生应激反应。生理状态下HPA轴活性呈近日节律性变化,且ACTH的分泌节律与CORT的昼夜分泌节律变化同步[14]。CORT作为HPA轴的终产物,其循环分泌主要通过HPA轴受SCN的调节,并在SCN和外周振荡器之间起到沟通相位信息的作用[15]。抑郁症患者多表现为HPA轴功能亢进,昼夜节律呈现紊乱状态,如CORT的时相改变、分泌的不稳定模式。本实验结果表明:慢性应激至抑郁样行为充分表达后,模型组大鼠血清ACTH、CORT的昼夜分泌节律紊乱,含量波动幅度减小;出现昼夜节律的完全倒置,峰相位也与对照组完全相反,且时相大幅度提前,振幅降低。
研究发现抑郁状态下可出现胃肠功能的紊乱,如精神心理障碍与功能性胃肠病的共病率约在42%~61%,最常见的是焦虑障碍、心境障碍(包括重性抑郁)等,多数人精神心理障碍的起病先于或同时于胃肠道症状的发生。其相互作用的机制与脑-肠轴的调节障碍有关。VIP是与胃肠道功能密切相关的脑肠肽,分布于中枢神经系统以及胃肠道粘膜、胃肠壁神经丛。实验证据表明VIP可以抑制小肠传导[16]。既往研究也发现,抑郁症伴肠易激综合征患者可出现血浆VIP含量的明显升高,这种抑郁状态下的异常分泌,进一步导致胃肠动力和功能的改变[17]。同时VIP也是一个公认的SCN的同步肽,可在昼夜节律中同步化SCN和外周组织[18]。本实验结果发现经过21 d的CUMS刺激后,应激大鼠血清VIP的24 h表达量与对照组相比明显增高,昼夜含量波动幅度降低;虽仍存在昼夜节律,但明显减弱,振幅也低于对照组,峰相位延迟约6 h。
综上所述,CUMS可引起大鼠外周神经内分泌激素的近日节律非同步于SCN,出现昼夜节律性和激素分泌量的异常,提示生物节律的紊乱可能在抑郁症的发病机理中发挥着重要的作用。而抑郁状态下,生物节律的中枢调控机制还存在许多未知,在后续研究中拟从分子水平进一步探讨生物节律异常与抑郁症发生的相关性,并开展有效干预措施的研究,提高机体对精神性应激损伤的抵御能力。
[1] Nikaido T, Akiyama M, Moriya T,etal. Sensitized increase of period gene expression in the mouse caudate/putamen caused by repeated injection of methamphetamine[J].MolPharmacol, 2007, 59(4): 894-900.
[2] Reppert SM, Weaver DR. Molecular analysis of mammalian circadian rhythms[J].AnnuRevPhysiol, 2008, 63: 647-676.
[3] Albrecht U. Circadian clocks and mood-related behaviors[J].HandbExpPharmacol, 2013, (217): 227-239.
[4] Monteleone P, Martiadis V, Maj M. Circadian rhythms and treatment implications in depression[J].ProgNeuropsychopharmacolBiolPsychiatry, 2011, 35(7): 1569-1574.
[5] Humphreys D, Schlesinger L, Lopez M,etal. Interleukin-6 production and deregulation of the hypothalamic-pituitary-adrenal axis in patients with major depressive disorders[J].Endocrine, 2006, 30(3): 371-376.
[6] Koenigsberg HW, Teicher MH, Mitropoulou V,etal. 24-h Monitoring of plasma norepinephrine, MHPG, cortisol, growth hormone and prolactin in depression[J].JPsychiatrRes, 2004, 38(5): 503-511.
[7] Willner P. Validity, reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation[J].Psychopharmacology(Berl), 1997, 134(4): 319-329.
[8] 景会锋, 王小梅. 褪黑素对过度训练大鼠胃肠动力及血浆中应激激素水平的影响[J]. 中国应用生理学杂志, 2015, 31(5): 411-413.
[9] Wilczynski W, Lutterschmidt DI. Biological Rhythms: Melatonin Shapes the Space-Time Continuum of Social Communication[J].CurrBiol, 2016, 26(19): R892-895.
[10]Bob P, Fedor-Freybergh P. Melatonin, consciousness, and traumatic stress[J].JPinealRes, 2008, 44(4): 341-347.
[11]Seidman SN, Weiser M. Testosterone and mood in aging men[J].PsychiatrClinNorthAm, 2013, 36(1): 177-182.
[12]Guardiola-Lemaitre B, De Bodinat C, Delagrange P,etal. Agomelatine: mechanism of action and pharmacological profile in relation to antidepressant properties[J].BrJPharmacol, 2014, 171(15): 3604-3619.
[13]Crasson M, Kjiri S, Colin A,etal. Serum melatonin and urinary 6-sulfatoxymelatonin in major depression[J].Psychoneuroendocrinology, 2004, 29(1): 1-12.
[14]Spiga F, Waite EJ, Liu Y,etal. ACTH-dependent ultradian rhythm of corticosterone secretion [J].Endocrinology, 2011, 152(4): 1448-1457.
[15]Balsalobre A, Brown SA, Marcacci L,etal. Resetting of circadian time in peripheral tissues by glucocorticoid signaling[J].Science, 2000, 289(5488): 2344-2347.
[16]Li S, Fei G, Fang X,etal. Changes in Enteric Neurons of Small Intestine in a Rat Model of Irritable Bowel Syndrome with Diarrhea[J].JNeurogastroenterolMotil, 2016, 22(2): 310-320.
[17]Han B. Correlation between gastrointestinal hormones and anxiety-depressive states in irritable bowel syndrome[J].ExpTherMed, 2013, 6(3): 715-720.
[18]Aton SJ, Colwell CS, Harmar AJ,etal. Vasoactive intestinal polypeptide mediates circadian rhythmicity and synchrony in mammalian clock neurons[J].NatNeurosci, 2005, 8(4): 476-483.
Effectsofchronicstressdepressiononthecircadianrhythmofperipheralneuroendocrinehormoneofrats
ZHAO Yan△, FU Yu
(College of Sports Medicine and Health, Chengdu Sport University, Chengdu 610041, China)
Objective: To investigate the circadian rhythmic alterations of plasma hormone and peptide induced by chronic unpredictable mild stress(CUMS).MethodsSixty male SD rats were randomly divided into two groups, model group and control group(n=30). Rats in model group
CUMS procedure (restraint, rotation, cage tilt, wet sawdust, cold, crowding, food or water deprivation, clamp tail and reverse light/dark cycle). Rats were randomly exposed to two stressors every day for 3 weeks. Exploratory locomotor activity was assessed by open field test and anxiety-like behavior was measured by elevated plus-maze test, and lack of pleasure by sucrose preference test. Blood samples were collected at each of six time points zeitgeber time (ZT1, 5, 9, 13, 17 and 21), 5 rats were executed at each time point. Plasma concentrations of corticosterone(CORT), melatonin (MT) and vasoactive intestinal peptide (VIP) were detected by ELISA kits, and plasma concentration of adrenocorticotropic hormone (ACTH) was determined by radioimmunoassay. The circadian rhythm changes of serum CORT, MT, VIP and ACTH in each group were compared by using cosinor.ResultsCompared with control group, locomotor activity, rearing, weight gain and sucrose consumption in model group were decreased significantly. The values of the percentage of open-arm time (OT) and open arm entries (OE) were obviously lower in the model group than those in the control group. The circadian rhythm of plasma ACTH and CORT showed an obvious disorder, including phase advance and decrease in amplitude, and markedly blunted circadian rhythm. There also showed a markedly blunted circadian rhythm and decreased levels of plasma MT. VIP still had 24-hour rhythm, but the amplitude was significantly lower, peak phase also delayed for six hours, and expression was significantly higher.ConclusionCUMS induces these peptides and hormones desynchronized from suprachiasmatic nucleus(SCN), manifested as the disturbed circadian rhythms and the abnormal hormone secretion of these synchronizers.
chronic unpredictable mild stress; depressive-like behavior; neuroendocrine factor; circadian rhythms
R395.6
A
1000-6834(2017)05-398-05
10.12047/j.cjap.5529.2017.096
成都体育学院博士基金项目(15YJBS05);成都体育学院科研骨干出国进修计划(2016-2017);四川省教育厅重点科研项目(13za0074);四川省教育厅创新团队项目(13TD0010);国家体育总局运动医学重点实验室暨运动医学四川省重点实验室资助基金(2014CTYY005)
2016-11-28
2017-07-03
△
Tel: 028-85090367; E-mail: miniezy@126.com
