两种酵母发酵海红果酒的相互作用研究
2017-10-24蒲鹏飞彭任芳杜姣姣闫晓哲
蒲鹏飞,杨 辉*,彭任芳,杜姣姣,闫晓哲
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
两种酵母发酵海红果酒的相互作用研究
蒲鹏飞,杨 辉*,彭任芳,杜姣姣,闫晓哲
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
探究了酿酒酵母(Saccharomyces cerevisiae)FY2的发酵上清液和细胞浆液对柠檬形克勒克酵母(Klockera apiculata)生长的影响,以单一菌种发酵作为对照,通过测定两种酵母不同比例混合发酵中乙醇生成量、CO2排放量及其酵母菌数量变化探索其在海红果酒发酵过程中的相互作用。结果表明,酿酒酵母FY2的发酵上清液对柠檬形克勒克酵母的生长具有抑制作用且对2 g/L的胰蛋白酶处理和70℃热处理敏感;混合发酵36 h后柠檬形克勒克酵母的生长受到抑制,发酵至108 h后已检测不到柠檬形克勒克酵母。
酿酒酵母;柠檬形克勒克酵母;混菌发酵;相互作用;海红果酒
在果酒自然发酵过程中往往有多种酵母的共同参与,依据酵母在发酵过程中所起的作用,可将酵母分为两大类:发酵效率高的酿酒酵母(Saccharomyces cerevisiae)和发酵效率较低但对风味有重要贡献的非酿酒酵母,它们在酒精及香味物质形成等诸多方面起着重要作用[1-4]。葡萄酒发酵是典型的多菌种混合发酵,葡萄皮上生长着多种酵母菌,只有能够很好适应葡萄果所营造的营养环境,且相互协作的酵母才能优势繁殖生长于葡萄皮上,在葡萄酒发酵过程中,这些酵母是最好的葡萄酒发酵剂,酿造中所接种的酵母只是对某种酵母作用进行了人为的强化,正因为如此,葡萄酒具有口感复杂、香味协调等诸多优点,相比较而言,采用鲜榨汁纯种发酵的海红果酒、苹果酒、梨酒等口感寡淡,缺乏复杂感,酒体不丰满。
通过混合发酵可以快速的判定微生物间的相互作用类型,探索其作用机理,加深对发酵本质的认识和理解,进而指导人们高效利用微生物的作用进行发酵,改善和提高发酵食品的质量[5]。如基于嗜热链球菌和保加利亚乳杆菌的协同产酸作用,它们被广泛应用于发酵酸奶,产品营养丰富,口感好[6]。
非酿酒酵母曾被认为是果酒酿造过程中的腐败酵母,对酒的品质有不利的影响,但是对果酒酿造过程中微生物的动态检测和果酒感官评价发现非酿酒酵母对果酒品质有着至关重要的作用[7-9]。近年来的研究报道就多次证明非酿酒酵母柠檬形克勒克酵母(Klockera apiculata)存在于葡萄酒及其他果酒的发酵过程中[10-11],因此本试验通过混合发酵探究了海红果酒酿造过程中酿酒酵母和柠檬形克勒克酵母的相互作用,以期提高海红果酒的品质,对其他果酒酿造也提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
海红果浓缩汁:府谷县聚金邦农产品加工有限公司。
酿酒酵母(Saccharomyces cerevisiae)FY2:本实验室保藏(保藏方式为冻干粉);柠檬形克勒克酵母(Kloechera apiculata):中国工业微生物菌种保藏中心,菌种编号为31232,提供方式为冻干管。
种子培养基为酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基;发酵培养基为海红果浓缩汁经4倍稀释所得,还原糖含量130.3 g/L,总糖含量179.8 g/L,总酸含量15.1 g/L,pH 3.11。
1.1.2 试剂
硫酸铜、氢氧化钠、酒石酸钾钠、无水乙醇、盐酸(纯度≥98%):天津市科密欧化学试剂有限公司;琼脂粉、葡萄糖、酵母浸粉、蛋白胨:北京奥博星生物技术有限责任公司;胃蛋白酶(效价1∶10000):南京奥多福尼生物科技有限公司。
1.2 仪器与设备
Biosafer250UP手持式超声波细胞破碎仪:赛飞(中国)有限公司;SP-756P紫外可见分光光度计:上海光谱仪器有限公司;PHS-3C型pH计:上海仪电科学仪器股份有限公司;GL20高速冷冻离心机:长沙英泰仪器有限公司。
1.3 方法
1.3.1 种子培养液
取保藏的酵母冻干粉少量于含有2%葡萄糖的无菌水中,37℃恒温水浴复水25 min;取2%的菌悬液接种至YPD培养基上28℃培养24 h,涂布于YPD固体培养基上,28℃培养48 h,在YPD固体培养基上挑取菌落特征明显的酵母菌株接种于YPD液体培养基中,于28℃、150 r/min条件下培养24 h制成种子液。
1.3.2 柠檬形克勒克酵母对酒精的耐受性
将柠檬形克勒克酵母种子液以2%的接种量分别接种于酒精体积分数分别为0、2.4%、3.6%、4.8%、6.0%的YPD液体培养基中,23℃条件下培养36 h左右,使用紫外可见分光光度计测定不同酒精体积分数下的柠檬形克勒克酵母的OD600nm值。
1.3.3 酿酒酵母产生抑制物对柠檬形克勒克酵母生长的影响
酿酒酵母FY2在海红果汁中发酵48 h后,离心取上清,0.22 μm微孔膜过滤除菌获得无细胞滤液,并收集酵母细胞。细胞破碎仪破碎细胞后,分别在细胞破碎液及发酵上清液中补加YPD培养基,超滤除菌。接入柠檬形克勒克酵母,23℃静置培养。做柠檬形克勒克酵母数-发酵时间曲线,探究酿酒酵母FY2细胞破碎液或发酵上清液2种培养基对柠檬型克勒克酵母生长的影响。
1.3.4 酿酒酵母产生抑制物对蛋白酶和热的敏感性
取经0.22 μm微孔滤膜过滤的酿酒酵母FY2上清液,经2 g/L的胰蛋白酶处理和70℃热处理两种方式,并补充YPD培养基,接入柠檬形克勒克酵母,23℃培养72 h,测定柠檬形克勒克酵母的生长曲线。
1.3.5 发酵特性试验
将柠檬形克勒克酵母和酿酒酵母FY 2分别接种于海红果汁,培养24 h,每3 h手动摇瓶一次,按2%的接种量接入800 mL海红果汁中于23℃静置培养8 d。柠檬型克勒克酵母∶酿酒酵母FY2按以下不同接种方式:(1)分别单独培养24 h后,按照1∶1比例接种;(2)分别单独培养24 h后,按照3∶1比例接种;(3)分别单独培养24 h后,按照7∶1比例接种。每隔24 h取样,测定不同培养方式下发酵液中还原糖、总酸、酒精度、酵母菌数等。
1.3.6 测定方法
发酵液理化指标:pH测定采用pH计;还原糖、总糖采用菲林试剂法测定;总酸采用电位滴定法测定;乙醇含量采用密度瓶法测定。
酵母计数:采用平板菌落计数法,所用培养基为改良的麦芽糖琼脂培养基:添加40 mg/L的溴酚蓝,pH 4.6。在该培养基上柠檬形克勒克酵母的菌落泛蓝,酿酒酵母FY2菌落则呈黄色[10]。
酵母发酵性能:采用CO2失重法[10]。每隔24 h称质量一次,直至发酵结束。
2 结果与分析
2.1 柠檬形克勒克酵母对酒精的耐受性
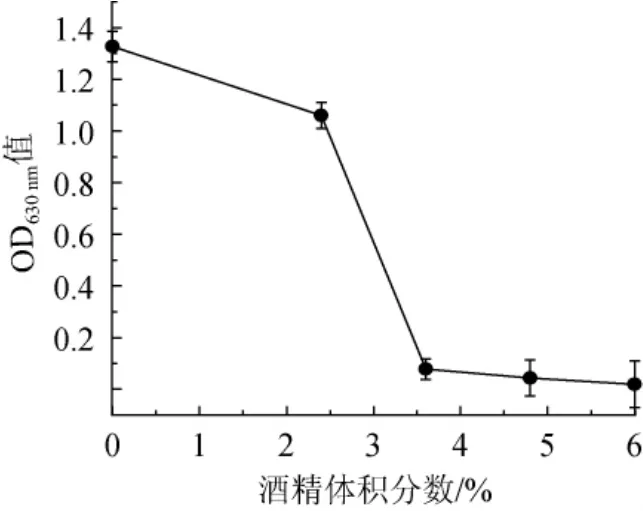
图1 柠檬形克勒克酵母对酒精的耐受性Fig.1 Tolerance ofKlockera apiculataon ethanol
如图1所示,酒精体积分数超过3.6%的培养液对柠檬形克勒克酵母的生长有极强的抑制作用,这可能与非酿酒酵母细胞膜的不饱和脂肪酸比率较低有关。研究表明,由于乙醇的极性较大,结合在磷脂极性头部,因而使磷脂双分子层变得松散,乙醇透过细胞膜对菌体产生毒害作用,而对乙醇等极性溶剂耐受性强的微生物,其细胞膜不饱和脂肪酸的比率较高[12-13]。结果表明,柠檬形克勒克酵母不能单独完成果酒的酿造,需要采用柠檬形克勒克酵母和酿酒酵母的混菌发酵或顺序发酵完成果酒的酿造。
2.2 酿酒酵母抑制柠檬形克勒克酵母生长机制的初步探究
2.2.1 酿酒酵母产生抑制物在细胞中的定位研究
由图2可知,酿酒酵母FY2细胞破碎后的胞内物质对柠檬形克勒克酵母的生长无明显影响;而酵母上清液对柠檬形克勒克酵母的生长有抑制作用,发酵48~72 h时,柠檬形克勒克酵母数急剧增长,至72 h时柠檬形克勒克酵母数已无明显变化,结果表明,酿酒酵母在生长过程中会产生某些胞外物质对柠檬形克勒克酵母的生长具有抑制作用。
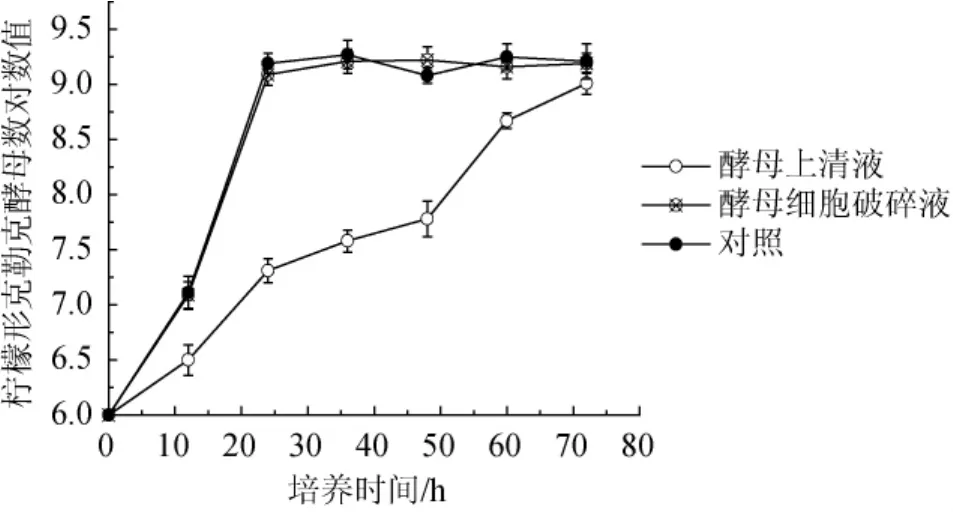
图2 酿酒酵母FY2细胞破碎液及发酵上清液对柠檬形克勒克酵母生长的影响Fig.2 Effects ofS.cerevisiaefragmentized liquid and its supernatant on the growth ofK.apiculata
2.2.2 酿酒酵母产生抑制物对蛋白酶和热的敏感性
有研究表明,酿酒酵母会产生某些肽类物质对其他微生物的生长具有毒害作用[14-15]。由图3可知,上清液经蛋白酶处理及热处理后,抑制作用有了很大程度的解除。分析其原因可能是因为蛋白酶降解了蛋白类抑制物,形成氨基酸;经热处理后上清液出现了絮状沉淀,可能是因为高温使胞外蛋白发生变性,从而失去了原来的抑制活性。
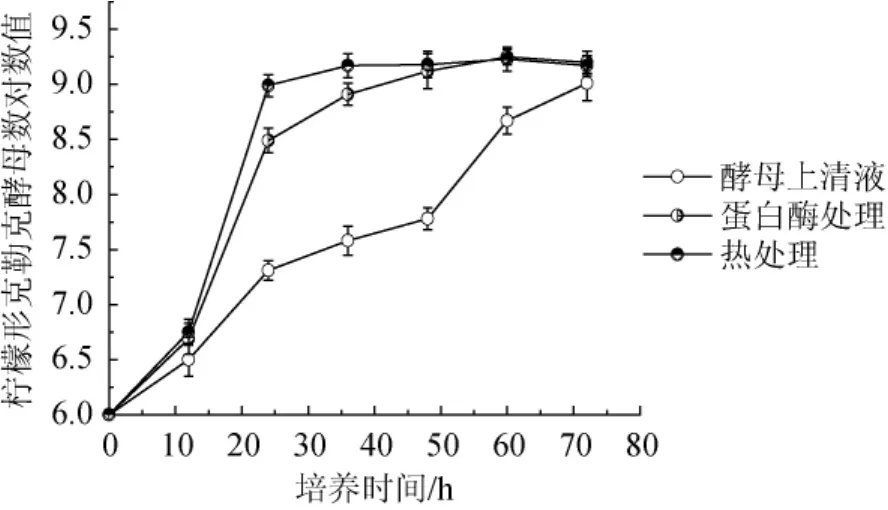
图3 酿酒酵母FY2发酵上清液对蛋白酶和热处理的敏感性Fig.3 Sensitivity of the supernatant produced byS.cerevisiaeon protease and heat treatment
2.3 发酵特性试验
2.3.1 发酵液总酸含量及pH变化
总酸含量的变化是酵母产酸和分解有机酸的动态结果,由图4A可知,酿酒酵母FY2的单菌发酵总酸含量一直处于缓慢下降趋势,说明酿酒酵母FY2分解有机酸的能力高于产酸能力;柠檬形克勒克酵母单菌发酵总酸含量72 h前急剧上升,之后缓慢下降,说明柠檬形克勒克酵母在菌体生长繁殖阶段产生大量的有机酸。3种比例的混菌发酵中,在发酵前48 h总酸含量都呈现了上升的趋势,随着柠檬形克勒克酵母接种比例的增大,总酸含量上升趋势越明显,并且不同比例混菌发酵发酵前48 h产酸均高于柠檬形克勒克酵母的单菌发酵。出现这种现象的原因可能是因为混菌发酵中,酿酒酵母和克勒克酵母彼此争夺营养和空间,柠檬形克勒克酵母为了抑制竞争对手的生长繁殖,分泌大量的酸性物质;并且因为酿酒酵母的产乙醇能力极强,在发酵至48 h时,混菌发酵液中的乙醇浓度已经达到了柠檬形克勒克酵母所能耐受的最高量,发酵48 h之后柠檬形克勒克酵母逐渐死亡,因此发酵液总酸含量急剧下降,到发酵结束时,混菌发酵和酿酒酵母单菌发酵的总酸含量基本一致。结果表明,将柠檬形克勒克酵母应用于果酒酿造中,运用柠檬形克勒克酵母和酿酒酵母的顺序发酵方式,对酸度欠佳的果酒有极大的好处。
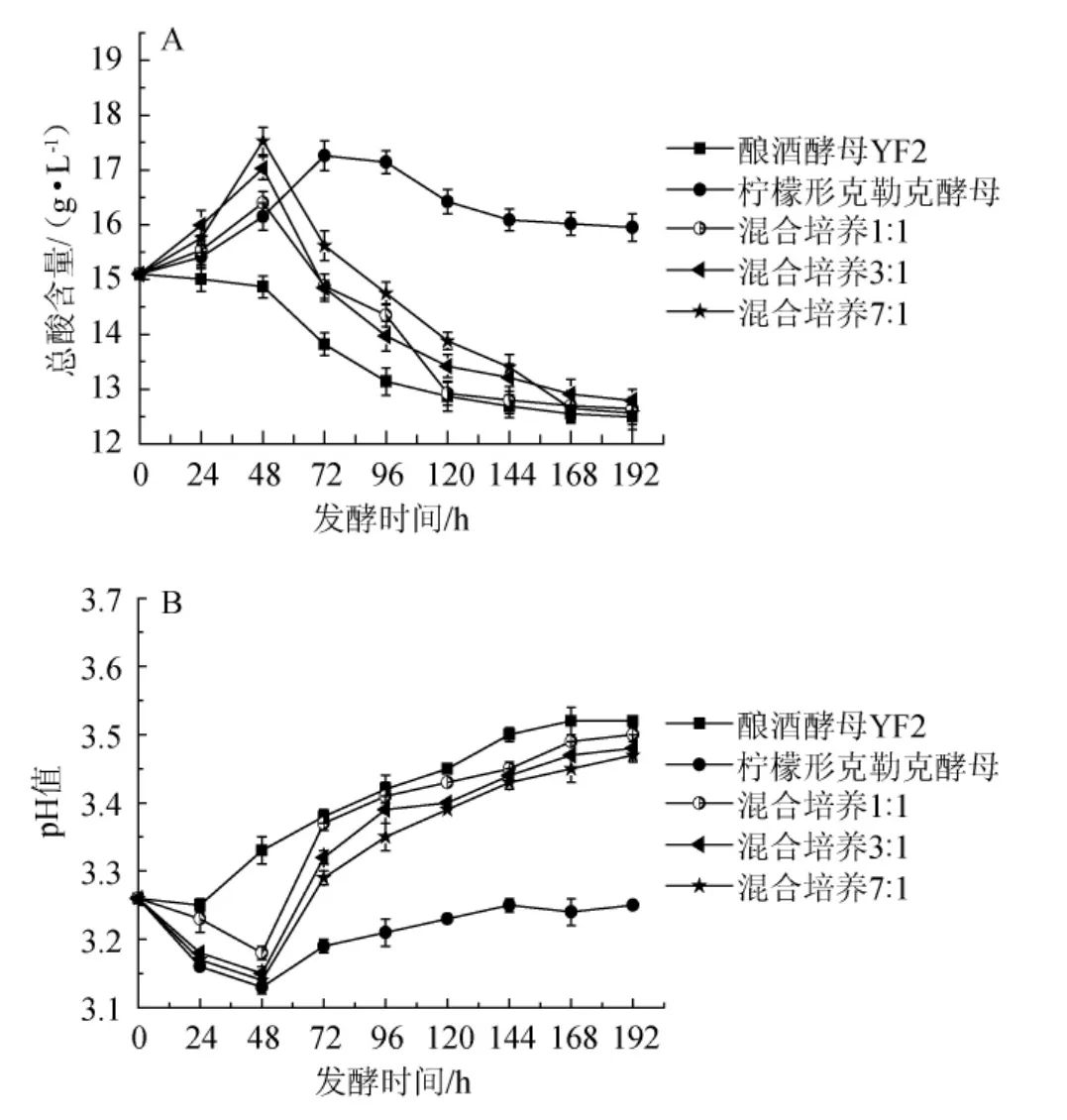
图4 发酵过程中总酸含量(A)及pH(B)变化Fig.4 Change of total acid contents(A)and pH(B)during fermentation
由图4B可知,酿酒酵母FY2单菌发酵整个发酵期间pH一直处于上升趋势,并且高于柠檬形克勒克酵母单菌发酵和不同比例混菌发酵的pH。柠檬形克勒克酵母单菌发酵相比其他发酵方式,pH一直处于较低的位置,并且在不同比例混菌发酵中,柠檬形克勒克酵母接种比例越高,发酵过程中pH越低。柠檬形克勒克酵母的产酸能力非常强,因此使发酵液pH维持在较低水平,而酿酒酵母产酸较前者弱,并且产乙醇能力极强,从而使得发酵液pH上升较快。
2.3.2 发酵液还原糖及乙醇含量
发酵过程中发酵液还原糖的变化是判断酵母生长的重要指标,由图5A可知,酿酒酵母FY2单菌发酵还原糖在72h就降至8 g/L,柠檬形克勒克酵母单菌发酵至第192小时时还原糖含量为64 g/L。3种不同比例的混菌发酵在发酵至120 h后还原糖含量都已降至7 g/L左右。
乙醇含量的变化是酵母利用糖无氧呼吸的结果,斜率反应酵母菌发酵生产乙醇能力的变化。由图5B可知,酿酒酵母FY2单菌发酵产乙醇性能最高,3种比例的混菌发酵产乙醇基本呈现一致的变化幅度,发酵结束时酒精体积分数达到了10%左右。柠檬形克勒克酵母单菌发酵整个发酵期间发酵效率低下,发酵至第192小时时乙醇含量为2.46%,此时残糖应该为90g/L左右[7],这与检测到的残糖64g/L相差较大,因此推断柠檬形克勒克酵母利用了一部分糖产生了其他的代谢产物而并非酒精。
2.3.3 酵母数量的动态变化
由图6A可知,在柠檬形克勒克酵母纯种发酵的前24h,柠檬形克勒克酵母数量一直处于上升趋势,在24 h时到达2.1×109CFU/mL,此后酵母数量没有显著变化。柠檬形克勒克酵母与酿酒酵母FY2的3种比例混合发酵过程中,柠檬形克勒克酵母的数量变化趋势基本呈现一致性,并且混合发酵中柠檬形克勒克酵母数量一直低于柠檬形克勒克酵母纯种发酵的酵母数量,在发酵36 h时酵母数量达到最大值;36~72 h时,柠檬形克勒克酵母数量逐步下降;72 h之后,柠檬形克勒克酵母数量急剧下降,到发酵结束时,酵母数量非常少。这可能是因为在混菌发酵至后期,酿酒酵母产乙醇含量增加,而柠檬形克勒克酵母不耐受超过酒精体积分数3%的发酵环境;另一方面原因可能是酿酒酵母分泌某种蛋白类物质抑制了柠檬形克勒克酵母的生长;因此36 h后柠檬形克勒克酵母数急剧下降。
由图6B可知,在酿酒酵母FY2纯种发酵的前24 h,酿酒酵母的数量一直处于上升趋势,在24 h时酵母数量达到4.2×109CFU/mL,此后酵母数量没有显著变化。3种比例混合发酵过程中,酿酒酵母的数量变化趋势基本也呈一致性。发酵0~96 h,混合发酵中酿酒酵母数量急剧增长,但是从96 h以后酵母数量基本稳定并且和酿酒酵母单菌发酵趋于一致。出现这一现象的原因可能是伴随着柠檬形克勒克酵母数量的急剧下降,为酿酒酵母留下了足够的营养物和空间,因此混菌发酵后期酿酒酵母数能达到与酿酒酵母单菌发酵相同的数量级。
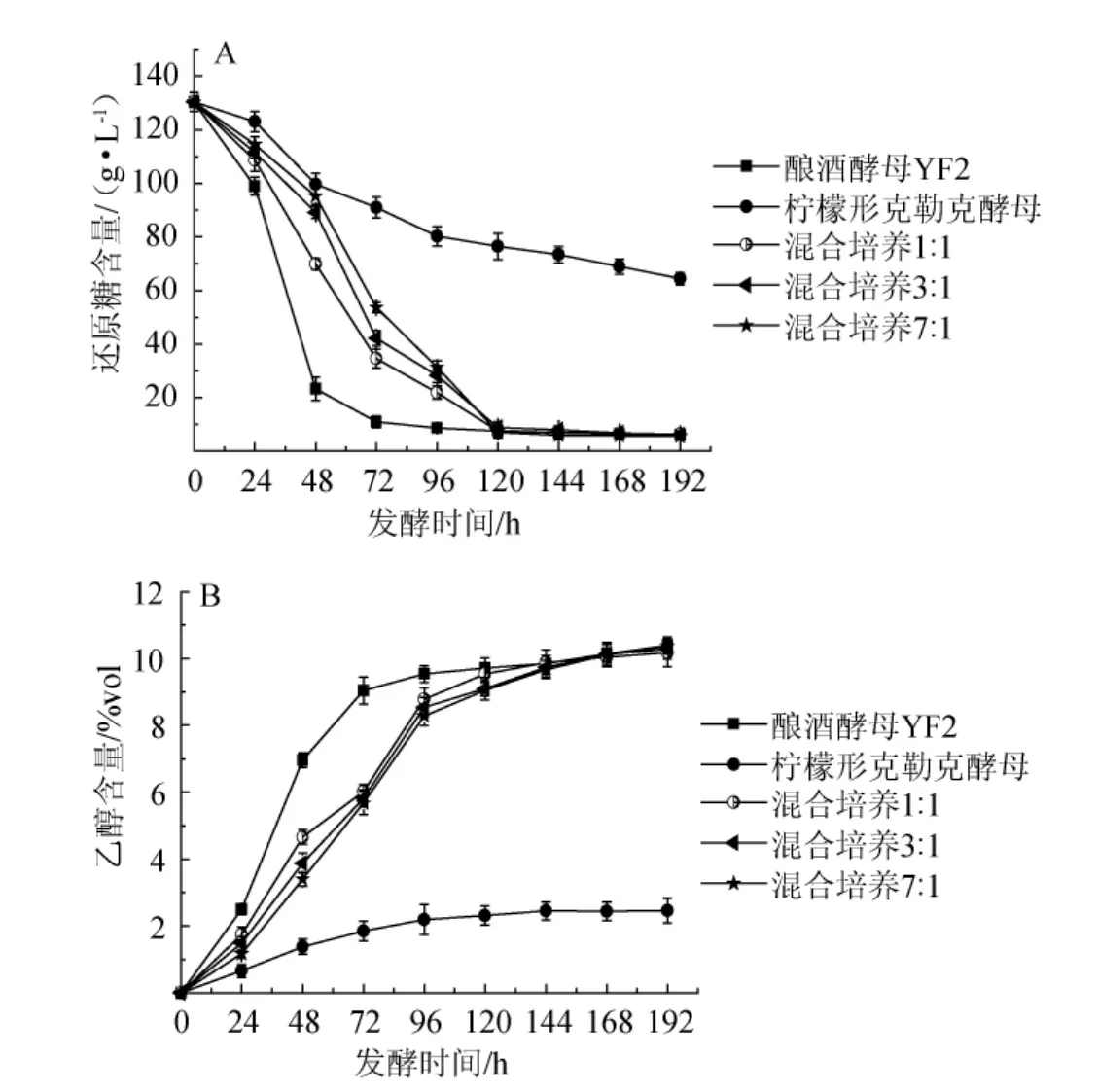
图5 发酵过程中还原糖(A)及乙醇(B)含量变化Fig.5 Change of reducing sugar content(A)and alcohol content(B)during fermentation
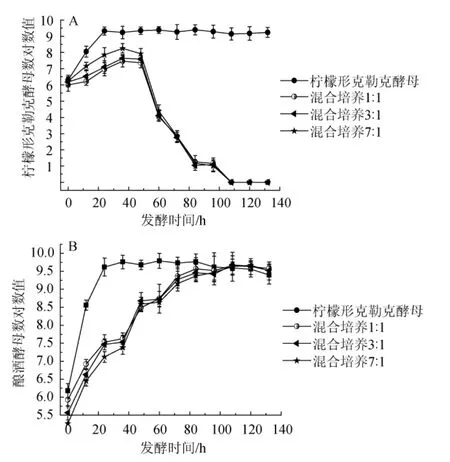
图6 发酵期间柠檬形克勒克酵母(A)及酿酒酵母(B)的生长情况Fig.6 Growth curves ofK.apiculata(A)andS.cerevisiae(B)during fermentation
2.3.4 酵母发酵性能的测定
发酵过程中发酵性能的动态变化结果见图7。由图7可知,酿酒酵母FY2单菌发酵与柠檬形克勒克酵母混菌发酵相比,0~120 h内发酵性能前者明显高于后者,之后至发酵结束发酵性能趋于一致;整个发酵周期中柠檬形克勒克酵母的单菌发酵发酵性能明显低于其他发酵方式,特别在起始发酵0~48 h时柠檬形克勒克酵母生长缓慢,发酵能力低下,这也同样体现在混菌发酵中,在起始发酵阶段0~48 h,不同比例的混和发酵性能均低于酿酒酵母的单菌发酵,并且随着柠檬形克勒克酵母接种比例的增加,发酵性能随之降低,但是发酵后期与酿酒酵母单菌发酵呈现一致性。其原因可能是在混合发酵初期,非酿酒酵母由于占有数量上的优势,从而在争夺营养物质和生存空间上处于非常有利的地位,间接影响了酿酒酵母的快速繁殖,但是随着发酵的进行,酿酒酵母较强的生存能力和对其他微生物的抑制能力逐渐发挥作用,使其在发酵后期成为优势菌。
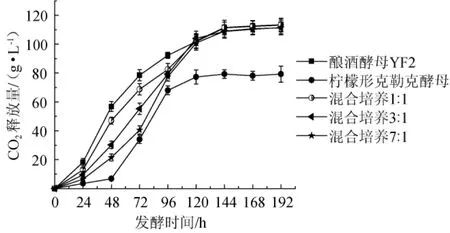
图7 不同酵母的发酵曲线Fig.7 Fermentation curves of different yeasts
3 结论
酿酒酵母FY2和柠檬形克勒克酵母的相互作用研究显示,酿酒酵母对柠檬形克勒克酵母的生长具有较强的抑制作用。这种抑制作用主要是因为酿酒酵母极强的产乙醇能力,当发酵液酒精体积分数超过2.4%时,柠檬形克勒克酵母的细胞膜通透性可能发生变化,导致柠檬形克勒克酵母不能正常生长繁殖,甚至死亡;其次酿酒酵母在生长繁殖过程中会产生某种其他物质,而柠檬形克勒克酵母对这类物质及其敏感,生长和繁殖很容易受到抑制,研究表明,这种物质对蛋白酶和热非常敏感,因此初步推断这种物质可能是蛋白类物质。
3种不同接种方式的混菌发酵结果类似,柠檬形克勒克酵母在发酵至48 h后数量急剧下滑,酿酒酵母开始主导整个发酵过程,因而在发酵结束时,发酵液的酒精体积分数能够达到10%,这与酿酒酵母单菌发酵结果相一致。
研究表明柠檬形克勒克酵母利用糖代谢产生了除酒精以外的产物。后续研究将探究这两种酵母不同接种方式对最终发酵液风味物质的影响。
[1]史学伟.新疆石河子地区非酿酒酵母菌多样性及其对葡萄酒呈香效应研究[D].武汉:华中农业大学,2015.
[2]SODEN A,FRANCIS I L,OAKEV H,et al.Effects of co-fermentation withCandida stellata,andS.cerevisiaeon the aroma and composition of Chardonnay wine[J].Aust J Grape Wine Res,2000,6(1):21-30.
[3]CHALIER P,ANGOT B,DELTEIL D,et al.Interactions between aroma compounds and whole mannoprotein isolated fromS.cerevisiaestrains[J].Food Chem,2007,100(1):22-30.
[4]舒 畅,吴春生,钟慈平,等.发酵食品微生物多样性研究方法进展[J].食品科学,2013,34(15):397-402.
[5]刘文俊.嗜热链球菌和保加利亚乳杆菌产酸、风味特性及其功能基因分型和表达研究[D].呼和浩特:内蒙古农业大学,2014.
[6]张春芝,江志国.微生物对葡萄酒香气的影响综述[J].中国酿造,2013,32(9):28-31.
[7]于 洋,粟春燕,陈晶瑜.3株葡萄酒非酿酒酵母的生长与发酵特性[J].食品科学,2015,36(19):106-111.
[8]王凤梅,马利兵.非酿酒酵母在发酵过程中的代谢产物对葡萄酒质量的影响[J].中国酿造,2016,35(12):12-17.
[9]ZOHRE D E,ERTEN H.The influence ofK.apiculataandCandida pulcherrimayeasts on wine fermentation[J].Process Biochem,2002,38(3):319-324.
[10]韩姗姗.柠檬形克勒克酵母(Klockera apiculata)在葡萄酒发酵中的应用研究[D].杨凌:西北农林科技大学,2008.
[11]张穗生,黄日波,周 兴,等.酿酒酵母乙醇耐受性机理研究进展[J].微生物学通报,2009,36(10):1604-1608.
[12]王鑫昕,王少华,李 维,等.细菌的有机溶剂耐受机制[J].生物工程学报,2009,25(5):641-649.
[13]李汉广,周秋香,罗 玮,等.微生物耐受乙醇与丁醇机制及其在生物燃料生产与生物转化中的应用[J].微生物学通报,2014,41(9):1864-1871.
[14]STOTZLER D,DUNTZE W.Isolation and characterization of four related peptides exhibiting alpha factor activity fromS.cerevisiae[J].Eur J Biochem,1976,65(1):257-262.
[15]ALBERGARIA H,FRANCISCO D,GORI K,et al.S.cerevisiaeCCMI 885 secretes peptides that inhibit the growth of some non-Saccharomyces,wine-related strains[J].Appl Microbiol Biot,2010,86(3):965-972.
Interaction of two kinds of yeast during Haihong wine fermentation
PU Pengfei,YANG Hui*,PENG Renfang,DU Jiaojiao,YAN Xiaozhe
(School of Food&Biology Engineering,Shaanxi University of Science&Technology,Xi'an 710021,China)
The effects ofSaccharomyces cerevisiaeFY2 fermented liquid supernatant and cell crushing solution on the growth ofKlockera apiculata was investigated.The ethanol yield,CO2production and yeast quantity change were determined by two kinds of yeast fermentation with different yeast proportion,and the interaction of two yeasts during Haihong wine fermentation process was investigated using pure yeast fermentation of K.apiculataorS.cerevisiaeas reference.The results showed that the fermentation supernatant ofS.cerevisiaeFY2 inhibited the growth ofK.apiculata,and the supernatant was sensitive to 2 g/L trypsin treatment and 70℃heat treatment.The growth ofK.apiculatawas significantly inhibited after fermentation for 36 h by mixed fermentation,and noK.apiculatawas detected after fermentation for 108 h.
Saccharomyces cerevisiae;Klockera apiculata;mixed fermentation;interaction;Haihong wine
TS262.3
0254-5071(2017)09-0069-05
10.11882/j.issn.0254-5071.2017.09.015
2017-06-07
科技部农业科技成果转化项目(2013GB2G000473);陕西科技大学学术带头人团队计划项目(2013XSD19)
蒲鹏飞(1993-),男,硕士研究生,研究方向为发酵工程。
*通讯作者:杨 辉(1960-),男,教授,博士,研究方向为发酵工程、生物化工。
