2013-2014年围产期孕妇携带B族链球菌的血清型与耐药分析
2017-10-16张丽华郭主声杨维青谢树金陈军剑王佳敏程志琴朱学海王剑文王海卿
张丽华, 郭主声, 杨维青, 谢树金, 陈军剑, 王佳敏, 程志琴, 王 欣, 朱学海,王剑文, 王海卿, 黄 娟
2013-2014年围产期孕妇携带B族链球菌的血清型与耐药分析
张丽华1, 郭主声1, 杨维青2, 谢树金1, 陈军剑2, 王佳敏2, 程志琴1, 王 欣2, 朱学海1,王剑文1, 王海卿1, 黄 娟2
目的对围产期孕妇B族链球菌(GBS)携带株的血清型及药敏结果进行分析。方法收集妊娠35~37周孕妇的阴道和直肠分泌物标本,进行细菌培养和鉴定,并统计其阳性率。采用凝集法进行血清学分型,用纸片扩散法进行药敏试验,参照2009版CLSI标准判定药敏结果,采用WHONET 5.6软件进行统计分析。结果2 533例围产期孕妇进行GBS的检测,检出GBS 264株,阳性率10.4%(264/2 533)。并对153株菌进行了血清分型,其中Ⅲ型占54.9%(84/153)、Ⅰa 型占 17.6%(27/153)、Ⅰb 型占13.1%(20 /153);药敏试验显示:该菌对青霉素、头孢曲松、万古霉素均敏感,对左氧氟沙星、红霉素和克林霉素的耐药率分别是32.9%、68.1%和62.1%;对不同血清型的耐药情况分析发现,Ⅲ型菌株对以上3种药物的耐药率明显高于其他血清型菌株。结论孕妇阴道和直肠均为GBS的定植部位,建议应对孕妇的阴道和直肠分泌物同时送检以提高其检出率;Ⅲ型是GBS主要的血清型;青霉素仍可作为孕产妇及新生儿治疗GBS感染的首选药物,GBS阳性的孕产妇应立即进行干预治疗,以保证围产儿健康。
围产期; B族链球菌; 血清型; 药敏试验
Abstract: ObjectiveTo analyze the serotypes and antimicrobial susceptibility profile of GroupB Streptococcus(GBS) in perinatal pregnant women.MethodsThe vaginal and rectal specimens were collected from pregnant women at 35 to 37 weeks of pregnancy for culture and identification. The serotypes were analyzed using agglutination assay. Antimicrobial susceptibility testing was conducted by using Kirby-Bauer method, and interpreted according to 2009 CLSI breakpoints. The data were analyzed via WHONET 5.6 software.ResultsThe prevalence of GBS was 10.4% (264/2 533) in the 2 533 perinatal pregnant women.Serotype III, Ia and Ib was identi fi ed in 54.9% (84/153), 17.6% (27/153) and 13.1% (20/153) of the GBS, respectively. All the GBS isolates were susceptible to penicillin, ceftriaxone and vancomycin. But 32.9%, 68.1% and 62.1% of the isolates were resistant to levofloxacin, erythromycin and clindamycin, respectively.The antibiotic resistance rate of serotype III isolates to the above three antibiotics was signi fi cantly higher than the other serotypes.ConclusionsGBS may colonize both vagina and rectum of pregnant women. Vaginal and rectal secretions should be sampled simultaneously for better screening GBS.GBS serotype III was the predominant serotype. Penicillin can be used as the fi rst-choice treatment for GBS infections inpregnant women and newborns. GBS-positive pregnant women should be given the intervention treatment immediately to ensure the health of perinatal infants.
Key words:perinatal period; groupB Streptococcus; serotype; antimicrobial susceptibility test
B 族链球菌(Group BStreptococcus, GBS) 又称 作 无 乳 链 球 菌(Streptococcus agalactiae),是一种条件致病菌。基于荚膜多糖(capsular polysaccharide,CPS)抗原成分,目前GBS可分为Ⅰa、Ⅰb、Ⅱ~Ⅸ等10种血清型[1]。美国疾病预防与控制中心(CDC)最新指南提倡对所有妊娠35~37周孕妇采集直肠和阴道拭子进行 GBS分离培养[2],培养阳性者或存在其他危险因素者(前一胎有过GBS感染,GBS菌尿,胎膜破裂≥18 h,胎龄≤37周,发热等)于分娩开始时接受抗生素预防性治疗。本研究对2013-2014年在东莞东华医院门诊产检的妊娠35~37周的孕妇进行口头告之并征得同意的情况下开展了常规的GBS检测及其药物敏感性检测,并对分离菌株进行血清学分型,现报道如下。
1 材料与方法
1.1 菌株来源
2013年1月1日-2014年12月31日在我院门诊就诊孕妇的阴道和直肠拭子的GBS分离株264株。
1.2 仪器 和试剂
法国生物梅里埃公司的VITEK 32细菌鉴定仪,哥伦比亚血平皿和血MH琼脂平皿购自广州市迪景微生物科技有限公司,药敏纸片扩散法、Todd-Hewrtt(T-H)培养基为英国OXOID公司产品,血清分型试剂购自丹麦血清研究所(Statens Serum Institut,Copenhagen,Denmark)。
1.3 GBS的检测
对孕期35~ 37周的围产期孕妇进行阴道和直肠分泌物标本采集,将采集的阴道拭子和直肠拭子分别浸入2 mL处理液(内含0.16 mg/mL庆大霉素的0.9%NaCl 溶液)中1 min;之后将其置于T-H肉汤管中进行增菌培养18~24 h;再分别接种到哥伦比亚血平皿上,在5%~10% CO2孵箱35 ℃孵育18~24 h;观察血平皿上菌落特点,挑取灰白色、圆形、半透明、中等大小、β溶血的可疑菌落作涂片镜检,把革兰阳性球菌且触酶阴性的菌落做camp试验或采用VITEK 32细菌鉴定仪鉴定分离菌株。
1.4 GBS药敏试验
采用纸片扩散法进行药敏试验,质控菌株为肺炎链球菌ATCC49619,按CLSI 2009标准判读结果。
1.5 血清分型试验
Ⅰa、Ⅰb、Ⅱ~Ⅸ 10 种乳胶凝集分型血清试剂,操作步骤及判读方法参考试剂盒的说明书。若菌株与10 种分型血清均不发生凝集,定义为不可分型(non-typeable,NT)。
1.6 数据分析
采用WHONET 5.6软件分析数据,用SAS9.2软件进行统计分析,统计学方法均为卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 GBS的检出情况
对2 533例在我院门诊就诊的妊娠35~37周的孕妇进行GBS检测,GBS检出阳性的孕妇264例,阳性率为10.4%(264/2 533)。2013年阳性检出率为11.3%(162/1 429),2014年为9.2%(102/1 104)。
2.2 GBS药物敏感性试验结果
所有菌株对青霉素和头孢曲松、万古霉素、利奈唑胺敏感,对红霉素、克林霉素和左氧氟沙星耐药率依次为 68.1%、62.1%和32.9%。GBS对7种常用抗菌药物的敏感性结果见表1。
2.3 GB S的血清学分型
我们按每月50 %的比例抽取菌株做血清分型试验,以检测不同季度或不同年份血清分型结果的差异。共检测了153株,占58.0%(153/264),结果Ⅲ型为 54.9%(84/153)Ⅰa 型 17.6%(27/153)、Ⅰb 型13.1%(20 /153)、Ⅴ型6.5%(10 /153)、Ⅵ型 1.3%(2/153)、 Ⅷ 型 0.7%(1/153),NT5.9%(9/153),GBS血清型的分布见表2。
2.4 各种血清型的GBS对抗菌药物的耐药率
不同血清型GBS对抗菌药物的耐药率略有差异,除Ⅵ型外,Ⅲ型菌株对左氧氟沙星、红霉素和克林霉素的耐药率明显高于其他血清型菌株。各种血清型的GBS对抗菌药物的耐药率见表3。

表1 2013-2014年GBS对抗菌药物的敏感率和耐药率Table 1 Antibiotic susceptibility pro fi le of groupB Streptococcusstrains in 2013 and 2014(%)
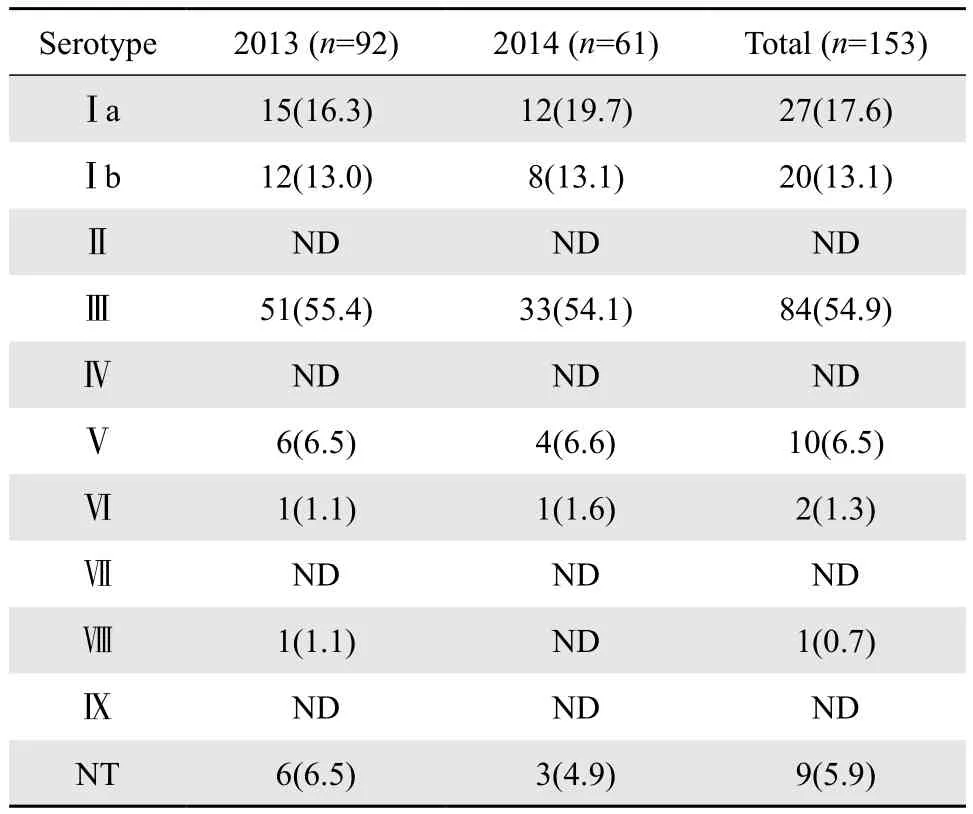
表2 GBS的血清型分布Table 2 Serotype distribution of groupB Streptococcusisolates[n(%)]
3 讨论
GBS属溶血链球菌,大约1/4健康成年女性阴道携带GBS,大多无症状。但该菌可通过产道上行引起子宫和胎膜感染,导致孕妇发生早产、晚期流产、胎儿发育不良、胎膜早破、死胎,也可引起绒毛羊膜炎、子宫内膜炎、血流感染、泌尿道感染等[3]。有研究表明,产前GBS定植阳性的孕妇,其婴儿出现早发型GBS感染的概率是阴性妇女的25倍[4]。目前我国有关孕产妇GBS的定植情况尚无大样本的流行病学资料。且因母亲妊娠期间不进行常规GBS感染调查,故产科仅能提供极少的相关感染病史,新生儿科医师怀疑新生儿感染时进行血培养才能发现病原菌[5]。普遍筛查35~37周孕妇的GBS定植和产时使用抗生素预防可大量降低新生儿早发性GBS感染。近年来,虽然早发性GBS感染比较少见,孕产妇GBS的定植率自上世纪70年代就很少变化[6]。2013-2014年我院在检测的2 533份样本中检出GBS 264株,检出率为10.4%,相仿于上海的11.2%[7]、济南的9%[8],低于南宁的29.2%[9],高于厦门的2.8%[10]、北京的7.5%[11],说明不同地区存在一定的差异。这些差异的存在,除了社会因素外,很大的原因是对围产期孕妇GBS的培养方法没有统一的程序。我国孕妇阴道GBS 定植率较低的原因可能为:①培养技术欠佳。培养时未使用选择性肉汤增菌培养基,而使用普通培养基导致约有50% 定植者出现假阴性结果;②GBS 定植有3 种形式:慢性带菌、短暂带菌和间歇带菌,采样时 GBS 可能处于间歇状态,导致假阴性结果;③未同时使用2 个拭子采集分泌物。应采集直肠和阴道拭子各1 份同时送检,培养阳性率可较单一拭子高 40%;④拭子采集后未立即送检。导致GBS死亡,出现假阴性结果[12]。我们采用阴道分泌物和直肠分泌物同时送检,进行标本增菌前抗生素处理、增菌后培养鉴定的程序,对GBS的检测实践证明本研究建立的检测围产期孕妇GBS的程序可行,具有临床应用价值。
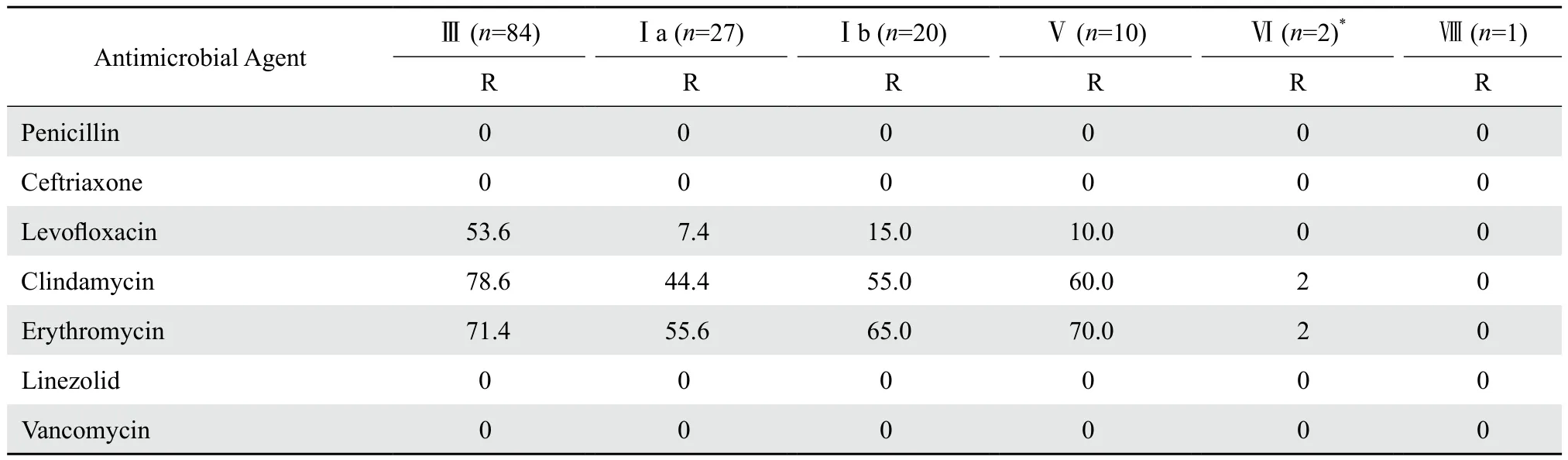
表3 各种血清型GBS对抗菌药物的耐药率Table 3 Antimicrobial susceptibility rate of groupB Streptococcusisolates in terms of serotypes(%)
本研究随机抽取58.0%(153/264)GBS 菌株进行了血清分型,结果显示Ⅲ、Ⅰa、Ⅰb 和Ⅴ型为常见,分布与英国和南非等报道相似[13-14],而与日本有较大差异[15],与北京地区妊娠妇女定植GBS的血清型分布情况相似[16-17]。本研究血清型中Ⅲ型占54.9%,高于Lu 等[16]的41.8%、仝净净等[17]的32.1%及Ueno等[15]的16.2%;Ⅰa 型占17.6%低于Lu 等的21.4%、稍低于仝净净等的17.9%、高于Ueno等的14.6%;Ⅰb 型占13.1%,高于Lu等的11.9%、低于仝净净等的16.1%及Ueno等的18.6 %;Ⅴ 型占6.5%,均低于Ueno等的19.1%、Lu 等的14.9%、仝净净等的14.3%;Ⅵ型占1.3%、Ⅷ型占0.7%均低于Ueno等的Ⅵ14.9%、Ⅷ型10.4%;未分型占5.9%;未检测出Ⅱ型、Ⅳ型、Ⅶ型和Ⅸ型。Ⅲ 型毒力最强[18],可产生多种外毒素和溶组织酶,引起严重感染 ,深圳市的研究也显示发生严重侵袭性GBS感染的病例以血清Ⅲ型为主[19]。提示若孕妇携带了GBS菌株,对新生儿生命的安全存在危险;目前育龄妇女接种GBS 疫苗是预防新生儿GBS 感染的理想策略,荚膜多糖是GBS 菌株的主要毒力因子,也是制备疫苗的基础。正在研发的多价疫苗主要覆盖Ⅲ、Ⅰa、Ⅰb 、Ⅱ和Ⅴ型5种血清型。本研究结果显示,东莞GBS血清型以Ⅲ型为主,Ⅲ型、Ⅰa型和Ⅰb型的总和占所有血清型的85.6%(131/153),通过检测分析,不同季节、不同年份GBS的血清分型,差异无统计学意义(P= 0.996)。提示多价疫苗可覆盖东莞GBS 感染株的92.2%,能有效预防东莞育龄妇女感染GBS,减少定植,从而减少孕产妇和新生儿GBS 感染。
多数报道GBS对青霉素和氨苄西林敏感。孕妇分娩时使用该2种药可有效预防感染。青霉素是一线治疗药物,因其是窄谱抗生素,抗GBS活性强,在患者对青霉素可能过敏时,可考虑应用头孢菌素类药物,其有较低的过敏率,同时能达到较高的羊膜内浓度;若患者对青霉素高度过敏时,考虑使用红霉素或克林霉素。美国 CDC 和美国孕产妇协会最近修订了指南[6],克林霉素的耐药率日益增加,大概从 3%增至15% ,红霉素从7%增至25% 。青霉素即使过敏也不再推荐使用红霉素。本研究的结果与大多数报道一致,GBS对青霉素类、头孢菌素类、糖肽类抗菌药物均呈高度敏感,未发现GBS对青霉素类敏感性下降的现象,本研究中GBS对红霉素耐药率为68.1%,低于北京、深圳[17,19],高于浙江、天津[20-21]地区的报道;对克林霉素耐药率为62.1%,低于北京、深圳、浙江[17,19-20],高于天津[21]地区的报道;对左氧氟沙星耐药率为32.9%,低于北京、浙江[17,20],高于深圳、天津[19,21]地区的报道。表3显示各种血清型GBS对抗菌药物的耐药率有所不同,6种血清型对于左氧氟沙星和克林霉素的耐药率有显著差异(P=0.001和P=0.012);同时还显示Ⅲ型菌株对克林霉素与Ⅰa型及Ⅰb型相比有显著差异、Ⅲ型菌株对左氧氟沙星与Ⅰa型、Ⅰb型及Ⅴ型相比均有显著差异,值得引起高度重视。本研究显示,青霉素类抗生素仍是东莞地区预防和治疗GBS感染的首选药物。抗菌药物的耐药率各地均不相同,携带的菌株血清型的不同,患者若对青霉素过敏,考虑使用红霉素或克林霉素时,要参考患者携带菌株的药敏结果。
多种血清型的存在及其分布的复杂性,成为制造有效疫苗和预防新生儿GBS感染的主要障碍。监测围产期孕妇GBS的感染状况,并进行血清分型,对提高GBS感染的预防和治疗,保证母子健康有重要意义。本研究了解GBS血清型分布及对抗菌药物敏感情况,对预防新生儿GBS感染及积极有效的治疗提供了重要理论依据。
[1] WANG H,ZHAO C,HE W,et al. High prevalence of fluoroquinolone-resistant group B streptococci among clinical isolates in China and predominance of sequence type 19 with serotype Ⅲ [J]. Antimicrob Agents Chemother,2013,57(3):1538-1541.
[2] VERANI JR, MCGEE L, SCHRAG SJ, et al. Prevention of perinatal group B streptococcal disease--revised guidelines from CDC, 2010[J]. MMWR Recomm,2010,59(RR-10):1-36.
[3] LINDAHL G,STALHAMMAR-CARLEMALM M,ARESEHONG T.Surface proteins ofStreptococcus agalactiaeand related proteins in othery bacterial pathogens[J]. Clin Microbiol Rev,2005,18(1):102-127.
[4] CDC.Prevention of perinatal group B streptococcal disease:public health perspective[J]. MMWR,1996,45(RR-7):1-24.
[5] 专家对谈录.围产期新生儿B族链球菌感染[ J ].中国循证儿科杂志,2011,7(6):241-244.
[6] CAGNO CK,PETTIT JM,WEISS BD. Prevention of perinatal group B streptococcal disease: updated CDC guideline[J]. Am Fam Physician,2012 ,86( 1) : 59-65.
[7] 孙荪.孕妇产道B群链球菌的调查报告[J].微生物学通报,1988,15(4):170-172.
[8] 张京海,杜桂香,刘桂英,等.孕妇产道B群链球菌的感染调查[J].中华医学检验杂,199l,14(2):119-121.
[9] 吴光,冯忠娜,李方青,等.南宁市孕妇B群链球菌携带情况调查[J].广西医科大学报,2000,17(1):166-167.
[10] 郭永建,戴以聪,陈红,等.孕妇产道B群链球菌带菌状态及其母婴传播[J].福建医学学报,1993,27(1):42-44.
[11] 孙芾,林宏,于俊峰,等.孕妇B群链球菌感染率及药物敏感性分析[J].江西医学检验,2005,23(3):193-194.
[12] 林新祝,吴健宁,张雪芹,等,晚孕期阴道B族链球菌定植与新生儿感染的关系[J].中华围产医学杂志,2016,19(7):491-496.
[13] JONES N,OLIVER K,JONES Y,et al. Carriage of groupB streptococcusin pregnant women from Oxford,UK[J]. J Clin Pathol,2006,59(4):363-366.
[14] MADZIVHANDILA M,ADRIAN PV,CUTLAND CL,et al. Serotype distribution and invasive potential of groupB streptococcusisolates causing disease in infants and colonizing maternal-newborn dy-ads[J]. PLoS One,2011,6(3):e17861.
[15] UENO H,YAMAMOTO Y,YAMAMICHI A,et al.Characterization of groupB streptococcusisolated from women in Saitama city,Japan[J]. Jpn J Infect Dis,2012,65(6):516-521.
[16] LU B,LI D,CUI Y,et al. Epidemiology of Group Bstreptocococcusisolated from pregnantwomen in Beijing,China[J]. Clin Microbiol Infect,2014,20(6):O370-O373.
[17] 仝净净,王萍,史伟,等,56株B族链球菌血清型耐药性及多位点序列分型研究[J].中国实用儿科杂志, 2015,30(3):194-198.
[18] MANNING SD, FAXMAN B, PIERSON CL, et al. Correlates of antibiotic-resistant group Bstreptococcusisolated from pregnant women[J]. Obstet Cynecol, 2003, 101(1):74-79.
[19] 李丽 ,吴伟元,吴本清,等.新生儿B族溶血链球菌感染血清型与临床表现相关性及药敏分析[J].中国新生儿科杂志,2015,30(5):339-342.
[20] 赵丽琴.育龄妇女分离无乳链球菌对氟喹诺酮类抗生素的耐药性及耐药机制研究[J].医学研究杂志,2015,44(8):149-151.
[21] 姚冬梅. 孕妇感染B群链球菌耐药性分析及其新生儿感染情况研究[J]. 国际检验医学杂志,2015,36 (19):2879-2880.
Serotypes and antimicrobial resistance profile of the Group B Streptococcus isolates in perinatal pregnant women during the period from 2013 to 2014
ZHANG Lihua, GUO Zhusheng, YANG Weiqing, XIE Shujin, CHEN Junjian, WANG Jiamin, CHENG Zhiqin,WANG Xin, ZHU Xuehai, WANG Jianwen, WANG Haiqing, HUANG Juan. (Department of Laboratory Medicine, Donghua Hospital, Dongguan Guangdong 523110, China)
R378.12
A
1009-7708 ( 2017 ) 05-0527-05
10.16718/j.1009-7708.2017.05.008
2016-09-27
2017-04-27
2 0 1 4年广东省东莞市社会科技发展项目(2014108101002)。
1. 东莞东华医院检验科,广东东莞 523110;
2. 广东医科大学临床微生物学教研室。
张丽华(1949—),女,主任技师,主要从事临床微生物检验及细菌耐药性监测。
张丽华, E-mail:13538684247@163.com。
