产NDM-1型碳青霉烯酶肺炎克雷伯菌儿童血流感染的临床特征及细菌耐药性分析
2017-10-16宋文琪郭凌云
张 烨, 董 方, 宋文琪, 郭凌云, 王 艳,刘 钢
产NDM-1型碳青霉烯酶肺炎克雷伯菌儿童血流感染的临床特征及细菌耐药性分析
张 烨, 董 方*, 宋文琪*, 郭凌云, 王 艳*,刘 钢
目的研究产NDM-1型碳青霉烯酶肺炎克雷伯菌儿童血流感染的临床特征及细菌耐药性。方法收集首都医科大学附属北京儿童医院2011年1月-2014年8月住院患儿血培养分离的非重复耐碳青霉烯类肺炎克雷伯菌(CRKp);用微量肉汤稀释法测定15种抗菌药物的MIC值;采用PCR法确定产NDM-1菌株;回顾分析病历资料了解感染产NDM-1菌株患儿的临床特征,并与感染非产NDM-1菌株患儿进行比较。结果52株CRKp中共检出28株产NDM-1菌株。产NDM-1菌株组均为多重耐药菌,对青霉素、头孢菌素和哌拉西林-他唑巴坦的耐药率达100%(28/28),对氨曲南、甲氧苄啶-磺胺甲唑及庆大霉素的耐药率均>75%,对亚胺培南和美罗培南的耐药率分别为100%(28/28)、92.9%(26/28)。产NDM-1菌株中碳青霉烯类高MIC值的菌株比例高于非产NDM-1菌株。产NDM-1菌株组的患儿中, 82.1%( 23/28)来自血液病房,常见基础疾病为血液系统恶性肿瘤(78.6%,22/28),20例(76.4%)患儿存在中性粒细胞缺乏伴发热;产与非产NDM-1肺炎克雷伯菌血流感染患儿相比,反复住院(P=0.202)、近期使用抗菌药物(P=0.615)、常见基础疾病(P=0.856)以及深静脉置管(P=0.099)方面差异无统计学意义。明确肺炎克雷伯菌感染后,37例患儿接受了碳青霉烯类药物联合敏感药物治疗。产NDM-1菌株组病死率与非产NDM-1菌株组相比无明显差异(2/28 对 3/24;P=0.625)。结论该院已出现产NDM-1肺炎克雷伯菌株,呈逐年增长趋势,此类细菌呈多重耐药,碳青霉烯类高MIC值的菌株所占比例高,临床特征上与非产NDM-1菌无明显区别。
新德里金属β内酰胺酶-1; 肺炎克雷伯菌; 血流感染; 儿童; 碳青霉烯类抗生素
Abstract: ObjectiveTo investigate the clinical characteristics and antibiotic resistance of the bloodstream infections due to NDM-1 producingKlebsiella pneumoniaein children.MethodsThe nonduplicate carbapenem-resistantKlebsiella pneumoniae(CRKp) strains isolated from blood samples were collected in Beijing Children’s Hospital from January 2011 to August 2014.Antimicrobial susceptibility was tested with broth microdilution method. PCR ampli fi cation and DNA sequencing were conducted targetingblaNDM-1genes. Medical records were reviewed and analyzed.ResultsOf the 52 CRKp strains,blaNDM-1gene was detected in 28 strains. All NDM-1-producing strains were multidrug-resistant. All the 28 isolates were resistant to penicillin, cephalosporins,piperacillin-tazobactam, and imipenem. More than 75.0% of these NDM-1-producing strains were resistant to aztreonam,trimethoprim-sulfamethoxazole, gentamicin, and meropenem (92.9%, 26/28). NDM-1-producing isolates had higher carbapenem MICs than non-NDM-1-producing isolates. Most (82.1%,23/28) of the NDM-1-producing isolates were isolated from hematology-oncology ward. The most common underlying disease was hematologic malignancy (78.6%, 22/28). Febrile neutropenia was found in 20 (71.4%) patients. No difference was found between NDM-1-producing and non-NDM-1-producing CRKp infection in terms of repeated hospitalization (P=0.202), prior antibiotic use (P=0.615), underlying diseases(P=0.856), and deep venous catheter (P=0.099). After the susceptibility results were available, 37 patients received carbapenembased combination regimen. The mortality did not show difference between NDM-1 producing CRKp infections and non-NDM-1-producing CRKp infections, 7.1% (2/28) vs. 12.5% (3/24),P=0.625.ConclusionsThe NDM-1 carbapenemase producingKlebsiella pneumoniaeis emerging in this hospital. NDM-1-producing strains are resistant to multiple antimicrobial agents, associated with higher carbapenem MIC value. However, no difference was found in the clinical features between the bloodstream infections due to NDM-1-producing strain and those due to non- NDM-1-producing strains.
Key words:NDM-1;Klebsiella pneumoniae; bloodstream infection; children; carbapenem antibiotics
2009年,Yong 等[1]在1例新德里旅游的印度裔瑞典患者尿液中分离出1株产新德里金属β内酰胺酶-1(NDM-1)肺炎克雷伯菌 ,此后产NDM-1的细菌在世界各地陆续被检出。2011年,我国香港首次发现1株产NDM-1酶大肠埃希菌[2],随后,国内多地在不同菌种中检出NDM-1[3]。NDM-1酶属于B类金属酶,能够水解除氨曲南外的所有β内酰胺类抗菌药物,包括碳青霉烯类药物[4]。近年来,携带blaNDM-1基因的肺炎克雷伯菌日益增多,引起的血流感染已成为医院感染的重要问题,对患者的生命构成严重威胁[5-6]。在国内,已有报道产NDM-1肺炎克雷伯菌在儿科病房暴发流行[7-8]。本研究对碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumoniae,CRKp)进行blaNDM-1基因检测,分析这些菌株的耐药特性、患儿的临床特征以及产与非产NDM-1肺炎克雷伯菌之间有无不同。
1 材料与方法
1.1 材料来源
共收集北京儿童医院2011年1月-2014年8月血培养阳性患儿分离的52株非重复CRKp。CRKp的定义为对碳青霉烯类抗菌药物亚胺培南或美罗培南至少一种不敏感(MIC≥2 mg/L)的肺炎克雷伯菌。收集患儿病历资料,包括一般情况、治疗及临床结局。
1.2 药敏试验
按照CLSI 2014年推荐的微量肉汤稀释法测定抗菌药物的MIC值[9]。统一进行15种抗菌药物MIC的测定,包括庆大霉素、阿米卡星、左氧氟沙星、环丙沙星、氨曲南、氨苄西林、头孢唑林、头孢他啶、头孢噻肟、头孢吡肟、亚胺培南、美罗培南、阿莫西林-克拉维酸、哌拉西林-他唑巴坦和甲氧苄啶-磺胺甲唑。质控菌株为大肠埃希菌ATCC25922,肺炎克雷伯菌ATCC BAA-1705。使用WHONET5.6软件对MIC结果进行耐药性分析。
1.3 碳青霉烯酶基因型PCR检测
检测blaNDM-1基因的引物参照文献[10]。各引物由天一辉远生物科技有限公司合成。PCR反应产物委托该公司纯化、测序,测得的碳青霉烯酶基因序列,在GenBank中Blast (http://www.ncbi.nlm.nih.gov/blast)进行同源分析。
1.4 统计学分析
计数资料使用数字和百分比描述,组间比较使用χ2检验或Fisher精确检验,计量资料使用中位数和四分位数描述,组间比较使用Mann-WhitneyU检验;使用SPSS 17软件进行统计分析。
2 结果
2.1 blaNDM-1基因检测结果
共分离52株CRKp。blaNDM-1基因检测结果28株阳性(PCR产物电泳图见图1)。其中23株来自血液病房,4株来自新生儿病房(包括3例NICU),1株来自心外科病房。产与非产NDM-1菌株在各年份的分布见图2。

图1 PCR扩增NDM-1基因产物电泳图Figure 1 Representative electrophoretogram of PCR products targetingblaNDM-1gene
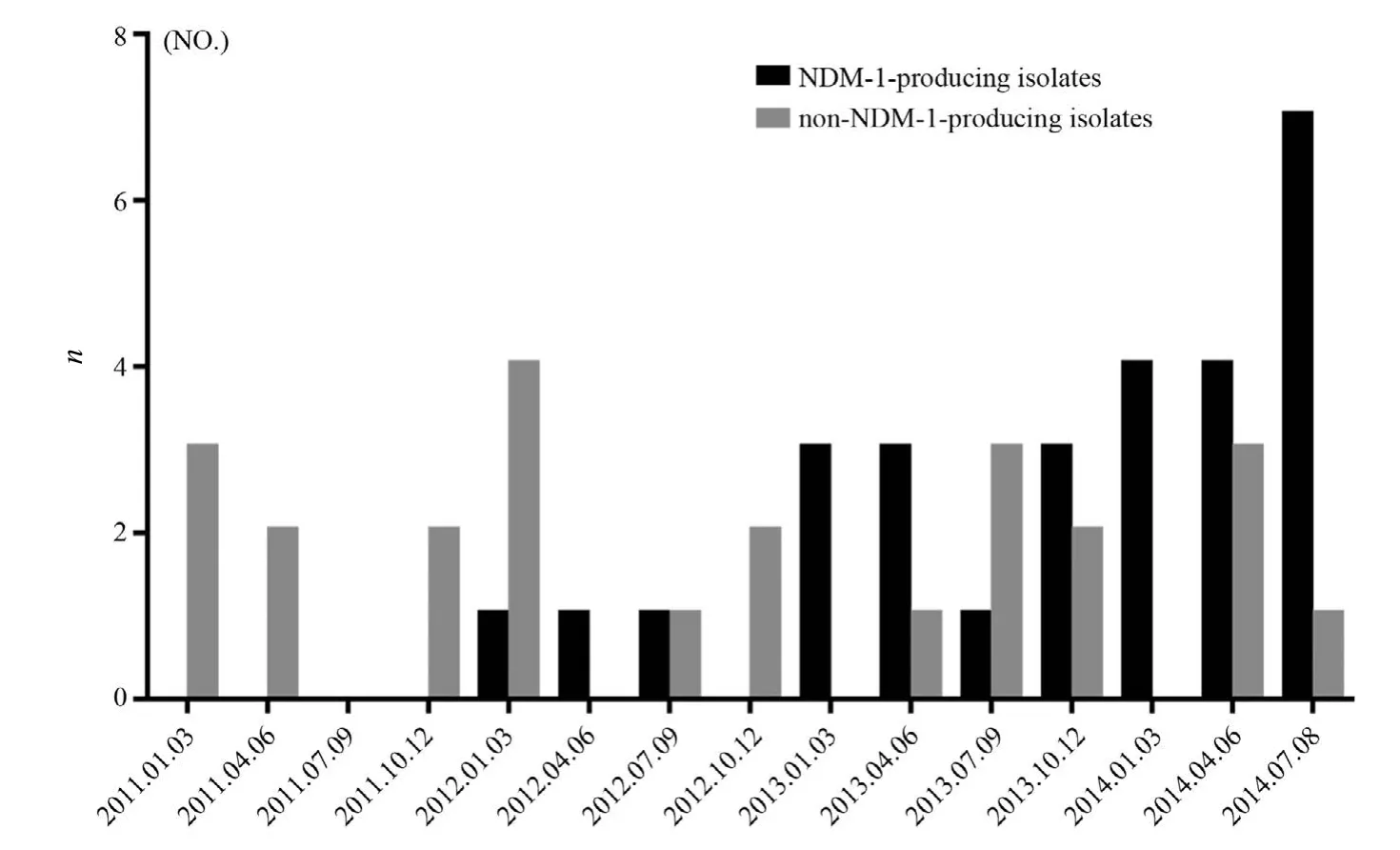
图2 2011-2014年耐碳青霉烯类肺炎克雷伯菌季度分布图Figure 2 The quarterly distribution of carbapenem-resistantKlebsiella pneumoniaeisolates during the period from 2011 to 2014
2.2 菌株耐药情况
52株细菌均为多重耐药菌,对氨苄西林、头孢噻肟、头孢他啶、头孢唑林、阿莫西林-克拉维酸耐药率达100%(52/52),对亚胺培南和美罗培南的耐药率分别为90.4%(47/52)、82.7%(43/52),仅对阿米卡星(3/52)、左氧氟沙星(4/52)、环丙沙星(5/52)耐药率低。碳青霉烯类药物对52株细菌的MIC值不尽相同,产NDM-1菌株碳青霉烯类药物的MIC值较高,MIC≥8 mg/ L,亚胺培南占89.3%(25/28)、美罗培南75.0%(21/28),而非产NDM-1菌株高MIC值的菌株所占比例相对偏低,均为62.5%(产与非产NDM-1菌株对亚胺培南耐药率差异P=0.022,对美罗培南P=0.33);产与非产NDM-1菌株的耐药情况见图3,与非产NDM-1菌株组相比,产NDM-1菌株组对环丙沙星的敏感率高(P=0.039),对哌拉西林-他唑巴坦及亚胺培南的耐药率高(P<0.001及P=0.016)。
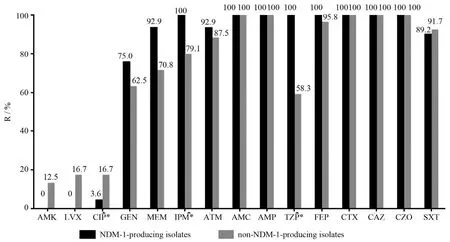
图3 耐碳青霉烯类肺炎克雷伯菌对15种抗菌药物的耐药率Figure 3 Resistance rate of 52 carbapenem-resistantKlebsiella pneumoniaestrains to 15 antimicrobial agents
2.3 患儿一般情况
28例产NDM-1肺炎克雷伯菌血流感染的患儿中,男20例,女8例,年龄中位数为5.0岁(四分位数间距:1.0~9.3岁)。23例(82.1%)来自血液病房,4例来自新生儿病房(包括3例NICU),1例来自心外科病房,中位住院天数为19 d(1~55 d)。22例(78.6%)患儿有近3个月反复住院史。18例患儿在近3个月有抗生素使用史,使用的抗菌药物种类从2种到8种不等。20例患儿为医院获得性感染[11],8例患儿为医疗相关性感染,无社区获得性感染。基础疾病包括:22例血液系统恶性肿瘤,1例神经母细胞瘤,1例早产,1例先天性心脏病。89.3%(25/28)的患儿进行了深静脉置管(包括外周导入中心静脉置管、脐静脉置管)。92.9%(26/28)的患儿感染首发症状为发热,其中76.9%(20/26)的患儿在化疗期间出现中性粒细胞缺乏伴发热[12];另外2例患儿(2/28)1例首发症状为呼吸暂停,1例为感染性休克表现。3例患者出现严重脓毒血症,其中1例心外科的患儿在先天性心脏病手术后合并感染性休克而死亡。4例出现多重耐药菌感染的患儿(包括铜绿假单胞菌、阴沟肠杆菌、唾液链球菌、屎肠球菌、奇异变形杆菌)中,1例放弃治疗,1例死亡。28例产NDM-1肺炎克雷伯菌血流感染患儿与24例非产NDM-1肺炎克雷伯菌血流感染患儿临床特征比较见表1,两组在年龄、性别、基础疾病、感染前3个月反复住院、感染前3个月抗菌药物使用史、科室分布以及临床表现上差异无统计学意义,仅在住院天数上差异有统计学意义(P=0.007)。
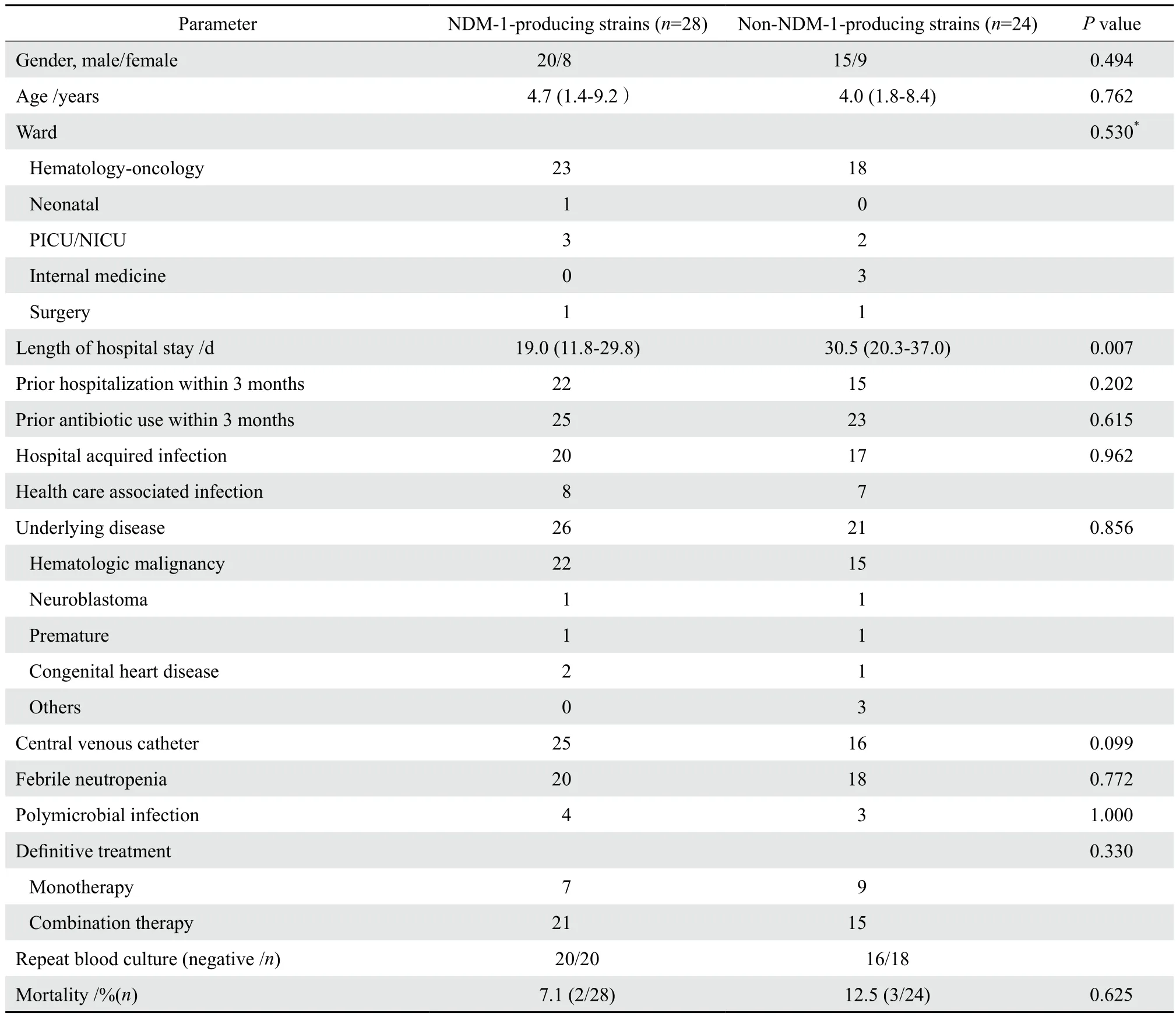
表1 碳青霉烯类耐药肺炎克雷伯菌血流感染患儿的临床特征Table 1 Clinical characteristics of patients with bloodstream infection due to carbapenem-resistantKlebsiella pneumoniae
2.4 抗菌药物治疗及临床结局
在明确肺炎克雷伯菌感染前所有患儿均使用了抗菌药物(表2),其中使用较多的是β内酰胺类-β内酰胺酶抑制剂复合剂和碳青霉烯类(美罗培南、亚胺培南),而氨基糖苷类(阿米卡星)和喹诺酮类(左氧氟沙星)仅占少数。在明确肺炎克雷伯菌感染后,37例患儿使用包含碳青霉烯类药物的联合治疗,30例患儿使用包含阿米卡星的联合治疗,这些患儿均未出现肾功能不全等药物不良反应。产NDM-1肺炎克雷伯菌血流感染患儿中,死亡2例(1例血液科患儿和1例心外科患儿),这2例患儿均仅使用了不敏感的单药[美罗培南(MIC: 4 mg/L)、头孢哌酮-舒巴坦]治疗;非产NDM-1肺炎克雷伯菌血流感染患儿中,死亡3例(2例血液科患儿和1例心外科患儿),3例患儿均仅使用单药治疗(美罗培南),其中2例患儿血培养分离菌株对美罗培南的MIC值均>8 mg/L。产与非产NDM-1组在治疗和临床结局上差异并无统计学意义。见表1。
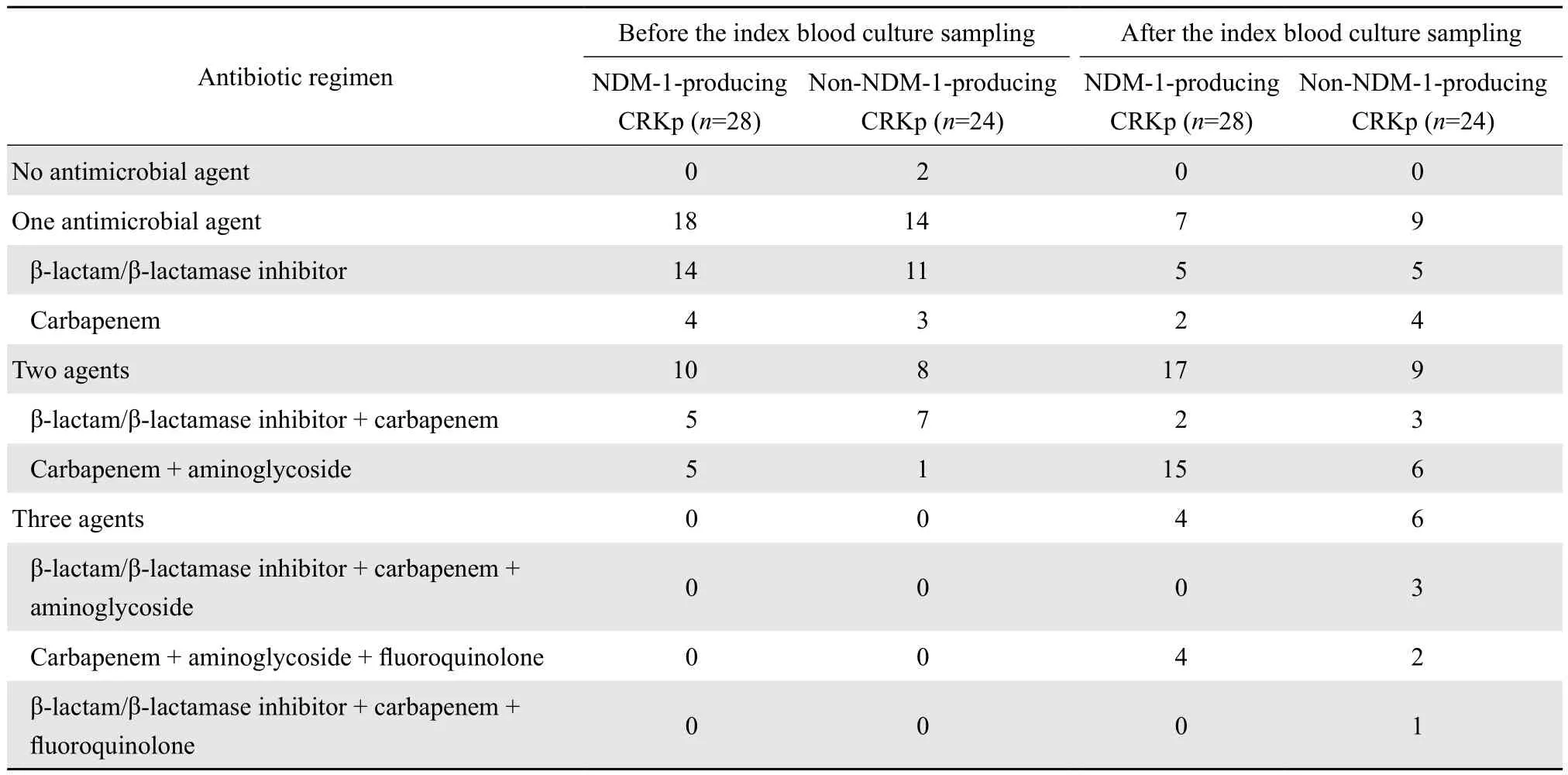
表2 碳青霉烯类耐药肺炎克雷伯菌血流感染患儿抗菌药物使用情况Table 2 Antimicrobial treatment administered to patients with bloodstream infection due to carbapenem-resistantKlebsiella pneumoniae
3 讨论
肺炎克雷伯菌可引起尿路、血液、肺部等多种感染,产NDM-1肺炎克雷伯菌引起的感染由于细菌的广泛耐药性使得临床治疗十分棘手。有学者综述国内文献发现儿童是感染产NDM-1细菌的易感人群[3]。目前关于儿童产NDM-1细菌感染的报道多为尿路感染,且多集中在流行病学及分子学特征,而对于携带blaNDM-1基因的肺炎克雷伯菌所致儿童血流感染的临床特征及治疗描述较少[7-8]。
本研究从2011年1月至2014年8月住院患者血培养中共分离出52株CRKp菌株,从中检测出28株产NDM-1肺炎克雷伯菌,在2012年以前,本院血液分离肺炎克雷伯菌主要为产IMP-4的菌株,未发现产NDM-1肺炎克雷伯菌[13],自2012年1月份从血液中分离出第一株开始,产NDM-1肺炎克雷伯菌呈逐年上升趋势,并逐渐成为主要菌株,非产NDM-1肺炎克雷伯菌则呈全年散发分布,然而同时期中国流行的CRKp的基因型为blaKPC-2[14],这可能与儿童这一特殊人群有关,具体原因需进一步研究。我院产NDM-1肺炎克雷伯菌的耐药谱整体趋势与王盛书等[3]总结的相符,但对阿米卡星、左氧氟沙星、环丙沙星的耐药率要明显偏低,考虑其原因可能为本研究的对象为儿童,这3种药在儿童中并不常用,而在成人属常用药,因此其耐药率存在差异。通过对患儿临床信息总结发现,52例CRKp血流感染患儿中57.7%患有血液系统肿瘤,这些患儿大都有长期反复住院史、近期使用抗菌药物史及深静脉置管史,并且在化疗期间出现中性粒细胞缺乏伴发热,然而产NDM-1与非产NDM-1肺炎克雷伯菌血流感染患儿相比,在反复住院、深静脉置管、近期使用抗菌药物方面以及所患基础疾病并无统计学差异,亦有研究发现,无论是产NDM-1细菌还是产IMP-4细菌,深静脉置管均为其引起血流感染的危险因素[15]。因此对于CRKp来说,无论是何种耐药机制,长期反复住院、抗菌药物长期反复使用以及深静脉置管均为其引起血流感染的危险因素[16-17]。在临床特征方面,两组患儿除住院时间有差异外,余未见明显不同。de Jager 等[15]回顾性分析病例发现产NDM-1革兰阴性菌感染者住院时间明显长于非产NDM-1菌感染者,而本研究中产NDM-1肺炎克雷伯菌血流感染患儿的总体住院时间要短于非产NDM-1组,原因需进一步研究。
目前临床上针对CRKp的治疗药物仍非常有限,大多数数据来自回顾性病例,缺乏强有力的依据,本研究中CRKp菌株均为多重耐药菌,仅对阿米卡星、左氧氟沙星、环丙沙星敏感,应用这些敏感药物及包含碳青霉烯类药物联合治疗的患儿均好转出院,且未出现肾功能不全及软骨毒性等药物不良反应,值得注意的是,死亡的5例患儿均使用单药治疗,但由于严重的基础疾病对预后也有影响[18],所以尚不能判断本研究中联合治疗或单药治疗对结局的影响有无区别。死亡病例中有3例患儿分离细菌对美罗培南的MIC值≥4 mg/L,有研究报道美罗培南的MIC值与患儿病死率密切相关[19],然而由于本研究样本量的限制,尚无法判断美罗培南MIC值与死亡率之间的关系。多项研究证明在治疗CRKp血流感染患者时,即使是在碳青霉烯类耐药的情况下,包含碳青霉烯类药物的联合治疗要好于单药及其他药物的联合治疗[18,20-21];另外,对于CRKp感染来说,若碳青霉烯类药物的MIC值≤8 mg/L时,可以使用高剂量美罗培南以及延长输注时间[22-24],而美罗培南的MIC值> 8 mg/L时,使用高剂量及延长输注时间治疗CRKp血流感染效果减弱[25]。本研究中菌株对碳青霉烯类药物的MIC值较高,60%~90%菌株MIC值≥8 mg/L,故联合治疗可能效果更佳。本研究中CRKp菌株对阿米卡星的敏感度高,进行联合治疗后大多取得良好结局,有文献报道对于CRKp所致血流感染,单用氨基糖苷类药物即可有效[23]。另外临床医师在治疗产NDM-1组和非产NDM-1组患儿时用药方面并无差异,且二者结局也无差异,因此在治疗CRKp血流感染时,无论何种耐药机制,选择敏感药物以及进行联合治疗均为有效治疗手段。共识[12]中推荐联合治疗的基础用药为替加环素和多黏菌素,但由于在研究阶段本院尚未引入替加环素以及微生物室对肺炎克雷伯菌的药敏试验中不包括这两种药物,故无法对其分析。
本研究中分离的菌株多来自同一病房,但由于未做多位点序列分型和脉冲场凝胶电泳,所以无法观察分离自同一病房菌株之间的同源性以及菌株的流行情况。然而产NDM-1肺炎克雷伯菌菌株数量的增加提示可能存在克隆菌株在病房内的流行传播,而且碳青霉烯耐药基因多位于质粒上,容易导致耐药质粒在不同种属细菌间转移,使敏感株转为耐药株,继而在医院内播散流行,另外使用既往不常用的药物将会筛选出耐药谱更广的细菌,这将对患儿的治疗和预后构成严重威胁。因此在检验出产NDM-1型碳青霉烯酶细菌的病房,医务人员应积极做好手卫生措施以及对患儿进行接触隔离以防止交叉感染,有条件时可以划分隔离病房来更好地防止产NDM-1碳青霉烯酶细菌在病区内传播及流行。
综上所述,本院血培养分离出的产NDM-1肺炎克雷伯菌占CRKp总数的半数以上,呈逐年上升趋势。产NDM-1菌与非产NDM-1菌均为多重耐药菌,产NDM-1菌中高MIC值的菌株比例较高。产NDM-1与非产NDM-1肺炎克雷伯菌血流感染患儿在临床特征上无明显区别。医院内携带产NDM-1肺炎克雷伯菌数量的增多需引起重视,需积极采取严格的监控及有力的感控措施以防出现大范围的暴发流行。
[1] YONG D, TOLEMAN MA, GISKE CG, et al. Characterization of a new metallo-beta-lactamase gene, bla(NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure inKlebsiella pneumoniaesequence type 14 from India[J]. Antimicrob Agents Chemother,2009,53(12):5046-5054.
[2] HO PL, LO WU, YEUNG MK, et al. Complete sequencing of pNDM-HK encoding NDM-1 carbapenemase from a multidrugresistantEscherichiacolistrain isolated in Hong Kong[J]. PLoS One,2011,6(3):e17989.
[3] 王盛书,孙金柱,苏文莉,等. 我国携带 NDM-1基因耐药菌流行现况分析[J]. 军事医学,2015,39(11):825-830.
[4] NORDMANN P, POIREL L, WALSH T R, et al. The emerging NDM carbapenemases[J]. Trends Microbiol,2011,19(12):588-595.
[5] BORER A, SAIDEL-ODES L, RIESENBERG K, et al.Attributable mortality rate for carbapenem-resistantKlebsiella pneumoniaebacteremia[J]. Infect Control Hosp Epidemiol,2009,30(10):972-976.
[6] 王莲慧,魏丹丹,刘洋,等. 血流感染中肺炎克雷伯菌的分布及耐药性分析[J]. 实验与检验医学,2016,34(1):27-28.
[7] 张丽萍,刘杰,孟冬娅,等. 我国北方地区部分医院产新德里金属β-内酰胺酶肠杆菌分子流行病学研究[J]. 沈阳药科大学学报,2015,32 (10):808-813.
[8] JIN Y, SHAO C, LI J, et al. Outbreak of Multidrug Resistant NDM-1-ProducingKlebsiella pneumoniaefrom a Neonatal Unit in Shandong Province, China[J]. PLoS One,2015,10(3):e119571.
[9] CLSI. Performance standards for antimicrobial susceptibility testing[S]. Twenty-fourth informational supplement,2014,M100-S24.
[10] 杨银梅,叶惠芬,张伟红,等. 臭鼻克雷伯和鲍曼不动杆菌中检出NDM-1型金属β内酰胺酶基因[J]. 国际检验医学杂志,2011,32(13):1407-1409.
[11] 中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志,2001,81(5):314-320.
[12] 中华医学会血液学分会,中国医师协会血液科医师分会. 中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南(2016年版)[J]. 中华血液学杂志,2016,37(5):353-359.
[13] 董方,宋文琪,徐樨巍,等. 对碳青霉烯类抗生素不敏感肠杆菌科细菌产碳青霉烯酶基因型研究[J]. 中国感染与化疗杂志,2013,13(4):270-274.
[14] GUAN X, HE L, HU B, et al. Laboratory diagnosis, clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli: a Chinese consensus statement[J]. Clin Microbiol Infect,2016,22 (Suppl 1):s15-s25.
[15] DE JAGER P, CHIRWA T, NAIDOO S, et al. Nosocomial outbreak of new delhi metallo-β-lactamase-1-producing gramnegative bacteria in South Africa: a case-control study[J]. PLoS One,2015,10(4):e123337.
[16] PIRES D, ZAGALO A, SANTOS C, et al. Evolving epidemiology of carbapenemase-producingEnterobacteriaceaein Portugal: 2012 retrospective cohort at a tertiary hospital in Lisbon[J]. J Hosp Infect,2016,92(1):82-85.
[17] PAÑO PARDO JR, SERRANO VILLAR S, RAMOS RAMOS JC,et al. Infections caused by carbapenemase-producingEnterobacteriaceae: risk factors, clinical features and prognosis[J]. Enferm Infecc Microbiol Clin,2014,32 (Suppl 4):41-48.
[18] DAIKOS GL, TSAOUSI S, TZOUVELEKIS LS, et al.Carbapenemase-producingKlebsiella pneumoniaebloodstream infections: lowering mortality by antibiotic combination schemes and the role of carbapenems[J]. Antimicrob Agents Chemother,2014,58(4):2322-2328.
[19] NABARRO LEB, SHANKAR C, PRAGASAM AK, et al.Clinical and bacterial risk factors for mortality in children with carbapenem-resistantEnterobacteriaceaebloodstream infections in India[J]. Pediatr Infect Dis J, 2017, 36(6):e161-e166.
[20] GARBATI MA, SAKKIJHA H, ABUSHAHEEN A. Infections due to carbapenem resistantEnterobacteriaceaeamong Saudi Arabian Hospitalized patients: a matched case-control study[J].Biomed Res Int,2016:3961684.
[21] TANGDEN T, GISKE CG. Global dissemination of extensively drug-resistant carbapenemase-producingEnterobacteriaceae:clinical perspectives on detection, treatment and infection control[J]. J Intern Med,2015,277(5):501-512.
[22] DAIKOS GL, MARKOGIANNAKIS A. CarbapenemaseproducingKlebsiella pneumoniae: (when) might we still consider treating with carbapenems?[J]. Clin Microbiol Infect,2011,17(8):1135-1141.
[23] TZOUVELEKIS L S, MARKOGIANNAKIS A, PSICHOGIOU M, et al. Carbapenemases inKlebsiella pneumoniaeand otherEnterobacteriaceae: an evolving crisis of global dimensions[J].Clin Microbiol Rev,2012,25(4):682-707.
[24] TUMBARELLO M, TRECARICHI EM, DE ROSA FG, et al.Infections caused by KPC-producingKlebsiella pneumoniae:differences in therapy and mortality in a multicentre study[J]. J Antimicrob Chemother,2015,70(7):2133-2143.
[25] GOMEZ-SIMMONDS A, NELSON B, EIRAS DP, et al.Combination regimens for treatment of carbapenem-resistantKlebsiella pneumoniaebloodstream infections[J]. Antimicrob Agent Chemother,2016,60(6):3601-3607.
Clinical characteristics and antimicrobial resistance of the bloodstream infections due to NDM-1 producing Klebsiella pneumoniae in children
ZHANG Ye, DONG Fang, SONG Wenqi, GUO Lingyun, WANG Yan, LIU Gang. (Department of Infectious Disease, Beijing Children's Hospital, Capital Medical University, Beijing 100045, China)
R378.996
A
1009-7708 ( 2017 ) 05-0516-07
10.16718/j.1009-7708.2017.05.006
2017-01-16
2017-03-16
1. 首都医科大学附属北京儿童医院感染内科,北京 100045;*细菌室。
张烨(1990—),女,硕士研究生,主要从事儿童感染性疾病研究。
刘钢,E-mail:liugang10@hotmail.com。
