药动学/药效学研究在临床药敏折点制定中的应用
2017-10-16朱德妹
李 鑫, 朱德妹, 张 菁
药动学/药效学研究在临床药敏折点制定中的应用
李 鑫, 朱德妹, 张 菁
药动学/药效学界值;药敏折点;应用
1 概述
抗菌药物临床药敏折点用于判断病原菌对药物耐药或敏感,根据药敏试验方法的不同,折点可以用浓度或抑菌圈直径表示。药敏折点作为药敏试验结果的判断标准,为临床医师选择抗菌药物治疗病原菌感染提供了重要依据。在不同的文献中,折点可能被表述为不同的含义,欧洲药敏试验委员会 (European Committee on Antimicrobial Susceptibility Testing, EUCAST) 对 折 点 的 不 同表述进行了定义[1]。第1种是指流行病学界值(epidemiological cutoff,Ecoff),即微生物折点,也称作野生型界值(wild-type cutoff,COWT),用于将细菌划分为野生型和突变型。确定Ecoff值需要收集大量临床野生型菌株,进行药敏试验获得其MIC分布,之后取一个完整MIC分布的MIC90作为Ecoff值,或者根据野生型菌株MIC呈正态分布的特性,用非线性最小二乘回归等统计学方法得到[2]。第2种即药动学/药效学(pharmacokinetics/pharmacodynamics, PK/PD)界值,是临床药敏折点建立中不可缺少的数据,EUCAST对PK/PD界值的制定规定了一系列标准程序[3],包括微生物MIC分布测定,抗菌药物PK研究,从体外模型、动物模型以及临床研究中预测取得目标疗效的 PD 靶 值(pharmacodynamics target, PDT), 通过Monte Carlo模拟预测抗菌药物在目标群体中的药物暴露量以进行达标概率(probability of target attainment, PTA)分析等[4-5],最终获得PK/PD界值。第3种即临床药敏折点,是综合考虑以上2种界值以及临床治疗结果等数据得出,用于微生物实验室的最终报告,以判断临床中抗菌药物治疗病原菌感染成功或失败的可能性。目前国际公认的折点制定机构,一个为EUCAST,另一个为美国临床和实验室标准化协会(CLSI)。
EUCAST是由欧洲临床微生物与感染性疾病协会建立,成立于1997年,其主要职能是为新抗菌药物制定临床药敏折点以及对已有抗菌药物的药敏折点进行更新,同时,EUCAST的工作还包括制定Ecoff,在适用地区范围内统一药敏试验方法,发布抗菌药物对病原菌的MIC分布数据等,本文主要对EUCAST推荐的PK/PD界值制定过程进行介绍(图1)。
2 EUCAST抗菌药物PK/PD界值制定过程
EUCAST新版抗菌药物折点制定标准操作规程发布于2016年,规定了制定折点需要收集的相关数据和制定流程[3],主要包括以下几部分。
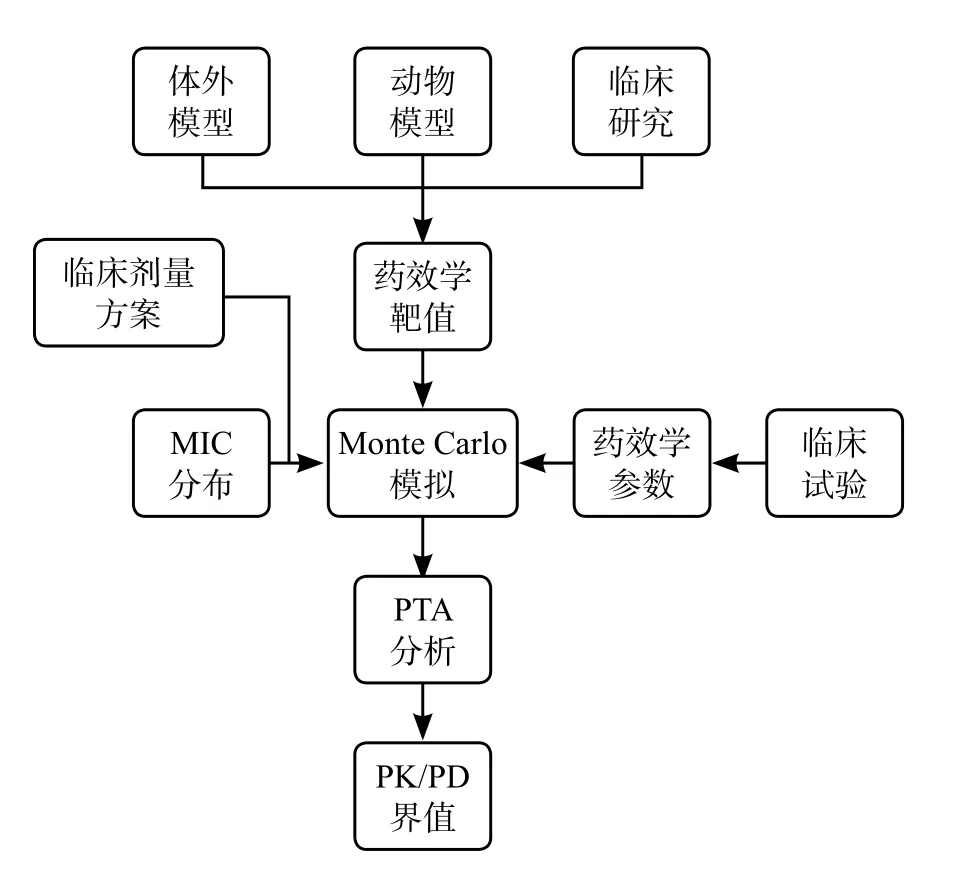
图1 EUCAST PK/PD界值制定流程
2.1 抗菌药物基本信息
抗菌药物基本信息包括其化学结构分类,抗菌谱及主要适应证,常用剂型及给药方式(口服、静脉注射、静脉输注等),临床推荐剂量(标准剂量及调整后剂量)等。对应不同的剂型和剂量方案,抗菌药物药敏折点可能不同。EUCAST根据抗菌药物临床标准剂量来确定S/I折点,据其最大剂量确定I/R折点。
2.2 确定抗菌药物对病原菌的MIC分布
EUCAST的抗菌药物MIC数据来源包括英国、挪威、法国等多个国家的耐药监测系统,已发表论文和会议报告,或由公司自行测定,要求在提交MIC数据的同时必须提供其测定方法,由于EUCAST从多种来源收集MIC数据,其测定方法并不统一,包括了国际标准化组织(ISO)、欧洲EUCAST、美国CLSI、英国抗菌化学治疗学会(BSAC)等多个组织推荐的标准方法。由不同方法获得的MIC值可能不同,但其变化较小,通常不超过一个稀释度,之后进行数据汇总绘制MIC分布柱状图并获得MIC50、MIC90和MIC范围等表征MIC分布特点的参数,对MIC分布进行统计分析后可得到该种细菌的Ecoff[2]。
除MIC值分布外,EUCAST还发布了抗菌药物对病原菌的抑菌圈直径分布,抗菌药物抑菌圈直径按照EUCAST规定的纸片扩散法进行测定[6-7],并根据抑菌圈直径与MIC值的相关性,确定了抗菌药物纸片扩散法的敏感折点[8]。
2.3 抗菌药物人体PK研究
药物疗效与感染部位的游离药物浓度直接相关,而体内药物浓度由给药剂量、给药方式以及药物体内PK过程等共同决定。明确抗菌药物在体内的PK过程,能够保证在感染部位有足够的药物浓度发挥抗菌作用,同时获得折点制定中所需要的Cmax、AUC、T1/2等PK参数。该部分数据来源于制药公司自己申请进行的临床试验或已发表的相关文献及会议报告。
健康人体内PK研究在Ⅰ期临床试验中完成,通常需进行多种剂量的单剂和多剂给药。组织部位药物浓度大多与体循环中血液药物浓度呈相关性,因此在PK研究中通常以血清、血浆或全血为样本测定体内药物浓度,还要注意考虑蛋白结合率的影响。但是在某些特殊情况下,则必须测定组织部位的药物浓度,例如对于脑膜感染患者,由于血脑屏障的存在,药物在血液和脑内感染部位的浓度差异很大,这就需要测定脑脊液中的药物浓度[9];对于肺炎感染患者,肺泡上皮细胞衬液比血浆更能准确代表肺组织中的药物浓度[10-11];还有一些特殊的目标适应证,可能需要测定中耳液、 前列腺液、白细胞内液的浓度。另外,不同目标群体的PK特征往往差异较大,例如适应证患者群体、肝肾功能有损伤的群体、老年人群体等,进行PK/PD研究时就需要预测特殊群体的PK参数。
2.4 抗菌药物PD研究
根据PK/PD特点的不同,抗菌药物可分为浓度依赖性和时间依赖性,浓度依赖性抗菌药物与疗效相关PK/PD指数通常为AUC/MIC和Cmax/MIC,时间依赖性抗菌药物根据其抗生素后效应(postantibiotic effect, PAE)的长短,对应 PK/PD指数分别为AUC/MIC和%T>MIC。PK/PD靶值又称为PDT,是基于对临床前或临床研究中药物暴露量-反应关系的分析,预测能够达到目标治疗效果的PK/PD指数的最小值。大量研究数据表明,临床前研究尤其是动物模型研究中获得的PDT与人体具有一致性[12-13],可以用于折点制定或给药剂量调整,同时临床前研究也避免了临床试验中的许多限制。
2.4.1动物模型研究 在抗菌药物的PK/PD研究中,动物感染模型作为重要方法被广泛采用。动物模型研究不仅可以模拟药物在人体内的吸收、分布、代谢和排泄过程,同时,也模拟了宿主免疫系统发挥的作用。Ambrose等[13]对各种感染性疾病的动物模型和人体研究获得的PK/PD指数进行了总结,发现在动物和人体内,能够达到治疗效果的药物暴露量和PDT是一致的,这并不难理解,因为抗菌药物作用的对象是病原菌而不是宿主。
Lepak等[14]、Andes等[15-16]最早对啮齿类动物感染模型的建立和抗菌药物动物体内PK/PD进行了大量研究,在PK/PD研究中常用的动物感染模型有大鼠/小鼠大腿感染模型和肺部感染模型,其建立方法都已经比较成熟,例如通过腿部菌液注射建立大腿感染模型[14],利用滴鼻法[17]、气管穿刺、气管插管[18]造成动物肺部感染等。随着动物模型的研究,一些其他模型也逐渐成功建立,包括血流感染模型、脑膜炎模型、皮肤软组织感染模型、尿路感染模型以及心内膜炎感染模型等[19-22]。为避免动物自身免疫系统的干扰作用,准确评价药物疗效,同时模拟感染患者免疫状态不同程度下降的情况,实验中通常采用腹腔注射环磷酰胺的方法获得中性粒细胞减少的免疫缺陷小鼠。
2.4.1.1获得动物PK参数[23]计算PK/PD指数需要获得药物在动物体内的AUC、Cmax、T1/2等PK参数。动物体内PK研究通常为单剂给药,设计3~5个剂量,需覆盖PD研究的剂量范围。采样点根据药物半衰期和给药时间间隔确定。啮齿类动物的药物清除率较快,药物在人体内的半衰期是小鼠体内的6~9倍[24],可以采用硝酸双氧铀造成动物肾小管损伤使药物在动物体内的半衰期与人体内接近。
2.4.1.2确定与疗效最佳相关PK/PD指数 应用动物模型确定PK/PD指数时,只需选用一株代表菌株进行感染。采用剂量分层法给药,设计4~5个日给药剂量,按照不同的时间间隔(例如间隔24、12、8、和6 h)给药。PD指标通常为给药24 h后动物感染部位每克组织细菌载量对数变化值(ΔLog10CFU),也可以用5~7 d内的生存率作为观察指标。结合PK研究中获得的参数和致病菌MIC值,计算不同给药方案中PK/PD指数的大小,用Emax模型对PK/PD指数和不同给药方案治疗后的PD结果的关系进行拟合,相关系数最大的指数即为最佳疗效相关指数[25](图2)。
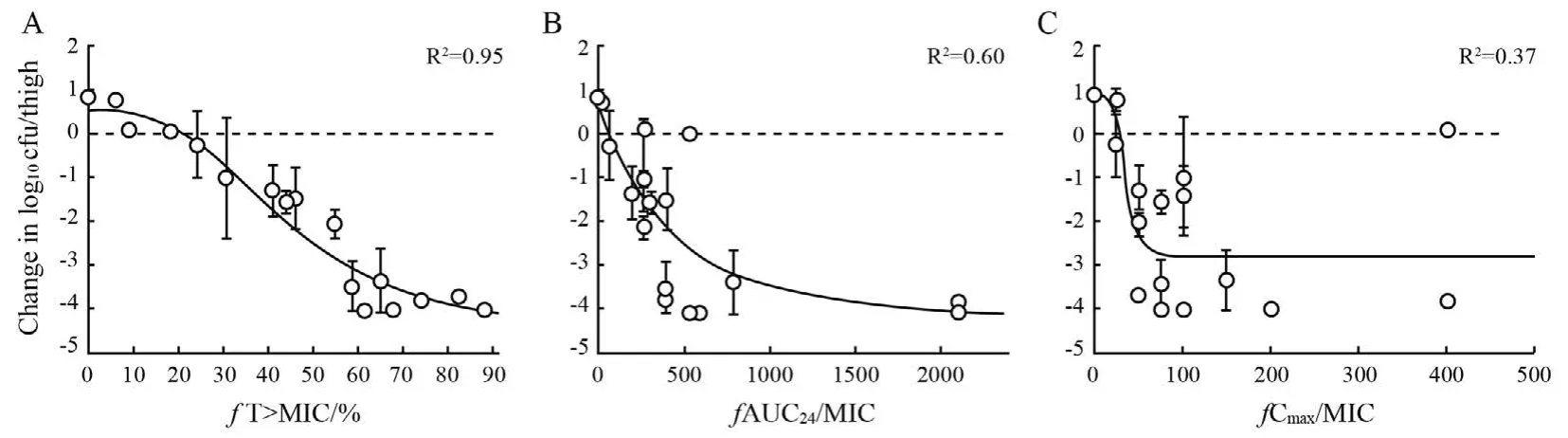
图2 舒巴坦在小鼠肺炎模型中的PK/PD分析[25]
2.4.1.3确定PDT 确定PDT的研究过程与确定疗效相关PK/PD指数基本相同,主要在细菌选择和给药频率上有所差别。确定PDT时,要增加感染动物细菌的种类和数量。对于同一种细菌,通常选用4~5株MIC值不同的菌株,尤其是耐药菌,用以观察PD指标随PK/PD指数的变化,检验对于不同菌种,或者同种菌不同敏感性的菌株PDT是否相同。同时,实验中可以只采用一种给药时间间隔,根据剂量拆分给药的实验结果和药物自身杀菌特点来确定。最后,分析PD结果和PK/PD指数的关系,在动物PK/PD研究中,通常认为Δlog10CFU=0时为取得抑菌效果,Δlog10CFU= -2或-3时为取得良好疗效。
2.4.2体外研究 在抗菌药物PK/PD研究中,体外中空纤维模型也有了越来越多的应用。相比动物模型,体外模型可以通过软件控制更准确模拟人体血药浓度变化过程,便于进行多时间点连续采样,对于动物体内不易生长的细菌尤其重要,同时可用于耐药性的研究。其缺点是不能模拟体内免疫系统的影响。从体外模型中获得PDT的过程与动物模型基本一致,同样需要获得药物在体外模型中的PK参数,确定PK/PD指数以及最后确定PK/PD靶值。另外,利用体外模型可以绘制药物杀菌曲线,对抗菌药物PK/PD指数进行初步判断或者确证。奈诺沙星为新型无氟喹诺酮类抗菌药物,体外PK/PD模型研究表明,其疗效与AUC0-24/MIC、Cmax/MIC相关性较好,下降3个Log10CFU时的靶值分别为AUC0-24/MIC≈47.05,Cmax/MIC≈5.07[26],该靶值已在人体PK/PD研究中作为药物剂量调整的参考数据[27]。
2.4.3临床研究 在临床试验中,给药方案往往比较单一,不能采用剂量分层法来确定最佳疗效相关PK/PD指数,同时,由于临床试验的伦理规范,不能给予患者安慰剂和亚临床治疗剂量,耐药菌感染患者的入选也有一定困难,可能缺少不敏感细菌感染病例的临床结果,在进行统计分析时也缺少临床和微生物治疗失败的案例 ,因此很少有临床试验用于PDT的确定,而是多用于回顾性的研究分析,以对从体外研究和动物模型研究中得到的靶值进行确证[1]。
2.5 进行Monte Crole模拟获得PK/PD界值
Monte Carlo模拟用于评价抗菌药物体内PK/PD指数达到PDT的可能性。在进行PK/PD分析时,不论是已有的致病菌MIC分布还是从临床试验中获得的人体PK参数,都只是一个样本,不能代表整体的MIC分布或者目标人群真实的PK参数。Monte Carlo模拟以现有的MIC分布特点、人体PK参数及其变异系数为基础,采用产生“随机数”的原理,进行5 000~10 000次模拟,获得在不同MIC值时的PTA。Drusano等[28-29]最早将Monte Carlo模拟应用到了抗菌药物的PK/PD研究及折点制定中,从2002年起,EUCAST将MCS规定为药敏折点制定中的标准方法。Monte Carlo的模拟结果有两种表示形式,第1种是用图表呈现随着MIC值的变化,达到1个或数个PDT时的PTA,通常取PTA≥90%时的MIC为PK/PD界值[30]。另1种是直接表示随着MIC值改变所能达到的PDT的大小,根据PDT的范围确定PK/PD界值(图3)。EUCAST抗菌药物折点基本文件中多采用第2种表示方法。
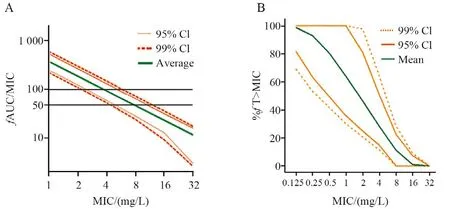
图3 氟康唑(400 mg/d,静脉注射,A)和头孢洛林(600 mg×2,60 min静脉注射,B)给药PTA结果[31-32]
3 EUCAST抗菌药物PK/PD界值制定实例介绍
氟康唑是唑类抗真菌药物,对念珠菌属抗菌活性良好,用于治疗念珠菌血症、侵袭性念珠菌病以及念珠菌引起的尿路感染、下呼吸道感染、骨髓炎、胆囊炎、关节炎等。其临床常用给药剂量为每天400 mg,最大剂量为每天800 mg,给药方式为口服或静脉注射[32]。氟康唑的人体PK参数如表1所示[33-35]。其疗效相关PK/PD指数为AUC/MIC, 在播散性念珠菌病小鼠感染模型中,剂量达到ED50所对应的PK/PD靶值为25[36],对于侵袭性念珠菌病,临床推荐靶值为100。图3为氟康唑Monte Carlo模拟结果,氟康唑剂量为每天400 mg,取PDT为100时与95%或99%下置信区间焦点所对应MIC值为PK/PD界值,2 mg/ L[32]。
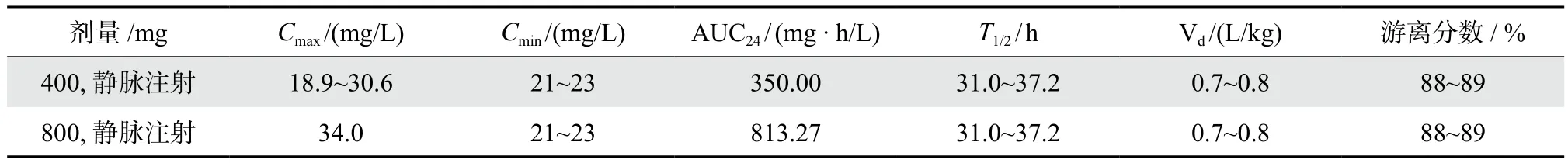
表1 氟康唑健康成年人常用剂量人体PK参数
头孢洛林为广谱头孢菌素类抗生素,于2010年10月在美国批准上市,对革兰阳性菌包括MRSA和耐多药肺炎链球菌以及常见革兰阴性菌具有杀菌活性,主要用于治疗成人社区获得性肺炎及复杂性皮肤软组织感染。常用给药方案为600 mg,每12小时1次,静脉滴注1 h,轻度肾损伤的患者剂量调整为400 mg。头孢洛林[31]的人体PK参数如表2所示。从体外模型、小鼠肺炎模型及小鼠大腿模型均得到头孢洛林与疗效相关PK/PD指数为%T>MIC。在体外PK/PD研究中,头孢洛林对金黄色葡萄球菌杀菌效果达到Δlog10CFU为-2时的靶值为(32.1±8.1)%[37]。在小鼠大腿感染模型中,头孢洛林对肺炎链球菌、金黄色葡萄球菌以及肠杆菌科感染达到Δlog10CFU=-2时的靶值分别为(50±10)%,(45±13)%和(54±3)%[15]。头孢洛林给药方案为600 mg,每12小时1次,1 h静脉滴注给药,取其PDT为50时获得的PK/PD界值为0.5 mg/L(置信区间为95%,图3)[31]。

表2 头孢洛林健康成年人临床常用剂量人体PK参数
4 结语
PK/PD界值是制定临床药敏折点的重要参考,并不能直接作为临床折点使用,还需和Ecoff进行平衡比较,从而获得一个初步的药敏折点。要求药敏折点尽量不要落在目标病原菌的野生型MIC分布中,即不能小于Ecoff[38],这样才能保证没有获得耐药机制的野生型菌株均被判断为“敏感”。初步折点制定后,还需继续收集临床试验数据对其进行确证,同时,如果抗菌药物有了新的适应证、目标致病菌和临床数据,病原菌敏感性发生变化,给药剂量进行了调整或者获得了新的PK/PD数据时,都应该根据情况对折点进行修订,EUCAST对已有抗菌药物折点修订流程也进行了规定[39]。
[1] TURNIDGE J, PATERSON DL. Setting and revising antibacterial susceptibility breakpoints[J]. Clin Microbiol Rev,2007,20(3):391-408.
[2] TURNIDGE J, KAHLMETER G, KRONVALL G. Statistical characterisation of bacterial wild-type MIC value distributions and the determination of epidemiological cut-off values[J]. Clin Microbiol Infect, 2006,12(5):418-425.
[3] European Committee on Antimicrobial Susceptibility Testing.Setting breakpoints for new antimicrobial agents, EUCAST SOP 1. 2[EB/OL]. [2016-12-11]. http://www. eucast. org.
[4] MOUTON JW, BROWN DF, APFALTER P, et al. The role of pharmacokinetics/pharmacodynamics in setting clinical MIC breakpoints : the EUCAST approach[J]. Clin Microbiol Infect,2012,18(3):e37-e45.
[5] 李耘, 郑波, 吕媛, 等. 新抗菌药物临床试验折点制定方案专家共识[J]. 中国临床药理学杂志, 2015,31(11):1069-1076.
[6] EUCAST Disk Diffusion Method for Antimicrobial Susceptibility Testing - Version 6. 0[EB/OL]. [2016-12-11]. http://www.eucast. org.
[7] MATUSCHEK E, BROWN DF, KAHLMETER G, et al.Development of the EUCAST disk diffusion antimicrobial susceptibility testing method and its implementation in routine microbiology laboratories[J]. Clin Microbiol Infect,2014,20(4):O255-O266.
[8] European Committee on Antimicrobial Susceptibility Testing.Procedure for establishing quality control criteria and zone diameter breakpoints for new antimicrobial agents. EUCAST SOP 9. 0[EB/OL]. [2016-12-11]. http://www. eucast. org.
[9] WU Y, KANG J, WANG Q. Drug concentrations in the serum and cerebrospinal fl uid of patients treated with norvancomycin after craniotomy[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(2):305-311.
[10] BERKHOUT J, MELCHERS MJ, VAN MIL AC, et al.Pharmacokinetics and penetration of ceftazidime and avibactam into epithelial lining fluid in thigh- and lung-infected mice[J].Antimicrob Agents Chemother, 2015,59(4):2299-2304.
[11] ZEITLINGER M, SCHWAMEIS R, BURIAN A, et al.Simultaneous assessment of the pharmacokinetics of a pleuromutilin, lefamulin, in plasma, soft tissues and pulmonary epithelial lining fl uid[J]. J Antimicrob Chemother, 2016,71(4):1022-1026.
[12] ABDUL-AZIZ MH, LIPMAN J, MOUTON JW, et al.Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing ef fi cacy and reducing resistance development[J]. Semin Respir Crit Care Med, 2015,36(1):136-153.
[13] AMBROSE PG, BHAVNANI SM, RUBINO CM, et al.Pharmacokinetics-pharmacodynamics of antimicrobial therapy:it's not just for mice anymore[J]. Clin Infect Dis, 2007,44(1):79-86.
[14] LEPAK AJ, MARCHILLO K, CRAIG WA, et al.In vivopharmacokinetics and pharmacodynamics of the lantibiotic NAI-107 in a neutropenic murine thigh infection model[J]. Antimicrob Agents Chemother, 2015,59(2):1258-1264.
[15] ANDES D, CRAIG WA. Pharmacodynamics of a new cephalosporin, PPI-0903 (TAK-599), active against methicillinresistantStaphylococcus aureusin murine thigh and lung infection models: identi fi cation of anin vivopharmacokineticpharmacodynamic target[J]. Antimicrob Agents Chemother,2006,50(4):1376-1383.
[16] ANDES D, CRAIG WA. Pharmacodynamics of the new fl uoroquinolone gati fl oxacin in murine thigh and lung infection models[J]. Antimicrob Agents Chemother, 2002,46(6):1665-1670.
[17] TAKASHIMA K, TATEDA K, MATSUMOTO T, et al.Establishment of a model of penicillin-resistantStreptococcus pneumoniaepneumonia in healthy CBA/J mice[J]. J Med Microbiol, 1996,45(5):319-322.
[18] 肖舒心, 赵旭, 郭蓓宁. 采用耳窥镜直视下气管插管法构建小鼠鲍曼不动杆菌肺炎模型[J]. 中国感染与化疗杂志, 2015,15(1):51-56.
[19] BRADY RA, BRUNO VM, BURNS DL. RNA-Seq Analysis of the host response toStaphylococcus aureusskin and soft tissue infection in a mouse model[J]. PLoS One, 2015,10(4):e124877.
[20] WANG L, Bi C, WANG T, et al. A coagulase-negative and non-haemolytic strain ofStaphylococcus aureusfor investigating the roles of SrtA in a murine model of bloodstream infection[J].Pathog Dis, 2015,73(6):ftro42.
[21] ROSSI B, SOUBIROU JF, CHAU F, et al. Cefotaxime and amoxicillin-clavulanate synergism against extended-spectrumbeta-lactamase-producingEscherichia coliin a murine model of urinary tract infection[J]. Antimicrob Agents Chemother, 2015,60(1):424-430.
[22] STUCKI A, ACOSTA F, COTTAGNOUD M, et al. Efficacy of ceftaroline fosamil againstEscherichia coliandKlebsiella pneumoniaestrains in a rabbit meningitis model[J]. Antimicrob Agents Chemother, 2013,57(12):5808-5810.
[23] 史军. 药物动力学和药效动力学在抗菌药物新药开发和临床治疗上的应用[J]. 中国临床药理学与治疗学, 2007,12(2):121-133.
[24] ANDES D, CRAIG W A. Animal model pharmacokinetics and pharmacodynamics: a critical review[J]. Int J Antimicrob Agents, 2002,19(4):261-268.
[25] YOKOYAMA Y, MATSUMOTO K, IKAWA K, et al.Pharmacokinetic/pharmacodynamic evaluation of sulbactam againstAcinetobacter baumanniiinin vitroand murine thigh and lung infection models[J]. Int J Antimicrob Agents, 2014,43(6):547-552.
[26] LIANG W, CHEN YC, CAO YR, et al. Pharmacokinetics and pharmacodynamics of nemonoxacin againstStreptococcus pneumoniaein anin vitroinfection model[J]. Antimicrob Agents Chemother, 2013,57(7):2942-2947.
[27] WU XJ, ZHANG J, GUO BN, et al. Pharmacokinetics and pharmacodynamics of multiple-dose intravenous nemonoxacin in healthy Chinese volunteers[J]. Antimicrob Agents Chemother,2015,59(3):1446-1454.
[28] DRUSANO GL, PRESTON SL, HARDALO C, et al. Use of preclinical data for selection of a phase II/III dose for evernimicin and identi fi cation of a preclinical MIC breakpoint[J]. Antimicrob Agents Chemother, 2001,45(1):13-22.
[29] DRUSANO GL, D'ARGENIO DZ, PRESTON SL, et al. Use of drug effect interaction modeling with Monte Carlo simulation to examine the impact of dosing interval on the projected antiviral activity of the combination of abacavir and amprenavir[J].Antimicrob Agents Chemother, 2000,44(6):1655-1659.
[30] FREI CR, WIEDERHOLD NP, BURGESS DS. Antimicrobial breakpoints for Gram-negative aerobic bacteria based on pharmacokinetic-pharmacodynamic models with Monte Carlo simulation[J]. J Antimicrob Chemother, 2008,61(3):621-628.
[31] European Committee on Antimicrobial Susceptibility Testing.Ceftaroline: Rationale for the clinical breakpoints, version 1.0[EB/OL]. [2016-12-15]. http://www. eucast. org.
[32] European Committee on Antimicrobial Susceptibility Testing.Fluconazole : Rationale for the clinical breakpoints, version 2.0[EB/OL]. [2016-12-15]. http://www. eucast. org.
[33] GRANT SM, CLISSOLD SP. Fluconazole,A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in superficial and systemic mycoses[J].Drugs, 1990,39(6):877-916.
[34] BRAMMER KW, FARROW PR, FAULKNER JK.Pharmacokinetics and tissue penetration of fluconazole in humans[J]. Rev Infect Dis, 1990,12 (Suppl 3) :s318-s326.
[35] GOA KL, BARRADELL LB. Fluconazole. An update of its pharmacodynamic and pharmacokinetic properties and therapeutic use in major superficial and systemic mycoses in immunocompromised patients[J]. Drugs, 1995,50(4):658-690.
[36] ANDES D, VAN OGTROP M. Characterization and quantitation of the pharmacodynamics of fl uconazole in a neutropenic murine disseminated candidiasis infection model[J]. Antimicrob Agents Chemother, 1999,43(9):2116-2120.
[37] MACGOWAN AP, NOEL AR, TOMASELLI S, et al.Pharmacodynamics of ceftaroline againstStaphylococcus aureusstudied in anin vitropharmacokinetic model of infection[J].Antimicrob Agents Chemother, 2013,57(6):2451-2456.
[38] ARENDRUP MC, KAHLMETER G, RODRIGUEZ-TUDELA JL, et al. Breakpoints for susceptibility testing should not divide wild-type distributions of important target species[J]. Antimicrob Agents Chemother, 2009,53(4):1628-1629.
[39] European Committee on Antimicrobial Susceptibility Testing.Review and revision of antimicrobial breakpoints, EUCAST SOP 3.1[EB/OL].[2016-12-20].http://www.eucast.org.
Application of PK/PD research in developing clinical susceptibility breakpoints of antimicrobial agents
LI Xin, ZHU Demei, ZHANG Jing. (Institute of Antibiotics, Huashan Hospital, Fudan University, Key Laboratory of Clinical Pharmacology of Antibiotics, Ministry of Health, Shanghai 200040, China)
R969.1
A
1009-7708 ( 2017 ) 05-0602-06
10.16718/j.1009-7708.2017.05.021
2017-02-10
2017-06-08
国家自然科学基金面上项目(81373494)。
复旦大学附属华山医院抗生素研究所,卫生部抗生素临床药理重点实验室,上海 200040。
李鑫(1993—),女,硕士研究生,主要从事抗生素动物体内药动学/药效学研究。
张菁,E-mail:zhangj61@fudan.edu.cn。
