褐飞虱热激蛋白70在不同温度胁迫下的差异表达特性研究
2017-09-23单丹王利华张月亮韩阳春牛洪涛潘磊方继朝1
单丹 王利华 张月亮 韩阳春 牛洪涛 潘磊 方继朝1,,*
(1南京农业大学 植物保护学院,南京 210095;2江苏省农业科学院 植物保护研究所,南京 210014;#共同第一作者;*通讯联系人,E-mail: fangjc126@126.com)
褐飞虱热激蛋白70在不同温度胁迫下的差异表达特性研究
单丹1,2,#王利华2,#张月亮2韩阳春2牛洪涛2潘磊2方继朝1,2,*
(1南京农业大学 植物保护学院,南京 210095;2江苏省农业科学院 植物保护研究所,南京 210014;#共同第一作者;*通讯联系人,E-mail: fangjc126@126.com)
【目的】褐飞虱是我国主要水稻害虫之一,随着全球气候变暖,其越冬范围逐年扩大。为了明确褐飞虱对温度的适应机制,研究了其热激蛋白70基因家族的组成及温度诱导表达特性。【方法】利用转录组测序和GenBank数据库获取热激蛋白70基因序列,采用MEGA4.1邻接法构建进化树,利用实时荧光定量PCR研究其温度诱导表达特性。【结果】筛选出与热激蛋白70基因同源性较高且具有完整开放阅读框的序列共15个,其中8个在正常或温度胁迫下表达,可能分布在细胞质/细胞核、内质网、线粒体等器官,且本身表达丰度存在显著差异。30~44℃高温胁迫后KX976471、KX976473、KX976475、KX976476、KX976477和KX976478等6个基因的表达量不同程度上调,最大上调倍数为1.72~245.33;0~22℃低温胁迫后,除KX976475表达量上调2.38倍外,其余基因表达量变化不显著或下降。【结论】褐飞虱8个热激蛋白70基因在正常或温度胁迫下表达,可能分布于细胞质/核、线粒体、内质网;在其高温适应性中可能起重要作用,但在低温适应性中的作用有限。
褐飞虱;温度;热激蛋白70;诱导表达
褐飞虱是危害我国水稻的三种主要稻飞虱之一。据统计,自20世纪以来,褐飞虱在东亚的暴发次数超过10次,而且危害有加重的趋势[1]。江苏省2004-2013 年的 10 年间,有3年褐飞虱大发生,3年偏重及偏重至大发生。广西省1991-2012年的22年间,褐飞虱偏重或大发生年份竟占17年,中等发生年份仅为5年[2]。贵州省江口县在1977-2007间,大发生年份有5年,中等偏重发生年份有5年[3]。
褐飞虱的发生受多种因素的影响。稻田生态系统自我调节能力差、水稻品种敏感、迁入虫量大、气候适宜等是褐飞虱大发生的主要原因[1]。褐飞虱最适发育温度为24~28℃[4,5]。28℃时产卵量最高,发育历期最短;34℃是其发育的限制性高温,该温度下卵不能孵化[5]。褐飞虱对高温具有一定的适应性。在一定的范围内,适当提高温度有利于褐飞虱繁殖,促进其种群发展[6,7]。Ghobadifar等[8]发现,在29~32℃气温下田间仍有褐飞虱活动;但是发生季节连续低温抑制褐飞虱的发育,导致低龄幼虫死亡,使其种群数量急剧减少[9]。
热激蛋白70是热激蛋白家族主要成员之一,在进化上高度保守。热激蛋白70家族主要包括4个成员,分别是诱导性热激蛋白70、组成型热激蛋白70、葡萄糖调节蛋白78 和GRP75[10]。其中,诱导性热激蛋白70正常情况下不表达或者低表达,但在温度等胁迫因子处理后,其表达量急剧上升;组成型热激蛋白70在正常环境下表达,在温度等胁迫因子作用下,其表达量轻微上升或不变;葡萄糖调节蛋白78主要位于内质网;GRP75主要位于线粒体内[10]。热激蛋白70在生物对温度胁迫的抗逆性中起重要作用。如苹果实蝇、始红蝽热激蛋白70表达量增加使其对高温或低温的耐受性增强[11,12]。为了明确褐飞虱对温度胁迫的适应机制,本研究筛选并克隆了正常或温度胁迫下表达的热激蛋白70家族基因序列,比较了这些基因在高温和低温处理后的表达特性,以期为了解温度胁迫下褐飞虱种群发展的内在机制提供理论参考。
1 材料与方法
1.1 供试褐飞虱
供试褐飞虱于2006年采自南京,室内采用武运粳7号饲养,饲养条件如下:温度27±1℃,相对湿度为65%,光周期为14h光照/10h黑暗。
1.2 热激蛋白70基因的筛选
褐飞虱热激蛋白70基因序列来源于转录组数据库。首先根据基因注释,从我们测定的褐飞虱转录组数据库中筛选热激蛋白70基因,然后再根据基因同源性搜索GenBank 褐飞虱转录组数据库,获得已登录的热激蛋白 70基因序列。在获得这些序列后,采用Sequencher 4.7组装排除重复序列。
1.3 褐飞虱温度相关热激蛋白70基因的克隆和序列分析
分别采用39℃、14℃温度处理褐飞虱,收集处理1h试虫和未处理试虫,提取总 RNA。总 RNA提取参照Promega公司的总RNA提取试剂盒(SV Total RNA Isolation System)说明书进行。将液氮速冻试虫研磨后加入175 µL裂解液,然后加入350 µL RNA稀释缓冲液,70℃下 3 min后,4℃下离心20 min。然后过柱、加入DNA酶后漂洗;最后加入100 µL无核酸酶的双蒸水洗脱。提取总RNA后使用1%琼脂糖凝胶电泳和微量分光光度计(Eppendorf BioPhotometer Plus) 检测RNA的完整度、纯度与浓度,-80℃下超低温冰箱贮存。
热激蛋白70基因克隆时将39℃、14℃温度处理和对照总 RNA等比例混合,反转录成cDNA,然后根据热激蛋白70基因序列,设计引物,克隆温度相关的热激蛋白70基因。采用ScanProsite 分析克隆序列的保守区域,预测其等电点、分子量等,采用DNAssist进行序列比对,利用Mega 4.1构建分子进化树。
1.4 热激蛋白70基因表达量分析
1.4.1 试虫处理
褐飞虱热激蛋白70基因丰度分析时,试虫直接取羽化1d的雌成虫,提总 RNA,然后进行qPCR分析。
温度诱导热激蛋白70基因表达特性分析时,收集羽化1d雌成虫,分别在低温0、6、10、14、18、22℃和高温30、33、36、39、42、44℃下处理1h,26℃恢复1h,液氮速冻后存于-80℃冰箱,用于总RNA提取。每处理3次重复,每重复6头。
1.4.2 总 RNA提取
总 RNA提取采用Promega公司总RNA提取试剂盒(SV Total RNA Isolation System)进行。方法与1.3同。在微量分光光度计测定RNA的浓度后,根据浓度计算cDNA第1链合成时所需的模板体积。
1.4.3 cDNA第1链的合成
cDNA第1链的合成采用TaKaRa的实时定量PCR反转录试剂盒[PrimeScript™ RT Master Mix (Perfect Real Time)]进行。根据试剂盒说明书,以500 ng总 RNA为模板,加入2 µL 含反转录酶预混液(5×PrimeScript RT Master Mix),然后以无RNA酶双蒸水补至10 µL,37℃下温育30 min,85℃下10s灭活反转录酶即得到第1链cDNA。

表1 褐飞虱热激蛋白70基因qPCR引物序列Table 1. Primer sequences of heat shock protein 70 genes for qPCR in N. lugens.
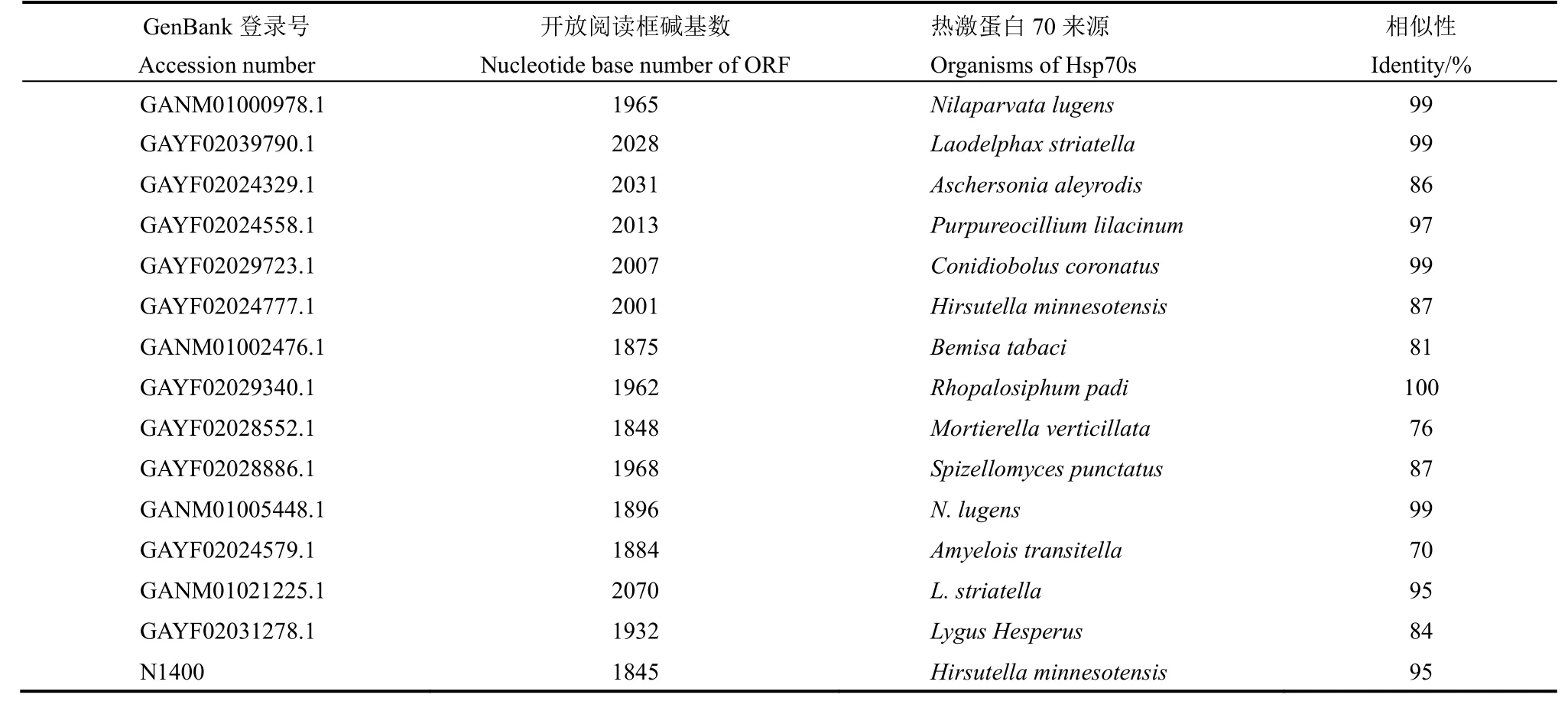
表2 从转录组数据库筛选到的褐飞虱热激蛋白70基因Table 2. Heat shock protein 70 genes of N. lugens screened from transcriptomic database.
1.4.4 实时荧光定量PCR
实时荧光定量PCR(qPCR)参考王利华等[13]的方法进行,以β-actin(EU179846)为内参[14],取1 µL稀释20倍的cDNA为模板,分别加入10 µL含Taq酶的qPCR预混液[ SYBR®Premix Ex Taq™、0.4 µL ROX Reference Dye (50×)]、和0.4 µL 10 µmol/L 上游和下游引物(引物序列见表1),以水补至20 µL。先95℃下预变性30 s,然后95℃下 5 s,60℃下31 s,共40个循环,最后进行溶解曲线的扩增。
1.5 数据分析
热激蛋白相对表达量的计算采用2-ΔΔCT法[15]。丰度比较时,以表达量最低的基因为对照,分别计算其他7个基因的相对表达量。温度诱导表达量的计算以正常饲养试虫为对照,结果采用SPSS 19.0ANOVA进行方差分析,最小显著性差异法在0.05水平上进行差异显著性分析。
2 结果与分析
2.1 热激蛋白70基因筛选
从GenBank转录组数据库获得与热激蛋白70同源性超过70%的基因序列22个,我们测定的转录组数据注释为热激蛋白70的序列共12个,排除重复序列后发现具有完整ORF的热激蛋白70基因共15个,其中GANM01000978.1等14个基因可以在GenBank转录组数据库中找到同源序列,N1400首次在褐飞虱中发现。这些基因与热激蛋白70基因的氨基酸同源性最高达到100%(表2)。进化树分析结果显示同一物种不同组织间热激蛋白70的同源性低于不同物种相同组织。GAYF02039790.1、GAYF02024777.1 与果蝇和人类的内质网热激蛋白70序列聚为一类,GAYF02024329.1、GAYF02029723.1和GANM01021225.1 与线粒体热激蛋白70聚为一类(图1)。
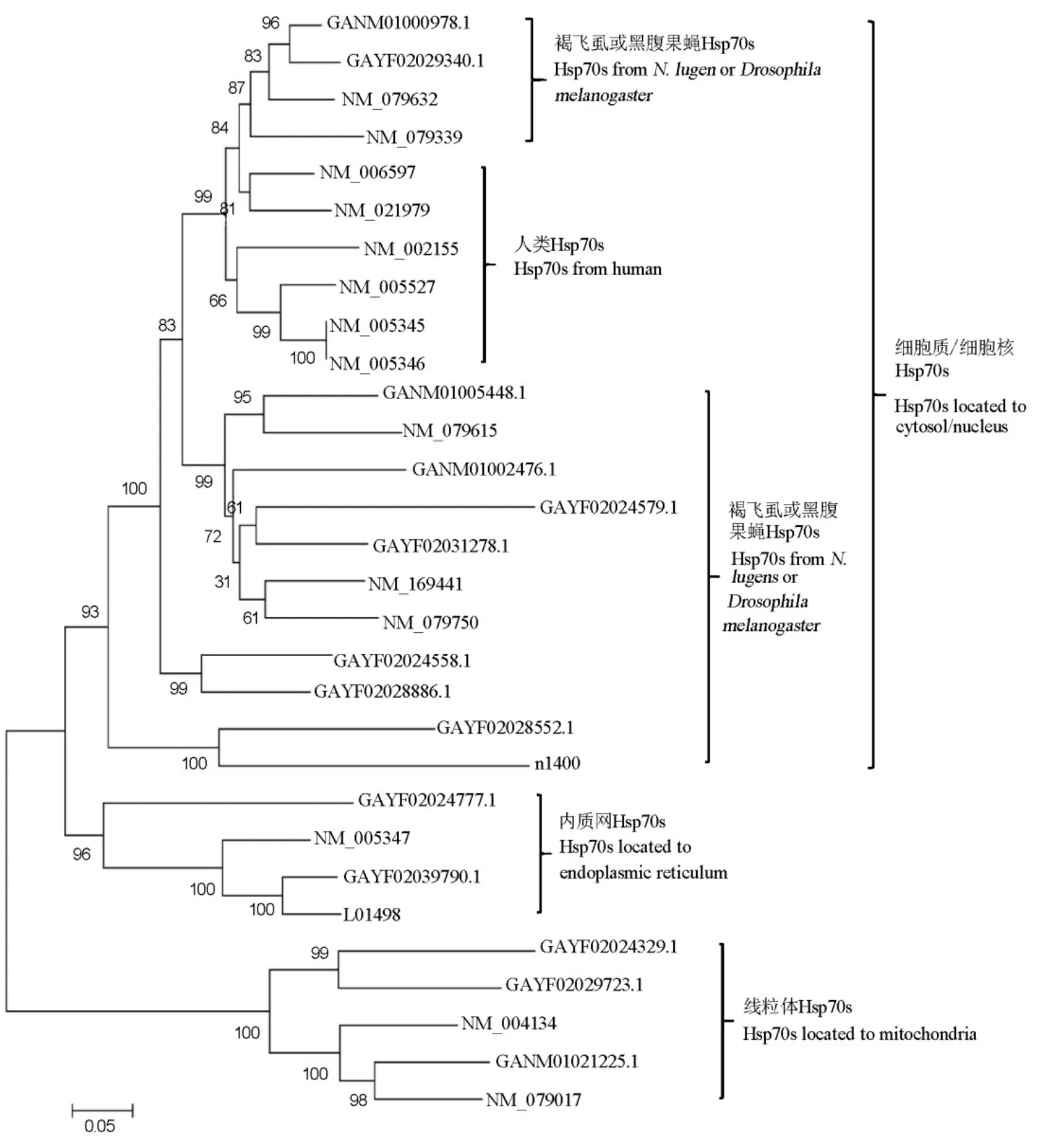
图1 褐飞虱与黑腹果蝇和人类的热激蛋白70的进化树Fig.1. Phylogenetic tree of HSP70 from N. lugens, Homo sapiens and Drosophila melanogaster based on Neighbor-Joining method.
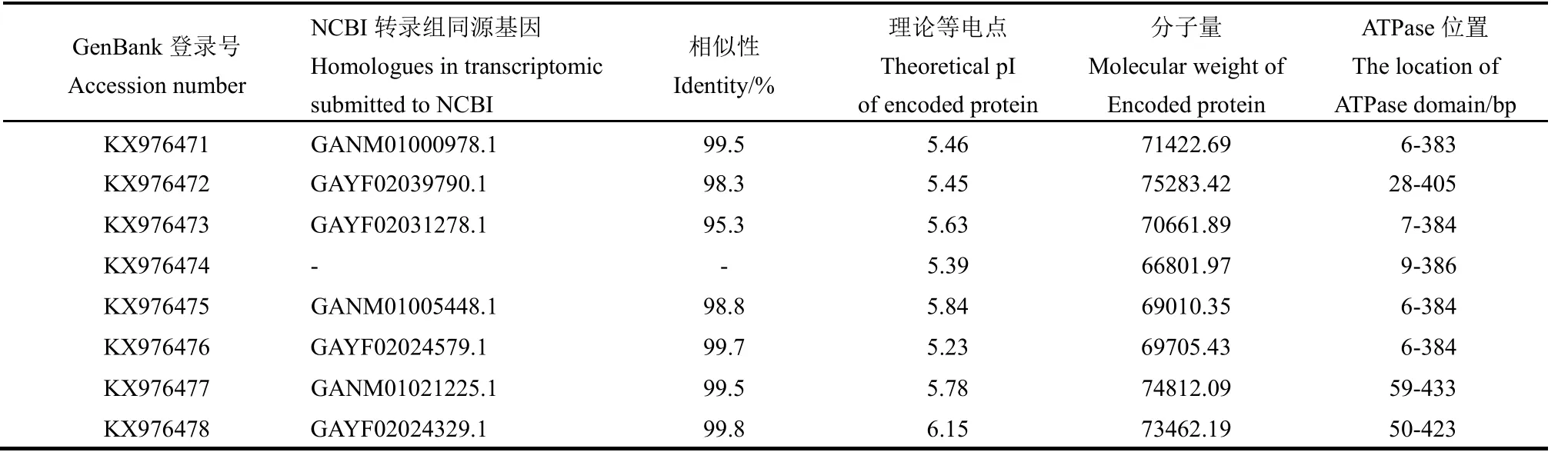
表3 褐飞虱正常或温度胁迫下表达的热激蛋白70序列及特征Table 3. Heat shock protein 70 genes cloned from N. lugens reared in normal condition or treated by high temperature stress.
2.2 褐飞虱正常或温度胁迫下表达的热激蛋白70基因克隆及序列分析
RT-PCR结果表明在正常或温度胁迫后,褐飞虱体内表达的热激蛋白70基因共有8个,基因登录号为KX976471-8。与NCBI转录组数据库中相关重复序列的相似性为95.3%~99.8%。预测这些基因编码的蛋白质分子量为66 801.97~75 283.42,等电点为4.94~6.15(表3)。所有基因都含有热激蛋白70的三个标志性序列,N端有ATPase结构域。KX976472 C端还有内质网靶向序列,N端含有信号肽序列(图2)。KX976477、KX976478 与其他6个基因相比N端ATPase结合区域前具有更长的碱基序列。
2.3 热激蛋白70的丰度比较

图2 克隆的褐飞虱热激蛋白70氨基酸序列比对Fig. 2. Amino acid alignment of heat shock protein 70 cloned from N. lugens.
褐飞虱热激蛋白70的丰度如图3所示。正常情况下,8个热激蛋白基因的表达存在显著差异。按从高到低的顺序排列依次为KX976471>KX976472> KX976477> KX976473> KX976475>KX976478> KX976476> KX976474。ANOVA数据分析结果显示KX976471和 KX976472的表达量显著高于其他6个热激蛋白70基因。
2.4 温度对热激蛋白70的诱导
2.4.1 高温对热激蛋白70的诱导
30~44℃高温处理后,褐飞虱热激蛋白70的表达量存在显著差异,KX976473和KX976476表达显著上升,尤其是KX976473,在42~44℃处理后,其表达量提高200倍以上。KX976472和KX976474在处理前后表达量无显著变化。其余4个基因KX976471、KX976475、KX976477和KX976478分别在44、30、39、33℃具有最高表达量,但是上升倍数均小于3倍(图4)。
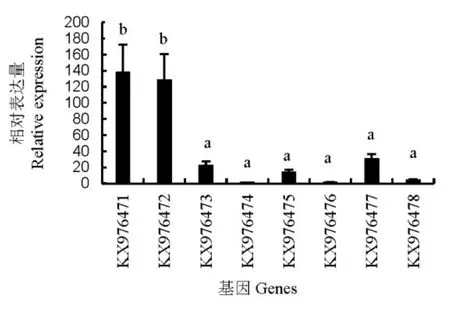
图3 褐飞虱热激蛋白70丰度分析Fig. 3. Comparison of abundance of heat shock protein 70 cloned from N.lugens.
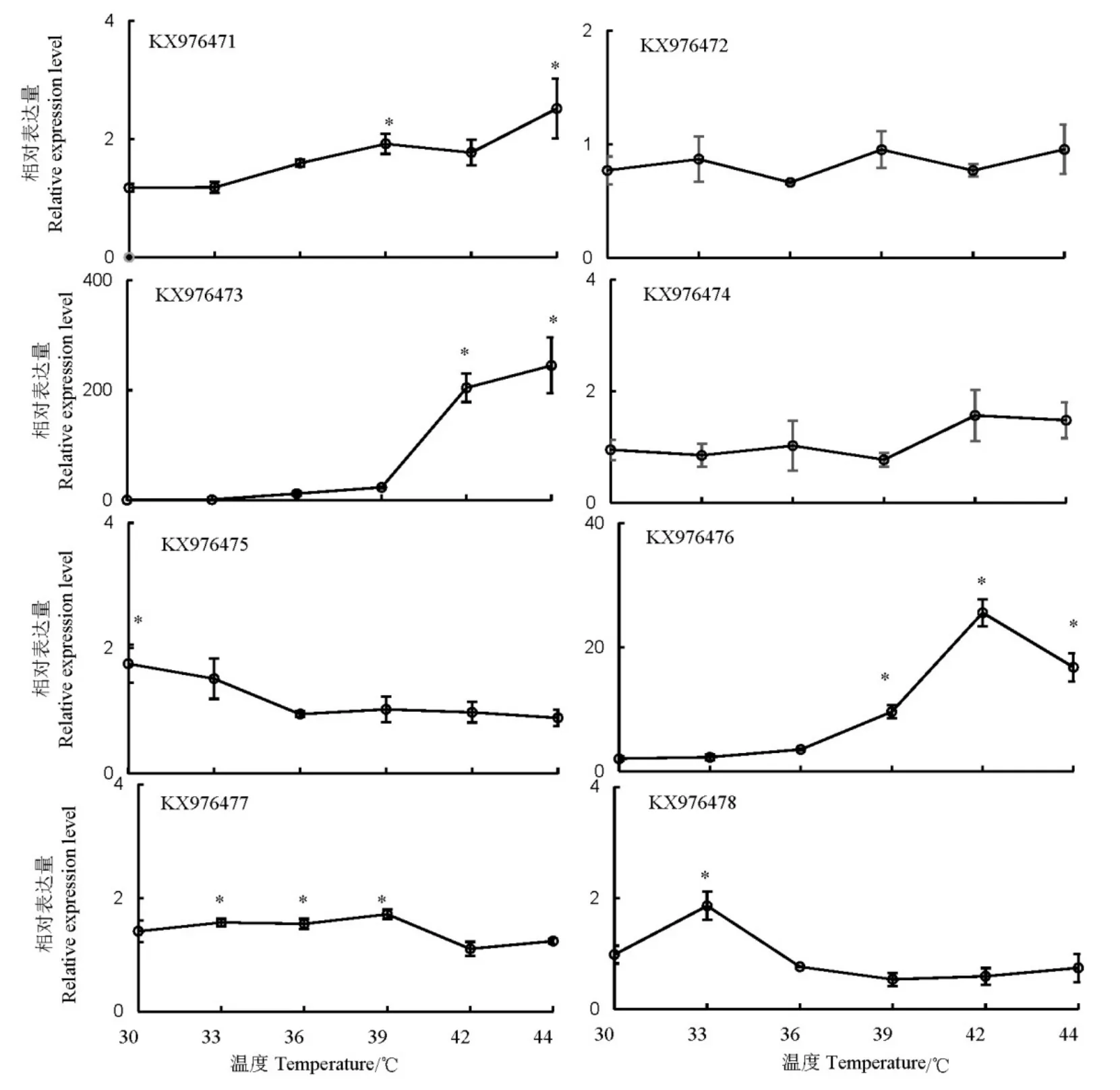
图4 高温胁迫对褐飞虱热激蛋白70基因表达量的诱导Fig. 4. Expression of heat chock protein 70 genes induced by high temperature in N. lugens.
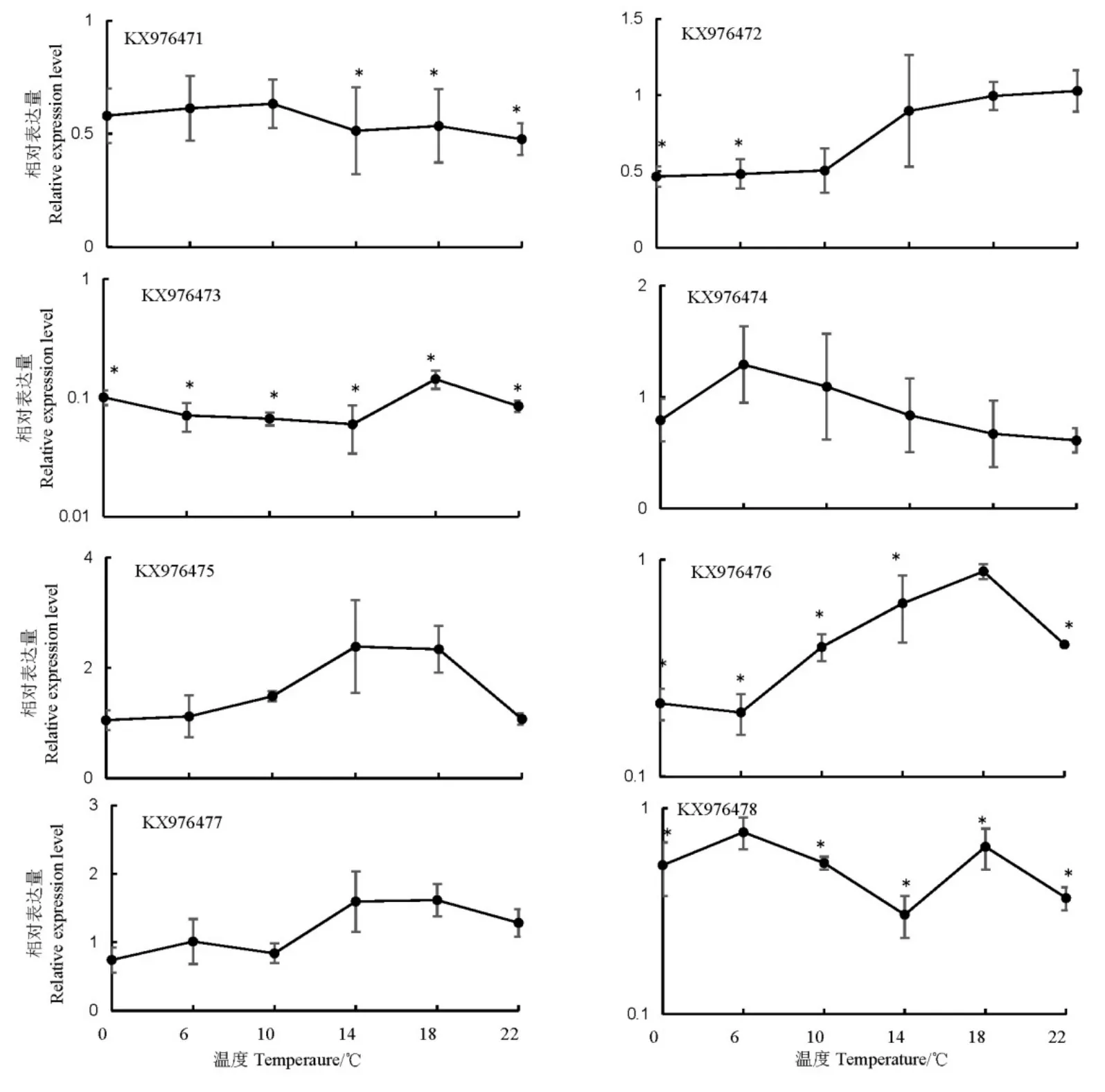
图5 低温胁迫对褐飞虱热激蛋白70基因表达量的诱导Fig. 5. Expression of heat chock protein 70 genes induced by low temperatures in N.lugens.
2.4.2 低温对热激蛋白70的诱导
低温胁迫对褐飞虱热激蛋白70表达的影响与高温胁迫存在显著差异。0~22℃低温胁迫后,除KX976475的表达量在14℃上升2.38倍外,KX976474和KX976477的表达量变化不显著,其余5个基因KX976471、KX976472、KX976473、KX976476和KX976478的表达被抑制,尤其是KX976473在14℃处理后,表达量下降约17倍(图5)。
3 讨论
昆虫热激蛋白70家族成员数量在不同种间差异较大。如家蚕(Bombyx mori)有10个热激蛋白70基因,其中4个为诱导型,6个为组成型[16]。珍珠边豹纹蝶(Glanville fritillary)有7个热激蛋白70基因,其中1个可能位于内质网,6个位于细胞质[17]。褐飞虱热激蛋白70家族至少包括15个成员,2个可能位于内质网,3个位于线粒体,其余位于细胞质或细胞核。位于内质网和线粒体的热激蛋白70与一般热激蛋白70的亲缘关系较远,其遗传距离大于不同物种间相同器官来源的热激蛋白70,这与果蝇热激蛋白70进化特征一致[18]。
正常和温度胁迫下表达的褐飞虱热激蛋白70基因有8个,其中KX976473和KX976476为诱导型热激蛋白70,KX976472位于内质网,KX976477和KX976478位于线粒体,其余4个基因为组成型热激蛋白70。以温度胁迫和正常试虫混合cDNA为模板,尚有7个热激蛋白70基因没有克隆出来。这可能有两方面的原因。一是这些基因表达丰度很低,在检测下限之下;二是这些基因可能与温度胁迫保护无关,而是对温度以外的其他胁迫因子负责。
热激蛋白70在生物应对高温、农药等环境胁迫中起重要作用[19]。研究发现害虫如梨小食心虫(Grapholita molesta)、珍珠边豹纹蝶、柑桔红螨(Panonychus citri)、三叶草斑潜蝇(Liriomyza trifolii)、烟粉虱(Bemisia tabaci)、苹果蠹蛾(cydia pomonella)、臭虫(Cimex lectularius)等热激蛋白70与其温度适应性有关,在温度胁迫后表达量急剧上升[17,20-25]。而且不同器官来源的热激蛋白70在减少胁迫伤害中具有一定的协同作用,如内质网和细胞质热激蛋白70通过协同作用提高机体对高温的适应性[26]。线粒体热激蛋白70 (PnHSP70)在生物高温、盐、干旱等环境胁迫保护中也起重要作用[27]。高温胁迫后,褐飞虱线粒体热激蛋白和细胞质/细胞核热激蛋白70表达量不同程度上升,可能促进其对高温的适应。
热激蛋白70家族不同成员具有不同的胁迫保护谱。苹果蠹蛾CpHsp70-1对高温胁迫具有保护作用,在高温胁迫后表达量显著上升,但对杀虫剂胁迫不敏感[20]。珍珠边豹纹蝶Hsp70和Hsc70在高温热激后表达量显著上升,但低温胁迫后,Hsp70表达量不变,Hsc70表达量仅轻微上升[17]。西花蓟马Fo-HSP70 的表达量与诱导温度有关;0℃胁迫时表达量显著上升;-4℃胁迫其表达量显著下降;31~46℃高温胁迫其表达量显著上升[28]。柑桔红螨3个热激蛋白70基因对冷胁迫无反应,但PcHsp70-2在热激后表达上调[22]。褐飞虱Nlhsc70在高温胁迫后表达量显著上升,但低温胁迫后表达量变化不大[29]。本研究发现褐飞虱8个热激蛋白70中,仅有2个对高温胁迫不敏感,其余6个基因在高温处理后其表达量不同程度上升;而低温胁迫后,除1个基因表达量轻微上调外,其余基因表达下降或无显著变化。尤其是KX976473在高温胁迫时表达量急剧上升,但低温胁迫时显著下降。这些结果说明褐飞虱高温和低温胁迫的保护机制可能存在差异,热激蛋白70在褐飞虱高温胁迫保护中起重要作用,但在低温胁迫伤害中的作用不大。这可能与褐飞虱的生物学特性有关。褐飞虱是一种迁飞性害虫,其越冬北界随各年冬季气温高低而摆动于北纬21~25℃间,这些地区冬季日均最低气温在15℃左右,所以褐飞虱野外生存中一般不需应对极端低温,因此,在进化上较少保留应对低温胁迫的基因。
综上所述,本研究通过转录组获取了15个褐飞虱热激蛋白70基因,其中8个可能与其温度适应性有关。这些与温度相关的热激蛋白70基因可能分布在细胞质/细胞核、内质网、线粒体等器官,在褐飞虱温度适应性中起不同的作用。正常情况或温度胁迫后,这些基因的表达量存在显著差异。大部分基因在高温胁迫后表达量上升,低温胁迫后下降或无变化,说明这些热激蛋白70基因在高温胁迫中可能起重要作用,但对低温胁迫不敏感。
[1] Cheng J A. Rice Planthoppers in the Past Half Century in China. Hangzhou: Zhejiang University Press, 2014: 1-33.
[2] 唐广田, 包云轩. 广西褐飞虱发生特点及其迁飞路径分析. 中国农业气象, 2015, 36(1): 74-82. Tang G T, Bao Y X. Analysis on occurrence pattern and migratory paths of brown plant-hopper in Guangxi Province. Chin J Agrometeorol, 2015, 36(1):74-82. (in Chinese with English abstract)
[3] 闫香慧, 刘怀, 赵志模, 何恒果, 代建平, 程登发. 水稻褐飞虱灯下发生期及种群数量动态分析. 植物保护学报, 2008, 35(6): 501-506. Yan X H, Liu H, Zhao Z M, He H G, Dai J P, Cheng D F. Population dynamics and occurrence period of brown planthoppers based on the historic data analysis of light trap catches. J Plant Prot, 2008, 35(6): 501-506.(in Chinese with English abstract)
[4] 祝树德, 陆自强, 杭杉保, 徐海. 温度对褐飞虱种群调控作用研究. 华东昆虫学报, 1994, 3(1): 53-59. Zhu S D, Lu Z Q, Hang S B,Xu H.Study of the temperature regulation on brown planthopper population. Entomol J East China,1994, 3(1): 53-59. (in Chinese with English abstract)
[5] 石保坤, 胡朝兴, 黄建利, 侯茂林. 温度对褐飞虱发育、存活和产卵影响的关系模型. 生态学报, 2014, 34(20): 5868-5874. Shi B K, Hu C X, Huang J L,Hou M L. Modeling the influence of temperature on development, survival and oviposition of the brown planthopper, Nilaparvata lugens. Acta Ecol Sin, 2014, 34(20): 5868-5874. (in Chinese with English abstract)
[6] Shi B K, Huang J L, Hu C X, Hou M L. Interactive Effects of Elevated CO2and Temperature on Rice Planthopper, Nilaparvata lugens. J Integ Agric, 2014, 13(7): 1520-1529.
[7] Pandi G G P, Chander S, Singh M .P, Pathak H. Impact of Elevated CO2and temperature on brown planthopper population in rice ecosystem. Proc Nat Acad Sci, India Sec B: Biol Sci, 2016: 1-8.
[8] Ghobadifar F, Aimrun W, Jebur M N. Development of an early warning system for brown planthopper (BPH) (Nilaparvata lugens) in rice farming using multispectral remote sensing. Prec Agric, 2016, 17(4): 377-391.
[9] 彭兆普, 马明勇, 傅强, 李一波, 邓龙飞. 湖南近三年褐飞虱发生规律研究. 植物保护, 2012, 38(4): 147-151. Peng Z P, Ma M Y, Fu Q, Li Y B, Deng L F. Occurrenceof the brown planthopper in Hunan Province in recent years. Plant Prot, 2012, 38(4): 147-151. (in Chinese with English abstract)
[10] Daugaard M, Rohde M, Jäättelä M. The heat shock protein 70 family: Highly homologous proteins with overlapping and distinct functions. FEBS letters, 2007, 581(19): 3702-3710.
[11] Vladimír K, Michaela T B. The 70 kDa heat shock protein assists during the repair of chilling injury in the insect,Pyrrhocoris apterus. Plos One, 2009, 4(2): e4546.
[12] Giancarlo L, Davidl D. Regulation of heat shock proteins in the apple maggot Rhagoletis pomonella during hot summer days and overwintering diapause. Physiol Entomol, 2008, 33(4): 346-352.
[13] 王利华, 单丹, 方继朝. 灰飞虱LHSC70基因表达特性及功能研究. 中国水稻科学,2015, 29(4): 424-430. Wang L H, Shan D, Fang J C. Expression profiling and function analyses of LHSC70 in Laodelphax striatellus, Chin J Rice Sci, 2015, 29(4): 424-430.(in Chinese with English abstract)
[14] Jiang J J, Huang L F, Chen H S, et al. Identification of reference genes and expression analysis of heat shock protein genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae), after exposure to heat stress. Acta Entomol Sin, 2015, 58(5): 479- 486.
[15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) Method. Methods, 2001, 25(4): 402-408.
[16] Lin H J, Li Z, Dang X Q, Su W J, Zhou Z Y. Short-term increased expression of the heat shock protein 70 family members during heat shock is positively correlated with basal thermotolerance in the midgut of three strains of the silkworm. Bombyx mori. African Entomol, 2009, 22(1): 24-29.
[17] Luo S, Ahola V, Shu C, Xu C, Wang R. Heat shock protein 70 gene family in the Glanville fritillary butterfly and their response to thermal stress. Gene , 2015, 556(2): 132-141.
[18] Rubin D M, Mehta A D, Zhu J, Shoham S, Chen X, Wells Q R, Palter K B. Genomic structure and sequence analysis of Drosophila melanogaster HSC70 genes. Gene, 1993, 128(2): 155-163.
[19] Wang L, Shan D, Zhang Y, Liu X, Sun Y, Zhang Z, Fang J C. Effects of high temperature on life history traits and heat shock protein expression in chlorpyrifos-resistant Laodelphax striatella. Pestic Biochem Physiol, 2017, 136: 64-69.
[20] Yang X Q, Wu Z W, Zhang Y L, Barrosparada W. Toxicity of six insecticides on codling moth (Lepidoptera: Tortricidae) and effect on expression of detoxification genes. J Econ Entomol, 2016, 109(1): 320-326.
[21] Chen H, Xu X L, Li Y P, Wu J X. Characterization of heat shock protein 90, 70 and their transcriptional expression patterns on high temperatures in adults of Grapholita molesta (Busck). Insect Sci, 2014, 21(4): 439 -448.
[22] Yang L H, Jiang H B, Liu Y H, Dou W, Wang J J. Molecular characterization of three heat shock protein 70 genes and their expression profiles under thermal stress in the citrus red mite. Mol Biol Reports, 2012, 39(4): 3585–3596.
[23] 郑丹, 崔旭红, 李红亮, 蔡冲, 高永生, 商晗武. 三叶草斑潜蝇hsp70的克隆及其表达量在高低温胁迫下的变化. 植物保护学报, 2010, 37(2): 159-164. Zheng D, Cui X H, Li H L, Cai C, Gao Y S, Shang H W. Cloning of heat shock protein gene, hsp70, in Liriomyza trifolii and its expression under temperature stress. J Plant Prot, 2016, 37(2): 159-164. (in Chinese with English abstract)
[24] 崔旭红, 谢明, 万方浩. 高温胁迫下B型烟粉虱热激蛋白基因hsp70表达量的变. 昆虫学报, 2007, 50(11): 1087-1091. Cui X H, Xie M, Wang F H. Changes in expression level of heat shock protein 70 gene in Bemisia tabaci B-biotype (Homoptera: Aleyrodidae)under high temperature stress. Acta Entomol Sin, 2007, 50(11): 1087-1091.(in Chinese with English abstract)
[25] Benoit J B, Lopez-Martinez G, Teets N M, Phillips S A, Denlinger D L. Responses of the bed bug, Cimex lectularius, to temperature extremes and dehydration: Levels of tolerance, rapid cold hardening and expression of heat shock proteins. Med Veterin Entomol, 2009, 23(4): 418-425.
[26] Xu X, Gupta S, Hu W,Mcgrath B C,Cavener D R. Hyperthermia Induces the ER Stress Pathway. PloS One, 2011, 6(8): 366-366.
[27] Liu S, Wang J, Cong B, Huang X H, Chen K S, Zhang P Y. Characterization and expression analysis of a mitochondrial heat shock protein 70 gene from the Antarctic moss Pohlia nutans. Polar Biol, 2014, 37(8): 1145-1155.
[28] Wang H H, Reitz S R, Wang L X, Wang S Y, Li X, Lei Z R. The mRNA expression profiles of five heat shock protein genes from Frankliniella occidentalis at different stages and their responses to temperatures and insecticides. J Integ Agric, 2014, 13(10): 2196-221.
[29] Lu K, Chen X, Liu W, Zhou Q. Characterization of heat shock cognate protein 70 gene and its differential expression in response to thermal stress between two wing morphs of Nilaparvata lugens (Stål).Comp Biochem Physiol A Mol Integr Physiol, 2016, 199: 47-53.
Induced Expression Profiles of Hsp70s in Brown Planthoppers, Nilaparvata lugens, Under Different Temperatures
SHAN Dan1,2,#, WANG Lihua2,#, ZHANG Yueliang2, HAN Yangchun2, NIU Hongtao2, PAN Lei2, FANG Jichao1,2,*
(1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China;2Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;#These authors contributed equally to this work;*Corresponding author, E-mail: fangjc126@126.com)
【Objective】The brown planthopper (BPH), Nilaparvata lugens, is one of the major insect pests on rice in China. In recent years, the overwintering area of BPH expanded with global warming. In order to explore the response mechanisms of BPH to temperature, the hsp70s were cloned and the induced expression profiles of these genes were analyzed. 【Method】 The nucleotide sequences of hsp70s were gotten from transcriptome sequencing and GenBank database, the phylogenetic tree of HSP70 was based on neighbor-joining method by MEGA4.1, and the induced expression profiles were analyzed by real-time quantitative PCR. 【Result】 It was found that fifteen hsp70 homologous genes with complete open reading frame were gotten in BPH, and 8 out of 15 genes were expressed in normal conditions or temperature stress. These eight hsp70s were distributed in the cytoplasm/nucleus, endoplasmic reticulum or mitochondria, and had significantly different expression in normal conditions. After 30-44°C high temperature treatment, the expression levels of KX976471, KX976473, KX976475, KX976476, KX976477 and KX976478 were up-regulated, and the maximum increased times was 1.72-245.33. However, only the expression level of KX976475 increased by 2.38 times, the other seven were not changed or even significantly decreased in expression level after 0-22°C temperature treatment.【Conclusion】It was found that eight hsp70s were expressed in normal conditions or temperature stress in the cytoplasm/nucleus, endoplasmic reticulum or mitochondria. These hsp70s might play an important role in high temperature adaptation, but a limited role in cold adaptation in BPH.
Nilaparvata lugens; temperature; heat shock protein 70; induced expression
Q786; S435.112+.4
A
1001-7216(2017)05-0533-09
2016-12-23; 修改稿收到日期:2017-02-17。
国家自然科学基金资助项目(31572004;31301660);江苏省自然科学基金资助项目(BK20130711),江苏省农业自主创新资金资助项目(6111608)。
