一个水稻小热休克蛋白的异源表达及寡聚特性分析
2017-09-23蔡年俊郭留明李静项聪英羊健陈剑平张恒木
蔡年俊 郭留明 李静 项聪英 羊健 陈剑平,* 张恒木,*
(1浙江师范大学 化学与生命科学学院, 浙江 金华321004;2浙江省农业科学院 病毒学与生物技术研究所,杭州 310021;*通讯联系人,E-mail:zhhengmu@tsinghua.org.cn)
一个水稻小热休克蛋白的异源表达及寡聚特性分析
蔡年俊1,2郭留明1,2李静2项聪英1,2羊健2陈剑平2,*张恒木2,*
(1浙江师范大学 化学与生命科学学院, 浙江 金华321004;2浙江省农业科学院 病毒学与生物技术研究所,杭州 310021;*通讯联系人,E-mail:zhhengmu@tsinghua.org.cn)
【目的】在前期研究中,本实验室已克隆了一个水稻小热休克蛋白基因(OsSHSP17.6),并发现该基因的表达明显受到热激和病毒侵染调控,表明该蛋白可能在逆境胁迫过程中起重要作用。本研究的目的在于进一步明确OsSHSP17.6的特性。【方法】在本研究中,进一步将该基因亚克隆至原核表达载体pET-32a并导入大肠杆菌E. coli BL21(DE3)pLysS诱导表达,通过亲和层析的方法纯化了该重组蛋白,进一步用于非变性聚丙烯酰胺凝胶电泳和Western blotting分析。【结果】异源表达的重组OsSHSP17.6能减轻IPTG对宿主菌的毒害。非变性聚丙烯酰胺凝胶电泳和Western blotting分析显示纯化的重组OsSHSP17.6蛋白在体外能形成同源二聚体和寡聚体。【结论】这些结果支持OsSHSP17.6是一个有功能的分子伴侣蛋白并表明该蛋白可能通过形成同源寡聚体的方式参与逆境胁迫反应,这为进一步明确OsSHSP17.6的功能机制奠定基础。
小热休克蛋白;异源表达;寡聚化作用
热休克蛋白(heat shock protein,HSP)是一类高度保守的、分子量在10~200 kD之间的分子伴侣蛋白,其中小热休克蛋白(small heat shock protein,SHSP)的分子量大小一般在15~30 kD,且在充当分子伴侣时不依赖ATP[1,2]。SHSP广泛存在于各类生物细胞中且含量丰富,在重金属、干旱、冷冻和氧化胁迫等诸多非生物逆境以及细胞凋亡、分化等发育过程中发挥重要功能[3-5]。作为动植物抗逆过程中的一道防线,SHSP在进化过程中呈现复杂性。据统计,哺乳动物中含有4个SHSP,果蝇中有4个SHSP,细菌中有2个SHSP[6],而拟南芥中至少有19个SHSP[7],表明植物SHSP种类更为丰富多样。根据进化树分析,植物SHSP至少被分为14个亚类(subfamilies),亚细胞定位预测显示,这些SHSP可能定位于不同的细胞器,包括细胞质、细胞核、叶绿体、线粒体、内质网、过氧化物体[7]。SHSP在不同细胞器中定位至少在一定程度上反应植物SHSP的功能多样性。最近的报道显示,植物SHSP不仅参与保护植物免受非生物逆境的伤害,还可能参与病毒等生物逆境响应过程[8],但对于它们的功能机制仍然了解很少。
在前期的研究中,本实验室在研究水稻条纹病毒与水稻互作的过程中首次发现病毒侵染可改变SHSP在水稻细胞内的定位和分布模式,并且水稻条纹病毒复制酶可特异性地与水稻中一个SHSP在细胞质中相互作用,表明SHSP参与病毒与水稻间的互作过程[8]。基因克隆鉴定显示,该SHSP分子量大小约17.6 kD;序列分析显示该类SHSP在不同的植物中是保守的,在分类上隶属于CI类;实时定量RT-PCR和Western blotting分析显示热激处理和病毒侵染都显著影响该基因的表达,且该蛋白可能存在寡聚体的形式[9]。为了进一步确定该SHSP的生物学功能,本研究进一步通过异源重组表达并利用纯化蛋白分析该蛋白的寡聚特性。
1 材料与方法
1.1 材料
所用的水稻品种为日本晴。大肠杆菌菌株DH5α由北京全式金生物有限公司提供;pGEM-T Easy载体购自Promega公司;SDS-PAGE低分子量蛋白标准购自Invitrogen公司;T4DNA连接酶购自TaKaRa公司;质粒小提试剂盒购自康为世纪生物科技有限公司;HSP20抗体由本实验室制备保存;表达载体pET-32a(+)购自Novagen 公司;本实验所需的引物由上海博尚生物技术有限公司合成。
1.2 三维结构分析
通过HOMCOS程序(http://homcos.pdbj.org/)对蛋白进行三维结构预测,并采用Rasmol软件(http://www.openRasmol.org)对模型结构进行分析。
1.3 原核表达载体构建
OsSHSP17.6扩增及其克隆参照项聪英等[9]。取水稻cDNA(约1~5 ng)作模板,采用基因特异性上游引物OsSHSP-F(CGCGGATCCATGTCGCTG ATCCGCCGCAG,划线部位为BamH Ⅰ识别位点)和下游引物OsSHSP-R(GCGAGCTCCTAGCCGG AGATCTGGATG,划线部位为SacⅠ识别位点),按项聪英等[9]的方法和反应条件进行PCR并构建克隆载体。获得克隆载体后取1~2 μg,依次加入2 μL 10 ×酶切反应缓冲液、1 μL BamH Ⅰ和Sac Ⅰ及ddH2O至终体积为20 μL,在37℃水浴条件下酶切3 h,酶切产物经琼脂糖凝胶电泳检测后回收纯化目的基因片段,然后将其连接至同样双酶切的原核表达载体pET-32a质粒上,连接反应体系如下:7 μL目的片段(50~200 ng)、1 μL表达载体pET-32a质粒(约50 ng)、1 μL 10×连接反应缓冲液、1 μL T4DNA连接酶,总体系10 μL,4℃下连接反应约12 h;并将连接产物转化大肠杆菌DH5α,通过菌液PCR、双酶切和测序鉴定筛选含有目的基因片段的重组子。
1.4 原核表达及重组蛋白纯化
将含有目的基因的表达载体质粒导入表达菌株E. coli BL21(DE3)pLysS,接种于含氨苄抗生素的固体LB培养基中,37℃下培养过夜;第2天转接至液体培养基振荡培养,当OD600值约0.6时加入异丙基-β-D-硫代半乳糖苷(IPTG)继续振荡培养1~3 h。然后离心收集菌体,加入苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)至其终浓度为1 mmol/L;菌体经超声波裂解后,4℃、12 000 r/min下离心25 min,收集上清;再按照商家说明使用Ni柱从上清液中亲和层析纯化目的重组蛋白。
1.5 非变性PAGE、SDS-PAGE和Western blot分析
ProtParam程序分析(http://web. expasy. org/ protparam/)显示OsSHSP17.6蛋白为酸性蛋白,因此我们选用分离酸性蛋白的缓冲液[10× Tris-Gly电泳缓冲液: 0.25 mol/L三羟甲基氨基甲烷(Trisbase),1.92 mol/L甘氨酸,pH 8.8]、4%浓缩胶[0.5 mL丙烯酰胺(30%)、1.25 mL Tris-HCl(0.5 mol/L,pH 6.8)、3.2 mL ddH2O、50 μL 10%过硫酸铵、5 μL四甲基乙二胺]、9%分离胶[3 mL丙烯酰胺(30%)、2.5 mL Tris-HCl (1.5 mol/L,pH 8.8)、4.5 mL ddH2O、50 μL 10%过硫酸铵、5 μL四甲基乙二胺]进行非变性凝胶电泳;SDS-PAGE参照梁国栋[10]的方法进行。总蛋白或纯化的重组蛋白经电泳分离后,通过电转移法将蛋白质转印到硝酸纤维素膜上,用OsSHSP17.6兔抗作为一抗,参照梁国栋[10]的方法进行蛋白质印迹分析,利用eECL Western Blot试剂盒按照商家说明进行显色反应,应用Amersham imager 600(美国GE公司)成像系统获取图像信号。
2 结果与分析
2.1 OsSHSP17.6结构预测
为了研究OsSHSP17.6蛋白的特性,首先利用该蛋白的一级结构序列(158 aa)进行二级结构分析,结果显示该蛋白含有3个α-螺旋,8个β-折叠;其C-端部分(52-143 aa)的α-晶体蛋白结构域(α-crystallin domain,ACD)(92 aa)[11]中含有7个β-折叠(图1-A),这与其他小热休克蛋白的二级结构相似[6];因此,我们进一步采用同源建模方式分析该蛋白的三维结构(图1-B~D),表明OsSHSP17.6蛋白中不仅存在α-螺旋(红色部分)、β-折叠(黄色部分)结构,还存在β-转角(Turn)(淡蓝色部分)以及其他无定形结构(白色部分)。在结构模型中,该蛋白还能够形成同源二聚体(图1-C)或寡聚体(图1-D),表明该蛋白可能以同源聚合的方式发挥作用。在二聚体结构模型中,邻近的2个OsSHSP17.6蛋白分子的ACD结构域均形成反向平行的β-折叠且相互靠近,表明ACD结构域及其中的β-折叠在同源互作形成二聚体过程中可能起关键作用;在同源十二聚体中,一个单体N-端的α-螺旋和C-端无规则区域和相邻单体也相互靠近,表明OsSHSP17.6蛋白的N-和C-端也可能在形成寡聚体过程中起一定作用。
2.2 OsSHSP17.6载体构建及其重组蛋白的表达分析
为了构建OsSHSP17.6基因的原核表达载体,我们首先通过双酶切实验从其克隆载体上切下目的片段,再亚克隆至原核表达载体质粒pET-32a并导入大肠杆菌DH5α,双酶切、PCR鉴定(图2-A)一致表明插入片段大小与预期一致,测序分析进一步表明所筛选的重组子含有目的基因片段,且阅读框架正确,表明我们获得正确的重组原核表达载体质粒pET-OsSHSP17.6。为了表达OsSHSP17.6重组蛋白,重组质粒pET-OsSHSP17.6转化至表达菌株E coli BL21 (DE3) pLysS,并且在含有IPTG的条件下诱导表达1-3 h;收集诱导表达后的菌液用于提取总蛋白,采用SDS-PAGE进行检测分析结果显示(图2-B),在含重组质粒pET-OsSHSP17.6的表达菌株样品中均存在一条分子量约36 kD的条带,这与预期重组蛋白的大小一致(推测的目的蛋白分子量约为17.6 kDa,此外表达载体 pET-32a 载体上还有一段包含有Trx-、His-、S-Tag分子量近18.2 kD的融合肽段,因此,重组蛋白的分子量约36 kD),表明重组OsSHSP17.6蛋白已在大肠杆菌中高水平表达。随着诱导时间的增加,重组蛋白的表达量也略有增加(图2-B,第7~9泳道)。
2.3 重组OsSHSP17.6蛋白对宿主菌的保护作用分析
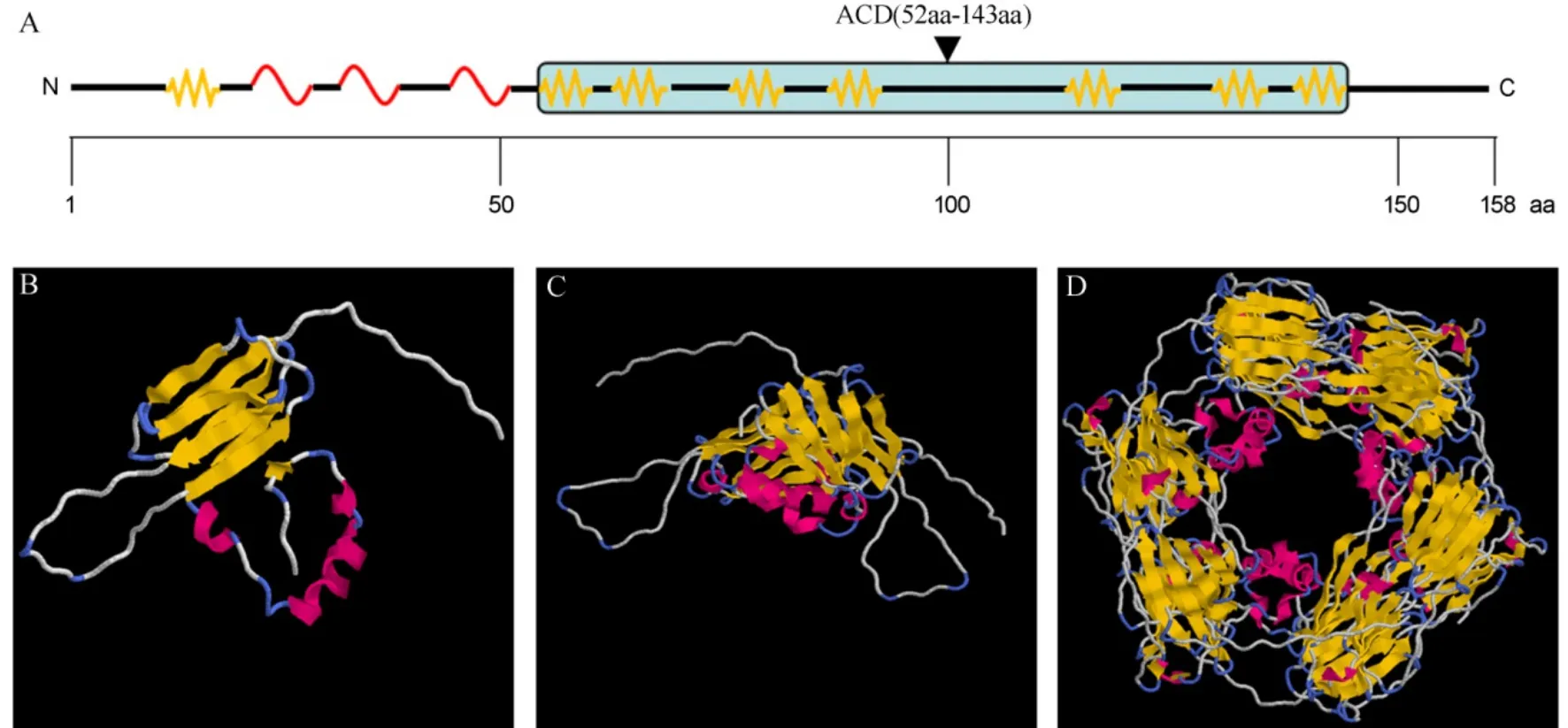
图1 OsSHSP17.6二级及高级结构预测Fig. 1. Secondary and tertiary structure predictions of OsSHSP17.6.
为了确定原核表达重组OsSHSP17.6蛋白是否有活性,我们进一步比较分析IPTG处理条件下含载体pET-32a和pET-OsSHSP17.6宿主菌的生长特点。当液体培养基中不加IPTG时,含pET-32a的宿主菌和含pET-OsSHSP17.6宿主菌的生长曲线基本一致;当加入IPTG时,二者的生长受到不同程度的抑制(图3-A),很显然携带载体pETOsSHSP17.6宿主菌要比含pET-32a的宿主菌生长得快。利用固体培养基进行IPTG的处理实验也得到相似结果(图3-B),以上表明原核表达的重组OsSHSP17.6蛋白具有生物学活性,且可大幅减轻IPTG对宿主菌的生长抑制作用;证实OsSHSP17.6蛋白和其他植物小热休克蛋白相似[2,12-14],具有增强细胞抗逆境胁迫能力的推测[9]。
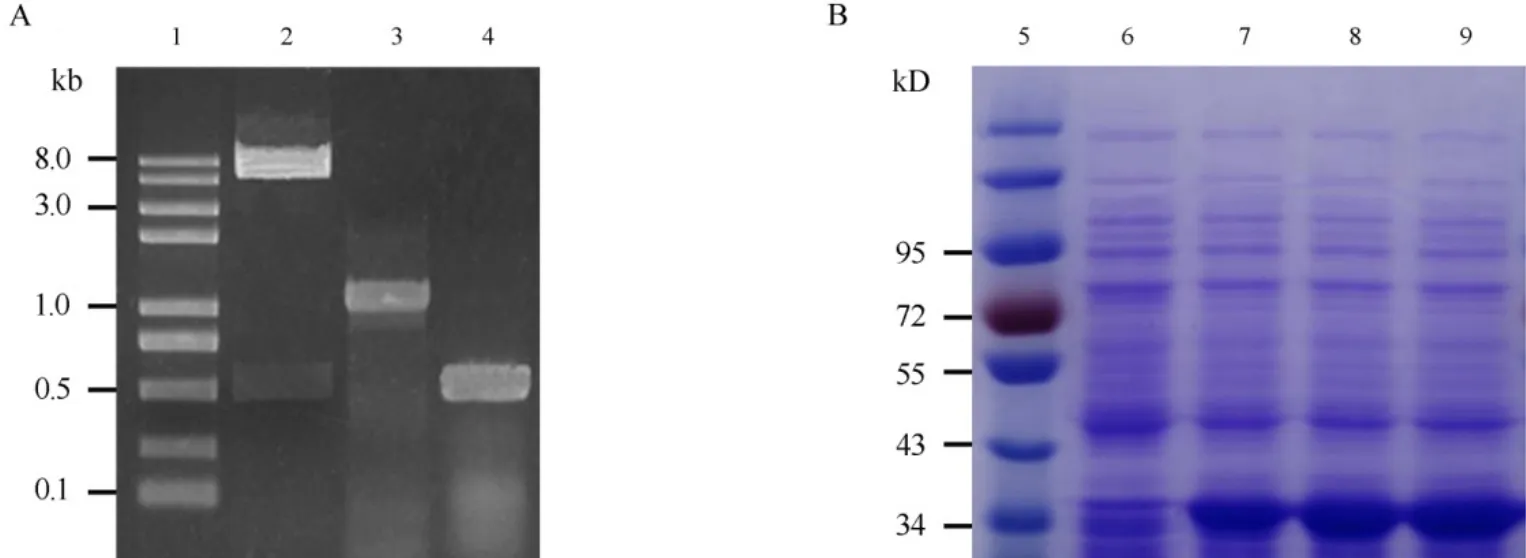
图2 重组质粒pET-OsSHSP17.6的鉴定(A)及其重组表达分析(B)Fig. 2. Identification of recombinant plasmid pET-OsSHSP17.6(A) and detection of recombinant OsSHSP17.6 (B) in E. coli.
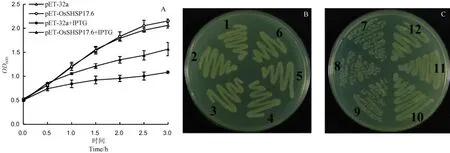
图3 重组OsSHSP17.6蛋白的活性分析Fig. 3. Activity assays of recombinant OsSHSP17.6 protein in E. coli.
2.4 重组OsSHSP17.6蛋白的聚合特性分析
重组表达的OsSHSP17.6具有生物活性,且结构预测显示该蛋白可能具有形成寡聚体的特性。为了确定该蛋白的存在形式,我们又采用亲和层析的方法从宿主菌超声波裂解液的上清液中提取并纯化重组表达的蛋白。检测结果显示纯化产物在SDS-PAGE中仅有一条与预期大小一致的特异条带(图4-A),进一步通过Western blot分析显示该条带可与OsSHSP17.6特异性多克隆抗体发生强烈的免疫学反应(图4-B),表明我们获得了纯化的重组OsSHSP17.6蛋白。为了验证该重组蛋白是否具有同源聚合活性,我们又对纯化产物进行了非变性(native)PAGE分析,结果显示该产物在约70 kD处存在一条特异性条带(图4-C),但在约36 kD处并没有条带;当通过Western blotting检测时,发现在纯化产物中在36 kD处也未发现条带,除了在约70 kD处存在一条特异性主要条带之外,还在高分子量(约200 kD)处存在一条弱带(图4-D),根据分子量估计,推测可能是少量的同源六聚体。这些结果一致性地表明在纯化的重组OsSHSP17.6蛋白不是以单体形式存在,而是主要以同源二聚体形式存在,小部分以更高同源聚合体形式存在。这与其他有关小热休克蛋白寡聚体特性的报道一致[6,7,15],表明异源表达的重组OsSHSP17.6蛋白具有自发的同源聚合特性。但是从本研究结果来看,异源表达的重组OsSHSP17.6蛋白主要形成同源二聚体(图4-D);根据三维结构模型预测的同源十二聚体却未检测到。有研究表明小热休克N-和C-端的氨基酸组成及其构型在小热休克分子聚合物形成过程中发挥重要功能[6,11,16-20];前面的三维结构模型预测表明OsSHSP17.6的N-和C-端可能在十二聚体中起重要作用,推测该重组蛋白N-端融合的Tag可能影响OsSHSP17.6的正确折叠,从而阻碍了十二聚体的形成,但确切的机制仍有待进一步鉴定。
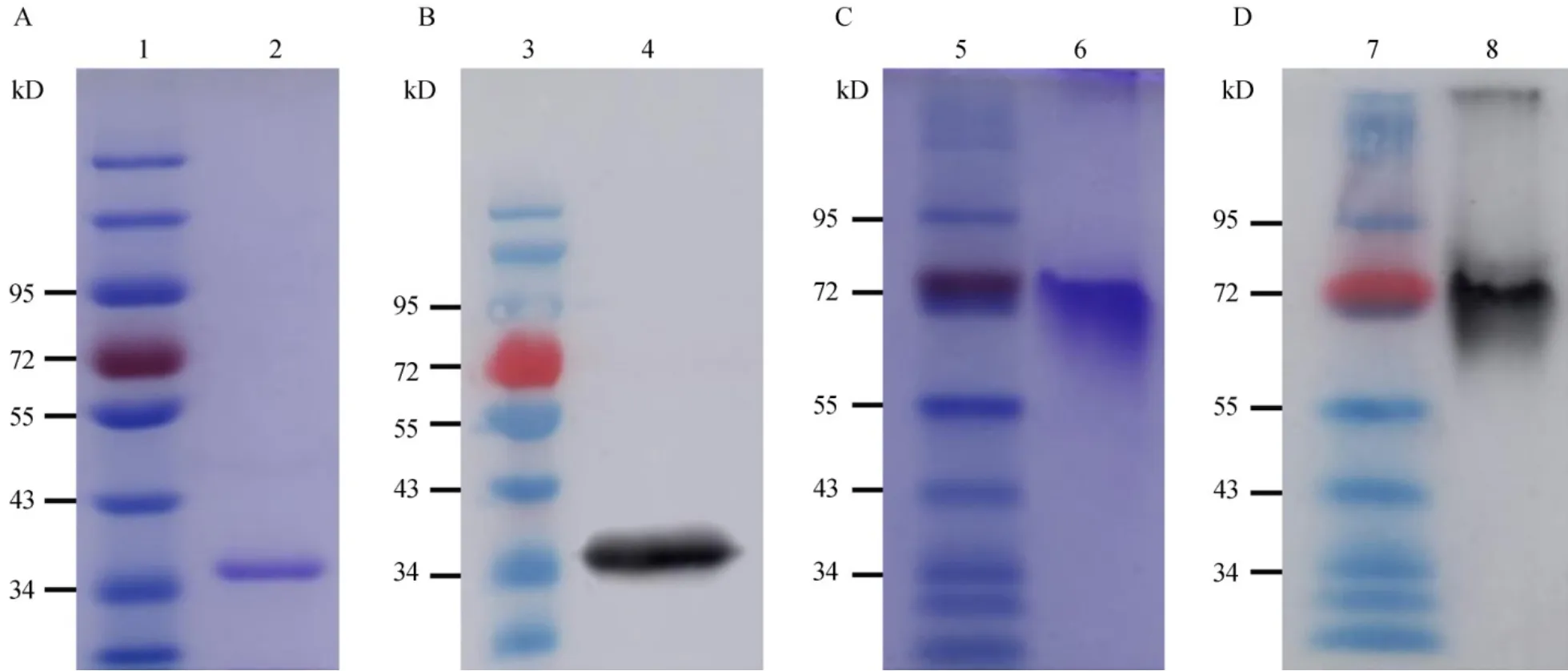
图4 PAGE和Western blot分析纯化的重组OsSHSP17.6蛋白Fig. 4. Assays of purified recombinant OsSHSP17.6 proteins by PAGE and Western blot.
[1] Miernyk J A. Protein folding in the plant cell. Plant Physiol, 1999, 121(3): 695-703.
[2] Vierling E. The roles of heat shock proteins in plants. Ann Rev Plant Physiol Plant Mol Biol, 2003, 42(4): 579-620.
[3] Arrigo A P. Small stress proteins: Chaperones that act as regulators of intracellular redox state and programmed cell death. Biol Chem, 1998, 379(1):19-26.
[4] Kappe G, Leunissen J A, DeJong W W. Evolution and diversity of prokaryotic small heat shock proteins. Prog Mol Subcell Biol, 2002, 28: 12-17.
[5] Zou J, Liu A, Chen X, Zhou X, Gao G, Wang W. Expression analysis of nine rice heat shock protein genes under abiotic stresses and ABA treatment. Plant Physiol, 2009, 166(8): 851-861.
[6] Haslbeck M, Franzmann T, Weinfurtner D, Buchner J. Some like it hot: The structure and function of small heat shock proteins. Nat Struct Mol Biol, 2005, 12(10): 842-846.
[7] Scharf KD, Siddique M, Vierling E. The expanding family of Arabidopsis thaliana small heat stress proteins and a new family of proteins containing alpha-crystallindomains (Acd proteins). Cell Stress Chaperones, 2001, 6(3): 225-237.
[8] Li J, Xiang C Y, Yang J, Chen J P, Zhang H M. Interaction of HSP20 with a viral RdRp changes its sub-cellular localization and distribution pattern in plants. Sci Rep, 2015, 5: 14016.
[9] 项聪英, 蔡年俊, 李静, 羊健, 陈剑平, 张恒木. 一个水稻小热休克蛋白基因的克隆和鉴定. 中国水稻科学, 2016, 30(6): 587-592. Xiang C Y, Cai N J, Li J, Yang J, Chen J P, Zhang H M. Cloning and characterization of a small heat shock protein (SHSP) gene in rice plant. Chin J Rice Sci, 2016, 30(6): 587-592. (in Chinese with English abstract)
[10] 梁国栋. 最新分子生物学实验技术. 北京: 科学出版社, 2001. Liang G D. The Newest Experimental Techniques of Molecular Biology. Beijing: Science Press, 2001. (in Chinese)
[11] MacRae T H. Structure and function of small heat shock/alpha-crystallin proteins: Established concepts and emerging ideas.Cell Mol Life Sci, 2000, 57(06): 899-913.
[12] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response. Trends Plant Sci, 2004, 9(5): 244-252.
[13] Seo J S, Lee Y M, Park H G, Lee J S. The intertidal copepod Tigriopus japonicus small heat shock protein 20 gene (Hsp20) enhances thermotolerance of transformed Escherichia coli. Biochem Biophysical Res Commun, 2006, 340(3): 901-908.
[14] Satoru T. Analytical assays of human HSP27 and thermal-stress survival of Escherichia coli cells that overexpress it. Biochem Biophysical Res Commun, 2006, 341(4): 1252-1256.
[15] DeJong W W, Caspers G J, Leunissen J A. Genealogy of the alpha-crystallin-small heat-shock protein superfamily. Intl J Biol Macromol, 1998, 22(3): 151-162.
[16] Gusev N B, Bogatcheva N V, Marston S B. Structure and properties of small heat shock proteins (sHsp) and their interaction with cytoskeleton proteins. Biochemistry (Moscow), 2002, 67(5): 511-519.
[17] van Montfort R, Slingsby C, Vierling E. Structure and function of the small heat shock protein/alpha-crystallin family of molecular chaperones. Adv Protein Chem, 2002, 59(59): 105-156.
[18] Narberhaus F. Alpha-crystallin-type heat shock proteins: socializing minichaper- ones in the context of a multichaperone network. Microbiol Mol Biol Rev, 2002, 66(1): 64-93.
[19] Cooper L F, Uoshima K. Differential estrogenic regulation of small Mr heat shock protein expression in osteoblasts. J Biol Chem, 1994, 269(11): 7869-7873.
[20] Boelens WC, Croes Y, De R M, De R L, De Jong W W. Negative charges in the C-terminal domain stabilize the alphaB-crystallin complex. J Biol Chem, 1998, 273(43): 28085-28090.
Heterologous Expression and Oligomeric Identification of a Small Heat Shock Protein (SHSP) from Oryza sativa
CAI Nianjun1,2, GUO Liuming1,2, LI Jing2, XIANG Congying1,2, YANG Jian2, CHEN Jianping2,*, ZHANG Hengmu2,*
(1College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004, China;2State Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control, Key Laboratory of Biotechnology in Plant Protection of MOA and Zhejiang Province, Institute of Virology and Biotechnology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;*Corresponding author, E-mail: zhhengmu@tsinghua.org.cn)
【Objective】In our previous study, a small heat shock protein gene OsSHSP17.6 was cloned from Oryza sativa and its expression was shown to be significantly up-regulated by heat shock or viral infection, suggesting that the OsSHSP17.6 could play an important role in both biotic and abiotic stress responses. In this study, our objective is to further identify the characteristics of OsSHSP17.6. 【Method】 The OsSHSP17.6 gene was sub-cloned into the plasmid pET-32a, a prokaryotic expression vector, and transformed into Escherichia coli BL21(DE3)pLysS for inducible expression. Then the recombinant protein was purified with affinity chromatography and used for native PAGE and Western-blotting assays.【Result】Its heterologous expression appeared to alleviate the poisonous effect of IPTG on the host E. coli. Native PAGE and Western-blotting assays showed that the purified recombinant OsSHSP17.6 could form homological dimers and oligomer in vitro. 【Conclusion】 Taken together, these findings supported the hypothesis that the protein should be functional molecular chaperone in vivo and indicated that OsSHPS17.6 could be involved in the stress response by its homological oligomerization, which could contribute to the functional identification of OsSHSP17.6.
small heat shock protein (SHSP); heterologous expression; oligomerization
Q755; S511.032
A
1001-7216(2017)05-0483-06
2017-01-18;修改稿收到日期: 2017-02-21。
国家自然科学基金资助项目(31601603);浙江省自然科学基金资助项目(LQ14C140003)。
