iPSCs定向分化的内耳毛细胞与支持细胞间相互作用的研究
2017-09-18王翠翠陈建玲唐子华邱世伟张翠李亮郭维维杨仕明王金福
王翠翠陈建玲唐子华邱世伟张翠李亮郭维维杨仕明王金福
1浙江大学紫金港校区,生命科学学院,细胞与发育研究所(杭州310058)
2解放军总医院耳鼻咽喉头颈外科,解放军耳鼻喉研究所(北京100853)
·基础研究·
iPSCs定向分化的内耳毛细胞与支持细胞间相互作用的研究
王翠翠1陈建玲1唐子华1邱世伟2张翠1李亮1郭维维2杨仕明2王金福1
1浙江大学紫金港校区,生命科学学院,细胞与发育研究所(杭州310058)
2解放军总医院耳鼻咽喉头颈外科,解放军耳鼻喉研究所(北京100853)
目的利用诱导多能性干细胞定向分化的内耳毛细胞和支持细胞探究这两种体外诱导分化细胞之间的相互作用。方法首先,利用细胞单层贴壁两步诱导法将三株iPS细胞(野生株、MYO7A缺陷株、MYO7A校正株)向内耳祖细胞及内耳毛细胞诱导分化,探究iPSCs定向分化内耳毛细胞的过程中是否有支持细胞的产生;其次,通过细胞免疫化学的方法探究体外分化的内耳毛细胞和支持细胞间的相互作用;最后,将表达绿色荧光蛋白(EGFP)的上皮样内耳祖细胞以圆窗膜穿刺的方法移植到白化荣昌猪的内耳中观察分析移植细胞在体内的迁移、分化以及在体内形成的联系。结果三株iPS细胞诱导分化为内耳毛细胞的过程中均有一部分细胞分化为支持细胞;对分化细胞进行E-cadherin、N-cadherin和ZO-1的免疫荧光检测结果显示,E-cadherin、N-cadherin和ZO-1在支持细胞-支持细胞连接和支持细胞-毛细胞连接间都有表达;移植4周后,耳蜗免疫组织化学结果显示,三株不同来源的移植细胞均有少量细胞成功迁移到了毛细胞受损部位—柯底氏器,并表达毛细胞标志性蛋白MYO7A。移植细胞之间以及移植细胞与宿主细胞之间有E-cadherin、N-cadherin和ZO-1的表达。结论iPSCs诱导分化的内耳毛细胞和支持细胞在体内、外均能形成钙粘连接和紧密连接。这些研究结果对毛细胞取代法治疗耳聋策略的完善与发展有一定的科学意义。
耳聋;诱导多能性干细胞(iPSCs);毛细胞;支持细胞;细胞间连接
Fund projects:the grants from National Basic Research Program of China(2014CB541705);Chinese National Science Foundation(81570932);Strategically Guiding Scientific Special Project from ChineseAcademy of Sciences(XDA04020202-23);National Development Program of Important Scientific Instrument(2013YQ030595);Opening Foundation of the State Key Laboratory of Space Medicine Fundamentals andApplication(SMFA12K02);TZ-1Application Program(KYTZ01-0901-FB-003).
Disclosure of potential conflicts of interest:Authors indicate no potential conflicts of interest.
耳聋多数情况下由环境因素引起,比如频繁暴露在高强度的声音环境中、病毒感染和耳毒性药物等等。由内耳毛细胞和神经细胞的缺失或损伤而导致的耳聋被称为感音性耳聋,这是听力损伤中最常见的一种,影响着全世界数以百万计的人[1]。成体哺乳动物的耳蜗毛细胞属于终末分化细胞,不具有再生修复能力,故由因其损伤引起的感音神经性耳聋通常是不可逆的[2]。目前,针对感音性耳聋病人的常规疗法主要是加装助听器和植入人工耳蜗,但由于毛细胞的不可再生性,这些手段并不能从病理上根治耳聋。近年来干细胞技术的发展为耳聋的治疗提供了一个崭新的更具前景性的方向[3,4]。胚胎干细胞(ESCs)和诱导多能性干细胞(iPSCs)在体外已经被成功诱导成内耳毛细胞样细胞[5,6]。近来有研究表明基因突变导致毛细胞损伤的耳聋病人来源的特异性iPSCs经基因校正后能产生形态和功能均正常的内耳毛细胞样细胞[7,8]。这种把诱导多能干细胞(iPS)技术和基因校正技术结合的研究将为毛细胞取代法治疗感音性耳聋提供无限可能。
耳蜗螺旋器(Organ of Corti)是感受声音刺激的听觉感受器,主要由毛细胞和支持细胞组成。毛细胞不能直接附着在基底膜上,而是由支持细胞所依托和包绕,这说明毛细胞在机械和生理很大程度上由支持细胞维持[9]。不同于毛细胞仅仅是附着在基底膜的表面,支持细胞可以横跨整个基底膜。支持细胞之间以及支持细胞和毛细胞之间通过钙粘连接和紧密连接建立起联系[10,11],支持细胞之间还可以通过间隙连接进行离子交换[12]。支持细胞在感觉上皮发挥着重要的作用,不仅可以维持感觉器官结构的完整性,而且可以维持上皮细胞的生存环境使毛细胞可以正常发挥功能[13]。支持细胞在非哺乳动物毛细胞损伤后的感觉修复方面也发挥了重要的作用。在非哺乳动物中,支持细胞利用有丝分裂再生和非有丝分裂再生两种机制来代替受损的毛细胞[13]。某些情况下,支持细胞作为祖细胞可进入细胞周期,持续分裂产生出成熟的毛细胞和支持细胞,以替代消失的毛细胞;其他情况下,支持细胞还可以不通过有丝分裂直接转分化为毛细胞。相比之下,在哺乳动物和人类的前庭系统,在毛细胞损害后出现非常有限的祖细胞分裂为再生的毛细胞,而在耳蜗系统,毛细胞不可再生。
因此,深入了解iPSCs诱导分化的内耳毛细胞与支持细胞之间的相互作用关系是iPSCs用于毛细胞功能修复研究的重要前提条件。本文中,我们采用三株iPS细胞(野生株、MYO7A缺陷株、MYO7A校正株)进行内耳毛细胞的诱导分化。首先,鉴定了在iPSCs定向诱导分化内耳毛细胞的过程中同时产生了支持细胞。其次,通过检测钙粘连接蛋白(E-cadherin、N-cadherin)和紧密连接蛋白(ZO-1)的存在与分布初步确定体外诱导分化的内耳毛细胞与支持细胞之间的关系。最后,我们将表达EGFP的上皮样祖细胞通过圆窗膜穿刺的方法移植到白化荣昌猪的内耳中观察分析细胞的迁移、分化以及细胞连接。
1 材料和方法
1.1实验细胞株和动物模型
所有的实验过程包括涉及到的动物都通过了杭州市浙江大学伦理审查委员会的批准。由浙江省卫生局批准,并且经过浙江省温岭市第一人民医院伦理委员会同意,我们成功采集到正常非耳聋患者、MYO7A杂合双突变耳聋病人的及其父母的尿液。C-iPSCs由正常非耳聋患者(MYO7AWT/WT)的尿液细胞经重编程诱导生成;P-iPSCs由MYO7A杂合双突变耳聋病人(MYO7A c.1184 G>A和MYO7A c.4118 C>T)的尿液细胞经重编程诱导生成;CP-iP⁃SCs是利用 CRISPR-Case9技术将 P-iPSCs中c.4118C>T突变位点校正之后得到的细胞株[7]。
Mitf-M基因突变的白化荣昌猪是由中国人民解放军总医院耳鼻喉研究所提供,猪龄8周左右,体重约10Kg。
1.2实验方法
1.2.1 iPS细胞向内耳祖细胞及进一步向内耳毛细胞诱导分化
本研究中,我们利用细胞单层贴壁两步诱导法[6],首先用 FGF3和 FGF10处理人iPS细胞10-12天,使其分化为内耳上皮样祖细胞。在第二步的向毛细胞方向诱导过程中,我们将细胞接到用laminin包被过的细胞爬片上,用添加了全反式视磺酸和EGF的鸡胚椭圆囊基质细胞条件培养液培养20天,这种诱导方法已经证实可以产生具有静纤毛束和电生理特性的毛细胞样细胞[15]。
1.2.2内耳祖细胞、内耳毛细胞的基因表达检测
使用Trizol试剂(TaKaRa)提取待检测样本的总RNA。使用逆转录酶(Fermentas)从2μg总RNA合成cDNA,用作聚合酶链反应(PCR)中的模板。推荐的引物和产物大小见表1。使用琼脂糖凝胶电泳和凝胶成像分析系统分析反应产物。使用Im⁃age J软件对带强度进行半定量分析。

表1 RT-PCR引物序列Table 1 Primer sequences for real time-PCR
1.2.3细胞免疫荧光
待测样品用4%多聚甲醛室温下固定15min,0.01M PBS洗涤3次,每次5min;0.25%TritonX-100室温下孵育样品10min,0.01M PBS洗涤3次,每次5min;1%牛血清白蛋白封闭1h。加入一抗(an⁃ti-PAX8,1:100,Abcam;anti-PAX2,1:250,Abcam;anti-Nestin,1:250,Abcam;anti-SOX2,1:900,Ab⁃cam;anti-ATOH1,1:500,Abcam;anti-BRN3C,1:50,Abcam;anti-Myosin 7a,1:500,Abcam;anti-Espin,1:200,Santa Cruz;anti-p27 Kip1,1:100,R&D System;anti-ZO-1,1:100,Thermos Fisher;an⁃ti-E-cadherin,1:50,BD Biosciences;anti-N-cad⁃herin,1:50,BD Biosciences)4℃孵育过夜。0.01M PBS洗涤3次,每次5min。加入1:400二抗(Alexa Flour 594,Alexa Flour 488,Alexa Flour 405,Jack⁃son)避光室温孵育1h。0.01M PBS洗涤3次,每次5min。加入DAPI(4,6-二脒基-2-苯基吲哚;Beyo⁃time),避光室温作用1min,0.01M PBS洗涤5min。封片,进行共聚焦扫描成像。
1.2.4 稳定表达 EGFP的上皮样祖细胞(EGFP-OEPs)的制备及移植
慢病毒感染的方法使iPS细胞稳定表达荧光标记蛋白EGFP,得到稳定的EGFP-iPS细胞株;由EGFP-iPS诱导分化了12天的内耳祖细胞利用差异消化法去除祖细胞中较早消化下来的神经祖细胞(ONPs),收集之后消化下来的上皮样内耳祖细胞(OEPs)用DMEM/F12配制成1×105个/μl的细胞悬液,4℃保存备用。对动物的右耳进行手术,暴露圆窗,将提前准备好的EGFP-OEPs细胞悬液轻轻吹打均匀,吸入10μl于微量进样器中,刺穿圆窗膜将细胞悬液缓慢注入耳蜗鼓阶,用明胶海绵填塞圆窗龛,逐层缝合切口,碘伏消毒伤口。
1.2.5组织学切片免疫化学分析
荣昌猪经4%多聚甲醛灌注后,解剖内耳取出耳蜗;将耳蜗浸泡在4%多聚甲醛中固定过夜;10%EDTA常温脱钙4周;0.01M PBS缓冲液漂洗后转移到30%蔗糖溶液中4℃脱水过夜;0.01M PBS缓冲液漂洗后浸泡在OCT包埋剂中4℃过夜后进行冷冻切片。0.01M PBS缓冲液漂洗三遍,每遍15min,洗去OCT包埋剂,5%BSA室温封闭1h,加入一抗(anti-EGFP,1:3000,Abcam;anti-Myosin VIIa,1:500,Abcam;anti-ZO-1,1:100,Thermos Fisher;anti-E-cadherin,1:50,BD Biosciences;an⁃ti-N-cadherin,1:50,BD Biosciences)4℃孵育过夜。0.01M PBS洗涤3次,每次15min。加入1:400二抗(Alexa Flour 594,Alexa Flour 488,Alexa Flour 674,Jackson)避光室温孵育1h,0.01M PBS洗涤3次,每次5min。加入DAPI(4,6-二脒基-2-苯基吲哚;Be⁃yotime,),避光室温作用1min,0.01M PBS洗涤5min。封片,进行共聚焦扫描成像。
2 结果
2.1 iPS细胞向内耳祖细胞及进一步向内耳毛细胞诱导分化
三株不同来源的iPS细胞通过单层贴壁诱导分化的方法,在FGF3和FGF10同时存在的内耳祖细胞诱导分化培养液中培养12天后进行基因检测和免疫荧光检测。RT-PCR分析显示,Pax2以及内耳早期发育特异性基因(如Pax8,Dlx5,Six1,Eya-1和GATA3)在诱导细胞中均表达(图1A);三株细胞分化来的内耳祖细胞在基因表达方面并无明显差异(图1B,P>0.05)。对内耳祖细胞标志性基因PAX8和PAX2(图1C),PAX8和SOX2(图1D),PAX8和Nestin(图1E),进行免疫共标检测,结果表明,三株iPS细胞均能诱导分化为内耳祖细胞。
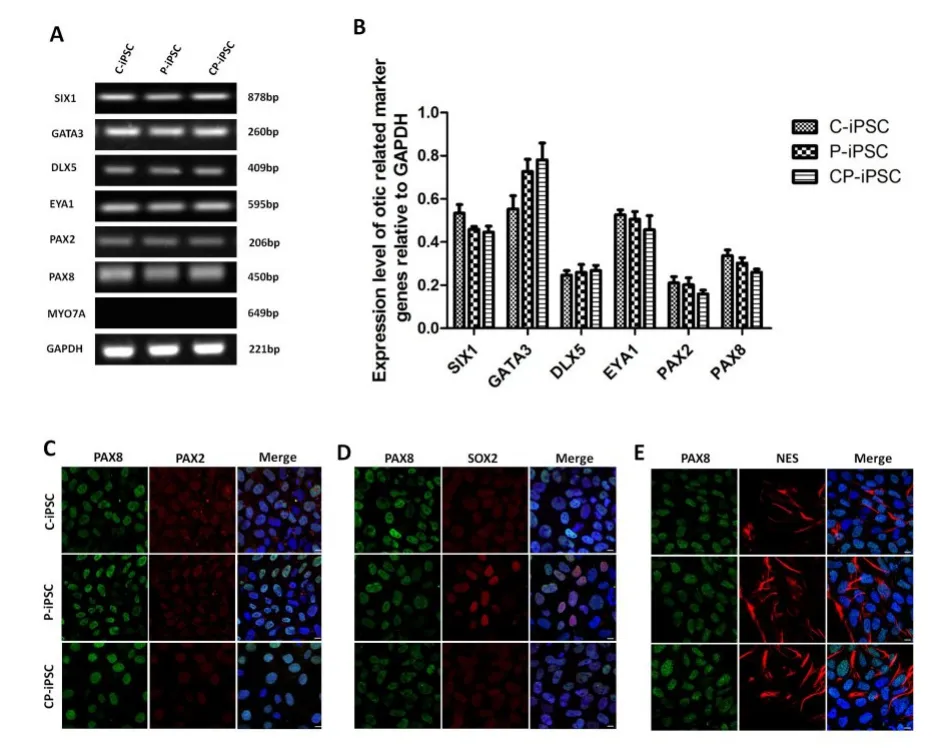
图1 内耳祖细胞检测结果。(A)C-iPS细胞株,P-iPS细胞株,CP-iPS细胞株来源的内耳祖细胞的标志性基因PAX2,PAX8,GATA3,EYA1,SIX1和DLX5的RT-PCR检测。GAPDH的表达量作为对照。(B)对三株来源的内耳祖细胞的标志性基因的表达进行量化分析,GAPDH的表达量作为对照。误差线代表方差(n=3)。(C-E)三株iPS细胞株来源的内耳祖细胞标志性基因PAX8和PAX2(C),PAX8和SOX2(D),PAX8和Nestin(E)的免疫共标检测。比例尺为10μm。Fig.1 Identification of otic progenitors differentiated from human iPSCs.(A)RT-PCR analysis of the expression of early otic progenitor marker genes PAX2,PAX8,GATA3,EYA1, SIX1,and DLX5 in cells derived from C-iPSCs,P-iPSCs,and CP-iPSCs.(B)The relative gene expression levels were quantified and plotted.The housekeeping gene GAPDH was used as an internal reference.Error bars represent the S.D.(n=3). (C-E)Co-expression of otic markers PAX8+PAX2(C), PAX8+SOX2(D),PAX8+NES(E)in otic progenitors derived from C-iPSCs,P-iPSCs,and CP-iPSCs.Scale bars=10 μm.Nuclei were stained with DAPI(blue).
收集OEPs并在补充有EGF和全反式视黄酸的鸡胚椭圆囊基质细胞的条件培养基上培养3周后进行基因检测和免疫荧光检测。RT-PCR分析显示,在诱导的毛细胞样细胞中表达毛细胞转录因子ATOH1和BRN3C、早期毛细胞结构蛋白MYO7A以及毛束发育所需的蛋白质ESPN(图2A);三株细胞分化来的内耳毛细胞在基因表达方面并无明显差异(图2B,P>0.05)。我们对内耳毛细胞标志性基因BRN3C和ATOH1(图2C),BRN3C和MYO7A(图2D),BRN3C和ESPN(图2E)进行免疫共标检测,结果表明,三株iPS细胞均有向内耳毛细胞分化的能力。

图2 内耳毛细胞检测结果。(A)C-iPS细胞株,P-iPS细胞株,CP-iPS细胞株来源的内耳毛细胞的标志性基因MYO7A、ATOH1、BRN3C和Espin以及支持细胞的标志性基因p27kip1的表达情况。GAPDH的表达量作为对照。(B)对三株来源的内耳毛细胞和支持细胞的标志性基因的表达进行量化分析,GAPDH的表达量作为对照。误差线代表方差(n=3)。(C-E)三株iPS细胞株来源的内耳毛细胞标志性基因BRN3C和ATOH1(C),BRN3C和MYO7A(D),BRN3C和ESPN(E)的免疫共标检测。比例尺为10μm。
2.2 iPS细胞体外诱导分化的内耳毛细胞样细胞和支持细胞间的相互作用
有文献报道,在内耳的发育过程中,内耳毛细胞和支持细胞来自于同一种前体细胞[16]。因此,我们推测在iPS体外诱导分化为内耳毛细胞的过程中有一部分细胞分化为支持细胞。为了证实这一推测,我们将三株不同来源的iPS细胞诱导分化成的内耳毛细胞固定后用免疫荧光特异性标记支持细胞的标志性基因p27kip1。免疫标记显示,分别有13.1%±2.7%、14.1%±2.9%和12.7%±2.7%的细胞表现为p27kip1和myosin7A双阳性(图3 A,B),我们将这类细胞视为未完全分化的处于分化初期的毛细胞;分别有7.6%±1.5%、9.1%±0.9%和7.2%± 1.7%的细胞仅表达p27kip1,而没有表达myosin7A(图3 C,D),我们将这类细胞视为支持细胞[17]。

图3 诱导分化的毛细胞体系中MYO7A和p27kip1的免疫荧光检测。(A)三株来源不同的iPS细胞诱导分化的内耳毛细胞样细胞中MYO7A和p27kip1的共标检测。比例尺为20μm。(B)三株来源不同的iPS细胞诱导分化的内耳毛细胞样细胞中MYO7A和p27kip1双阳性细胞在总体细胞所占比例的比较分析。误差线代表方差(n=3)。(C)三株来源不同的iPS细胞诱导分化的内耳毛细胞样细胞中p27kip1的检测。比例尺为20μm。(D)三株来源不同的iPS细胞诱导分化的内耳毛细胞样细胞中只表达p27kip1而不表达MYO7A的细胞在总体细胞所占比例的比较分析。误差线代表方差(n=3)。Fig.3 Detection of MYO7A and p27kip1 expression.(A)The co-expression of MYO7A and p27kip1 in cells derived from C-iPSCs,P-iPSCs,and CP-iPSCs were evaluated by immunochemistry.Scale bars=20 μm.(B)Percentage of MYO7A and p27kip1 double-positive cells in the total cell population derived from C-iPSCs,P-iPSCs,and CP-iPSCs.Error bars represent SD(n=3).(C)The expression of p27kip1 in cells derived from C-iPSCs,P-iPSCs,and CP-iPSCs were evaluated by immunochemistry.Scale bars=20 μm.(D)Percentage of p27kip1 positive cells in the total cell population derived from C-iPSCs, P-iPSCs,andCP-iPSCs.ErrorbarsrepresentSD(n=3).
此后,我们探究诱导分化成的毛细胞和支持细胞之间是否存在形态上的联系。E-cadherin和N-cadherin是钙粘蛋白家族中存在于钙粘连接中的两种经典的跨膜糖蛋白,ZO-1是检测紧密连接的一种常用蛋白。于是,本实验中我们通过特异性检测E-cadherin、N-cadherin和ZO-1的存在和分布来判定毛细胞和支持细胞之间在形态上的关系。结果表明E-cadherin(图4A)、N-cadherin(图4B)和ZO-1(图4C)在毛细胞-支持细胞之间以及支持细胞-支持细胞之间都存在。
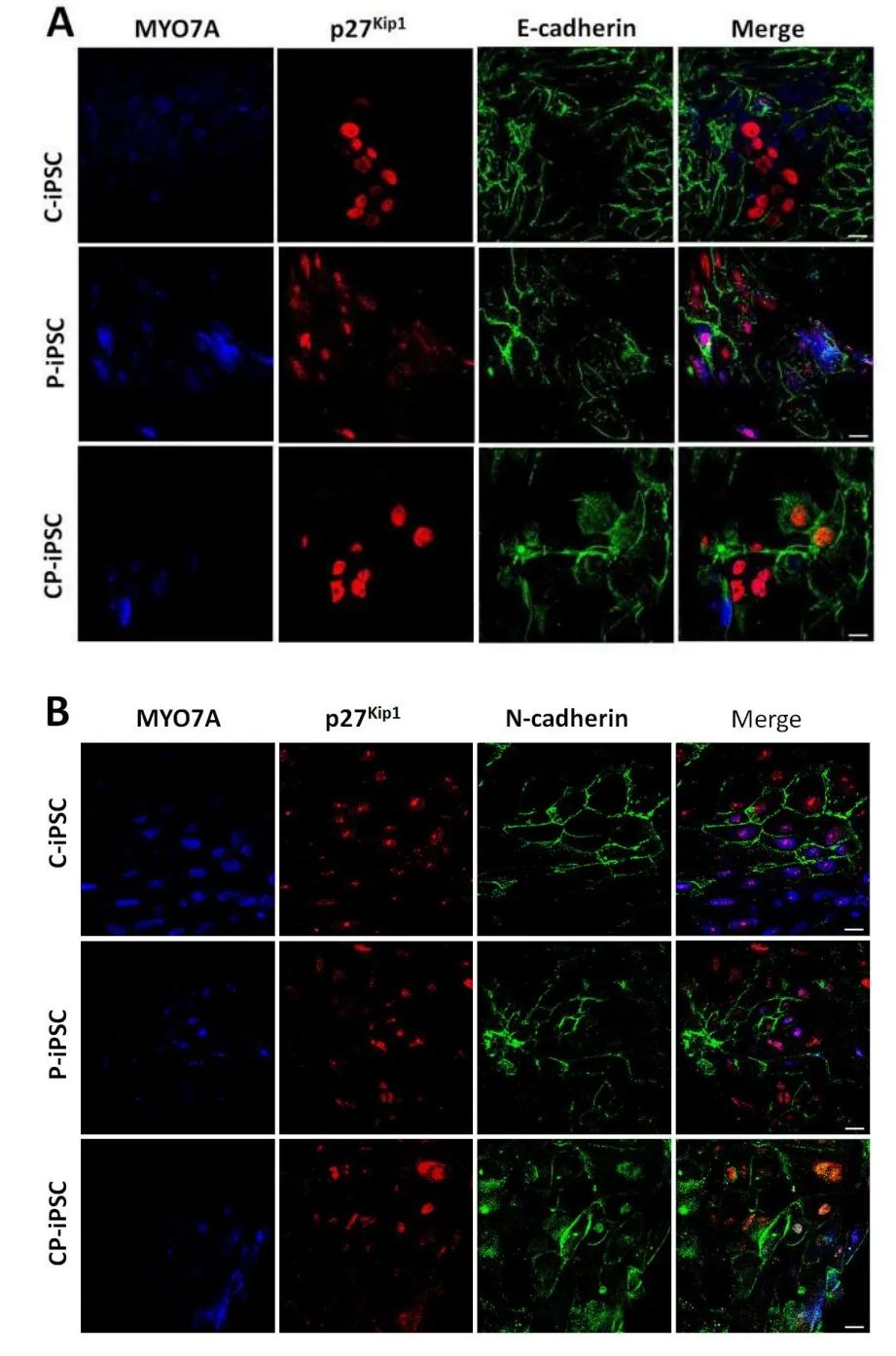

图4 三株iPS细胞来源的内耳毛细胞样细胞与支持细胞间细胞连接。三株不同来源的内耳上皮样内耳祖细胞在lam⁃inin上诱导分化20天后毛细胞和支持细胞之间E-cad⁃herin(A)、N-cadherin(B)和ZO-1(C)的表达。其中毛细胞由MYO7A特异性标记,支持细胞由p27kip1特异性标记。比例尺为20μm。Fig.4 Intercellular junctions between hair cell-like cells and supporting cells derived from otic epithelial progenitors.Immunofluorescence of cells induced from otic epithelial progenitors derived from C-iPSCs,P-iPSCs,and CP-iPSCs for 3 weeks on laminin showed positive labeling for(A)E-cadherin,(B)N-cadherin and(C)ZO-1 in the junction between hair cell-like cells marked with MYO7A and supporting cells marked with p27Kip1.Scale bars=20 μm.
2.3移植细胞在白化荣昌猪内耳中的迁移、分化及细胞间连接
移植四周后,免疫组化结果显示,移植细胞大部分以细胞团的形式存在于鼓阶,小部分细胞迁移到了中阶,其中只有极小部分细胞迁移到了毛细胞损伤部位-柯底氏器(图5A)。为探究OEPs在耳蜗微环境中的分化潜能,我们对毛细胞标志物MYO7A进行免疫荧光检测,结果表明,迁移到柯式器上的细胞部分呈MYO7A阳性(图5B),初步断定迁移到柯底氏器上的细胞可以成功分化为毛细胞。最后,我们特异性检测钙粘连接蛋白E-cadherin和N-cadherin以及紧密连接蛋白ZO-1的表达情况来探究体外已经证实过的存在于毛细胞和支持细胞之间的钙粘连接和紧密连接是否在体内依然能够形成,结果显示,移植细胞分化后相互之间依然有E-cadherin(图6A)、N-cadherin(图6B)和ZO-1(图6C)的表达,且少量移植细胞与宿主组织之间也有E-cadherin、N-cadherin和ZO-1的表达。通过对三株细胞株的比较发现,三株不同来源的上皮样祖细胞在内耳中的迁移、分化以及E-cadherin、N-cadherin和ZO-1的表达和分布方面并没有明显的差异。
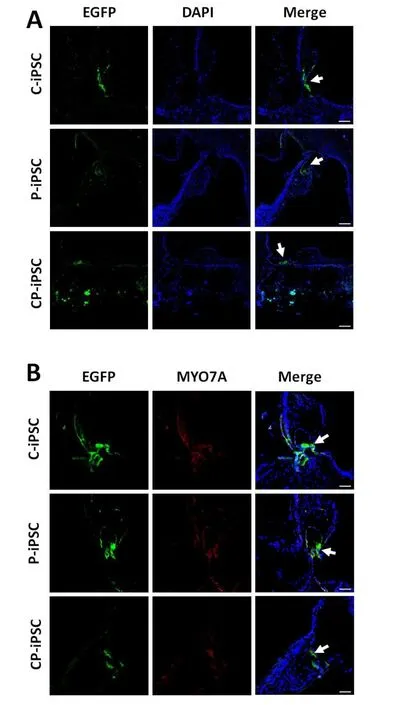
图5 移植细胞在白化荣昌猪内耳中的迁移和分化。三株不同来源的表达EGFP的上皮样祖细胞移植到荣昌猪内耳四周后,均发现有细胞迁移到了毛细胞损伤部位-柯式器(A),并且部分细胞向毛细胞方向分化(B)。移植细胞由EGFP的表达显示,诱导分化的毛细胞由MYO7A特异性标志,蓝色标记的细胞核用来显示耳蜗的结构。比例尺为50μm。Fig.5 Migration and differentiation of OEPs transplanted into the inner ear of Rong-Chang swine.(A)Migration of cells derived from C-iPSCs,P-iPSCs,and CP-iPSCs in the organ of Corti of the albino Rong-Chang swine.Scale bars=100 μm.(B)Differentiation of cells derived from C-iPSCs,P-iPSCs,and CP-iPSCs toward inner hair cells in the organ of Corti.Scale bars=50 μm.Grafted cells were visualized by EGFP expression and differentiated hair cells were marked by MYO7A.Nuclei were stained with DAPI(blue).


图6 移植细胞在体内的连接。三株不同来源的上皮样内耳祖细胞迁移到柯式器上以后分化细胞之间以及移植细胞与宿主细胞之间E-cadherin(A)、N-cadherin(B)和ZO-1(C)的表达。移植细胞由EGFP的表达显示,诱导分化的毛细胞由MYO7A特异性标志,蓝色标记的细胞核用来显示耳蜗的结构。比例尺为50μm。Fig.6 Formation of Intercellular junctions by cells transplanted into inner ear.Expression of(A)E-cadherin,(B) N-cadherin and(C)ZO-1 in the cell-cell contact formed by cells derived from C-iPSCs,P-iPSCs,and CP-iPSCs in the organ of Corti.Grafted cells were visualized by EGFP expression and hair cells differentiated were marked by MYO7A. Nuclei were stained with DAPI(blue).Scale bars=50 μm.
3 讨论
随着干细胞技术的发展,越来越多的科学家尝试利用干细胞替换损伤的毛细胞[18-20]和听觉神经元[21-25]的方法来治疗耳聋。Wei Chen等人将hESCs体外诱导分化成的内耳祖细胞移植到成年的耳聋沙鼠模型中,发现细胞不仅成功分化成了螺旋神经元细胞,而且产生了实质性的功能恢复,这为将来的基于干细胞取代的听觉神经性耳聋的治疗提供了很有前景的发展方向[6]。毛细胞被看作是耳聋治疗的重要靶点,它的取代是听力恢复的最彻底的治疗。然而,几乎没有研究表明外源细胞已成功取代受损的毛细胞并改善听觉功能,这可能是由于外源细胞很难整合进宿主组织。在体内,支持细胞可以维持上皮细胞的生存环境,对毛细胞发挥功能起着重要的作用。因此,深入了解干细胞体外诱导分化的内耳毛细胞样细胞与支持细胞之间的相互作用关系可能会为外源细胞在宿主组织上的整合提供一定帮助。
在所有的内耳感觉上皮中,毛细胞和支持细胞的有序排列对于听力是必须的。在感觉上皮的表面,毛细胞和支持细胞的质膜通过粘附连接和紧密连接相互作用,形成对柯底氏器的结构完整性至关重要的网状层[11]。粘附连接主要通过机械的连接相邻的细胞以保持组织的完整性,而紧密连接主要是通过形成一个离子渗透屏障来保证内淋巴液和外淋巴液的离子环境[26]。在网状层中介导接触的重要分子之一是钙粘素,一种参与钙依赖性细胞间粘附的跨膜糖蛋白家族,这个家族包括E-cad⁃herin、N-cadherin和P-cadherin。有研究已经证明,在成年哺乳动物的柯底氏器上,钙粘蛋白存在于毛细胞-支持细胞异型连接之间和支持细胞-支持细胞同型连接之间[10,27]。紧密连接由多种蛋白质组成,包括 Occluding[28],claudins[29],zonula oc⁃cludens ZO)家族和其他细胞质蛋白。紧密连接蛋白ZO-1存在于支持细胞-毛细胞异型连接和支持细胞-支持细胞同型连接中[11]。于是,我们通过检测粘附连接蛋白(E-cadherin和N-cadherin)以及紧密连接蛋白(ZO-1)的分布探究体外诱导的毛细胞与支持细胞之间的关系。
为了探究移植的外源细胞能否迁移到柯底氏器中并与宿主细胞建立起联系,我们将三株不同来源的上皮样内耳祖细胞移植到白化耳聋荣昌猪的内耳中。以往进行的利用细胞取代策略治疗耳聋的研究中,大家常选用小鼠,大鼠和其他啮齿类动物。而在我们这次的研究中,采用小型猪作为动物模型。与传统耳科研究中使用的啮齿类动物相比,小型猪的优势在于其与人类基因组的高度同源性,以及其在内耳解剖、内耳形态及电生理等方面与人的相似性[32]。本次实验采用的荣昌猪具有Mitf-M基因突变,可使血管纹发生病变,耳蜗发育不良,螺旋神经节细胞和毛细胞数量减少,从而导致感觉神经性耳聋[14]。我们这次研究的主要目标就是探究移植的外源细胞在内耳中的迁移、分化以及在柯底氏器中细胞之间建立连接的情况。移植四周后,我们在柯底氏器周围靠近盖膜的地方发现了EGFP标记的细胞,这和以往的研究结果大体一致[33]。这些结果表明外源细胞可以从鼓阶迁移到中阶。然而,只有极少数量的细胞整合到听觉上皮组织中。这可能是由于我们的动物模型是一种先天性耳聋模型,其耳蜗病变不是急性损伤,因此不能发生炎症反应,并且在微环境中没有炎症细胞因子有效地促进外源细胞与听觉上皮组织的整合[34]。在整个研究过程中,我们均采用三种不同来源的iPS细胞株同时进行实验,结果对比发现,三株不同来源的iPS细胞诱导分化的支持细胞和内耳毛细胞样细胞之间在体外和体内均能形成钙粘连接和紧密连接,并且在E-Cadherin、N-cadherin和ZO-1的表达和分布方面并无明显差异。因此,我们初步推测MYO7A基因突变对于毛细胞和支持细胞间连接没有明显影响。当然,在本研究中使用的动物模型不是最佳的,特别是对于源自CP-iPSC的细胞的移植实验。我们正在寻找MYO7A突变的动物模型,并将探究CP-iPSC来源的细胞对体内毛细胞的形态和功能的恢复效应。
本研究通过一系列实验得到最终结论:iPSCs诱导分化的内耳毛细胞和支持细胞在体外和体内均能形成钙粘连接和紧密连接。更好的了解干细胞体外诱导分化的毛细胞与支持细胞之间的关系有助于基于毛细胞取代的干细胞治疗耳聋的进一步研究和发展。
1 Strenzke N,Pauli-Magnus D,Meyer A,et al.Update on physiolo⁃gy and pathophysiology of the inner ear[J].Pathomechanisms of Sensorinerual Hearing Loss,2008,56(1):27–36.
2 Rubel EW,Furrer SA,Stone JS.A brief history of hair cell regen⁃eration research and speculations on the future[J].Hearing Re⁃search,2013,297(3):42–51.
3 Peng T,Dong Y,Zhu G,et al.Induced pluripotent stem cells: landscape for studying and treating hereditary hearing loss[J]. Journal of Otology,2014,9(4):151–155.
4 Hu Z,Ulfendahl M.The potential of stem cells for the restoration of auditory function in humans[J].Regenerative Medicine,2013,8 (3):309–318.
5 Oshima K,Shin K,Diensthuber M,et al.Mechanosensitive hair cell like cells from embryonic and induced pluripotent stem cells [J].Cell,2010,141(4):704–716.
6 Chen W,Jongkamonwiwat N,Abbas L,et al.Restoration of audito⁃ry evoked responses by human ES-cell-derived otic progenitors [J].Nature,2012,490(7419):278–282.
7 Tang ZH,Chen JR,Zheng J,et al.Genetic correction of induced pluripotent stem cells from a deaf patient with MYO7A mutation results in morphologic and functional recovery of the derived haircell-like cells[J].Stem Cell Translation Medicine,2016,5(5): 561-571.
8 Chen JR,Tang ZH,Zheng J,et al.Effects of genetic correction on the differentiation of hair cell-like cells from iPSCs with MYO15A mutation[J].Cell Death and Differentiation,2016,23 (2016):1347-1357.
9 Mann ZF,Kelley MW.Development of tonotopy in the auditory pe⁃riphery[J].Hearing Research,2011,276(1):2–15.
10 Leonova EV.Raphael Y.Organization of cell junctions and cyto⁃skeleton in the reticular lamina in normal and ototoxically dam⁃aged organ of Corti[J].Hearing Research,1997,113(1):14-28.
11 Gulley RL,Reese TS.Intercellular junctions in the reticular lami⁃na of the organ of Corti[J].Journal of Neurocytology,1976,5(4): 479-507.
12 Forge A,Becker D,Casalotti S,et al.Gap Junctions in the inner ear:Comparison of distribution patterns in different vertebrates and assessement of connexin composition in mammals[J].Com⁃parative Neurology,2003,467(2):207-231.
13 Wan GQ,Corfas G,Stone JS.Inner ear supporting cells:Rethink⁃ing the silent majority[J].Seminars in Cell and Developmental Bi⁃ology,2013,24(5):448-459.
14 任丽丽.白化荣昌猪耳聋的分子病理机制研究.中国人民解放军医学院,2013. Ren LL.Probing the molecular pathological mechanism underly⁃ing the deafness in albino Rongchang swine.Dissertation in Medi⁃cal School PLA,2013.
15 Ding J,Tang ZH,Chen JR,et al.Induction of differentiation of hu⁃man embryonic stem cells into functional hair-cell-like cells in the absence of stromal cells.Inter[J].The International Journal of Biochemistry and Cell Biology,2016,81(A):208-222.
16 Fekete DM,Muthukumar S,Karagogeos D.Hair cells and support⁃ing cells share a common progenitor in the avian inner ear[J]. Journal of Neuroscience,1998,18(19):7811-7821.
17 Chen P,Segil N.p27(Kip1)links cell proliferation to morphogene⁃sis in the developing organ of Corti[J].Development,1999,126 (1):1581–1590.
18 Hildebrand MS,Dahl HH,Hardman J,et al.Survival of partially differentiated mouse embryonic stem cells in the scala media of the guinea pig cochlea[J].Journal of the Association for Research in Otolaryngology,2005,6(4):341–354.
19 Ito J,Kojima K,Kawaguchi S.Survival of neural stem cells in the cochlea[J].Acta Oto-Laryngologica,2001,121(2):140–142.
20 Li H,Roblin G,Liu H,et al.Generation of hair cells by stepwise differentiation of embryonic stem cells[J].Proceedings of the Na⁃tional Academy of Sciences of the United States of America,2003, 100(23):13495–13500.
21 Matsumoto M,Nakagawa T,Kojima K,et al.Potential of embryon⁃ ic stem cell-derived neurons for synapse formation with auditory hair cells[J].Neuroscience Research,2008,86(14):3075–3085.
22 Altschuler RA,O’Shea KS,Miller JM,et al.Stem cell transplanta⁃tion for auditory nerve replacement[J].Hearing Research,2008, 242(1):110–116.
23 Coleman B,Hardman J,Coco A,et al.Fate of embryonic stem cells transplanted into the deafened mammalian cochlea[J].Cell Transplantation,2006,15(5):369–380.
24 Nishimura K,Nakagawa T,Ono K,et al.Transplantation of mouse induced pluripotent stem cells into the cochlea[J].NeuroReport, 2009,20(14):1250–1254.
25 Corrales CE,Pan L,Li H,et al.Engraftment and differentiation of embryonic stem cell–derived neural progenitor cells in the co⁃chlear nerve trunk:Growth of processes into the organ of corti[J]. Neurobiology,2006,66(13):1489–1500.
26 Jahnke,K.The fine structure of freeze-fractured intercellular junc⁃tions in the guinea pig inner ear[J].Acta Oto-Laryngologica, 1975,80(336):5-40.
27 Whitlon DS.E-cadherin in the mature and developing organ of Corti of the mouse[J].Journal of Neurocytology,1993,22(12): 1030-1038.
28 Furuse M,Hirase T,ItohM,et al.Occludin:a novel integral mem⁃brane protein localizing at tight junctions[J].The Journal of Cell Biology,1993,123(6):1777–1788.
29 Furuse M,Sasaki H,Tsukita S.Manner of interaction of heteroge⁃neous claudin species within and between tight junction strands [J].The Journal of Cell Biology,1999,147(4):891-903.
30 Itoh M,Nagafuchi A,Yonemura S,et al.The 220-kD protein colo⁃calizing with cadherins in non-epithelial cells is identical to ZO-1,a tight junction-associated protein in epithelial cells:cDNA cloning and immunoelectron microscopy[J].The Journal of Cell Biology,1993,121(3):491-502.
31 Itoh M,Morita K,Tsukita S.Characterization of ZO-2 as a MA⁃GUK family member associated with tight as well as adherens junctions with a binding affinity to occludin and alpha catenin[J]. Journal of Biological Chemistry,1999,274(9):5981-5986.
32 杨仕明.小型猪动物模型在耳科学领域的应用[J].中华耳科学杂志.2016,14(1):1-5. Yang SM.The miniature pig as an animal model in otological re⁃search[J].Chinese Journal of Otology,2016,14(1):1-5.
33 Zhao LD,Li L,Wu N,et al.Migration and differentiation of mouse embryonic stem cells transplanted into mature cochlea of rats with aminoglycoside-induced hearing loss[J].Acta Oto-Laryngologi⁃cal,2013,133(2):136-143.
34 Shi Y,Su J,Roberts A,et al.How mesenchymal stem cells inter⁃act with tissue immune responses[J].Trends in Immunology, 2012,33(3):136-143.
Intercellular Junctions Between Hair Cell-like Cells and Supporting Cells Derived From Human iPSCs
WANG Cuicui1,CHEN Jianling1,TANG Zihua1,QIU Shiwei2,ZHANG Cui1,LI Liang1, GUO Weiwei2,YANG Shiming2,WANG Jinfu1
1 Institute of Cell and Development Biology,College of Life Sciences,Zijingang Campus,Zhejiang University, Hangzhou,Zhejiang 310058,P.R.China
2 Institute of Otolaryngology,Chinese PLA General Hospital,Beijing,100853,China
WANG Jinfu Email:wjfu@zju.edu.cn
Obiective To examine the relationships between inner ear hair cells and supporting cells from induced pluripotent stem cells(iPSCs).Methods Normal iPSCs derived from a healthy donor(C-iPS),iPSCs with myosin7A mutation derived from a deaf patient(P-iPS)and iPSCs with myosin 7A corrected genetically(CP-iPS)were induced to differentiate into otic progenitors,and then OEPs were isolated from otic progenitors and induced to differentiate into inner ear hair cell-like cells and supporting cells.Immunofluorescence was used to examine in vitro formation of intercellular junctions between the induced hair cell-like cells and supporting cells.Furthermore,EGFP-OEPs derived from three iPSCs were transplanted into the inner ear of albino Rong-Chang swine via round widow to examine the migra-tion,differentiation and intercellular junctions between these cells.Results OEPs derived from iPSCs could be induced into hair cell-like cells and supporting cells simultaneously,and intercellular junctions such as adhering junctions and tight junctions were formed between hair cell-like cells and supporting cells derived from OEPs.After transplantation, the grafted cells could migrate from the scala tympani to the scala media.However,only a limited number of cells were integrated into the native auditory epithelial tissue,and some EGFP-cells integrated into the organ of Corti and expressed the hair cell marker MYO7A,indicating that these exogenous cells had differentiated into hair cell-like cells. Further immunolabeling assays showed production of adhering junction proteins(E-cadherin and N-cadherin)and a tight junction protein(ZO-1)between these differentiated cells and other cells,similar to what was observed in vitro. Conclusions Cell-cell interactions such as adhering junctions and tight junctions between hair cell-like cells and supporting cells derived from iPSCs can be formed not only in vitro but also in vivo.These results may facilitate the development of hair cells replacement-based strategy for deafness.
Deafness;IPSCs;Hair Cells;Supporting Cells;Intercellular Junctions
R764
A
1672-2922(2017)04-489-9
2017-06-21审核人:翟所强)
10.3969/j.issn.1672-2922.2017.04.020
国家重大基础研究(973)项目,编号:2014CB541705
王翠翠,硕士,研究方向:干细胞治疗感音神经性耳聋的临床基础研究
王金福,Email:wjfu@zju.edu.cn
