中华绒螯蟹蜕壳过程中肌肉的组织学、超微结构及主要蛋白质含量的变化
2017-09-12田志环成永旭吴旭干刘
田志环成永旭吴旭干刘 青
(1. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306; 2. 广东韶关学院英东生命科学学院, 韶关 512005)
中华绒螯蟹蜕壳过程中肌肉的组织学、超微结构及主要蛋白质含量的变化
田志环1,2成永旭1吴旭干1刘 青1
(1. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306; 2. 广东韶关学院英东生命科学学院, 韶关 512005)
为探讨中华绒螯蟹(Eriocheir sinensis)蜕壳前后肌肉组织的形态特征变化, 采用石蜡切片、电镜及生物化学方法, 研究了中华绒螯蟹蜕皮过程中步行足和腹部肌肉的组织学、超微结构及主要蛋白质含量的变化。结果显示: 相对于蜕皮间期, 步行足在蜕皮前后组织学形态特征无明显变化; 超微结构在蜕皮前无明显变化,蜕皮后可见肌原纤维纵裂及肌小节横裂现象, 表明蜕皮后外骨骼硬化的过程伴随着肌肉的生长。相对于蜕皮间期, 腹部肌肉在蜕皮前后组织学特征变化明显: 蜕皮前肌束间隙增大, 蜕皮后肌束内肌纤维间隙增大。电子显微镜观察显示, 蜕皮前肌原纤维在内部降解, 出现空洞, 肌原纤维边缘降解, 导致肌原纤维间隙增大; 蜕皮后肌原纤维重新组装、重建, 恢复到间期正常形态。生物化学研究发现, 蜕皮前后步行足和腹部肌肉中肌原纤维蛋白和可溶性蛋白含量的变化同其结构特征的变化相一致。以上研究结果表明, 中华绒螯蟹肌肉组织的结构特征同蜕皮周期密切相关。
组织学; 超微结构; 肌原纤维蛋白; 可溶性蛋白; 蜕皮; 步行足; 腹部肌肉; 中华绒螯蟹
甲壳动物由于体表覆盖着坚硬的外骨骼, 其生长发育和蜕皮周期密切相关。在蜕皮过程中, 甲壳动物发生一系列形态结构、生理生化及分子生物学方面的变化[1—5]。更为重要的是, 对甲壳动物来说, 蜕皮即意味着生长, 而衡量动物生长的一项重要指标即肌肉的生长发育。目前, 国内对于甲壳动物蜕壳与肌肉生长的关系并无相关研究, 对于蜕壳过程中肌肉生长及调节机制更是一无所知。本文以中华绒螯蟹(Eriocheir sinensis)为实验对象, 研究其蜕皮前后肌肉组织的显微结构、超微结构及主要蛋白质含量的变化, 为后续研究蜕皮与肌肉生长在分子水平方面的变化及其调节机制提供基础资料。
1 材料与方法
1.1 实验材料
一年生中华绒螯蟹取自上海海洋大学崇明养殖基地, 平均体重(8.24±2.17) g, 此体重的中华绒螯蟹性腺尚未发育, 故雌雄个体随机取材。按照文献[6, 7]的方法鉴定蜕皮周期, 分别取蜕皮间期C期、蜕皮前晚期D3-4期及蜕皮后A-B期个体, 按照图 1所示, 分别取第3步行足前节的开肌及腹部第Ⅴ腹节肌肉进行研究。
1.2 实验方法
组织学研究 按照图 1所示, 取不同蜕皮时期中华绒螯蟹的肌肉组织, Bouin氏液固定24h, 系列酒精脱水, 二甲苯透明, 石蜡包埋, 常规切片, 切片厚度 6—8 μm。苏木精-伊红染色, 光学显微镜(Leica, RM2125 RTS)观察拍照。
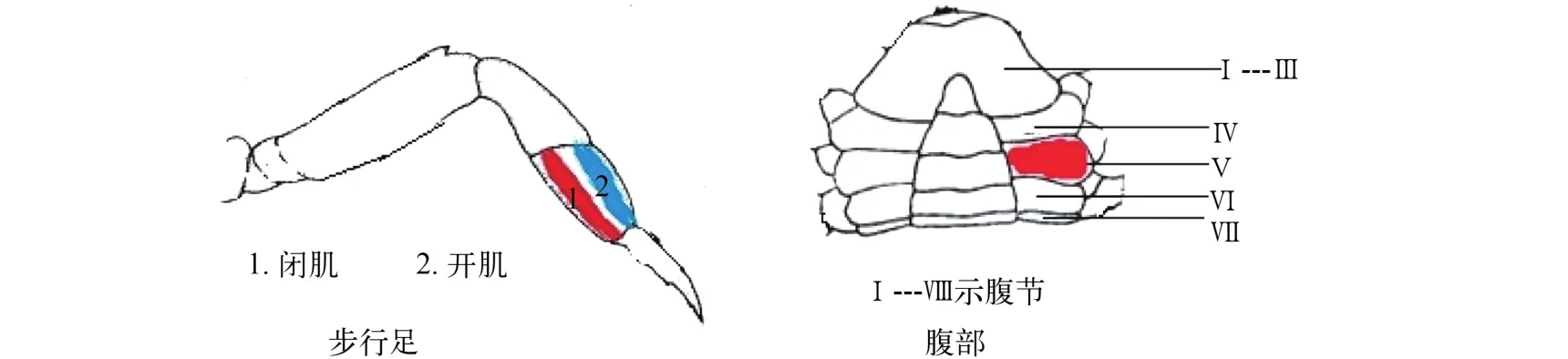
图 1 中华绒螯蟹步行足和腹部肌肉示意图Fig. 1 Diagram of the walking leg and abdomen muscle of Eriocheir sinensis
超微结构研究 按照图 1所示, 取不同蜕皮时期中华绒螯蟹的肌肉组织, 切成1 mm×1 mm× 1 mm的小块, 立即投入2.5%的戊二醛固定液中固定2—24h, 然后于1%锇酸后固定2h, 环氧树脂包埋。常规超薄切片70—90 nm, 2%柠檬酸铅和0.1%醋酸铀双重电子染色, 透视电子显微镜(JEM2100)观察拍照。
肌纤维蛋白与可溶性蛋白含量测定 按照Saito等[8]的方法, 略作改动: 准确称取一定量的肌肉组织, 按1:4 (w/v)的比例加入0.05 mol/L磷酸盐缓冲液 (pH=7.4), 电动匀浆器匀浆2min, 4℃离心10min(转速12000 r/min), 收集上清液, 重复上次步骤2次, 合并上清液待测蛋白含量。收集可溶性蛋白提取后剩余的沉淀, 按1:2(w/v)的比例加入含0.6 mol/L NaCl的0.05 mol/L磷酸盐缓冲溶液(pH=7.4), 电动匀浆器匀浆2min, 4℃离心10min (转速12000 r/min), 收集上清液, 重复上次步骤2次, 合并上清液测定蛋白含量。蛋白质含量测定试剂盒由南京建成生物公司提供。
数据处理 利用SPSS 17.0 软件处理数据, 采用单因素方差分析, 显著性水平P<0.05, 数值以平均数±标准差表示。
2 结果
2.1 不同部位肌肉组织在蜕皮间期的形态特征不同
步行足肌纤维多椭圆形, 多核, 细胞核位于肌膜(细胞膜)下方, 并且肌纤维排列疏松、游离, 不形成肌肉束(图 2a)。腹部肌肉肌纤维为不规则块状,排列紧密, 几到十几束肌纤维聚集成束, 形成肌肉束(图 2b, 箭头所示), 外包结缔组织形成的肌束膜。电子显微镜下, 步行足肌节长度约为(3.80± 0.17) μm, A、I带和Z线清晰可见, H带隐约可见。肌原纤维之间分布着大量肌质网及二连体(图 3a)。腹部肌原纤维的肌节长度约为(4.44±0.45) μm, H带不明显(图 3b)。
2.2 不同部位肌肉组织蜕皮前后结构特征变化不同
步行足 组织切片上步行足蜕皮前后看不出明显变化(图 4)。电子显微镜观察显示, 与蜕皮间期相比, 蜕皮前肌原纤维结构无明显变化, 蜕皮后可见纵裂的纤维束及肌节横裂, 显示肌纤维的生长(图 5)。

图 2 中华绒螯蟹蜕皮间期C期步行足(a)和腹部肌肉(b)的组织学特征Fig. 2 Histology of walking leg muscle (a) and abdominal muscle (b) of E. sinensis in intermolt C stage箭头示纤维束(标尺: 100 μm)Fiber bundles are indicated by arrowheads. Scale bar: 100 μm
腹部肌肉 与蜕皮间期相比, 蜕皮前腹部肌肉组织的肌束间隙有所增大, 但肌纤维无明显萎缩。蜕皮后可见肌束膜内肌纤维间隙增大(图 6)。电子显微镜切片显示, 腹部肌肉组织在蜕皮前肌原纤维有降解现象, 肌原纤维内部出现空洞, 肌原纤维间隙增大, 严重者Z线断裂、消失。蜕皮后, 肌原纤维得以重建、恢复, 但弯曲、折叠, 在纵切面上肌丝断断续续, I带、A带不明显(图 7)。
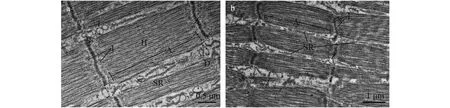
图 3 中华绒螯蟹蜕皮间期C期步行足(a)和腹部肌肉(b)的超微结构Fig. 3 Ultrastructure of walking leg muscle (a) and abdominal muscle (b) of E. sinensis in inter-molt C stageA. A带, I. Z带, H. H带, Z. Z线, D. 二联体, T. 三联体, SR. 肌质网A band (A), I band (I), H band (H), Z line (Z), dyad (D), triplet (T) and sarcoplasmic reticulum (SR) are indicated
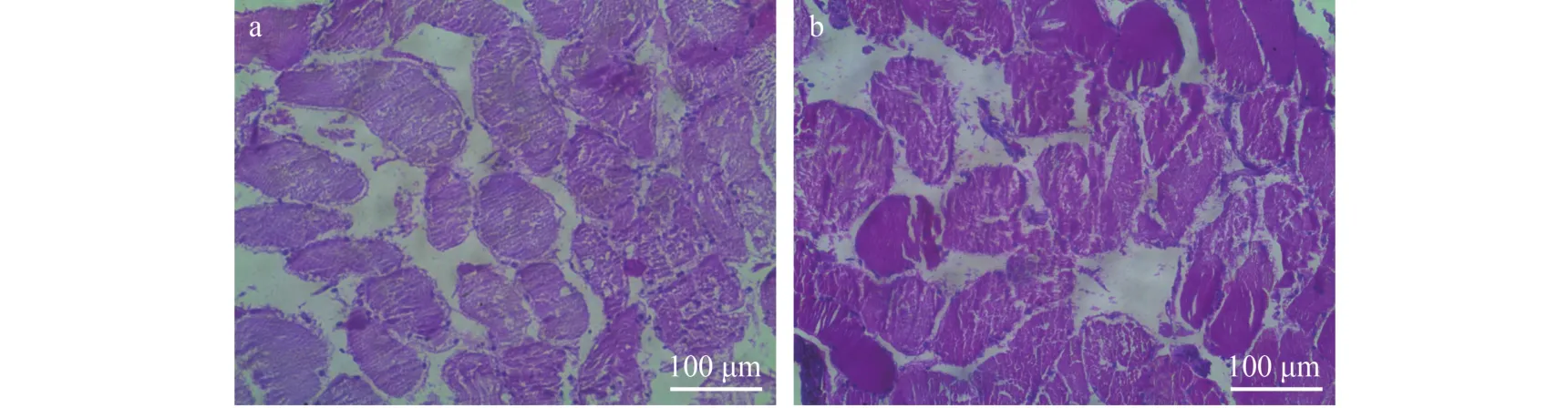
图 4 中华绒螯蟹蜕皮前晚期D3-4期(a)和蜕皮后A-B期(b)步行足的组织学特征(标尺: 100 μm)Fig. 4 Histology of walking leg muscle of E. sinensis in later pre-molt D3-4stage (a) and post-molt A-B stage (b). Scale bar: 100 μm

图 5 中华绒螯蟹蜕皮前晚期D3-4期(a)和蜕皮后A-B期(b)步行足超微结构
2.3 肌肉组织肌原纤维蛋白和可溶性蛋白含量的变化
从蜕皮后A-B期至蜕皮间期C期, 步行足和腹部肌肉肌原纤维蛋白含量都有所增加; 从蜕皮间期C期到蜕皮前晚期D3-4期, 步行足肌原纤维蛋白含量略有升高, 而腹部肌肉肌原纤维蛋白含量略有下降。可溶性蛋白含量变化与此有所不同, 在所测量的3个时期, 步行足和腹部肌肉的可溶性蛋白含量都是在蜕皮前晚期D3-4期最高, 蜕皮后A-B期可溶性蛋白含量最低, 此后逐渐升高, 恢复到蜕皮间期水平(图 8)。
3 讨论
3.1 中华绒螯蟹蜕壳前后肌肉组织的形态结构变化
甲壳动物肌纤维按肌节长度主要分为长肌节纤维(>6 μm)、短肌节纤维(<4 μm)和混合型肌节纤维(4—6 μm)[9]。不同长度的肌纤维形态特征不同:长肌节纤维Z线弯曲不平整, H带不明显, 短肌节纤维Z线平直, H带可见, 混合型肌节纤维介于二者之间[10—12]。很明显, 中华绒螯蟹步行足属于短肌节纤维, 而腹部肌肉属于混合肌节纤维, 二者的超微结构特征差异明显(图 3)。在光学显微镜下, 步行足和腹部肌肉的组织学特征也是差异明显, 前者肌纤维游离, 没有形成肌纤维束; 后者肌纤维聚集成束,外包肌束膜。不同部位肌肉组织结构的特征和它们的功能相适应, 游离、无肌束膜包裹的肌纤维更有利于步行足在不同方向的灵活运动。

图 6 中华绒螯蟹蜕皮前晚期D3-4期(a)和蜕皮后A-B期(b)腹部肌肉的组织学特征Fig. 6 Histology of abdominal muscle of E. sinensis in later pre-molt D3-4stage (a) and post-molt A-B stage (b)箭头示增大的纤维束间隙, 星号示增大的肌纤维间隙(标尺: 100 μm)The enlarged space of fiber bundles and fibers are indicated by arrowheads and stars respectively. Scale bar: 100 μm

图 7 中华绒螯蟹蜕皮前晚期D3-4期(a)和蜕皮后A-B期(b)腹部肌肉超微结构Fig. 7 Ultrastructure of abdominal muscle of E. sinensis in later pre-molt D3-4stage (a) and post-molt A-B stage (b)M. 线粒体, Z. Z线, 箭头示内部空洞, 星号示增大的肌原纤维间隙The mitochondrion (M) and Z line (Z) are indicated. The erosions in myofibrilla and enlarged space of myofibrilla are indicated by arrowheads and stars respectively
甲壳动物的肌肉纤维, 一端附着于甲壳上, 一端附着于表皮内突。刚蜕壳的动物, 甲壳柔软, 随着甲壳的硬化, 动物身体由于吸水膨胀而长大。在这一过程中, 肌肉纤维必须随着甲壳的硬化而伸长来适应增大了的外骨骼。对于龙虾及蟹类等外骨骼钙化程度较高的种类, 螯足与身体连接处狭窄,蜕皮前肌肉纤维发生降解以顺利蜕出, 蜕皮后肌肉组织重建以适应宽大的外骨骼[9,13,14](中华绒螯蟹相关数据将另文发表)。对于步行足而言, 其肌肉组织不如螯足宽大, 步足肌肉蜕壳时可顺利通过各关节, 所以蜕壳前肌纤维没有明显的萎缩、降解,其组织学特征于蜕壳前后无明显变化。步足肌肉的超微结构在蜕皮前亦无明显变化, 蜕皮后, 可见有些肌原纤维内部纵裂, 有些肌原纤维在H带横向断裂, 形成新的Z线(图 5)。肌纤维的生长包括两方面, 增粗和伸长。根据现有资料, 节肢动物肌纤维的增粗源自肌原纤维的横向生长, 即肌原纤维纵裂;伸长则源自肌原纤维的纵向生长, 通常有3种方式, (1)现有肌小节长度的增加, (2)肌原纤维末端添加肌小节数目, (3)通过Z线裂开或者肌节横裂添加肌小节数目[15—21]。通常来说, 甲壳动物的短肌节纤维肌小节长度不会变化太多, 推测其肌纤维伸长主要是靠增加肌小节数目来完成[16,18], 至于新的肌小节是在肌纤维附着的甲壳端增加, 还是表皮内突端增加, 或者两端同时增加, 目前还不清楚[9]。目前所能观察到的, 多是通过肌节横裂或者Z线裂开的方式增加肌小节的数目[19—21]。在本研究中, 中华绒螯蟹步行足肌纤维肌小节长度在蜕皮间期、前期和后期分别为(3.80±0.17)、(3.7±0.4)和(3.6 ±0.11) μm,无明显差异。蜕皮后发现肌原纤维纵裂, 以此增加肌纤维的横截面积; 肌节横裂以增加肌小节数目,以此增加肌纤维长度。肌节横裂表现为在H带, 形成新的Z线, 进而形成新的肌小节。
中华绒螯蟹腹部肌肉属于混合肌节, 蜕皮前有较大的形态结构特征变化。蟹类在蜕壳时, 头胸甲和腹节的裂缝不断增大, 腹部首先由此蜕出。腹部肌肉在蜕出时虽不如螯足肌肉发生显著的肌纤维降解, 但也表现出纤维束之间的间隙增大, 提示纤维束横截面积的缩小。电子显微观察则显示肌丝发生了降解, 表现为肌原纤维内部出现空洞, 肌原纤维间隙增大, 二联体、肌质网等结构消失或者破坏。在蜕皮后, 降解的肌丝开始组装, 逐步重建恢复。随着动物吸水膨胀, 外骨骼逐渐硬化, 肌纤维亦随之膨胀、伸展, 恢复到间期状态, 从而完成生长。
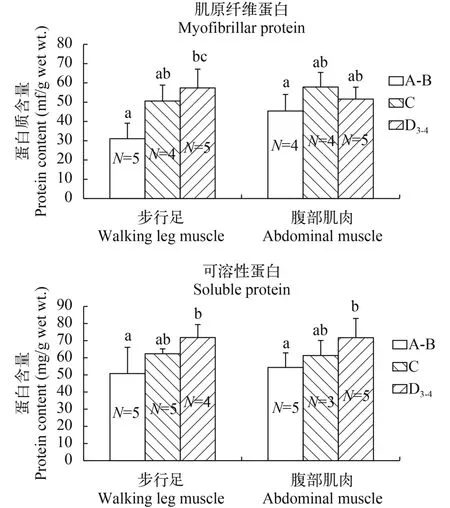
图 8 中华绒螯蟹蜕皮过程中步行足和腹部肌肉主要蛋白质含量的变化Fig. 8 Changes in main protein content in walking leg and abdominal muscle of E. sinensis during the molt cycleA-B. 蜕皮后A-B期, C. 蜕皮间期, D3-4. 蜕皮前晚期D3-4A-B. post-molt A-B stage, C. inter-molt stage, D3-4. later pre-molt D3-4stage
3.2 中华绒螯蟹蜕壳前后肌肉组织主要蛋白质含量的变化
在肌肉组织中肌原纤维蛋白和可溶性蛋白含量的变化和步行足及腹部肌肉的结构特征变化是一致的。肌原纤维蛋白, 是肌肉组织的主要成分,主要包括肌球蛋白、肌动蛋白、肌原蛋白和肌原球蛋白等, 是组装成肌原纤维(粗肌丝和细肌丝)的原料[5,22,23]。蜕皮后A-B期至蜕皮间期C期, 正是外骨骼逐渐硬化的过程, 亦是肌纤维生长的过程, 所以不论是步行足还是腹部肌肉, 此过程肌原纤维蛋白含量增加。由于步行足在整个蜕皮过程中肌肉纤维无萎缩、降解现象, 所以从蜕皮间期C期至蜕皮前晚期D3-4期, 其肌原纤维蛋白含量仍有升高, 有利于蜕皮后肌纤维的组装生长[24]。而腹部肌肉在蜕皮前有较大的组织形态变化, 肌丝降解, 其肌原纤维蛋白含量于蜕皮前D3-4期有所降低。
肌肉中的可溶性蛋白又称作肌浆蛋白, 主要包括肌清蛋白、肌红蛋白、蛋白酶、糖水解酶、肌酸激酶等。甲壳动物在蜕皮前会进行一系列生理准备, 合成蜕皮所需的各种酶、调节因子及受体[9,22,23]。已有研究显示[24], 甲壳动物蜕皮前肌肉组织中可溶性蛋白和肌原纤维蛋白合成速度都大于蜕皮间期, 而可溶性蛋白的合成速度更是肌原纤维蛋白合成速度的3.2倍。在本研究中, 蜕皮前步行足和腹部肌肉组织的可溶性蛋白含量在蜕皮前D3-4期均有升高, 蜕皮后A-B期则降到最低水平, 以利于肌原纤维的生长, 此后逐渐恢复到蜕皮前期水平。
目前对于水产甲壳动物肌肉生长发育的研究还很薄弱, 本文初步研究了中华绒螯蟹步行足和腹部肌肉在蜕皮前后的形态特征变化, 后续将在分子水平研究其蜕皮过程中不同部位肌肉的生长变化及调节机制, 以促进甲壳动物基础生物学研究, 从而丰富动物肌肉生长发育理论。
[1]Chang E S, Mykles D L. Regulation of crustacean molting: A review and our perspectives [J]. General and Comparative Endocrinology, 2011, 172: 323—330
[2]Tian Z H, Kang X J, Jiao C Z. Structural and constituent changes in integument during the molt cycle of Chinese mitten crab Eriocheir sinensis [J]. Acta Hydrobiologica Sinica, 2013, 37(5): 899—904 [田志环, 康现江, 焦传珍.中华绒螯蟹蜕皮过程中体壁结构和主要成分的变化.水生生物学报, 2013, 37(5): 899—904]
[3]Wang Z, Leary D H, Liu J, et al. Molt-dependent transcriptomic analysis of cement proteins in the barnacle Amphibalanus amphitrite [J]. BMC Genomics, 2015, 16(1): 1—14
[4]Pratoomchat B, Sawangwong P, Pakkong P, et al. Organic and inorganic compound variations in haemolymph, epidermal tissue and cuticle over the molt cycle in Scylla serrata (Decapoda) [J]. Comparative Biochemistry and Physiology. Part A: Molecular and Integrative Physiology, 2002, 131(2): 243—255
[5]Cesar J R D O, Zhao B, Malecha S, et al. Morphological and biochemical changes in the muscle of the marine shrimp Litopenaeus vannamei, during the molt cycle [J]. Aquaculture, 2006, 261(2): 688—694
[6]Tian Z H, Kang X J, Mu S M. The molt stages and the hepatopancreas contents of lipids, glycogen and some selected inorganic elements during the molt cycle of the Chinese mitten crab, Eriocheir sinensis [J]. Fisheries Science, 2012, 78(1): 67—74
[7]Kang X J, Tian Z H, Wu J L, et al. Molt stages and changes in digestive enzyme activity in hepatopancreas during molt cycle of the Chinese mitten crab Eriocheir sinensis [J]. Journal of Fishery Sciences of China, 2012, 19(5): 806—812 [康现江, 田志环, 吴江立, 等. 中华绒螯蟹蜕皮周期及蜕皮过程中肝胰腺消化酶活性变化. 中国水产科学, 2012, 19(5): 806—812]
[8]Saito T, Iso N, Mizuno H, et al. Effect of thermal treatment on extraction of proteins from meats [J]. Nihon-suisan-gakkai-shi, 1983, 49(10): 1569—1572
[9]West J M. Ultrastructural and contractile activation properties of crustacean muscle fibres over the moult cycle [J]. Pacing and Clinical Electrophysiology, 1997, 22(3): 525—527
[10]Govind C K, Bevengut M, Pearce J. Lobster swimmerets: Muscle fiber composition and membrane definition of excitatory synapses in a predominantly fast system [J]. Journal of Experimental Zoology, 1995, 272(1): 13—24
[11]Brandt P W, Reuben J P, Girardier L, et al. Correlated morphological and physiological studies on isolated single muscle fibers: I. Fine structure of the crayfish muscle fiber [J]. Journal of Cell Biology, 1965, 25(3): 115—129
[12]Crabtree R L, Sherman R G. Ultrastructural characterization of superficial and deep flexor muscles in the crayfish thorax [J]. Canadian Journal of Zoology, 1981, 59(3): 357—363
[13]Schmiege D L, Ridgway R L, Moffett S B. Ultrastructure of autotomy-induced atrophy of muscles in the crab Carcinus maenas [J]. Canadian Journal of Zoology, 2011, 70(5): 841—851
[14]Mykles D L, Skinner D M. Preferential loss of thin filaments during molt-induced atrophy in crab claw muscle [J]. Journal of Ultrastructure Research, 1981, 75(3): 314—325
[15]Bittner G D, Traut D L. Growth of crustacean muscles and muscle fibers [J]. Journal of Comparative Physiology, 1978, 124(3): 277—285
[16]Haj A J E, Houlihan D F. Growth of lobster leg muscle fibers over intermolt and molt [J]. Journal of Crustacean Biology, 1984, 4(4): 536—545
[17]Goudey L R, Lang F. Growth of crustacean muscle: asymmetric development of the claw closer muscles in the lobster, Homarus americanus. [J]. Journal of Experimental Zoology, 1974, 189(3): 421—427
[18]Govind C K, She J, Lang F. Lengthening of lobster muscle fibres by two age-dependent mechanisms [J]. Experientia, 1977, 33(1): 35—36
[19]Houlihan D F, Newton J R L. Sarcomere formation and longitudinal growth in the developing flight muscles of Calliphora [J]. Journal of Insect Physiology, 1979, 25(11): 879—893
[20]Jahromi S S, Charlton M P. Transverse sarcomere splitting. A possible means of longitudinal growth in crab muscles [J]. Journal of Cell Biology, 1979, 80(3): 736—742
[21]West J M, Humphris D C, Stephenson D G. Characterization of ultrastructural and contractile activation properties of crustacean (Cherax destructor) muscle fibers during claw regeneration and moulting [J]. Journal of Muscle Research & Cell Motility, 1995, 16(3): 267—284
[22]Ismail S Z M, Mykles D L. Differential molt-induced atrophy in the dimorphic claws of male fiddler crabs, Uca pugnax [J]. Journal of Experimental Zoology, 1992, 263(1): 18—31
[23]Mykles D L, Skinner D M. Molt cycle-associated changes in calcium-dependent proteinase activity that degrades actin and myosin in crustacean muscle [J]. Developmental Biology, 1982, 92(2): 386—397
[24]Covi J A, Bader B D, Chang E S, et al. Molt cycle regulation of protein synthesis in skeletal muscle of the blackback land crab, Gecarcinus lateralis, and the differential expression of a myostatin-like factor during atrophy induced by molting or unweighting [J]. Journal of Experimental Biology, 2010, 213(1): 172—183
CHANGES OF HISTOLOGY, ULTRASTRUCTURE AND MAIN PROTEIN IN MUSCLES OF CHINESE MITTEN CRAB, ERIOCHEIR SINENSIS DURING THE MOLT CYCLE
TIAN Zhi-Huan1,2, CHENG Yong-Xu1, WU Xu-Gan1and LIU Qing1
(1. Key Laboratory of Freshwater Fishery Germplasm Resources of Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China; 2. College of Yingdong Life Science, Shaoguan University, Shaoguan 512005, China)
To investigate morphological characteristic of muscles in Eriocheir sinensis before and after molt, histology, ultrastructure and main protein contents in walking leg and abdominal muscles of E. sinensis during molt cycle were studied. The results showed that the histology of walking leg muscle at pre- and post-molt was similar with inter-molt. Their ultrastructure had no obvious change in pre-molt stage compared with inter-molt, and it took on visible myofibrillar fissure and sarcomere transverse crack in post-molt, indicating that the muscle was growing while the exoskeleton was hardening. In termers of abdominal muscle, enlarged muscle bounds space in pre-molt stage and enlarged muscle fibers space in post-molt stage were observed. Moreover, there were erode area in myofibril and enlarged inter-myofibril space in pre-molt. The myofibril re-assembled in post-molt and re-covered to the normal form of inter-molt. Myofibrillar protein and soluble protein content in walking leg and abdominal muscle fluctuated and agreed well with their structure. The results indicate that the structural characters of walking leg and abdominal muscles of E. sinensis are closely related to the animal’s molt stage.
Histology; Ultrastructure; Myofibrillar protein; Soluble protein; Molting; Walking leg; Abdominal muscles; Eriocheir sinensis
10.7541/2017.129
2016-09-18;
2017-02-14
国家自然科学基金(31572635); 科技部港澳台科技合作专项项目(2014DFT30270); 上海市科学技术委员会科研项目(16DZ2281200); 上海高校水产学高峰学科建设项目(2015-62-0908)资助 [Supported by the Grant from National Natural Science Foundation of China (31572635); The Hongkong, Macao and Taiwan Science and Technology Cooperation Projects (2014DFT30270); The Projects (16DZ2281200) from Shanghai Municipal Science and Technology Commission; The Shanghai Universities First-class Disciplines Project of Fisheries (2015-62-0908) from Shanghai Municipal Education Committee]
田志环(1971—), 女, 山东省夏津县人; 博士, 副教授; 研究方向为甲壳动物生长发育。E-mail: tianzhihuan@126.com
成永旭(1964—), 男, 教授, 博士生导师; 研究方向为甲壳动物营养繁殖学。E-mail: yxcheng@shou.edu.cn
Q174
A
1000-3207(2017)05-1036-06
猜你喜欢
杂志排行
水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE
