鹰嘴豆中异黄酮类化合物体外模拟胃肠道代谢研究
2017-09-12李辛慧梁现蕊
李辛慧,梁现蕊,2
(1.浙江工业大学 长三角绿色制药协同创新中心,浙江 杭州 310014;2.浙江工业大学 药学院,浙江 杭州 310014)
鹰嘴豆中异黄酮类化合物体外模拟胃肠道代谢研究
李辛慧1,梁现蕊1,2
(1.浙江工业大学 长三角绿色制药协同创新中心,浙江 杭州 310014;2.浙江工业大学 药学院,浙江 杭州 310014)
为了研究鹰嘴豆中异黄酮类化合物在体外模拟胃肠道中的代谢转化.将鹰嘴豆提取液及其主要异黄酮单体化合物分别在模拟胃液、肠液和肠道菌群中孵育,并采用UPLC-QTOF-MS方法分析代谢物.结果显示:鹰嘴豆提取液在模拟胃液和肠液中不发生代谢变化;在肠道菌群中芒柄花苷产生2个代谢物,6″-O-丙二酰芒柄花苷和6″-O-丙二酰印度黄檀苷分别产生4个代谢物,而芒柄花素和鹰嘴豆芽素A并未发生明显变化;异黄酮苷主要的代谢方式有水解、去糖基化、羟基化和去羟基化.表明鹰嘴豆中异黄酮类化合物在模拟胃液、肠液中稳定,肠道菌群对其代谢起了关键作用.
鹰嘴豆;异黄酮;模拟胃肠道;代谢;UPLC-QTOF-MS
鹰嘴豆(Cicerarietinum)属豆科草本植物,也被称为桃尔豆、鸡豆、鸡心豆等,在维吾尔族应用较为广泛,既可做食材,又可为药材,被收录在《维吾尔药志》中.新疆民族医院及民间用其治疗糖尿病、肾虚、高脂血症、气管炎、霍乱、便秘、痢疾、消化不良和营养不良等.异黄酮类化合物是鹰嘴豆的主要化学成分,具有调节血糖、降低血脂[1]、降胆固醇、抑制CaCo-2细胞、改善学习记忆能力和抑制肿瘤细胞的生长等药理作用[2].
天然药物一般通过口服给药,口服药物进入体内后不可避免地进入胃肠道.胃肠道中的pH环境、存在的代谢酶和肠道菌群会对药物进行初步代谢,改变药物的结构,增加或降低药物活性,生物利用度低.其中肠道菌的代谢能力最强,是肝代谢的100倍[3-4].近年来,体外代谢模型越来越多地被用来研究天然药物的代谢过程,以检测药物在人体消化道内复杂的物理化学变化[5]:人参皂苷Re和Rb3在人工胃液中代谢后发生了脱糖基和脱水反应[6];McDougall等[7]考察了紫甘蓝中18种不同结构的花青素在模拟胃肠液中的稳定性,结果发现花青素在胃液中几乎没有发生变化,但在肠液中降解后生成新的多酚化合物;黄芩根的水提取液在模拟胃肠道中的代谢后,发现其在模拟胃液、肠液中稳定,但在肠道菌群中异黄酮苷均转化成各自苷元[8].传统方法检测天然药物的代谢物时,一般先用溶剂提取,再用不同方法制备代谢物[9-11],但由于代谢物的浓度低且成分复杂,传统方法检测时具有一定难度.近年来,色谱-光谱联用技术应用于代谢物的检测,大大缩短了样品分析时间,同时可准确分析代谢物的结构.笔者主要采用UPLC-QTOF-MS方法研究鹰嘴豆提取液和其主要的异黄酮类化合物在模拟胃肠道中的代谢转化,推导异黄酮的代谢途径.
1 材料和仪器
鹰嘴豆购自新疆木垒;对照品芒柄花苷、芒柄花素、鹰嘴豆芽素A(上海阿拉丁试剂有限公司,纯度≥98%);单体化合物6″-O-丙二酰芒柄花苷和6″-O-丙二酰印度黄檀苷由实验室自制(纯度≥95%);色谱纯甲醇、乙腈购自德国默克公司;本实验中的其他溶剂或试剂均为分析纯(天津市永大化学试剂有限公司);Waters Acquity超高效液相色谱仪(Waters,美国);Bruker micrOTOF四级杆飞行时间质谱仪(Bruker,美国);XS205 DualRange分析天平(Mettler Toledo,瑞士);Mettler Toledo Delta 320 pH计(Mettler Toledo,瑞士);旋转蒸发仪(Buchi,瑞士);隔水式恒温培养箱(上海一恒科技有限公司);Thermo Electron LED GmbH D-37520 Osterode离心机(Thermo Fisher,德国);高压蒸汽灭菌器(mLS-3780,日本三洋);7 L厌氧培养罐,2.5 L厌氧产气包和氧气指示剂(日本三菱瓦斯化学株式会社).
2 实验方法
2.1 鹰嘴豆提取液的制备
称取鹰嘴豆粉末50 g,加入500 mL 70%乙醇溶液,浸泡1 h后,超声提取30 min.提取两次,合并提取液,真空旋干,再用20%乙醇溶解即得到鹰嘴豆提取液,用UPLC检测后得色谱图如图1所示.1~5号峰分别为芒柄花苷、6″-O-丙二酰芒柄花苷、6″-O-丙二酰印度黄檀苷、芒柄花素和鹰嘴豆牙素A.
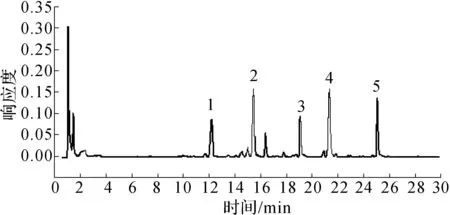
1—芒柄花苷;2—6″-O-丙二酰芒柄花苷;3—6″-O-丙二酰印度黄檀苷;4—芒柄花素;5—鹰嘴豆芽素A图1 鹰嘴豆芽中各异黄酮成分Fig.1 The isoflavones in chickpea
2.2 鹰嘴豆提取液在模拟胃液和肠液中的代谢
取鹰嘴豆提取液1 mL,加入模拟胃液5 mL(pH=1.2,包含50 mg胃蛋白酶),混匀后将放入摇床中(37 ℃,转速200 r/min),分别于0,1,2,4 h取样200 μL,加入1 mol/L NaHCO3调节溶液pH值至7.0,加入1 mL乙腈混匀,使酶失活;离心(1 000 r/min,15 min),取上清液过0.22 μm微孔滤膜,然后用UPLC-QTOF-MS检测.每个样品平行3 组.
取鹰嘴豆提取液1 mL,加入模拟肠液5 mL(pH=6.8,包含50 mg胰蛋白酶),混匀后将放入摇床中(37 ℃,转速200 r/min),分别于0,1,2,4,6 h取样200 μL.样品处理方法同模拟胃液代谢的样品.
2.3 GAM培养基的配制
根据文献[12],取胰蛋白胨10 g,示蛋白胨10 g,消化血清粉13.5 g,酵母提取物5 g,大豆蛋白胨3 g,葡萄糖3 g,氯化钠3 g,可溶性淀粉5 g,磷酸二氢钾2.5 g,牛肉膏2.2 g,半胱氨酸盐酸盐0.3 g,硫代乙酸钠0.3 g,牛肝提取物1.2 g,加入蒸馏水,用玻璃棒搅拌溶解,用氢氧化钠调节pH至7.3±0.2,定容到1 000 mL容量瓶,即得GAM培养基.121 ℃灭菌20 min,冷却后备用.
2.4 肠道菌群的培育
取人体新鲜粪便4 g,加入20 mL已灭菌的生理盐水,均质混合.1 000 r/min离心20 min.取上清液,再加入灭菌生理盐水稀释2 倍,1 000 r/min离心15 min,取上清液即为人肠道菌液.将肠道菌液加入到GAM培养基中,混合均匀.于37 ℃恒温培养箱中厌氧培养48 h即得到肠道菌群孵育液.
2.5 鹰嘴豆中异黄酮类化合物在肠道菌群中的代谢
将芒柄花苷、6″-O-丙二酰芒柄花苷、6″-O-丙二酰印度黄檀苷、芒柄花素和鹰嘴豆牙素A用甲醇溶解,各取200 μL样品溶液和空白甲醇于灭菌dorf管中,再分别加入1 mL肠道菌孵育液,混匀后放入厌氧培养罐中厌氧孵育;将厌氧培养罐放在37 ℃恒温培养箱内,分别于0,1,3,6,12,24,48 h取出样品;样品取出后,立即加入3 mL乙酸乙酯,涡流混悬,使肠道菌失活,终止反应;离心(1 000 r/min,15 min);取上清液真空旋干;加入1 mL甲醇溶解,过0.22 μm PTFE滤膜;取滤液用UPLC-QTOF-MS联用技术检测.每组样品平行3 组.
2.6 UPLC-Q-TOF-MS检测条件
色谱条件为Waters Acquity HSS T3色谱柱(2.1 mm×50 mm,1.7 μm),流动相A为0.05% 甲酸,流动相B为乙腈,梯度洗脱程序见表1;检测波长254 nm;柱温25 ℃;流速0.2 mL/min;进样体积5 μL.

表1 UPLC梯度洗脱程序
UPLC-QTOF-MS分析:UPLC条件同上,质量扫描范围m/z为50~5 000;扫描模式正离子模式;干燥气(N2)温度200 ℃;干燥气(N2)流速6.0 L/min;雾化气(N2)压力0.8 bar;毛细管电压(+)4 500 V;以0.01 mol/L三氟乙酸钠溶液作为外标校正相对分子质量,数据通过Hystar软件采集,由Bruker daltonics dataanalysis 4.0软件处理.
3 结果与讨论
3.1 鹰嘴豆提取液在模拟胃液和肠液中的稳定性
鹰嘴豆提取液在模拟胃液、肠液中代谢后,各成分含量没有明显变化.用UPLC-QTOF-MS进一步检测,发现无新化合物产生.说明鹰嘴豆中异黄酮类化合物在模拟胃液(pH=1.2)、肠液(pH=6.8)中稳定.
3.2 鹰嘴豆中异黄酮类成分在肠道菌群中代谢物的鉴定
芒柄花苷、6″-O-丙二酰芒柄花苷、6″-O-丙二酰印度黄檀苷、芒柄花素和鹰嘴豆芽素A分别在离体肠道菌群中孵育,不同时间点取出用UPLC检测分析.以各化合物相对峰面积为参考,其含量变化见图2.

图2 鹰嘴豆中异黄酮成分代谢48 h后的含量 Fig.2 The content of isoflavones in chickpea after 48 h metabolism
从图2可以看出:芒柄花苷、6″-O-丙二酰芒柄花苷和6″-O-丙二酰印度黄檀苷的相对峰面积随着代谢时间的增加急剧减小,表示它们在离体肠道菌群中发生了代谢转化;而芒柄花素和鹰嘴豆芽素A的相对峰面积随孵育时间的增加,变化不大.用UPLC-QTOF-MS进一步研究了各化合物的代谢变化:在芒柄花苷样品中检测到2 个代谢物(M1-1,M1-2);在6″-O-丙二酰芒柄花苷样品中检测到4 个代谢物(M2-1,M2-2,M2-3,M2-4);在6″-O-丙二酰印度黄檀苷样品中也检测到4 个代谢物(M3-1,M3-2,M3-3,M3-4),见图3.

图3 母体药物及其代谢产物的BPC图Fig.3 The BPC of parent compounds and its metabolites
3.2.1 芒柄花苷代谢物的鉴定
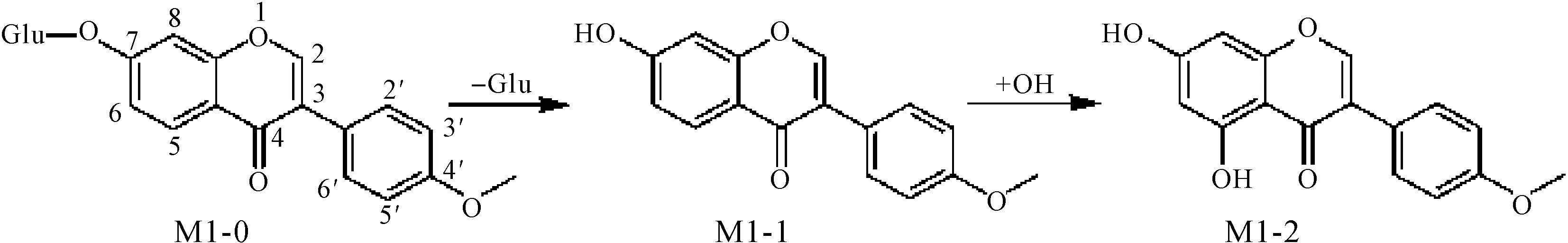
芒柄花苷(M1-0)及其两个代谢物(M1-1,M1-2)的保留时间、实测分子量和MS/MS碎片离子等数据见表2.M1-1的准分子离子峰[M+H]+m/z为269(保留时间为21.2 min),比其母体结构少162 Da(Glu,(431-269) Da),恰好为一个葡萄糖分子的相对分子质量,推测M1-1可能是M1-0的苷元成分.对比芒柄花素对照品的保留时间(图4),恰好与M1-1一致.进一步分析M1-1的碎片离子,m/z分别为254,213,197,137,也与芒柄花素对照品的数据一致,由此可确定M1-1是芒柄花素.M1-2的准分子离子峰[M+H]+m/z为285(保留时间为25.3 min),比M1-1多16 Da(O,(285-269) Da),推测M1-2是M1-1羟基化的代谢物.Kulling等[13]研究发现异黄酮类化合物经过代谢转化后会产生2,5,6,3′位羟基化代谢物.分析M1-2的碎片离子发现,m/z分别为269,229,213,153,恰好与鹰嘴豆芽素A对照品的碎片离子相同,确定羟基化位点在5位.对比发现鹰嘴豆芽素A对照品和M1-2的保留时间也一致(图4),由此确定M1-2为鹰嘴豆芽素A.推导芒柄花苷的代谢途径为

图4 对照品芒柄花素和鹰嘴豆芽素A的UPLC色谱图 Fig.4 The UPLC chromatograms of formononetin and biochanin A
3.2.2 6″-O-丙二酰芒柄花苷代谢物的鉴定
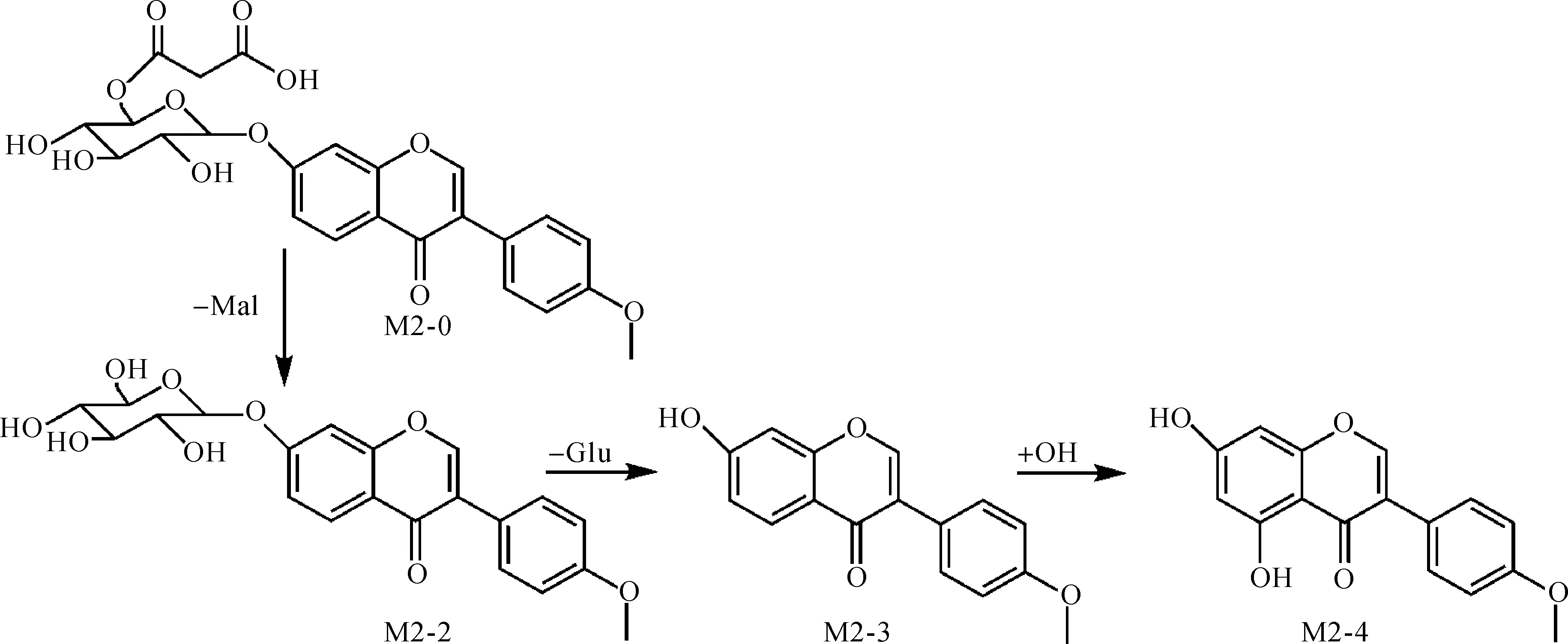
6″-O-丙二酰芒柄花苷(M2-0)在离体肠道菌群中孵育后可检测到4 个代谢物(M2-1,M2-2,M2-3,M2-4),母体化合物及其代谢物的保留时间、实测分子量和MS/MS碎片离子等数据见表2.
M2-1和M2-0具有相同的分子离子峰[M+H]+,m/z为517(C25H25O12,保留时间14.3 min),由此可以鉴定M2-1是母体药物6″-O-丙二酰芒柄花苷的同分异构体.
M2-2的分子离子峰[M+H]+m/z为431(C22H23O9,保留时间11.9 min),与M2-0相比丢失了一个丙二酰基(Mal,(517-431) Da).通过对比保留时间和碎片离子m/z分别为269,254,213,137,可以鉴定M2-2是芒柄花苷.
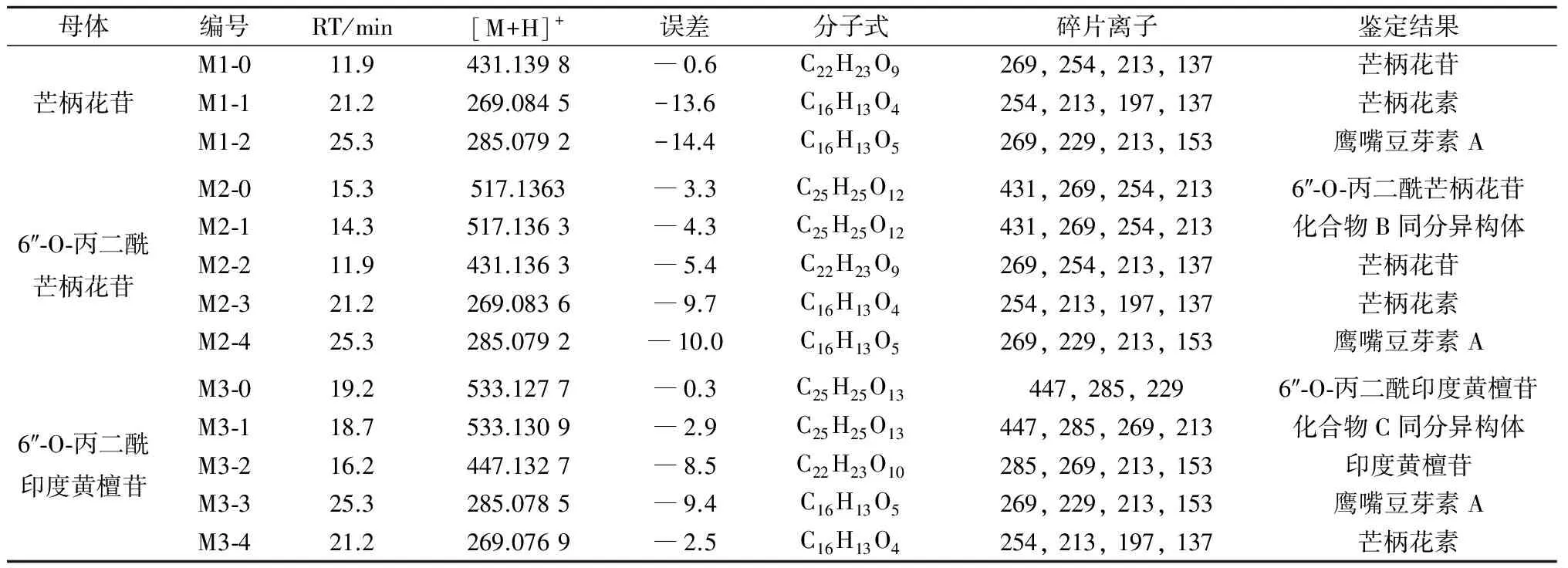
表2 鹰嘴豆中各异黄酮及其代谢物的UPLC-QTOF-MS数据
M2-3的分子离子峰[M+H]+m/z为269(C16H13O4,保留时间21.2 min),与M2-2相比失去162 Da,即丢失一个葡萄糖分子.其碎片离子m/z分别为254,213,197,137,与芒柄花素相同.由此可以鉴定M2-3是芒柄花苷脱糖基的产物,即芒柄花素.
M2-4的分子离子峰[M+H]+m/z为285(C16H13O5,保留时间25.3 min),与M2-3相比增加了16 Da,可鉴定是M2-3羟基化的产物.同M1-2相同,M2-4的保留时间25.3 min与鹰嘴豆芽素A对照品的保留时间一致,比较碎片离子m/z分别为269,229,213,153,与鹰嘴豆芽素A也相同,由此可以鉴定M2-4是鹰嘴豆芽素A.
综合4个代谢物的化学结构,推导出6″-O-丙二酰芒柄花苷的代谢途径为
3.2.3 6″-O-丙二酰印度黄檀苷代谢物的鉴定
6″-O-丙二酰印度黄檀苷(M3-0)在离体肠道菌群中孵育后同样检测到4个代谢物(M3-1,M3-2,M3-3,M3-4),其UPLC-QTOF-MS数据见表2.
M3-1和M3-0具有相同的分子离子峰[M+H]+,m/z为533(C25H25O13,保留时间18.7 min),由此可以鉴定M3-1是母体化合物6″-O-丙二酰印度黄檀苷的同分异构体.
M3-2的分子离子峰[M+H]+m/z为447(C22H23O10,保留时间16.2 min),与M3-0相比少86 Da,即丢失了一个丙二酰基.进一步分析其碎片离子m/z分别为285,269,213,153,发现碎片离子与鹰嘴豆芽素A相似.因此可以确定M3-2是M3-0水解后的产物,即印度黄檀苷.
M3-3的分子离子峰[M+H]+m/z为285(C16H13O5,保留时间25.3 min),与M3-2相比失去162 Da,即丢失一个葡萄糖分子.可以鉴定M3-3是印度黄檀苷脱糖基的产物,即鹰嘴豆芽素A.
M3-4的分子离子峰[M+H]+m/z为269(C16H13O4,保留时间21.2 min),与M3-3相比减少了16 Da,可鉴定是M3-3去羟基化的产物,对比保留时间21.2 min与芒柄花素相同,碎片离子m/z分别为254,213,197,137,与芒柄花素也一致,由此可证实M3-4是芒柄花素.
综合4个代谢物的化学结构,推导出6″-O-丙二酰印度黄檀苷的代谢途径为

从芒柄花苷、6″-O-丙二酰芒柄花苷和6″-O-丙二酰印度黄檀苷的代谢结果得知,丙二酰化的异黄酮苷不稳定,易水解为异黄酮葡萄糖苷.各异黄酮苷都先脱糖基为对应的苷元成分,增加了脂溶性,使其更容易被吸收进入血液,从而发挥药效.苷元成分进一步发生不同类型的代谢反应,主要是Ι相代谢反应包括羟基化、去羟基化.
4 结 论
笔者建立了快速、准确的UPLC-QTOF-MS方法研究鹰嘴豆中异黄酮类化合物在体外模拟胃肠道中的代谢转化.结果表明异黄酮类化合物在胃液、肠液中较稳定.肠道菌群对异黄酮糖苷类化合物的代谢起着重要作用,从实验结果可看出:芒柄花苷产生了2个代谢物;6″-O-丙二酰芒柄花苷和6″-O-丙二酰印度黄檀苷分别产生了4个代谢物;主要的代谢途径包括水解、脱糖基化、羟基化和去羟基化.传统中药以口服给药为主,药物成分到达体内组织器官发挥药效作用需要经过吸收、分布、代谢和排泄等过程[7],体外模拟代谢研究有助于我们了解药物在体内的变化过程.通过代谢物的鉴定和代谢途径的推测,为筛选天然药物中的活性成分提供依据,也为寻找先导化合物提供了参考.
[1] JOHNSON S K, THOMAS S J, HALL R S. Palatability and glucose, insulin and satiety responses of chickpea flour and extruded chickpea flour bread eaten as part of a breakfast[J]. European journal of clinical nutrition, 2005, 59(2): 169-176.
[2] 毛人杰.鹰嘴豆芽提取物对Caco-2细胞凋亡的作用[J].西南国防医药,2011,21(5):469.
[3] NICHOLSON J K, HOLMES E, WILSON I D.Gut microorganisms,mammalian metabolism and personalized health care[J]. Nature reviews microbiology, 2005, 3(5): 431-438.
[4] POSSEMIERS S, BOLCA S, VERSTRAETE, et al. The intestinal microbiome: A separate organ inside the body with the metabolic potential to influence the bioactivity of botanicals[J]. Fitoterapia, 2011, 82(1): 53-66.
[5] 张艳芳,董平,梁兴国.食品成分消化模型的研究进展[J].食品工业科技,2013,18(34):356-361.
[6] KONG H, WANG M, VENEMA K, et al. Bioconversion of red ginseng saponins in the gastro-intestinal tractinvitromodel studied by high-performance liquid chromatography-high resolution Fourier transform ion cyclotron resonance mass spectrometry[J]. Journal of chromatography A, 2009, 1216(11): 2195-2203.
[7] MCDOUGALL G J, FYFFE S, DOBSON P, et al. Anthocyanins from red cabbage-stability to simulated gastrointestinal digestion[J]. Phytochemistry, 2007, 68(9): 1285-1294.
[8] XING S H, WANG M Y, PENG Y, et al. Simulated gastrointestinal tract metabolism and pharmacological activities of water extract ofScutellariabaicalensisroots[J]. Journal of ethnopharmacology, 2014, 152(1): 183-189.
[9] 蒋慧,李恒,张澜,等.高效液相色谱法测定壳寡糖的含量[J].发酵科技通讯,2016,45(4):232-236.
[10] 哈志瑞,马文有,沈春娟,等.L-色氨酸色谱分离工艺中试研究[J].发酵科技通讯,2016,45(3):165-169.
[11] 张由明,章银军,沈雪亮.绿咖啡豆中绿原酸的分离纯化[J].发酵科技通讯,2016,45(3):140-146.
[12] ZHAO M, DU L Y, TAO J H, et al. Ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry for rapid analysis of the metabolites of morroniside produced by human intestinal bacteria[J]. Journal of chromatography B, 2015, 976: 61-67.
[13] KULLING S E, HONIG D M, SIMAT T J, et al. Oxidativeinvitrometabolism of the soy phytoestrogens daidzein and genistein[J]. Journal of agricultural and food chemistry, 2000, 48(10): 4963-4972.
(责任编辑:朱小惠)
Simulated gastrointestinal tract metabolism of the isoflavones from Chickpeas
LI Xinhui1, LIANG Xianrui1,2
(1.Collaborative Innovation Center of Yangtze River Delta Region Green Pharmaceuticals, Zhejiang University of Technology, Hangzhou 310014, China; 2.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
The metabolic transformation of isoflavones from chickpeas in simulated gastrointestinal tract was investigated. The UPLC-QTOF-MS was applied to monitor theinvitrometabolic process of chickpeas extract and its isoflavone compounds incubated in simulated gastric juice, intestinal juice and human intestinal flora, respectively. The extract of chickpeas unchanged during the incubation with simulated gastric juice and intestinal juice. 2 metabolites were identified from ononin, 4 metabolites from formononetin 7-O-β-D-glucoside 6″-O-malonate, and 4 from biochanin A 7-O-β-D-glucoside 6″-O-malonate in human intestinal flora, respectively. However, formononetin and biochanin A didn’t change significantly in human intestinal flora. The main metabolic process of isoflavone included hydrolysis, deglycosylation, dehydroxylation and hydroxylation. The results showed that isoflavones in chickpeas were stable in simulated gastric juice and intestinal juice, and intestinal flora played an important role in the metabolism of isoflavones from chickpeas.
chickpeas; isoflavones; simulated gastrointestinal tract; metabolism; UPLC-QTOF-MS
2017-03-03
国家自然科学基金资助项目(21206148)
李辛慧(1991—),女,浙江诸暨人,硕士研究生,研究方向为药物结构分析,E-mail:1065280757@qq.com.通信作者:梁现蕊副教授,E-mail:liangxrvicky@zjut.edu.cn.
R284
A
1674-2214(2017)03-0147-06
