酿酒酵母产泛酸工程菌株的构建与诱变
2017-09-12孙杰,姜杰,任郑,魏春
孙 杰,姜 杰,任 郑,魏 春
(浙江工业大学 生物工程学院,浙江 杭州 310014)
酿酒酵母产泛酸工程菌株的构建与诱变
孙 杰,姜 杰,任 郑,魏 春
(浙江工业大学 生物工程学院,浙江 杭州 310014)
泛酸具有重要的生理功能,参与糖、脂肪、蛋白质及能量的代谢,广泛用作微生物药物、食品添加剂和饲料添加剂.通过强化酿酒酵母泛酸生物合成途径的酮泛解酸羟甲基转移酶、酮泛解酸还原酶、泛酸合成酶和多胺氧化酶的表达水平,提高酵母泛酸合成量.在不含泛酸的培养基中培养102 h后,泛酸质量浓度达到290 μg/L.进一步对菌株BYPAN01进行微波辐照诱变,筛选到的突变株BYPAN02泛酸质量浓度较菌株BYPAN01和BY4741分别提高了43.3%和203.2%,达到415.7 μg/L,为实现泛酸的环保和低成本合成提供了新的思路.
酿酒酵母;泛酸;表达盒;微波辐射
泛酸(pantothenic acid),又称遍多酸或维生素B5,具有手性,只有D型泛酸具备生理活性.泛酸在生物体内同腺嘌呤、核糖核酸和磷酸等生物分子组成辅酶A.辅酶A为乙酰化反应的辅酶,参与糖、脂肪、蛋白质及能量的代谢[1].泛酸广泛用作微生物药物、食品添加剂和饲料添加剂.动物不能合成泛酸,只能通过饮食获得.在细菌和酵母中,缬氨酸合成的中间代谢物α-酮异戊酸由酮泛解酸羟甲基转移酶、酮泛解酸还原酶和泛酸合成酶催化生成泛解酸[2-3].细菌中L-天冬氨酸脱羧生成β-丙氨酸,泛解酸和β-丙氨酸缩合生成泛酸[4].酿酒酵母的生长需要外源泛酸,而White等[3]发现酵母具有合成泛酸的能力,FMS1基因编码的胺氧化酶催化精胺生成β-丙氨酸.当以葡萄糖为酿酒酵母的培养基碳源时,FMS1基因的表达受到抑制,酵母需要依靠外源泛酸维持生长;而当酵母以甘油或乙酸作为唯一碳源时,FMS1基因表达,酵母可以从头合成泛酸[3].
在工业合成D-泛酸时,首先需要通过化学合成DL-泛解酸或泛解酸内酯,再进行手性拆分,工艺复杂,产物分离困难,并且需使用大量有机溶剂[5].饲料工业是泛酸的主要应用领域.酵母细胞含有大量蛋白质和丰富的维生素,广泛应用于饲料工业[6].本研究目的是增强酵母的泛酸合成能力,从而提供一种简单和低成本的泛酸来源.
1 材料与方法
1.1 菌种与质粒
S.cerevisiaeBY4741(MATa, his3△1, leu2△0, met15△0, ura3△0)和泛酸含量测试菌LactobacillusplantarumATCC 8014均购自American type culture collection(ATCC);pYES2质粒购自Invitrigen公司.
1.2 试剂和引物
Prim star HS DNA聚合酶、Taq DNA聚合酶、dNTPs、限制性内切酶NcoI和HindIII、T4 DNA连接酶、100 bp plus Marker、基因组提取试剂盒、质粒提取试剂盒、PCR产物纯化试剂盒和DNA琼脂糖凝胶回收试剂盒均购自大连TaKaRa公司.所用引物列于表1,引物名称中同一个大写字母表示一个表达盒.引物合成及测序由上海桑尼生物科技有限公司完成.
1.3 培养基
YPD培养基(1%酵母提取物,2%蛋白胨和2%葡萄糖)用于酵母培养和感受态制备;缺少尿嘧啶的SD-Ura培养基购自北京泛基诺科技有限公司,用于重组子的筛选;无泛酸培养基购自青岛海博生物技术有限公司.
1.4 方 法
1.4.1 酵母菌的培养
摇瓶培养时,平板上挑取单克隆,接种至5 mL的SD-Ura中培养过夜.培养物离心并用无菌水清洗后,加至50 mL的无泛酸培养基中,起始OD600 nm达到0.05,进行培养.
1.4.2 泛酸合成酵母菌的构建
按照Shao等[7]的方法进行质粒构建.为制备基因表达盒,首先提取酿酒酵母基因组DNA.使用表1列出的引物,用PCR分别扩增启动子GPM1p(760 bp),TDH3p(673 bp),TEF1p(458 bp)和PGK1p(756 bp).分别将泛酸合成相关酶的编码基因及其转录终止子ECM31(去除线粒体信号肽,1 018 bp),PAN5(1 411 bp),PAN6(1 256 bp)和FMS1(1 787 bp)扩增出来.PCR反应程序为98 ℃变性2 min;98 ℃ 10 s,60 ℃退火15 s,扩增启动子延伸时间为1 min,扩增结构基因延伸时间为2 min,32 个循环.扩增pYES2的质粒骨架的PCR反应程序为98 ℃变性2 min;98 ℃ 10 s,68 ℃退火和延伸8 min,32 个循环.PCR反应产物进行琼脂糖凝胶电泳,切胶回收DNA片段.

表1 用于构建基因表达盒的引物
使用重叠延伸PCR(OE-PCR)连接4个基因表达盒.首轮PCR反应体系不加入引物,以待连接片段互为引物和模板,反应程序为98 ℃变性2 min;98 ℃变性10 s,58 ℃退火30 s,72 ℃延伸2 min,20个循环.取出5 μL作为模板,加入反应体系为50 μL的第二轮PCR反应中,使用表达盒外侧引物,PCR程序为98 ℃变性2 min;98 ℃ 10 s,68 ℃退火和延伸1.5 min,32 个循环.PCR反应产物进行琼脂糖凝胶电泳,切胶回收DNA片段.
将上述4个基因表达盒(各300 ng)、线性的pYES2质粒骨架(500 ng)混合,使用乙酸锂化学转化法进行酵母细胞转化.转化后,涂布SC-Ura平板,30 ℃培养2~3 d后长出单菌落.将克隆随机挑入液体培养基,培养1 d,然后提取质粒DNA,使用PCR进行阳性转化子的验证.表达质粒的菌株命名为BYPAN01.
1.4.3 微波诱变
为进一步提高菌株的泛酸产量,进行了酵母菌的微波诱变.使用无菌水将酵母悬液调整至107cells/mL,30 ℃下在SD-Ura培养基中进行培养.将培养物的试管插在冰中,微波辐射数秒.微波炉输出功率850 W,2 450 MHz.辐射处理后,涂布SC-Ura平板培养,确认质粒没有因突变而丢失.30 ℃培养2 d,计算致死率.致死率=(诱变前菌落数-诱变后菌落数)/诱变前菌落数×100%.
挑取突变后的50 个单菌落,30 ℃下在试管中液体培养2 d,取上清通过微生物法测定泛酸含量.选取泛酸产量较高的菌株进行下一轮诱变.连续进行5 轮诱变,最后一轮诱变得到的菌株培养于不含泛酸的培养基中,30 ℃培养至96 h.泛酸产量最高的突变株命名为BYPAN02.
1.4.4 微生物法测定泛酸含量
以L.plantarumATCC 8014作为测定菌株,在泛酸测定培养基中测定泛酸的含量[8].取100 μL酵母工程菌的发酵上清液于3 mL泛酸测定培养基中,121 ℃高压灭菌15 min.接种50 μL植物乳杆菌,置于37 ℃恒温培养箱中培养,直至植物乳杆菌的光密度不再发生变化.同时使用0~60 ng泛酸标准品,制作泛酸含量与植物乳杆菌生长状况的标准曲线.通过测定植物乳杆菌在640 nm的光密度,间接测定泛酸含量.
2 结果与讨论
2.1 酿酒酵母泛酸合成基因的克隆与表达盒组装
从酵母基因组中扩增了4个组成型启动子和4个带有终止子的泛酸合成基因(图1a),通过OE-PCR方法,在体外成功组装了GPM1p-ECM31,TDH3p-PAN5,TEF1p-PAN6和PGK1p-FMS14个表达盒(图1b).同时扩增pYES2质粒骨架.4个表达盒与质粒骨架之间有45 bp左右碱基互相重叠.

M—100 bp plus Marker;A1—GPM1p;A2—ECM31;B1—TDH3p;B2—PAN5;C1—TEF1p;C2—PAN6;D1—PGK1p;D2—FMS1;V—载体骨架(a) PCR获得的核酸片段电泳图
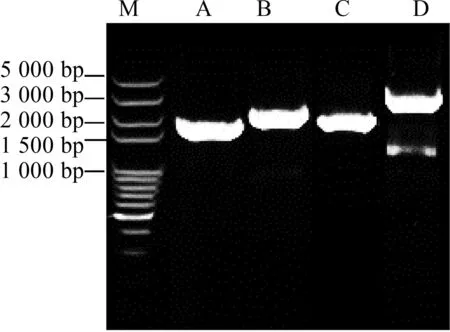
M—100 bp plus Marker;A—表达盒GPM1p-ECM31;B—表达盒TDH3p-PAN5;C—表达盒TEF1p-PAN6;D—表达盒PGK1p-FMS1(b) 表达盒的OE-PCR组装产物电泳图图1 泛酸合成基因表达盒组装过程中的DNA电泳图Fig.1 DNA electrophoresis of the assemblied expression cassettes involving in pantothenic acid synthesis
2.2 增强酿酒酵母泛酸的合成
本实验使用组成型强启动子,过表达泛酸合成途径的酮泛解酸羟甲基转移酶、酮泛解酸还原酶和泛酸合成酶.另外,葡萄糖为唯一碳源时,FMS1基因的表达受到抑制,无法合成泛酸.而通过组成型启动子增强FMS1基因表达,可以解除葡萄糖对酵母泛酸合成的抑制.而当培养基中同时含有乙酸钠和葡萄糖两种碳源,泛酸的合成则不会完全被葡萄糖抑制.如图2所示,宿主菌BY4741在无泛酸平板划线,酵母菌可以生长,但是生长并不旺盛.而通过基因改造得到的菌株BYPAN01在无泛酸平板划线,菌株生长旺盛.说明高表达泛酸合成的相关酶,并解除葡萄糖对酵母泛酸合成的抑制后,泛酸可以在酵母体内合成.

A—菌株BYPAN01;B—菌株BY4741;C—菌株BYPAN02图2 构建酵母菌的无泛酸平板划线培养Fig.2 Culture of the engineered yeast on the agar plate with pantothenic acid-free medium
在不含泛酸的培养基中同时含有乙酸钠和葡萄糖两种碳源,泛酸的合成不会完全被葡萄糖抑制,原始菌株BY4741在不含泛酸的培养基中培养102 h后,泛酸质量浓度达到137.1 μg/L.相同培养时间,菌株BYPAN01的泛酸质量浓度达到290 μg/L.
2.3 诱变和筛选
微波诱变具有正突变频率高和所选育菌株遗传性状稳定等优点[9].Grundler等[10]发现微波辐照对酵母细胞的生长具有较大影响.为进一步提高表达ECM31,PAN5,PAN6和FMS1基因的菌株的泛酸产量,进行了微波辐照诱变实验.酵母致死率和辐射时间的关系见图3.随着辐射时间的延长,酵母的致死率升高.普遍认为酵母致死率达到85%左右,正向突变的概率最高.当微波照射时间为85 s,酵母致死率达到85.3%.每次诱变后,涂布SC-Ura平板,确认质粒没有因突变而丢失.

图3 酵母菌微波诱变致死曲线Fig.3 The lethal curve of yeast after microwave mutagenesis
5轮突变-筛选之后,选取平板上较大的单菌落接种于摇瓶中,在50 mL不含泛酸的培养基中30 ℃培养120 h,测定突变株的泛酸产量.通过微波辐照,筛选得到泛酸产量提高的突变株BYPAN02.如图4(a)所示,泛酸产量提高的菌株,到达生长平台期后的生物量较宿主菌略低.这可能与菌株BYPAN01带有强启动子驱动的ECM31,PAN5,PAN6和FMS1基因,造成较大的代谢负担有关.如图4(b)所示,在培养102 h后,突变株BYPAN02泛酸质量浓度较BYPAN01和BY4741菌株分别提高了43.3%和203.2%,达到415.7 μg/L.然而该产量仍然较低,下一步需要对中心代谢途径进行改造,结合发酵培养优化,进一步提高泛酸产量.

图4 不同酵母菌株的生长曲线和泛酸质量浓度Fig.4 Growth curve and pantothenic acid yield of different yeast strains
3 结 论
泛酸具有重要的生理功能,是重要的营养补充剂.笔者尝试使用代谢工程改造的酵母合成泛酸.将带有强启动子驱动的泛酸合成相关基因ECM31,PAN5,PAN6和FMS1基因构建菌株BYPAN01.在不含泛酸的培养基中培养102 h后,泛酸质量浓度达到290 μg/L.进一步对菌株BYPAN01进行微波辐照诱变.筛选到的突变株BYPAN02泛酸质量浓度较BYPAN01和BY4741菌株分别提高了43.3%和203.2%,达到415.7 μg/L.然而该产量仍然较低,下一步需要对中心代谢途径进行改造,结合发酵培养优化,进一步提高泛酸产量,才有可能具备应用价值.
[1] WILLIAMSON J M, BROWN G M. Purification and properties of L-Aspartate-alpha-decarboxylase, an enzyme that catalyzes the formation of beta-alanine inEscherichiacoli[J]. Journal of biological chemistry, 1979, 254(16):8074-8082.
[2] SCHMITZBERGER F, SMITH A G, ABELL C, et al. Comparative analysis of theEscherichiacoliketopantoate hydroxymethyltransferase crystal structure confirms that it is a member of the (βα)8 phosphoenolpyruvate/pyruvate superfamily[J]. Journal of bacteriol, 2003, 185:4163-4171.
[3] WHITE W H, GUNYUZLU P L, TOYN J H.Saccharomycescerevisiaeis capable of de novo pantothenic acid biosynthesis involving a novel pathway of beta-alanine production from spermine[J]. Journal of biological chemistry, 2001, 276(14):10794-10800.
[4] CRONAN J E. Beta-alanine synthesis inEscherichiacoli[J]. Journal of bacteriology, 1980, 141(3):1291-1297.
[5] 汪钊, 黄美娟, 高亮, 等.化学酶法合成D-泛解酸内酯的研究进展[J]. 发酵科技通讯, 2016, 45(4):193-198.
[6] 楼志坚, 戴利伟, 张艳丽. 固态发酵生产活性干酵母的研究[J]. 发酵科技通讯, 2016,45(2):98-102.
[7] SHAO Z, ZHAO H, ZHAO H. DNA assembler, aninvivogenetic method for rapid construction of biochemical pathways[J]. Nucleic acids research, 2009, 37(2):e16.
[8] 张旭, 马妮, 郑洪. 微生物法测定食品中泛酸的含量[J].中国微生态学杂志, 2012, 24(7):654-655.
[9] 李永泉, 翁醒华, 贺筱蓉. 微波诱变结合化学诱变选育酸性蛋白酶高产菌[J]. 微生物学报, 1999(4):181-184.
[10] GRUNDIER W, KEILMANN F. Resonant microwave effect on locally fixed yeast microcolonies[J]. Zeitschrift für naturforschung C, 1989, 44(9/10):863-866.
(责任编辑:朱小惠)
Construction and mutagenesis of engineeringSaccharomycescerevisiaestrain producing pantothenic acid
SUN Jie, JIANG Jie, REN Zheng, WEI Chun
(College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China)
Pantothenic acid has important physiological functions involved in sugar, fat, protein and energy metabolism. As such, it was widely used as microbial drugs, as well as food and feed additives. To increase the yield of pantothenic acid, the expression of enzymes responsible for pantothenic acid synthesis inSaccharomycescerevisiae, such as ketopantoate hydroxymethyltransferase, 2-dehydropantoate-2-reductase, pantoate-beta-alanine ligase and polyamine oxidase were increased. The yield of pantothenic acid reached 290 μg/L after 102 h incubation in pantothenic acid-free medium. The strain BYPAN01 was further mutated by microwave irradiation and the obtained mutant BYPAN02 resulted in production of 415.7 μg/L pantothenic acid, which was 43.3% higher than that of BYPAN01 and 203.2% higher than that of wild type BY4741. This study provides a new strategy for the environment-friendly and low cost synthesis of pantothenic acid.
Saccharomycescerevisiae; pantothenic acid; expression cassettes; microwave irradiation
2017-06-02
浙江省自然科学基金资助项目(LQ14C010002);浙江工业大学自然科学基金资助项目(1301105071408)
孙 杰(1981—),男,内蒙古包头人,讲师,博士,研究方向为代谢工程,E-mail:jsun@zjut.edu.cn.
Q93
A
1674-2214(2017)03-0134-04
