HPLC法测定印度黄檀中黄檀素等3种成分含量
2016-04-11李然林励祁龙凯杜海芳李静蔡聪郑来安叶耀祥
李然,林励,祁龙凯,杜海芳,李静,蔡聪,郑来安,叶耀祥
(1.广州中医药大学 中药学院,广东 广州 510006; 2.广东省湛江南药试验场,广东 遂溪 524338; 3.广东中檀实业有限公司,广东 台山 529200)
HPLC法测定印度黄檀中黄檀素等3种成分含量
李然1,林励1,祁龙凯1,杜海芳1,李静1,蔡聪2,郑来安2,叶耀祥3
(1.广州中医药大学 中药学院,广东 广州 510006; 2.广东省湛江南药试验场,广东 遂溪 524338; 3.广东中檀实业有限公司,广东 台山 529200)
摘要:目的 建立印度黄檀中黄檀素、黄檀素甲醚和4-甲氧基黄檀醌的质量分数测定方法。方法 色谱柱为Waters Symmetry C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-0.2 %(体积分数)H3PO4水溶液;梯度洗脱,流速为1.0 mL/min,柱温为30 ℃,黄檀素、黄檀素甲醚、4-甲氧基黄檀素检测波长分别为260、254、280 nm。结果 黄檀素、黄檀素甲醚、4-甲氧基黄檀醌的平均回收率分别为98.24%、99.66%、99.06%,RSD值分别为1.57%、0.98%、1.29%。国内引种印度黄檀中黄檀素、黄檀素甲醚、4-甲氧基黄檀醌质量分数范围分别为0.756%~2.347%、0.059%~0.349%、0.047%~1.240%。结论 本方法简便、准确,重复性、稳定性好,可用于印度黄檀中黄檀素、黄檀素甲醚和4-甲氧基黄檀醌的质量分数测定。
关键词:印度黄檀; 高效液相色谱法; 黄檀素; 黄檀素甲醚; 4-甲氧基黄檀醌
印度黄檀DalbergiasissooRoxb.为豆科黄檀属(Dalbergia)落叶半落叶大乔木,原产于印度、尼泊尔、巴基斯坦、孟加拉国、巴西、马达加斯加等国[1],我国主要引种于广东、广西、云南等地,被列为QB/T2385-200X《深色名贵硬木家具》中的红酸枝木类[2]。印度黄檀为中药降香原植物降香檀D.odorifera同属植物,其心材曾进口作为降香药材使用,即《本草纲目》木部降真香所载“俗呼舶上来者为番降”中的番降,具有化瘀止血、理气止痛功效[3]。该植物生长迅速,尤其在生长初期,株高及胸径一般可达同龄降香檀的2倍左右,种植5年生的印度黄檀一般就能形成心材,10~15 a基本成材[4]。
印度黄檀心材主要含挥发油和黄酮类成分[5-6],其主要成分黄檀素(黄檀内酯)具有抗肿瘤、抗菌、抗氧化[7]等生物活性,对离体兔心有显著增加冠脉流量、减慢心率、轻度增加心跳幅度的作用[8],对兔血浆有微弱的抗凝作用[9];4-甲氧基黄檀醌则表现出显著的抗感染活性[10]。
迄今为止尚鲜见对印度黄檀中黄檀素等成分质量分数测定的报道。为此,本文对国内引种的印度黄檀中黄檀素、黄檀素甲醚和4-甲氧基黄檀醌进行质量分数测定,以期为该药材的质量评价及产品开发利用提供参考依据。
1仪器与试药
1.1仪器
E2695型高效液相色谱仪(2998检测器,Empower3软件,美国Waters公司);BP 211D型电子分析天平(十万分之一,瑞士Sartorious公司);XS 225A型电子分析天平(万分之一,瑞士Precisa公司);KQ500型超声波清洗器(功率500 W,频率40 kHz,昆山超声仪器有限公司)。
1.2试药
印度黄檀各样品经广州中医药大学林励研究员鉴定为豆科植物印度黄檀D.sissooRoxb.的心材,其来源见表1;黄檀素、黄檀素甲醚和4-甲氧基黄檀醌对照品均为自制(经面积归一化法计算质量分数均大于98%);甲醇 (德国Merck公司,色谱纯);乙腈 (德国Merck公司,色谱纯);H3PO4(天津科密欧化学试剂有限公司,色谱纯);水为纯净水;其他试剂均为分析纯。
2方法
2.1混合对照品溶液的制备
分别取黄檀素、黄檀素甲醚、4-甲氧基黄檀醌对照品适量,精密称定,置于50 mL容量瓶中,加甲醇至刻度,溶解,摇匀,得黄檀素、黄檀素甲醚、4-甲氧基黄檀醌质量浓度分别为0.764、0.868、0.892 mg/mL的对照品溶液。上述3种对照品溶液各取1 mL混合,0.45 μm微孔滤膜滤过,取续滤液,即得。
表19批印度黄檀的来源信息表
Table 1The information of 9 batches ofDalbergiasissooRoxb. samples
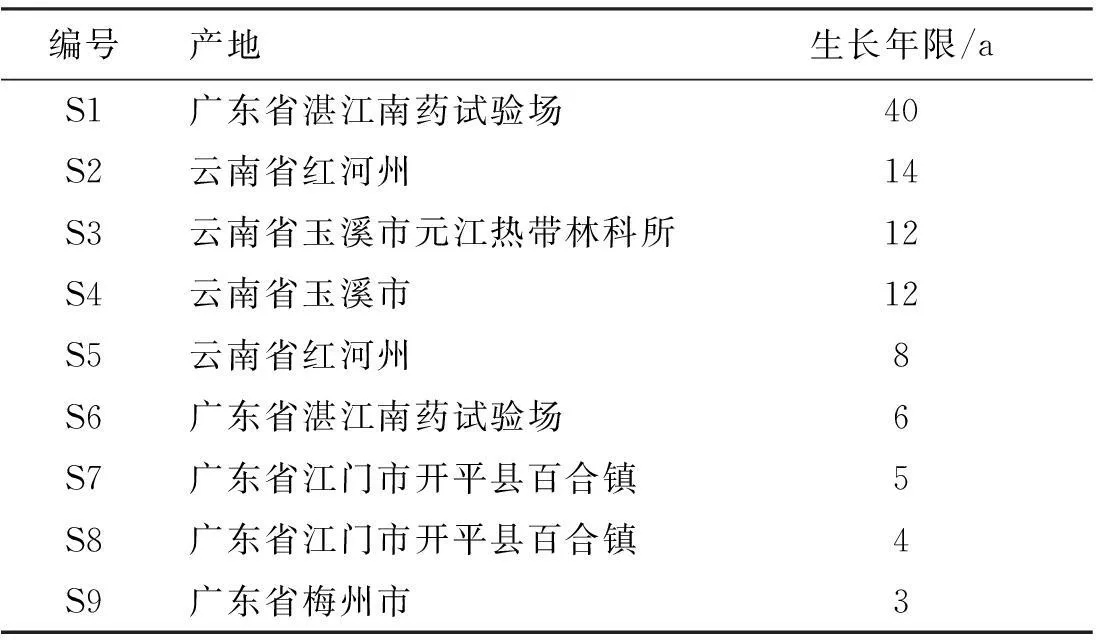
编号产地生长年限/aS1广东省湛江南药试验场40S2云南省红河州14S3云南省玉溪市元江热带林科所12S4云南省玉溪市12S5云南省红河州8S6广东省湛江南药试验场6S7广东省江门市开平县百合镇5S8广东省江门市开平县百合镇4S9广东省梅州市3
2.2供试品溶液的制备
取印度黄檀干燥心材,粉碎(过2号药筛),称取约0.5 g,精密称定,准确加入甲醇50 mL,称定质量。超声提取30 min,补足质量,摇匀。用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.3检测波长的选择
在210~400 nm全波长扫描S1供试品溶液发现黄檀素在260 nm有较强吸收,黄檀素甲醚在254 nm有较强吸收峰,4-甲氧基黄檀醌在280 nm有较强吸收峰,故分别采用260、254、280 nm为测定波长。
2.4色谱条件
色谱柱:Waters Symmetry ODS C18色谱柱(4.6 mm×250 mm,5 μm);流动相:甲醇-0.2%(体积分数,下同)H3PO4水溶液,梯度洗脱条件见表2。流速:1 mL/min;检测波长:0~23 min为260 nm,23~27 min为254 nm,27~52 min为280 nm;柱温:30 ℃;进样量:10 μL。分别精密吸取混合对照品、供试品溶液 10 μL进样,按上述条件测定,所得图谱见图1。
表2印度黄檀中3种成分的梯度洗脱条件
Table 2Gradient elution program in the determinations of 3 constituents from ofDalbergiasissooRoxb.
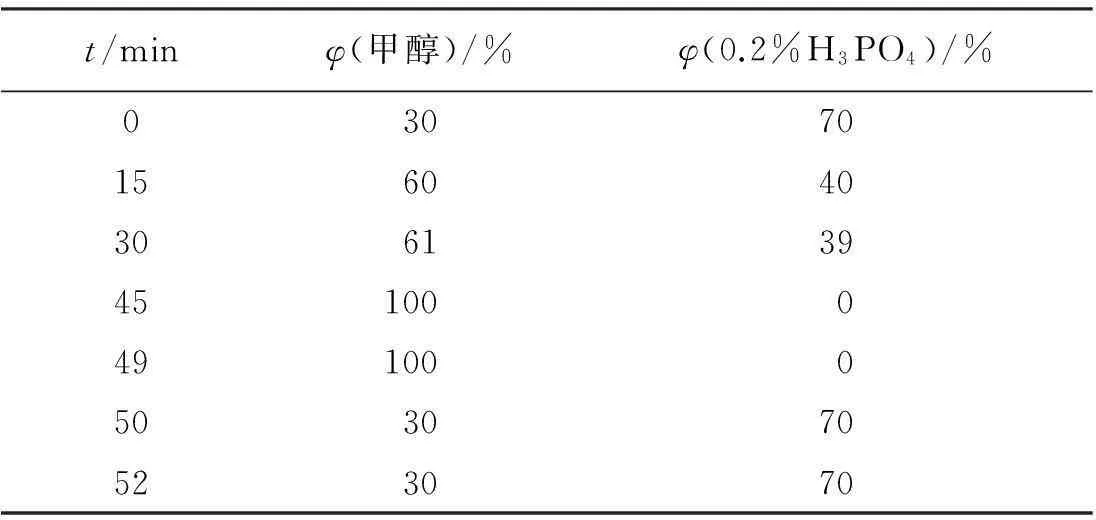
t/minφ(甲醇)/%φ(0.2%H3PO4)/%03070156040306139451000491000503070523070
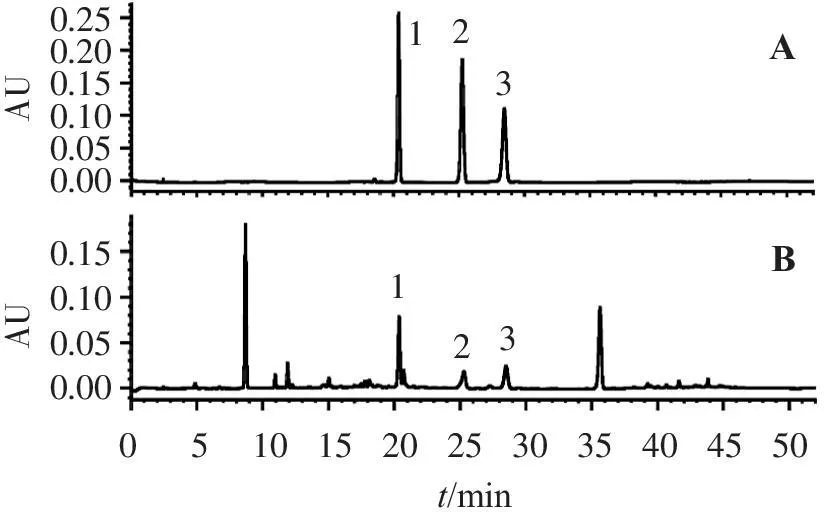
231123AB0.250.200.150.100.050.000.150.100.050.00AU05101520253035404550t/minAU
1.黄檀素; 2.黄檀素甲醚; 3. 4-甲氧基黄檀醌。
图1混合对照品(A)、供试品(B)溶液的HPLC色谱图
Figure 1HPLC chromatograms of reference substances(A)and test sample(B)
2.5线性关系的考察
分别精密吸取对照品溶液1、2、3、4、5、10 mL置于10 mL容量瓶中,用甲醇定容至刻度,摇匀,按“2.4”项下色谱条件进样分析,分别以各成分质量浓度(ρ)对峰面积(A)进行线性回归,所得回归方程及线性范围见表3。
2.6精密度试验
精密吸取对照品溶液10 μL,连续进样5次,按“2.4”项下色谱条件测定并计算,结果黄檀素、黄檀素甲醚、4-甲氧基黄檀醌峰面积的RSD值分别为2.32%、1.66%、2.76%。

表3 黄檀素、黄檀素甲醚和4-甲氧基黄檀醌的回归方程
2.7稳定性试验
取印度黄檀样品(S1)约0.5 g,精密称定,按“2.2”项下方法制备供试品溶液,室温放置,在0、2、4、6、8、10 h分别进样,按“2.4”项下色谱条件连续测定6次,结果黄檀素、黄檀素甲醚、4-甲氧基黄檀醌峰面积的RSD值分别为0.84%、1.48%、2.28%。表明供试品溶液室温放置10 h内基本稳定。
2.8重复性试验
取印度黄檀样品(S1)0.5 g,精密称定,平行操作5份。分别按“2.2”项下方法制备供试品溶液,按“2.4”项下色谱条件测定。结果黄檀素、黄檀素甲醚、4-甲氧基黄檀醌峰面积的RSD值分别为1.88 %、0.35%、0.71%,表明方法重复性良好。
2.9加样回收率试验
称取已知质量分数的S1号印度黄檀样品6份,每份约0.1 g,每2份为1组,精密称定,每组分别准确加入新配置的黄檀素、黄檀素甲醚和4-甲氧基黄檀醌质量浓度分别为0.764、0.868、0.892 mg/mL的混合对照品溶液1、2、3 mL,加甲醇至10 mL,称定质量,超声提取30 min,补足质量,摇匀。分别按“2.2”项下方法制备供试品溶液,按“2.4”项下色谱条件测定,计算回收率及其RSD值。结果如表4~表6所示,表明本方法加样回收率良好。
2. 10样品的测定
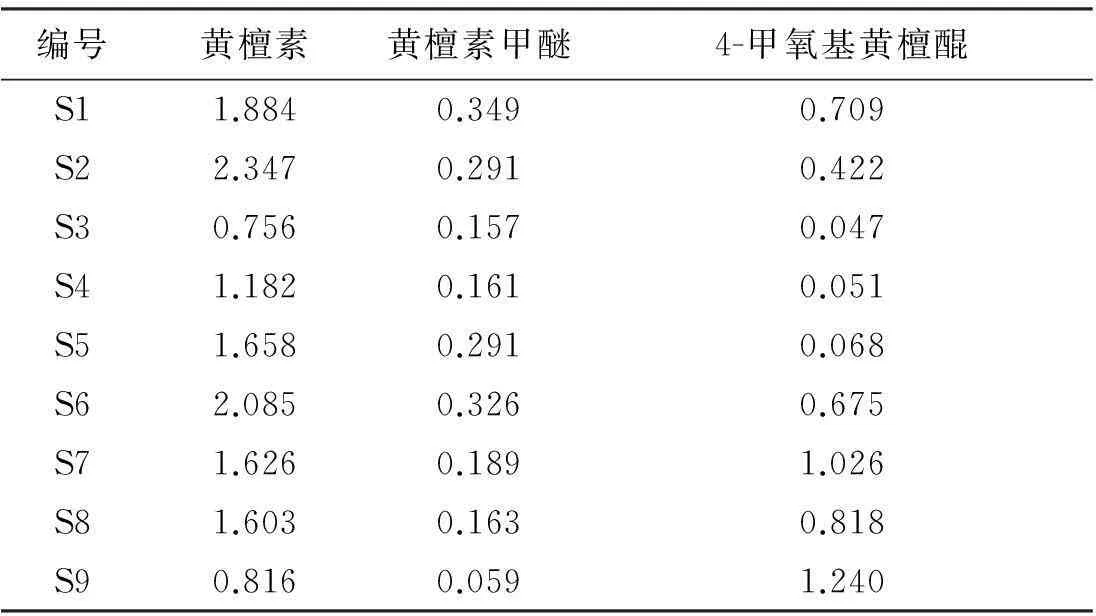
取9批不同来源印度黄檀心材,按“2.2”项下方法制备供试品溶液,每批制备3份,按“2.4”项下色谱条件测定,根据标准曲线及峰面积计算各成分质量分数,结果见表7。
表4印度黄檀中黄檀素的加样回收率试验结果
Table 4Recovery results of dalbergin inDalbergiasissooRoxb. (n=6)
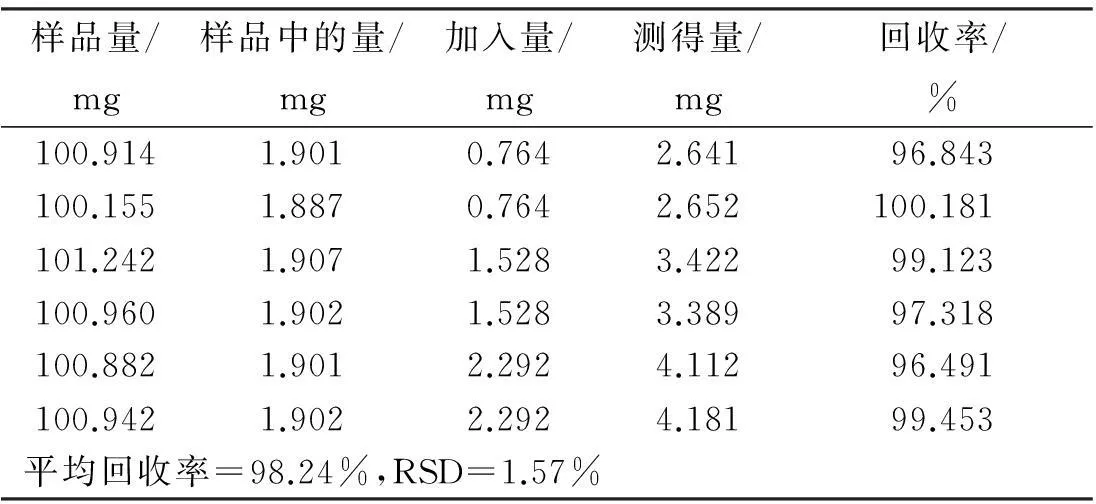
样品量/mg样品中的量/mg加入量/mg测得量/mg回收率/%100.9141.9010.7642.64196.843100.1551.8870.7642.652100.181101.2421.9071.5283.42299.123100.9601.9021.5283.38997.318100.8821.9012.2924.11296.491100.9421.9022.2924.18199.453平均回收率=98.24%,RSD=1.57%
表5印度黄檀中黄檀素甲醚的加样回收率试验结果
Table 5Recovery results ofO-methyldalbergin inDalbergiasissooRoxb. (n=6)
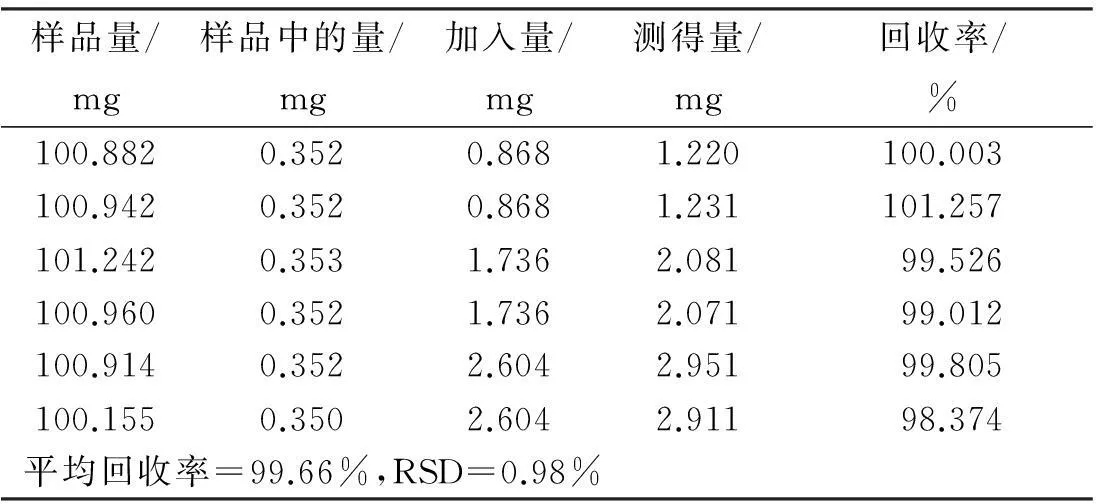
样品量/mg样品中的量/mg加入量/mg测得量/mg回收率/%100.8820.3520.8681.220100.003100.9420.3520.8681.231101.257101.2420.3531.7362.08199.526100.9600.3521.7362.07199.012100.9140.3522.6042.95199.805100.1550.3502.6042.91198.374平均回收率=99.66%,RSD=0.98%
表6印度黄檀中4-甲氧基黄檀醌的加样回收率试验结果
Table 6 Recovery results of 4-methoxydalbergione inDalbergiasissooRoxb. (n=6)
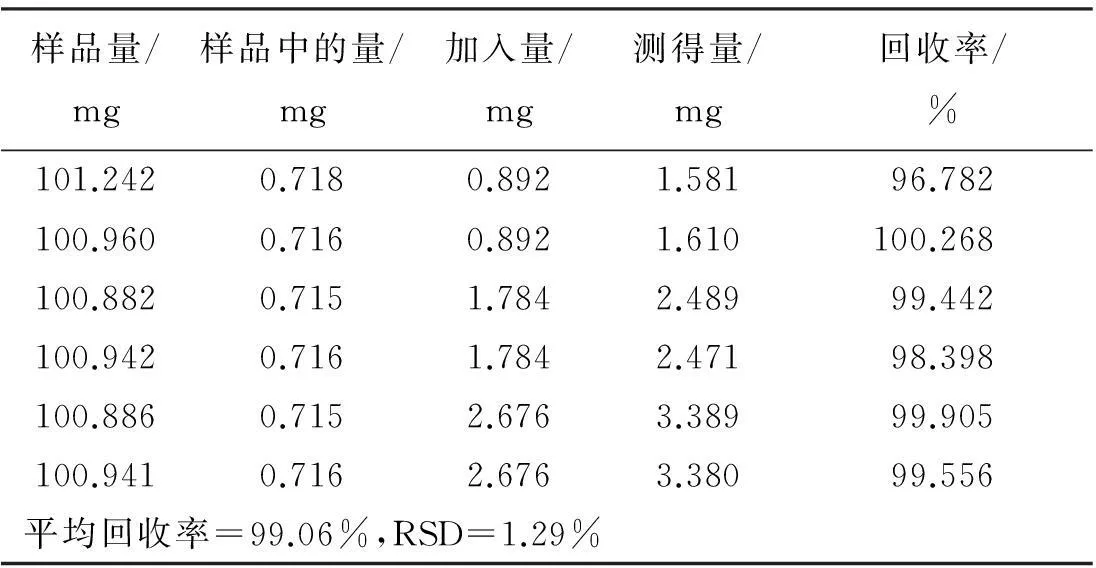
样品量/mg样品中的量/mg加入量/mg测得量/mg回收率/%101.2420.7180.8921.58196.782100.9600.7160.8921.610100.268100.8820.7151.7842.48999.442100.9420.7161.7842.47198.398100.8860.7152.6763.38999.905100.9410.7162.6763.38099.556平均回收率=99.06%,RSD=1.29%
表79批印度黄檀中黄檀素、黄檀素甲醚和4-甲氧基黄檀醌的质量分数测定结果
Table 7 Determination results of dalbergin,O-methyldalbergin and 4-methoxydalbergione inDalbergiasissooRoxb.
w/%
3讨论
通过测定9批印度黄檀样品得知,国内引种印度黄檀中主要有效成分黄檀素质量分数较高,在0.756%~2.347%范围内,其中以湛江引种的印度黄檀S1、S6中黄檀素质量分数较高且比较稳定,云南引种印度黄檀S2~S5中黄檀素质量分数差异较大。黄檀素甲醚质量分数范围为0.059%~0.326%,以S1、S6质量分数最高。4-甲氧基黄檀醌质量分数范围为0.047%~1.240%,在S2~S5中质量分数最低,以S7、S8和S9(生长年限分别为5、4和3 a)为高,提示在树龄较低的印度黄檀中4-甲氧基黄檀醌质量分数较高,随着树龄增加此成分长较慢。由此可见,印度黄檀的生长环境、栽培条件、生长年限等因素对其化学成分影响较大。
本文采用HPLC法测定了印度黄檀中3种成分的质量分数,该法灵敏度高,简单、快速,能准确有效地测定印度黄檀化学成分、尤其是主要有效成分黄檀素的质量分数,为建立印度黄檀的质量控制标准奠定了良好的基础。
参考文献:
[1] TEWARI D N. A monograph onDalbergiasissooRoxb.[M]. Dehradun: International Book Distributors,1994.
[2] 王小芳.深色名贵硬木家具用材研究[D].南宁:广西大学,2008:17.
[3] 中药商品知识编写组.中药商品知识:中册[M].广州:广东科技出版社,1989:157.
[4] 石雷,梁英扬,邓疆.印度黄檀引种试验研究[J].西南农业学报,2010,23(2):559-559.
[5] 林励,徐鸿华,肖省娥,等.不同品种降香质量研究[J].中药材,1997,20(7):366-370.
[6] 肖省娥,林励.不同来源的降香药材中总黄酮含量测定[J].基层中药杂志,2000,14(6):12-14.
[7] KAWAII S,TOMONOY,KATASE E,et al.Effect of coumarins on HL-60 cell differentitation [J].Anticancer Res,2000,20(4):2505-2512.
[8] 朱亮,冷红文,谭力伟,等.降香挥发油对血栓形成、血小板 cAMP 和血浆纤溶酶活性的影响[J].中成药,1992,14(4):30.
[9] 訾慧,沙明.中药降香研究进展[J].辽宁中医学院学报,2003,5(2):90-91.
[10] CHAN S C,CHANG Y S,WANG J P,et al.Three new flavonoids and antiallergic,anti-inflammatory constituents from the heartwood of Dalbergia odorifer[J].Planta Med,1998,64(2):153-158.
(责任编辑:刘晓涵)
Quantitative determination of dalbergin and other two compounds inDalbergiasissooRoxb. by HPLC
LI Ran1,LIN Li1,QI Longkai1,DU Haifang1,LI Jing1,CAI Cong2,ZHENG Lai′an2,YE Yaoxiang3
(1.SchoolofChineseHerbalMedicine,GuangzhouUniversityofChineseMedicine,Guangzhou510006,China; 2.ZhanjiangSouthMedicineFieldTestingGround,Suixi524338,China; 3.ZhongtanIndustrialCo.,LTDinGuangdong,Taishan529200,China)
Abstract:Objective To establish an HPLC method for the quantitative determination of dalbergin,O-methyldalbergin and 4-methoxydalbergione in Dalbergia sissoo Roxb.Methods The separation was performed on Waters Symmetry C18column (250 mm×4.6 mm,5 μm) eluted with a mobile phase of methanol-0.2% phosphoric acid solution in a gradient elution. The detection wavelength of dalbergin,O-methyldalbergin and 4-methoxydalbergione were 260,254 and 280 nm,respectively.Results The average recoveries of dalbergin,O-methyldalbergin and 4-methoxydalbergione were 98.24%,99.66%,and 99.06%,with RSD of 1.57%,0.98% and 1.29%,respectively. The contents of dalbergin,O-methyldalbergin and 4-methoxydalbergione were in the range of 0.756%-2.347%,0.059%-0.349%,and 0.047%-1.240% in the introduced Dalbergia sissoo Roxb.Conclusion The HPLC method is accurate and reproducible for the quantitative determinations of dalbergin,O-methyldalbergin and 4-methoxydalbergione in Dalbergia sissoo Roxb.
Key words:Dalbergia sissoo Roxb.; HPLC; dalbergin; O-methyldalbergin; 4-methoxydalbergione
DOI:10.16809/j.cnki.1006-8783.2015102101
中图分类号:R284.1
文献标志码:A
文章编号:1006-8783(2016)01-0051-04
作者简介:李然(1985—),男,2013级博士生,从事中药资源开发与新药研发,Email:wwwlr@163.com;通信作者:林励(1954—),男,研究员,博士生导师,从事中药资源开发与新药研发,Email:LL76611@126.com。
收稿日期:2015-10-21
网络出版时间:2016-01-15 18:33网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160115.1833.009.html
