瑞舒伐他汀侧链(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯合成研究进展
2017-09-12何人宝胡忠梁金逸中林娇华张晓健王亚军柳志强
何人宝,胡忠梁,金逸中,林娇华,张晓健,王亚军,柳志强
(1.浙江永太科技股份有限公司, 浙江 台州 317016; 2. 浙江工业大学 生物工程学院 浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014)
瑞舒伐他汀侧链(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯合成研究进展
何人宝1,胡忠梁2,金逸中1,林娇华1,张晓健2,王亚军2,柳志强2
(1.浙江永太科技股份有限公司, 浙江 台州 317016; 2. 浙江工业大学 生物工程学院 浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014)
瑞舒伐他汀是一种高效的羟甲戊二酰辅酶A(HMG-CoA)还原酶抑制剂,能有效降低低密度脂蛋白(LDL)胆固醇,且无副作用,被称为“超级他汀”.瑞舒伐他汀是由疏水性母核和开环侧链构成,其手性侧链是合成中的难点.目前,化学法和生物酶法合成瑞舒伐他汀关键手性侧链(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯受到研究者广泛的关注.主要介绍了不对称还原合成(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯的研究进展.
(3R, 5S)-6-R-取代基-3,5-二羟基己酸叔丁酯;瑞舒伐他汀;手性中间体;不对称还原
瑞舒伐他汀钙商品名为可定(Crestor),能够有效减少高胆固醇血症患者体内胆固醇水平,由阿斯利康制药公司(AstraZeneca)开发,于2003年8月通过美国FDA认证.瑞舒伐他汀能够抑制HGM-CoA还原酶转化3-羟基-3-甲基戊二酰辅酶A生成胆固醇前体甲羟戊酸,从而减少胆固醇的生成.瑞舒伐他汀与其他他汀类药物相比能更有效降低低密度脂蛋白(LDL)胆固醇,因而被称为“超级他汀”[1].
手性二羟基侧链与3-羟基-3-甲基戊二酰辅酶A(HGM-CoA)分子结构中的HMG结构相似,因此能够竞争性抑制HMG-CoA还原酶的催化还原.(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯是全合成的HGM-CoA还原酶抑制剂合成中重要的中间体.传统化学全合成瑞舒伐他汀钙化合物的工艺路线反应步骤共有七步,其中两步不对称催化还原手性物反应可用生物法替代,有效减少了对环境的污染.瑞舒伐他汀相关专利于2016年过期,各医药企业和研发单位竞相开展高效稳定的合成新方法路线的研究和开发,并取得了一定的进展.笔者综述了化学法和生物酶法在瑞舒伐他汀侧链手性中间体(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯合成中的应用.
1 3,5-二羰基己酸叔丁酯的不对称还原
瑞舒伐他汀是全合成药物,它保留了与天然他汀药物相同的手性立体结构(3R,5S)-3,5-二羟基链烷酸酯侧链.瑞舒伐他汀母核环状及取代基部分结构不同于其他他汀类药物,其中极性磺酰基团使瑞舒伐他汀钙分子具备相对较低的亲油性.手性中间体(3R,5S)-二羟基己酸盐侧链是合成中的难点,两个手性中心要求e.e.>99.5%,d.e.>99%.本节主要介绍以6-R-取代基-3,5-二羰基己酸叔丁酯为底物通过化学法或生物酶“一锅法”催化转化形成二元醇不对称手性中心产物的还原反应.当R是氰基(CN)时,可用于合成阿托伐他汀,当R是氯、苄氧基等取代基时,可用于合成瑞舒伐他汀.不对称还原3,5-二羰基己酸叔丁酯合成(3R,5S)-二羟基己酸叔丁酯的反应式为

1.1 化学法不对称还原3,5-二羰基己酸叔丁酯
利用化学法不对称还原3,5-二羰基己酸叔丁酯为较传统的方法,需金属催化剂及硼氢化物分别对底物的3位和5位羰基进行手性还原反应,对两个手性中心的光学纯度要求较高.Minami等[2]以酒石酸二异丙酯为原料合成3,5-二羰基己酸叔丁酯,3,5-二羰基己酸叔丁酯底物在四氢呋喃(THF)溶剂中,反应温度≤-78 ℃,反应时间4 h,以二异丁基氢化铝(DIBAL)为催化剂选择性还原生成3,5-二羰基己酸叔丁酯中间产物.当3,5-二羰基己酸叔丁酯底物取代基(R2)不同时,不对称还原生成的中间产物产率和手性纯度存在一定的差异.当R2为甲基时,产物产率为51%,手性纯度达89%;当R2为乙基时,产率提高至56%,e.e.值达97%;当R2为异丙基时,产率达到最高为61%,e.e.值>99%.化学法不对称还原3,5-二羰基己酸叔丁酯生成3,5-二羟基己酸叔丁酯反应式为

在Et2BOMe中以硼氢化钠(NaBH4)为催化剂,-78 ℃低温条件下,将3,5-二羰基己酸叔丁酯生成手性产物3,5-二羟基己酸叔丁酯,反应12 h后产物产率达76%.但化学法不对称还原3, 5-二羰基己酸叔丁酯产率较低、设备要求高、对环境不友好,不适于工业化生产.
1.2 生物酶法不对称还原3, 5-二羰基己酸叔丁酯
生物酶法不对称还原3,5-二羰基己酸叔丁酯生产3,5-二羟基己酸叔丁酯具有反应条件温和、操作简易等优点,因此生物法合成工艺比传统化学法合成更具有优势.Guo等[3]将不动杆菌Acinetobactersp. SC13874细胞提取液用于不对称催化6-苄氧基-3,5-二羰基己酸叔丁酯(tert-butyl 6-benzyloxy-3,5-dioxohexanoate,BDOH)还原生成(3R,5S)-6-苄氧基-3,5-二羟基己酸叔丁酯(tert-butyl (3R,5S)-6-benzyloxy-3,5-dihydroxyhexanoate,(3R,5S)-BDHH).6-苄氧基-3,5-二羰基己酸叔丁酯先经不动杆菌中双羰基还原酶(DKR)还原生成一元醇(S)-6-苄氧基-5-羟基-3-羰基己酸叔丁酯,e.e.值为87%,再进一步将(S)-6-苄氧基-5-羟基-3-羰基己酸叔丁酯还原生成二元醇(3R,5S)-6-苄氧基-3, 5-二羟基基己酸叔丁酯,d.e.值为51%.
Wu等[4]在大肠杆菌中共表达了该双羰基还原酶(DKR)和来源于芽孢杆菌(Bacillusmegaterium)的葡萄糖脱氢酶(GDH)(图3),在pH 7.0,无外源辅酶添加情况下,e.e.,d.e.值分别提高至99.5%,99.5%.Wolberg等[5-6]报道了利用Lactobacilluskefir菌株克隆得到的醇脱氢酶在重组大肠杆菌中表达,并不对称催化合成(3R,5S)-6-氯-3,5-二羟基己酸叔丁酯(tert-butyl 6-chlore-3,5-dihydroxyhexanoate,(3R,5S)-CDHH).该酶为NADP(H)依赖型,具有高区域和立体选择性,能够催化还原实验室克级规模的6-氯-3,5-二羰基己酸叔丁酯(tert-butyl 6-chlore-3,5-dioxohexanoate,CDOH)合成(3R,5S)-CDHH,反应24 h后d.e.值达到99.5%,产物反应总收率达72%.醇脱氢酶能够通过氧化共底物异丙醇生成丙酮使辅酶实现自我循环,因此无需额外添加昂贵的辅酶来构建辅酶循环系统.异丙醇的氧化反应不仅能使辅酶自我再生,减少生产成本,而且能够促进不对称还原反应的进行.但由于Lactobacilluskefir的培养成本较高,只能达到较低的细胞浓度,因此要获得大量的乳酸杆菌细胞比较困难.在此工艺基础上,通过分批补料优化后,反应放大到了百克级别规模,反应时间24 h,转化率>90%.DKR和GDH共表达全细胞不对称催化BDOH合成(3R,5S)-BDHH以及醇脱氢酶不对称还原CDOH合成(3R,5S)-CDHH的反应式分别为

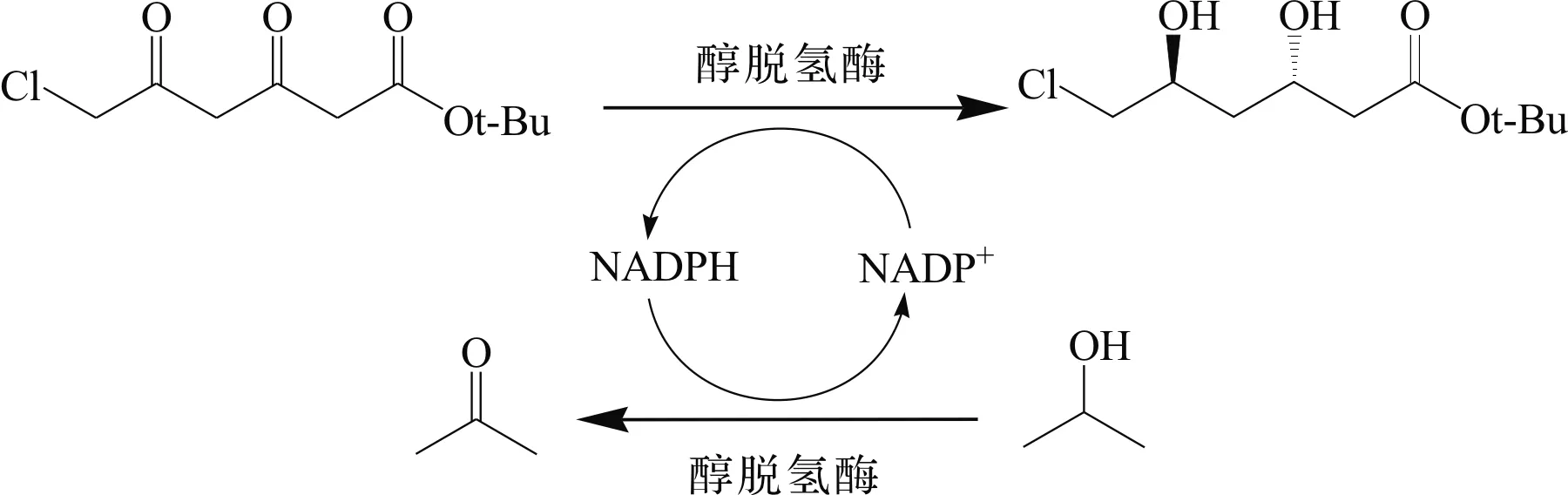
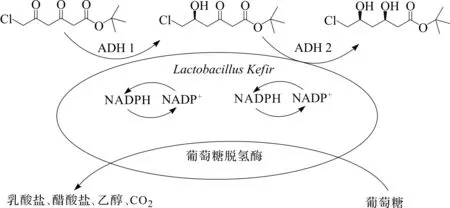
另外,Pfruender等[7]报道了一种有效的全细胞生物不对称催化转化工艺,利用高加索乳杆菌(LactobacilluskefirDSM 20587)两步法不对称还原催化CDOH合成(3R,5S)-CDHH.5 L发酵罐中利用MRS对高加索乳杆菌进行分批补料发酵培养,发酵76 h后细胞量达到14.2 g/L(细胞干重),单位菌体酶活达到850 U/g(细胞干重).随后放大至150 L发酵罐分批补料发酵培养,71 h后细胞量达到10.8 g/L(细胞干重),单位菌体酶活达到844 U/g(细胞干重).在5 mmol/L MgCl2,200 mmol/L葡萄糖,200 mmol/L pH 6.5磷酸缓冲液体系中,50 g/L(细胞干重)高加索乳杆菌全细胞能够催化100 mmol/L 6-氯-3,5-二羰基己酸叔丁酯生成47.5 mmol/L (3R,5S)-CDHH及11.7 mmol/L副产物呋喃酮,产物收率为47.5%,d.e.>99%.
在Lactobacilluskefir菌株中含有两种醇类脱氢酶ADH I和ADH II,ADH I还原底物5位上的羰基,还原6-氯-3,5-二羰基己酸叔丁酯生成(S)-6-氯-5-羟基-3-羰基己酸叔丁酯,ADH II还原3位上的羰基,将(S)-6-氯-5-羟基-3-羰基-己酸叔丁酯(tert-butyl (S)-6-chloro-5-hydroxy-3-oxohexanoate, (S)-CHOH)不对称还原生成(3R,5S)-CDHH,并且以上两步都是以NADPH作为辅酶,以葡萄糖作为共底物.Amidjojo等[8]在Pfruender基础上考察了全细胞不对称还原体系中缓冲液浓度、温度、pH等对反应的影响.反应温度对Lactobacilluskefir的醇脱氢酶ADH II的立体选择性有着重要的影响:随着温度的升高,d.e.值逐渐下降,当温度为22 ℃时,d.e.值为99%,当温度提高到30 ℃时,d.e.值下降了2%.根据反应动力学模型优化得到的底物投料策略,使不对称合成产物产率提高到79%,时空产率达到4.7 mmol/(L·h).高加索酸奶乳杆菌催化合成(3R,5S)-6-氯-3,5-二羟基己酸叔丁酯反应式为
2 (S)-5-羟基-3-羰基己酸叔丁酯的不对称还原
以单羟基前手性化合物(S)-5-羟基-3-羰基己酸叔丁酯为底物不对称合成瑞舒伐他汀手性中间体(3R,5S)-二羟基己酸盐侧链,能够更有针对性地催化羰基生成相应手性醇产物,减少副产物的生成.手性产物(3R,5S)-二羟基己酸盐要求d.e.>99%.以(S)-5-羟基-3-羰基己酸叔丁酯为底物不对称催化转化形成不对称手性中心产物的还原反应过程为

2.1 化学法不对称还原(S)-5-羟基-3-羰基己酸叔丁酯
化学法可利用催化剂NaBH4/BEt3不对称还原合成光学手性二元醇.Beck等[9]在四氢呋喃/甲醇溶剂中不对称还原(S)-6-苄氧基-5-羟基-3-羰基酯合成二元醇,反应5 h后,产物产率达80%,但需在低温(≤-60 ℃)条件下才能达到较高的立体选择性,d.e.>98%.需使用大量昂贵的硼试剂,并会造成严重的环境污染问题.硼化物法不对称转化加氢(S)-6-苄氧基-5-羟基-3-羰基己酸叔丁酯反应式为


此方法避免了使用硼烷试剂及低温等苛刻反应条件,但是金属催化剂价格昂贵成本过高,且手性选择性较低,因此需要开发一种反应条件温和,能够有效高选择性催化合成瑞舒伐他汀手性中间体的方法.
2.2 生物酶法不对称还原(S)-5-羟基-3-羰基己酸叔丁酯
生物酶法不对称催化(S)-5-羟基-3-羰基己酸叔丁酯具有高区域和立体选择性、副产物少、反应条件温和、能源消耗低等优点,更加符合绿色合成和工业要求.王盛等[11]从实验室酵母中筛选出了一株对(S)-6-氯-5-羟基-3-羰基-己酸叔丁酯具有一定还原能力的野生菌株RhodotorulagracilisAS 2.499.通过添加酶抑制剂(烯丙基氯)、热预处理酵母细胞方法,提高了细胞不对称催化还原(S)-CHOH的立体选择性.最终底物质量浓度达到1 g/L,湿菌体质量浓度为100 g/L,pH值6.0,反应时间48 h,收率68.3%,d.e.值95.1%,但是仍然存在明显的底物抑制现象.Kizaki等[12]利用木兰假丝酵母CandidamagnoliaIFO0705可不对称还原(S)-6-氯-5-羟基-3-羰基-己酸叔丁酯生成(3R,5S)-CDHH,反应时间20 h,产物得率达到71%,d.e.值达100%.放大至5 L发酵罐培养,将离心得到的菌体以60 g葡萄糖为辅底物,不对称催化还原30 g (S)-CHOH至(3R,5S)-CDHH,反应18 h后经乙酸乙酯萃取,减压蒸馏得到24 g产物,产物总得率为80%.在此基础上,在大肠杆菌中共表达了该菌株的羰基还原酶与巨大芽孢杆菌BacillusmegateriumIA1030中的葡萄糖脱氢酶(GDH).在24 h内催化底物质量浓度为200 g/L的(S)-CHOH,产率为97.2%,d.e.值为98.5%[13].羰基还原酶与GDH共表达全细胞不对称还原(S)-CHOH合成(3R,5S)-CDHH的反应式为

羰基还原酶不对称合成(3R,5S)-二羟基己酸叔丁酯反应中需要大量的NADPH或NADH作为辅酶,增加了生产成本.细胞内含有大量的还原酶和辅酶(NADPH或NADH),且理论转化率能达到100%,因而全细胞生物催化转化方法已经广泛应用于不对称还原羰基化合物生产合成手性醇产物.随着固定化技术的发展,固定化细胞可多批次回收重复使用,提高了生产率,有利于产物的分离提纯,进一步降低了生产成本,利用全细胞生物转化大规模生产工业产品具有可行性.Sun等[14]利用细胞液芯包囊固定化技术将酿酒酵母SaccharomycescerevisiaeCGMCC No. 2233固定化后催化还原(S)-CHOH生产(3R,5S)-CDHH.确定了最优的固定化条件,在pH 6.8~7.2,反应温度30 ℃条件下不对称还原50 g/L (S)-CHOH,36 h后转化率达100%,d.e.值为99%,固定化细胞回收重复利用15 批次仍能保持较高活力.美国Codexis公司Giver等对编码酿酒酵母Saccharomycescerevisiae野生型酮还原酶的Ydl124wp基因进行改造,得到一株活力较高的正突变菌株.在100 mg/L NADPH辅酶的存在下,底物15 g/L,反应4 h后底物转化率达99.8%,d.e.值达99.2%[15].Avecia Pharmaceuticals公司[16]利用毕赤酵母(Pichiaangusta)羰基还原酶进行全细胞不对称还原(S)-5, 6-二羟基-3-羰基己酸叔丁酯((S)-5,6-dihydrxy-3-oxohexanoate,(S)-DHOH)生成(3R,5S)-3,5,6-三羟基己酸叔丁酯,底物质量浓度达25 g/L(0.11 mol/L),产物总收率80%,d.e.>99 %.该过程通过毕赤酵母自身细胞的正常新陈代谢即可维持辅酶的再生循环.进一步地利用南极假丝酵母(Candidaantarctica)脂肪酶B固定化细胞对(3R,5S)-3,5,6-三羟基己酸叔丁酯进行乙酰化作用,形成对羟基基团的保护.毕赤酵母不对称还原(S)-5-羟基-3-羰基己酸叔丁酯及南极假丝酵母脂肪酶B酰化反应的过称为

3 结 论
瑞舒伐他汀作为目前主要的降血脂药物,具有巨大的市场前景,近年已对合成瑞舒伐他汀手性侧链中间体(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯进行大量的研究.化学法和生物酶法催化非手性化合物制备高附加值的手性中间体是工业化生产手性药物的重要方法.其中生物酶法对环境友好、区域选择性高、反应条件温和,在一定程度上替代了高污染且反应条件苛刻的传统化学合成工艺,具有良好的应用前景.随着定向进化、高通量筛选技术及基因组学等技术的发展,可挖掘出大量的不对称催化合成(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯的商品化生物酶催化剂,将有效提高生产效率、降低工业生产成本.
[1] MCTAGGART F. Comparative pharmacology of rosuvastatin[J]. Atherosclerosis supplements, 2003, 4(1): 9-14.
[2] MINAMI T, TAKAHASHI K, HIYAMA T. Stereoselective reduction ofβ,δ-diketo esters derived from tartaric acid. A facile route to optically active 6-oxo-3,5-syn-isopropylidenedioxy-hexanoate, a versatile synthetic intermediate of artificial HMG CoA reductase inhibitors[J]. Tetrahedron letters, 1993, 34(3): 513-516.
[3] GUO Zhiwei, CHEN Yijun, GOSWAMI A, et al. Synthesis of ethyl andt-butyl (3R,5S)-dihydroxy-6-benzyloxy hexanoates via diastereo-and enantioselective microbial reduction[J]. Tetrahedron: asymmetry, 2006, 17(10): 1589-1602.
[4] WU Xuri, JIANG Jinpeng, CHEN Yijun. Correlation between intracellular cofactor concentrations and biocatalytic efficiency: coexpression of diketoreductase and glucose dehydrogenase for the preparation of chiral diol for statin drugs[J]. ACS catalysis, 2011, 1(12): 1661-1664.
[5] WOLBERG M, HUMMEL W, WANDREY C, et al. Highly regio-and enantioselective reduction of 3,5-dioxocarboxylates[J]. Angewandte chemie international edition, 2000, 39(23): 4306-4308.
[6] WOLBERG M, HUMMEL W, MULLER M. Biocatalytic reduction ofβ,δ-diketo esters: a highly stereoselective approach to all four stereoisomers of a chlorinatedβ,δ-dihydroxy hexanoate[J]. Chemistry-a european journal, 2001, 7(21): 4562-4571.
[7] PFRUENDER H, AMIDJOJO M, HANG F, et al. Production ofLactobacilluskefircells for asymmetric synthesis of a 3,5-dihydroxycarboxylate[J]. Applied microbiology and biotechnology, 2005, 67(5): 619-622.
[8] AMIDJOJO M, FRANCO-LARA E, NOWAK A, et al. Asymmetric synthesis oftert-butyl (3R,5S)-6-chloro-dihydroxyhexanoate withLactobacilluskefir[J]. Applied microbiology and biotechnology, 2005, 69(1): 9-15.
[9] BECK G, JENDRALLA H, KESSELER K. Practical large scale synthesis of tert-butyl (3R,5S)-6-hydroxy-3,5-O-isopropylidene-3,5-dihydroxyhexanoate: essential building block for HMG-CoA reductase inhibitors[J]. Synthesis, 1995(8): 1014-1018.
[10] EVERAERE K, FRANCESCHINI N, MORTREUX A, et al. Diastereoselective synthesis of syn-3,5-dihydroxyesters via ruthenium-catalyzed asymmetric transfer hydrogenation[J]. Tetrahedron letters, 2002, 43(14): 2569-2571.
[11] 王盛, 吴坚平, 徐刚, 等. 酵母细胞催化(S)-6-氯-5-羟基-3-羰基己酸叔丁酯的不对称还原[J]. 化学反应工程与工艺, 2006, 22(6): 554-559.
[12] KIZAKI N, YAMADA Y, YASOHARA Y, et al. Process for the preparation of optically active 2-[6-(hydroxymethyl)-1,3-dioxan-4-yl]acetic acid derivatives: WO 0008011[P]. 2000-02-17.
[13] KIZAKI, N, YAMADA, Y, YASOHARA, Y, et al. Expression vector, transformants,E.coli,CandidaBacillus, use of microorganisms to producet-butyl (3R,5S)-6-chloro-3,5-dihydroxyhexanoate, by enzymatic asymmetrical reduction, for drug, pesticide and HMG-CoA reductase inhibitor synthesis: US 6645746[P]. 2003-11-11.
[14] SUN Xingyuan, SHI Hanbing, BI Hongxia, et al. Bioconversion process for synthesis oftert-butyl (3R,5S)-6-chloro-3,5-dihydroxyhexanoate using liquid-core immobilizedSaccharomycescerevisiaeCGMCC No 2233[J]. Korean journal of chemical engineering, 2013, 30(1): 166-171.
[15] GIVER L, NEWMAN L, MUNDORFF E, et al. Polynucleotides encoding ketoreductases for producing stereoisomerically pure statins and synthetic intermediates therefor: US 20130040364A1[P]. 2013-12-31.
[16] HOLT R A, BLACKER A J, REEVE C D, et al. Process for the preparation of dihydroxy esters and derivatives thereof: WO 0185975[P]. 2001-05-01.
(责任编辑:朱小惠)
Research advance in synthesis of the rosuvastatin side chain intermediatetert-butyl (3R,5S)-6-R-substituent-3,5-dihydroxyhexanoate
HE Renbao1, HU Zhongliang2, JIN Yizhong1, LIN Jiaohua1, ZHANG Xiaojian2, WANG Yajun2, LIU Zhiqiang2
(1.Zhejiang Yongtai Technology Co., Ltd., Taizhou 317016, China; 2. Key Laboratory of Bioorganic Synthesis of Zhejiang Province, College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China)
Rosuvastatin is an effective 3-hydroxy-3-methyl-glutaryl CoA (HMG-CoA) reductase inhibitor. Regarded as “super-statin”, rosuvastatin effectively reduces low-density lipoprotein (LDL) cholesterol without additional adverse effects. Rosuvastatin is composed of the hydrophobic parent nucleus and the side chain, while the the preparation of side chain is the bottleneck for the whole synthesis. Chemical and enzymatic synthesis of the rosuvastatin side chain intermediatetert-butyl (3R,5S)-6-R-substituent-3,5-dihydroxyhexanoate has attracted increasing attentions. Research progress in synthesis oftert-butyl (3R,5S)-6-R-substituent-3,5-dihydroxyhexanoate was reviewed in this paper.
tert-butyl (3R,5S)-6-R-substituent-3,5-dihydroxyhexanoate; rosuvastatin; chiral intermediates; asymmetric reaction
2016-10-12
国家自然科学基金面上项目(21672190)
何人宝(1965—),男,浙江台州人,高级工程师,研究方向为化学工程与工艺,E-mail: renbao.he@yongtaitech.com. 通信作者:柳志强教授,E-mail: microliu@zjut.edu.cn.
TQ46
A
1674-2214(2017)03-0188-05
