乙酸与钾离子强度对聚唾液酸合成及过程分子质量变化的影响
2017-09-03付旭东吴剑荣蒋芸马旭郑志永张丽敏詹晓北
付旭东,吴剑荣,蒋芸,马旭,郑志永,张丽敏,詹晓北
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
研究报告
乙酸与钾离子强度对聚唾液酸合成及过程分子质量变化的影响
付旭东,吴剑荣,蒋芸,马旭,郑志永,张丽敏,詹晓北
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
聚唾液酸是由大肠杆菌K235合成的一种Group II型胞外多糖。发酵液中有机酸积累、pH控制方式和K2HPO4对聚唾液酸合成和分子质量有较大影响。该研究发现,代谢累积有机酸及外源乙酸胁迫使得聚唾液酸产量和分子量降低;相比摇瓶所需100 mmol/L的K2HPO4,在发酵罐控制pH发酵时,20 mmol/L左右的K2HPO4可以获得较高的聚唾液酸分子量和产量;在发酵16 h后把氨水变成KOH流加来控制pH,并补入适量胰蛋白胨作为有机氮源,聚唾液酸产量有所提高,而且在发酵结束前较长时间内聚唾液酸的产量和分子质量维持稳定状态。
大肠杆菌K235;聚唾液酸;乙酸;钾离子;分子质量
唾液酸(Sialic acid)是一类含有9个碳原子并具有吡喃糖结构的酸性氨基糖,又称为神经氨酸,按照5号位碳原子上取代基的不同,唾液酸主要分为3类:N-乙酰神经氨酸(Neu5Ac),N-羟乙酰神经氨酸(Neu5Gc)和3-脱氧-D-甘油-D-半乳壬酮糖(Kdn)。聚唾液酸(Polysialic acid,PSA)则是由N-乙酰神经氨酸以α-2,8糖苷键链接的线性同聚物,聚合度通常在8~400之间[1]。PSA在动物和人体中主要存在于神经黏附分子上,参与细胞迁移、突触形成以及神经导向,在神经系统发育中起着重要作用[2]。在肿瘤发生过程,聚唾液酸与多种肿瘤细胞的黏附性、迁移性和侵袭性等特性密切相关[3]。另外,聚唾液酸也存在于少数几种病原菌的胞外荚膜中,能协助病菌在入侵宿主时候起到“分子模拟”作用而躲避宿主攻击[4]。由于聚唾液酸具有良好非免疫原性、生物可降解性和生物相容性,是优良的生物材料。目前,有研究把聚唾液酸替代聚乙二醇用于修饰药物蛋白如L-天冬酰胺酶、铜锌超氧化物歧化酶等,修饰后蛋白稳定性普遍提高,半衰期延长,免疫原性降低,生物利用度提高[5-6]。另外,有报道将聚唾液酸与其他材料如壳聚糖、聚己内酯、透明质酸等进行共混、交联或共聚形成复合材料,用作药物缓释或组织工程的生物材料[7-8]。
当前聚唾液酸的制备方法是通过大肠杆菌发酵和纯化获得,主要研究集中在温度、pH、碳源、氮源、磷酸盐、补料工艺等对聚唾液酸发酵的影响。最近,ZHENG等[9]采用两阶段氨水流加进行pH控制来生产聚唾液酸,即前段pH 6.4、后段pH 7.4,可以使得PSA分子量可达260 kDa。陈芳等[10]利用基因工程获得产聚唾液酸工程菌,虽然摇瓶产量1.0 g/L,但在7 发酵罐中通过氨水控制pH为7.0并流加葡萄糖以维持其浓度在1.0 g/L,使得聚唾液酸达到16.0 g/L,分子量为113 kDa。对于大肠杆菌发酵生产聚唾液酸过程,一般在摇瓶中采用高浓度(100 mmol/L)磷酸氢二钾进行缓冲或在发酵罐采用pH控制在pH 6.4~7.0并降低K2HPO4用量,这样才能达到高产PSA目的。当大肠杆菌以葡萄糖和山梨醇为碳源时会积累大量乙酸,尤其是利用葡萄糖时;当利用木糖为碳源时则积累大量丙酮酸[11]。有机酸积累会造成PSA不稳定性,发酵液中还能检测到唾液酸单体[11]。另外,PSA分子线性结构中唾液酸单元都含有-COOH,解离时候有-COO-和H+的电荷平衡,也会形成内酯结构有利于稳定[12];而在酸性条件下,H+容易对α-2,8糖苷键产生攻击,造成PSA降解和分子量降低。
我们在利用发酵法生产PSA时,发现在后期营养不足、细胞停止生长后,PSA分子量急剧下降且PSA产量也减少,这给在PSA生产过程中获得稳定可靠的PSA分子量提出重要挑战。本实验主要研究乙酸和钾离子强度对PSA发酵过程中分子量变化的影响,可为PSA发酵生产提供指导。
1 材料与方法
1.1菌株与培养基
大肠杆菌K235(保藏号CCTCC M208088),由江南大学糖化学与生物技术教育部重点实验室保藏。
固体培养基(g/L):NaCl 5,胰蛋白胨10,牛肉膏3,酵母粉2,琼脂20,pH 7.2~7.4(灭菌前)。
一级种子培养基(LB培养基,g/L):NaCl 10,胰蛋白胨10,酵母粉5,pH 7.0(灭菌前)。
二级种子培养基(g/L):NaCl 5,胰蛋白胨10,牛肉膏3,酵母粉2,pH 7.2~7.4(灭菌前)。
发酵培养基 (g/L):山梨醇40,(NH4)2SO44.94,K2HPO4蛋白胨1.5,MgSO40.9,pH 7.8(灭菌前)。
上罐培养基(g/L):山梨醇40或20,(NH4)2SO44.94,K2HPO45,胰蛋白胨1.5,MgSO40.9,pH 7.8(灭菌前)。
1.2培养方法
种子制备:用接种环从培养12 h的琼脂平板挑取单菌落,接种在装有10 mL的LB培养基(50 mL三角瓶),置于摇床中,于37 ℃、200 r/min培养12 h。之后,按5%的接种量接种于500 mL带挡板的三角瓶中(二级种子培养基,装液量为50 mL),于37 ℃、200 r/min培养12 h。
摇瓶培养:将上述制备好的二级种子培养液按5%的接种量接种到500 mL带挡板的三角瓶中(发酵培养基,装液量40 mL),于200 r/min、37 ℃培养60 h。
发酵罐分批发酵:7 L发酵罐(NBS)装入4 L上罐培养基,接种量为8%,初始山梨醇质量浓度为40 g/L,发酵温度为37 ℃,通气量为1 vvm,搅拌转速为400 r/min,通过流加体积分数为30%的氨水和2 mol/L的HCl溶液控制pH在6.4。
1.3pH控制方式对PSA发酵的影响
在7 L发酵罐中,起始K2HPO4为5 g/L, pH控制方式为发酵前16 h流加体积分数为30%的氨水溶液,后面用2 mol/L KOH控制pH在6.4。实验组A:在16 h一次性流加400 mL的200 g/L的山梨醇溶液,从16 h后每隔5 h(即发酵16,21,26,31,36 h)流加10 mL的120 g/L的胰蛋白胨溶液以补充不流加氨水造成的氮源减少情况。实验组B:其他情况和对照组一样,分别在16h和24 h一次性流加200 mL的包含有200 g/L的山梨醇和15 g/L的胰蛋白胨溶液。
1.4分析方法
菌体浓度的测定:测定发酵液OD600值,根据OD600吸光度与细菌干重的标准曲线计算菌体浓度,1.0 OD600相当于0.4 g/L细菌的干重。
聚唾液酸浓度的测定采用间苯二酚-盐酸法[13]。聚唾液酸平均聚合度的测定采用荧光法[14]。采用水杨酸钠-次氯酸钠的比色法测定发酵液中的(NH4)2SO4的浓度[15]。
碳源和有机酸含量的测定:采用HPLC法,使用岛津高效液相色谱进行测定。利用高效液相色谱仪(LC-2010A,岛津)测定,色谱柱为 Aminex HPX-87H(9μm,300 mm×7.8 mm,Biorad);流动相为5 mmol/L 硫酸;流动相流速为0.6 mL/min;示差检测器;柱温35 ℃;进样量10 μL[16]。
2 结果与分析
2.1不同碳源代谢对PSA合成及过程分子量变化的影响
聚唾液酸发酵生产主要利用大肠杆菌K1株及其衍生的K235株,文献报道主要利用山梨醇、葡萄糖和木糖为碳源进行PSA发酵[17]。研究发现,不同碳源、氮源的组合会显著影响PSA的合成[17]。利用不同碳源时,发酵液中有机酸有很大不同,如以木糖为碳源时会产生大量丙酮酸,而利用葡萄糖时则产生大量乙酸,并在利用木糖和葡萄糖的发酵液中甚至检测到唾液酸单体,推测PSA可能受有机酸影响降解[18]。为探索不同碳源条件下发酵过程的PSA分子量变化情况,分别以山梨醇、葡萄糖和木糖为唯一碳源在7 L发酵罐进行PSA发酵,结果如图1所示。以山梨醇为碳源的发酵作为对照,发现E.coliK235都可以利用这些碳源并合成PSA;其中以木糖为碳源时,生物量最高为13.0 g/L,以山梨醇、葡萄糖为唯一碳源时,生物量分别为10.4 g/L和6.3 g/L。在以山梨醇为碳源时,PSA产量最高为1.96 g/L;以葡萄糖和木糖为碳源时,PSA的最高产量分别仅为0.72 g/L 和0.89 g/L。在以山梨醇为碳源时PSA的最高分子量为53.2 kDa,而以葡萄糖和木糖为碳源时,最高PSA分子量分别为10.1 kDa和13.2 kDa,发酵40h后分子量和PSA产量迅速下降。
发酵过程产生的乙酸如图1D所示,可以看出,以葡萄糖作为碳源时,大肠杆菌整个生长过程中乙酸的含量都比其他两种碳源要高,最高可以达到150.3 mmol/L,这与GREGORY等人的结论是一致的[19]。以木糖作为碳源时,乙酸的含量最低,最高只有10.0 mmol/L,但是实验中检测到较高浓度丙酮酸(最高可以达到54.2 mmol/L)。而以山梨醇为碳源时,乙酸随着发酵过程逐渐升高,在20 h补入20 g/L山梨醇后乙酸迅速下降,之后又逐渐升高,最高可达109.6 mmol/L。在已有PSA发酵报道中,大部分发酵过程使用pH控制在中性或弱酸性(6.4~7.0)。因为发酵过程产酸造成发酵液pH下降,而PSA在酸性条件下容易降聚,使分子量下降[18]。从图1可以看出,随着有机酸的积累,后期PSA分子量迅速下降。PSA在碱性条件下相对稳定,ZHENG等控制pH为7.4,能避免有机酸对分子量的影响,提高PSA分子量到260 kDa[9],但是pH控制在偏碱性会抑制菌体生长,PSA产量有所下降。

A:山梨醇; B:葡萄糖;C:木糖;■DCW;●PSA;▲分子量;○碳源pH控制在6.4,初始碳源20 g/L,20 h流加碳源20 g/L图1 以山梨醇、葡萄糖和木糖为碳源的PSA发酵过程曲线Fig.1 Time course of PSA fermentation with sorbitol, glucose or xylose as sole carbon source
2.2乙酸胁迫对PSA生物合成及过程分子量的影响
为了进一步探索有机酸对PSA合成和分子量的影响,在摇瓶发酵0 h和12 h(对数中期)分别添加不同浓度的乙酸,考察外源乙酸胁迫对PSA发酵的影响。如图2A所示,在0 h添加不同浓度的乙酸后,菌体生长受到抑制,在添加超过90 mmol/L的乙酸时菌体不生长,而添加30 mmol/L和60 mmol/L乙酸时,PSA合成和分子量明显下降。在培养12 h后添加乙酸,结果如图2B所示。同样乙酸添加超过90 mmol/L时;则菌体生长完全受抑制,乙酸添加超过60 mmol/L时PSA合成量很少;而添加30 mmol/L乙酸时,虽然PSA产量接近1.5 g/L,但是其分子量低于20 kDa。 这表明在发酵过程中加入乙酸,会严重干扰菌体生理活性,影响PSA合成和分子量;而在一开始添加60 mmol/L乙酸时,细菌通过延滞期调整适应,菌体能够生长并合成PSA,但是分子量下降不少。因此,在PSA发酵过程中,尽量控制乙酸生成则有利于PSA积累和PSA分子量(聚合度)增加,如CHEN等[10]以葡萄糖为碳源时,控制葡萄糖在1.0 g/L以避免有机酸产生,最终达到较高PSA浓度。
2.3不同浓度磷酸氢二钾对PSA发酵过程及分子量的影响
PSA在酸性条件下唾液酸上羧基解离形成电负性,造成整条PSA长链相互排斥,长链也容易受到H+的攻击而降解;PSA在碱性条件下则相对稳定,容易形成内酯增强稳定性[20]。在一定浓度的聚唾液酸溶液中,加入20~50 mmol/L K2SO4溶液和10~25 mmol/L K2HPO4溶液进行溶解,采用端基法测定PSA分子量[21]时发现,PSA数均分子量增大5~8倍。由于端基法是测定还原端唾液酸单体含量,由此推测:一定浓度K+正电荷能够掩蔽PSA上解离的-COO-,使PSA部分失去电负性而扭曲聚集,造成还原端唾液酸测定量减少。叶进富等[22]认为,溶液中无机盐的加入将改变带电微粒周围的离子分布从而影响Zeta电位。采用Zeta电位测定也发现在一定浓度K+的时候,PSA溶液Zeta电位增大(数据未显示),表明PSA分子溶液行为发生变化。而K+浓度过高时,则PSA则可能都带上正电荷,又形成PSA链相互的排斥性,端基法测定分子量时又和不添加K+时一样。
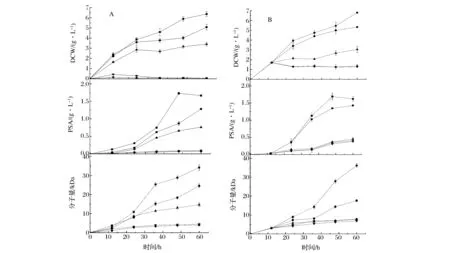
摇瓶发酵A: 起始培养基添加乙酸-B: 发酵12 h 添加乙酸 ■ 0 mmol/L 乙酸;● 30 mmol/L 乙酸;▲ 60 mmol/L 乙酸;▼ 90 mmol/L 乙酸;◆ 120 mmol/L 乙酸图2 乙酸添加对聚唾液酸发酵过程的影响Fig.2 Effect of acetateaddition on PSA fermentation

(7L 发酵罐中培养基添加 ■ 2.5 g/L,● 5.0 g/L,▲ 10.0 g/L K2HPO4 )图3 K2HPO4 浓度对聚唾液酸发酵的影响Fig. 3 Effect ofdifferent K2HPO4 concentration on PSA fermentation
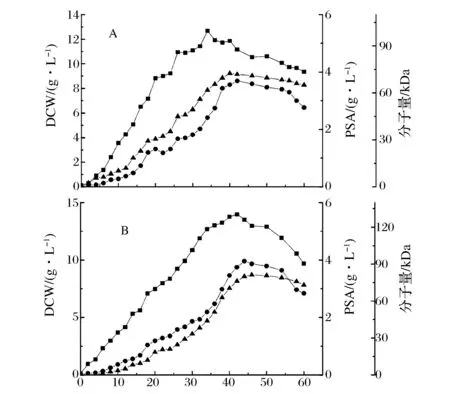
实验组A:山梨醇补料/分次添加胰蛋白胨;实验组B:两次补料山梨醇-胰蛋白胨;图例:■ DCW,● PSA,▲ MW图4 氨水和KOH溶液组合流加控制pH对聚唾液酸合成和分子量的影响Fig.4 Effect of pH control with combination of ammonia water and KOH feeding on PSA fermentation
以往研究在摇瓶都使用90~100 mmol/L的K2HPO4进行PSA发酵,后来在发酵罐上采用pH控制后可以降低K2HPO4用量到2.5 g/L (10 mmol/L)[23]。但是这些研究没有分析不同K2HPO4浓度下PSA的分子量变化。因此,我们在7 L发酵罐水平上,分别采用不同起始K2HPO4浓度进行PSA发酵,结果如图3所示。在添加5.0 g/L K2HPO4的条件下,菌体的生物量可以达到11.9 g/L,聚唾液酸含量可以达到2.2 g/L,分子量最高可以达到52.3 kDa。添加2.5 g/L和10 g/L的 K2HPO4的PSA合成、分子量和生物量都比5 g/L K2HPO4发酵的参数低。尤其是分子量, K2HPO4为2.5 g/L时,PSA最高分子量仅为20 kDa左右。如同前期预实验结果,溶于20 mmol/L(5.0 g/L)K2HPO4能够改变PSA分子的溶液行为,同时也提高发酵过程的PSA分子量和发酵过程稳定性。
2.4pH调控方式对PSA合成及发酵过程分子量的影响
由于K+存在可能影响PSA合成和发酵过程聚唾液酸分子量稳定性,因此在7 L发酵罐中,将氨水流加控制pH模式改成两阶段,即前18 h用体积分数30%的氨水控制pH,后期采用KOH溶液控制pH在6.4,并且在补料液中加入一定量胰蛋白胨以弥补不流加氨水可能造成的氮源不足,结果如图4所示。以图1A为对照,在起始 K2HPO4为5.0 g/L并后期用KOH流加进行pH控制补入K+后,2个实验组的聚唾液酸分子量在发酵40 h之后较为稳定,没有迅速下降,2组数均分子量在70~80 kDa之间;聚唾液酸含量在3.8~4.0 g/L之间,也稳定10 h左右,没有迅速下降;最高菌体干重在13~14 g/L之间,变化不是太大。因此,可以看出,相比对照组(图1A)中PSA合成和分子量在后期迅速下降,通过后期流加KOH溶液,强化发酵液中K+浓度,通过增强聚唾液酸的稳定性来提高分子量。
在可以合成聚唾液酸的E.coli中,控制聚唾液酸合成及后期转运的基因主要位于kps基因簇中,它由3个区域组成。据STEENBERGEN等[24]报道,第2个区域中的neuDBACES基因可以用于唾液酸的合成、活化、聚合和可能的异位作用,其中neuS基因可以合成聚唾液酸转移酶,使聚唾液酸长链达到延伸的目的,从而形成一定聚合度的聚唾液酸长链而转运到细胞外膜。但是,针对PSA的链长控制机理上,还没有分子生物学上的假设和结论。另外,大肠杆菌K1或K235都是来源于尿道的致病菌,其合成的PSA是大肠杆菌致病因子,在入侵宿主时候起到“模拟”作用而逃避宿主的攻击。一般情况下尿道含乳酸菌等,环境成酸性,不利于大肠杆菌K1生长或合成PSA。而实际情况是,尿道中渗透压较高,K+/Na+等正离子的存在另一方面也有利于PSA合成和稳定性,因此这里涉及环境H+与K+/Na+等离子之间的平衡关系。在应用此类大肠杆菌生产PSA时,应该尽量避免有机酸的积累,采用碱中和,同时适当提高发酵液的K+/Na+等离子浓度,这样可以达到稳定PSA产量和分子量的效果。我们也发现,PSA保存于水溶液中很容易发生降聚,而以固体钠盐或钾盐形式存在有利于长久保存。另外,当PSA用作生物材料时,为了维持PSA的稳定性,可以考虑在系统中加入K+/Na+等离子,以避免PSA受到水溶液中质子的攻击而降解。
3 结论
微生物代谢碳氮源形成有机酸积累,影响PSA合成和分子量,尤其是乙酸积累产生胁迫作用影响较大。适合浓度的K2HPO4有利于促进PSA合成和分子量的提高,但是细胞停止生长后PSA产量和分子量迅速下降;通过氨水和KOH溶液组合两阶段流加控制pH方式补入适量K+,使得在发酵后期PSA产量和分子量不会急剧下降,表明一价正电荷的K+对维持PSA稳定性具有促进作用。
[1] FERRERO M, APARICIO L R. Biosynthesis and production of polysialic acids in bacteria [J].Appl Microbiol Biotechnol,2010, 86(6):1 621-1 635.
[2] KISS J Z N, ROUGONT G. Cell biology of polysialic acid [J].Current Opinion in Neurobiology,1997,7(5):640-646.
[3] 王欣,关锋.多聚唾液酸(PSA)及其修饰的神经粘附分子(PSA-NCAM)对肿瘤及细胞信号通路的影响[J].遗传,2014,36(8): 739-746.
[4] CIESLEWICZ M, VIMR E. Reduced polysialic acid capsule expression inEscheichiacoliK1 mutants with chromosomal defects in KpsF[J].Molecular Microbiology,1997,2(26):237-249.
[5] GREGORIADIS G, MCCORMACK B, Wang Z, et al. Polysialic acids: potential in drug delivery [J].FEBS Letters,1993,315(3): 271-276.
[6] FERNANDES A I, GREGORIADIS G. Polysialylated asparaginase: preparation, activity and pharmacokinetics [J].Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology,1997,1 341(1):26-34.
[7] 卢绍曾,吴剑荣,朱莉等.聚乙二醇聚唾液酸嵌段聚合修饰尿酸酶[J].生物加工过程,2015(2):86-92.
[8] 付浩,冯昌雨,詹晓北等.聚唾液酸-透明质酸接枝聚合物的合成及其在药物缓释载体中的应用[J].合成化学,2016(7):570-575.
[9] ZHENG Zhi-yong, WANG Shun-zhi, LI Guo-shun, et al. A new polysialic acid production process based on dual-stage pH control and fed-batch pH control and fed-batch fermentation for higher yield and resulting high molecular weight product [J].Appl Microbiol Biotechnol,2013,97(6):2 405-2 412.
[10] CHEN Fang, TAO Yong, JIN Cheng, et al. Enhanced production of polysialic acid by metabolic engineering of Escherichia coli [J]. Biotechnological Products and Process Engineering, 2015,99(6):2 603-2 611.
[11] 闫霞,吴剑荣,郑志永等.大肠杆菌K235能量代谢扰动影响聚唾液酸合成的研究[J].生物技术通报,2015,31(9):209-217.
[12] MOHLENHOFF M,ECKHARDT M, GERARDY-SCHAHN R. Polysialic acid:three-dimensional structure,biosynthesis[J]. Current Opinion in Structural Biology,1998,8(5):558-564.
[13] SVENNERHOLM L. Quantitative estimation of silalic acid: a colorimetric rescorcinol-hydrochloruc acid [J].Biochimica Et Biophysica Acta, 1957,24(3):604-611.
[14] MARKELY L R A, ONG B T, HOI K M, et al. A high-throughput method for quantification of glycoprotein sialylation[J]. Analytical Biochemistry,2010,407(1):128-133.
[15] 张佳程,骆承庠,张丽娟.水杨酸钠-次氯酸钠比色法测定食品中总凯氏氮的研究[J].中国农业科学,1999(1):85-88.
[16] 姜岷,雷丹,陈可泉等.纤维素水解液厌氧发酵产丁二酸发酵液中有机酸和混合单糖的测定[J].分析化学,2009,37(4):605-608.
[17] RODE B, ENDRES C, RAN C, et al. Large-scale production and homogenous purification of long chain polysialic acids fromE.coliK1 [J]. Journal of Biotechnology, 2008, 135(2):202-209.
[18] MANZI A E, HIGAS H H, DIAZ S, et al. Intramolecular self-cleavage of polysialic acid[J]. The Journal of Biowgical Chemistry, 1994,38(269):23 617-23 624.
[19] LULI G, WILLIAMR S. Comparison of growth,acetate production,and acetate inhibition ofEscherichiacolistrains in batch and fed-batch fermentations[J].Applied and Environmental Microbiology,1990,4(56):1 004-1 011.
[20] ZHANG Y, LEEY C. Acid-catalyzed lactonization of α-2,8-linked oligo/polysialic acids studied by high performance anion-exchange chromatography [J].The Journal of Biological Chemistry,1999,10(274):6 183-6 189.
[21] 李国顺,郑志永,李丹,等.端基法测定聚唾液酸平均聚合度[J].工业微生物,2012, 42(5): 19-23.
[22] 叶进富.蛋白质zeta电位与离子交换层析分离的相关性研究[D].杭州:浙江大学,2006.
[23] 刘金龙.微生物发酵法制备聚唾液酸的研究[D].无锡:江南大学,2013.
[24] STEENBERGEN S.M,VIMR E.R.Mechanism of polysialic acid chain elongation inEscherichiacoliK1[J].Molecular Microbiology,1990,4(4):603-611.
Effectofacetateandpotassiumionicstrengthonpolysialicacidsynthesisandmolecularweightchangeinfermentationprocess
FU Xu-dong, WU Jian-rong*, JIANG Yun, MA Xu ,ZHENG Zhi-yong, ZHANG Li-min, ZHAN Xiao-bei
(Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122,China)
Polysialic acid (PSA) belongs to group II extracellular polysaccharide produced byEscherichiacoliK235. Previous studies have shown that the accumulation of organic acids in the fermentation broth, pH control mode and K2HPO4have a great influence on the biosynthesis and molecular weight of polysialic acid. In this study, we found that the accumulation of organic acids and exogenous acetic acid addition reduced the production and molecular weight of polysialic acid. Compared with the 100 mmol/L K2HPO4required for shake flask cultivation, 20 mmol/L K2HPO4could obtain higher molecular weight and yield of polysialic acid in fermenter. After 16 h of fermentation, the ammoniawater was switched to KOH feeding to control the pH, and the appropriate amount of tryptone was added as the organic nitrogen source. As a result, the production of polysialic acid was increased and the molecular weight and yield of PSA remained stable. Results from this study can provide a good hint for industrial scale production of PSA with stable molecular weight.
Escherichiacoli; ploysialic acid; acetic acid; K+; molecular weight
10.13995/j.cnki.11-1802/ts.013824
硕士研究生(吴剑荣副教授为通讯作者,E-mail: kinowu@jiangnan.edu.cn)
国家“863”计划项目(2012AA021505)
2017-01-13,改回日期:2017-03-09
