啤酒污染菌的鉴定及其细胞膜脂肪酸的组成分析
2017-09-03邱然陆健
邱然,陆健
(江南大学生物工程学院, 工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
研究报告
啤酒污染菌的鉴定及其细胞膜脂肪酸的组成分析
邱然,陆健*
(江南大学生物工程学院, 工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
从纯生啤酒中富集分离得到11株啤酒污染菌。对这11株菌进行16S rRNA同源性分析和系统发育树构建。结果表明:11株菌均属于乳酸杆菌,分属于植物乳杆菌(Lactobacillusplantarum)、类布氏乳杆菌(Lactobacillusparabuchneri)和乳酸短杆菌(Lactobacillusbrevis)3个种。进一步对11株菌的膜脂肪酸组成进行分析,其脂肪酸组成变化规律与16S rRNA进化分布高度一致。将BN01、BN02和BN03号菌接种到不同程度啤酒环境胁迫的培养基中,发现随着啤酒成分增加,菌的膜不饱和直链脂肪酸和链长18和20碳的脂肪酸含量增加。该研究结果不仅对啤酒污染菌进行了分类鉴定,而且阐述了基于膜脂肪酸调控的污染菌膜对啤酒环境胁迫的耐受机制。
啤酒;啤酒污染菌;乳酸杆菌;鉴定;脂肪酸
啤酒中含有酒花浸出物质、乙醇、高浓度CO2及低pH、低量溶氧和一定的营养物质,大多数微生物不能在啤酒环境中进行理想的生长繁殖[1]。但是有一些微生物能够适应啤酒中的环境,并进行正常的生长代谢,这些微生物是啤酒污染菌[2]。啤酒污染菌是一类厌氧或兼性厌氧的微生物,其中乳酸菌是啤酒污染菌中最常见的微生物,大约占啤酒污染菌的80%[3]。这些乳酸菌在啤酒中滋生会影响啤酒风味和生物稳定性,如啤酒变酸、产生杂异味、浑浊、沉淀和产生菌膜等,从而降低了啤酒的可饮用性,缩短了啤酒货架期[4]。
乳酸菌污染啤酒的前提是它能够对啤酒环境的胁迫具有适应能力。细胞膜是微生物与外界环境接触和敏感部位,其脂肪酸组成与细胞适应环境胁迫密切相关[5]。啤酒污染菌的抗酒花蛋白(HopA、HopB、HopC和HitA)和调控酸胁迫相关蛋白(H+-ATPase)都位于细胞上,膜脂肪酸组成能够调控其活性,进而影响啤酒污染菌的抗酒花和耐酸性能[6]。另外,研究发现乳酸菌膜脂肪酸组成在其耐受乙醇胁迫和酸胁迫方面也起到重要的调控作用[7-8]。因此本研究从市售纯生啤酒富集分离啤酒污染菌,运用16S rRNA基因序列分析方法在分子生物学水平上对所分离菌株进行鉴定。然后对不同啤酒污染菌细胞膜的脂肪酸组成进行分析,并进一步研究啤酒环境胁迫对啤酒污染菌膜脂肪酸组成的影响,最终阐明啤酒污染乳酸菌对环境胁迫的适应性及其调控机理, 进而为啤酒污染菌的检测、评价和控制提供理论依据。
1 材料与方法
1.1材料
1.1.1 实验原料
市售5个品牌共60瓶瓶装(500 mL)纯生啤酒,用于啤酒污染乳酸菌的分离。
1.1.2 培养基
MRS培养基:购于青岛海博生物技术有限公司。NBB培养基(%):葡萄糖1.5,麦芽糖1.5,酪蛋白胨0.5,酵母浸粉0.5,牛肉膏0.2,乙酸钾0.6,磷酸氢二钠0.2,L-半胱胺酸盐酸盐0.02,L-苹果酸0.05,琼脂2;Tween-80 0.05 ,氯酚红0.0022 ,m(啤酒)∶m(蒸馏水)=1∶1,pH 5.8。
1.1.3 菌株
乳酸短杆菌ATCC367:来源于青贮,购于中国普通微生物菌种保藏管理中心(CGMCC)。
啤酒酵母w-34/70:由江南大学生物工程菌种保藏中心提供。
1.2试验方法
1.2.1 纯生啤酒理化分析
啤酒脱气:旋转振荡法[9];pH检测:运用梅特勒酸度计检测脱气啤酒pH;乙醇浓度:顶空进样气相色谱法检测[9];啤酒苦味值:参考文献[9]。
1.2.2 啤酒污染菌的分离纯化
在无菌条件下,将每瓶纯生啤酒(500 mL)用超滤膜(直径10 cm,孔径0.22 μm)进行过滤,然后将滤膜倒置于NBB固体培养基上,30 ℃恒温培养48 h,揭开超滤膜,将平板上单菌落转接至NBB斜面上,于4 ℃进行保藏。
在Whitley A35厌氧工作站中进行厌氧菌筛选,包括纯生啤酒过滤、培养和NBB培养基穿刺保藏。
1.2.3 啤酒污染菌理化鉴定
污染菌啤酒腐败能力鉴定参考文献[10];显微形态观察,革兰氏染色和过氧化氢酶活性参考文献[11];乳酸检测运用高效液相色谱法参考文献[11]。
1.2.4 16S rRNA序列与菌株鉴定
[11]。
1.2.5 细胞膜脂肪酸组成检测[7,12]
(1)菌体培养
将啤酒污染菌接种到MRS培养基中,30 ℃恒温静止培养,在稳定前期收集菌体,取一定量混匀发酵液,在4℃条件下8 000 r/min离心10 min,去离子水洗涤2遍,收集菌体,然后对其膜脂肪酸组成进行检测。
(2)细胞膜脂肪酸提取
取约1 g的菌体,加入7 mL甲醇氯仿(2∶1,v/v)混合溶液。室温条件下旋涡2 h,迅速置于4℃条件下放置24 h,取出后在4℃条件下6 000 r/min离心10 min,收集上清液备用;沉淀用3.75 mL甲醇氯仿水(2∶1∶0.8,体积比)混合溶液润洗,在4℃条件下6 000 r/min离心10min,收集上清液备用。将前面两次离心所得上清液合并,在其中加入5 mL、4℃预冷的水氯仿(1∶1,v/v)转换为双向体系。用移液管移出氯仿(下相),此相包括细胞膜脂,迅速氮吹蒸发溶剂,获得约50 μL的细胞膜脂,迅速加入1 mL(4℃)预冷的氯仿甲醇(1∶1,v/v)混合溶液,样品于-20℃保存备用。
(3)脂肪酸甲酯化
将所得细胞膜脂肪酸样品重新氮吹,蒸发除去氯仿:甲醇混合溶液,加入3 mL KOH的甲醇溶液,70 ℃水浴回流5 min。冷却加入1 mL三氯化硼乙醚溶液70 ℃水浴回流5 min,冷却。加入3 mL正己烷提取3次。合并提取液,用甲醇润洗,移除上层溶液,加入饱和NaCl,放置3~5 min,氮气吹干,1 mL正己烷定容,获得脂肪酸甲酯待测样品。
(4)脂肪酸分析
气相色谱分析条件:采用HP-5弹性石英毛细管柱(30 m × 0.25 mm × 0.25 μm),进样口温度250 ℃,载气为高纯氦气,柱流速1 mL/min,柱前压73.0 kPa,柱起始温度70℃,保持2 min,以5℃/min升至230℃,保持20 min,再以5℃/min升至280℃,保持15 min,分流进样1 μL,分流比20∶1。
质谱分析条件:用电子轰击源(EI)分析,电子能量70 eV,离子源温度200 ℃,接口温度250 ℃,选取全程离子碎片扫描(SCAN)模式,质量扫描范围40~650,溶剂延迟3.5 min。
(5)脂肪酸组成分析
细胞膜脂肪酸峰面积总和认为是100%,根据每种脂肪酸峰面积占总峰面积的比例计算脂肪酸的相对质量分数,即:
饱和度和链分支组成分析:直链饱和脂肪酸质量分数总和,直链不饱和脂肪酸质量分数总和,支链饱和脂肪酸质量分数总和,支链不饱和脂肪酸质量分数总和;链长组成分析:不同长度脂肪酸质量分数总和。
1.2.6 啤酒环境胁迫对膜脂肪酸组成的影响
将啤酒污染菌接种到MRS培养基中,30 ℃恒温静止培养48 h,然后用无菌MRS培养基稀释发酵液浓度至OD600=0.2。将稀释发酵液以1%接种量分别接种到培养基M(MRS培养基)、培养基M/B(50% MRS培养基+50%啤酒)和培养基B(啤酒)中,30 ℃恒温静止培养,在对数期和稳定期取一定量混匀发酵液,在4 ℃条件下8 000 r/min离心10 min,去离子水洗涤2遍,收集菌体,然后对其膜脂肪酸组成进行检测。生物量运用MRS平板计数法检测。
2 结果与讨论
2.1啤酒的理化性质
50瓶5个品牌的瓶装纯生啤酒的pH、乙醇浓度和苦味值进行分析,结果见表1。5个品牌的纯生啤酒的pH范围为pH3.9~pH4.2,乙醇浓度范围为2.2%~2.3%和苦味值范围为7.2~8.0。

表1 5个品牌啤酒的理化指标(n=10)
2.2啤酒污染菌的分离纯化
7个菌落从NBB固体培养基从纯生啤酒中被分离出来,然后经过5代划线纯化得到7株啤酒污染菌,编号:BN01~BN07。在厌氧条件下,4株菌被分离出来,编号:ABN01~ABN04。这11株菌均能引起啤酒明显浑浊,说明这些菌是啤酒腐败菌。另外,这11株菌均表现为短杆状、革兰氏阳性、过氧化氢酶阴性和产乳酸。根据这一结果初步断定这些菌为乳酸菌。
2.3啤酒污染菌的16SrRNA鉴定及系统发育树构建
对上述11株啤酒污染菌进行16S rRNA序列为分子指标进行菌种鉴定。运用NCBI网站中BLAST程序,将所测定的11株菌株的16S rRNA序列,与Genbank数据库中已知细菌的16S rRNA序列进行比较鉴定,寻找与目的基因序列同源性最高的已知分类地位的菌种,结果如表2所示。

表2 啤酒污染菌的16S rRNA序列对比与分子鉴定
一般认为,16S rRNA序列同源大于98%属于同一种。由表2结果可知,这11株啤酒污染菌与基因数据库中已报道的乳酸杆菌属的16S rRNA的同源性匹配性较高,均在98%以上,其中BN01、ABN02和ABN04号菌与植物乳杆菌(Lactobacillusplantarum)同源性最高,BN02号菌与类布氏乳杆菌(Lactobacillusparabuchneri)同源性最高,其余菌(BN03~BN07、ABN01和ABN03)与乳酸短杆菌(Lactobacillusbrevis)同源性最高。
采用Clustal X2.1和MEGA4.1软件进行16S rRNA多序列对比和邻近连接(NJ)分析,构建系统发育树,结果见图1。
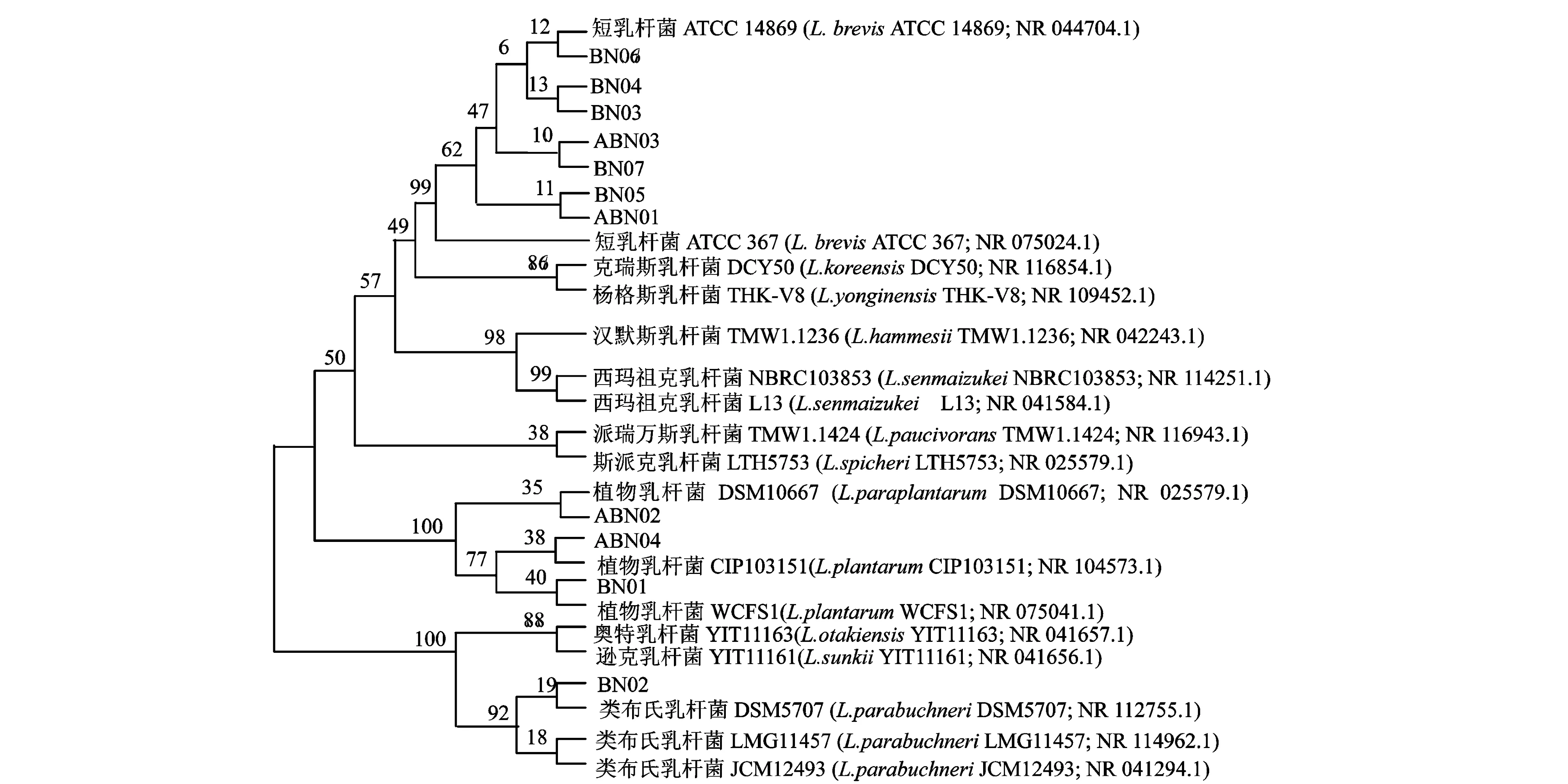
图1 啤酒污染菌16S rRNA序列的系统发育树Fig. 1 Phylogenetic tree based on the homologies of 16S rRNA sequences of beer bacteria
由图1可知,来源于啤酒的污染菌同属于乳酸杆菌属,分属3个不同种。菌株BN01、ABN02和ABN04与植物乳杆菌(Lactobacillusplantarum)WCFS1处于同一分支;菌株BN02与类布氏乳杆菌(Lactobacillusparabuchneri)DSM5707处于同一分支;菌株BN03~BN07、ABN01和ABN03与乳酸短杆菌(Lactobacillusbrevis)ATCC14869和ATCC367处于同一分支。这一结果说明污染菌与不同来源的乳酸菌可能拥有共同祖先,但在不同环境中进化所致。也表明这些乳酸菌可能具有多样的适应机制能够在不同环境胁迫中生存。
这11株菌均为Lactobacillus属。Lactobacillus菌是一类革兰氏阳性,并且是乳酸菌的重要组成部分。在啤酒腐败菌中,Lactobacillus菌被认为是对啤酒生产极具威胁的腐败菌,因为其会对啤酒品质和风味产生不良影响。这一结果与文献报道的多年来世界各地啤酒污染菌绝大部分是乳酸杆菌,70%以上是乳酸短杆菌的结果一致[3]。此次分离得到的11株啤酒污染菌中7株为乳酸短杆菌(L.brevis)。MENZ等[13]从澳大利亚精酿啤酒中分离出45株乳酸菌,其中34株为乳酸短杆菌(L.brevis)。HOLLEROV和 KUBIZNIALCOV[14]研究发现,捷克啤酒的污染菌种62.5%为乳酸短杆菌(L.brevis)。另外,本研究分离得到3株植物乳杆菌(L.plantarum)和1株类布氏乳杆菌(L.parabuchneri)。LIN等[15]会在麦汁、酿造过程或啤酒中检测到植物乳杆菌(L.plantarum)、类布氏乳杆菌(L.parabuchneri)和布氏乳杆菌(L.buchneri)。
2.4细胞膜脂肪酸组成分析
将11株啤酒污染菌在MRS平板上进行划线,30 ℃恒温培养48 h,收集菌体,进行细胞膜脂肪酸提取和脂肪酸甲酯衍生化,然后进行气相色谱分析,并根据饱和度、链分支情况和链长分布等特征进行总结,结果见图2和图3。
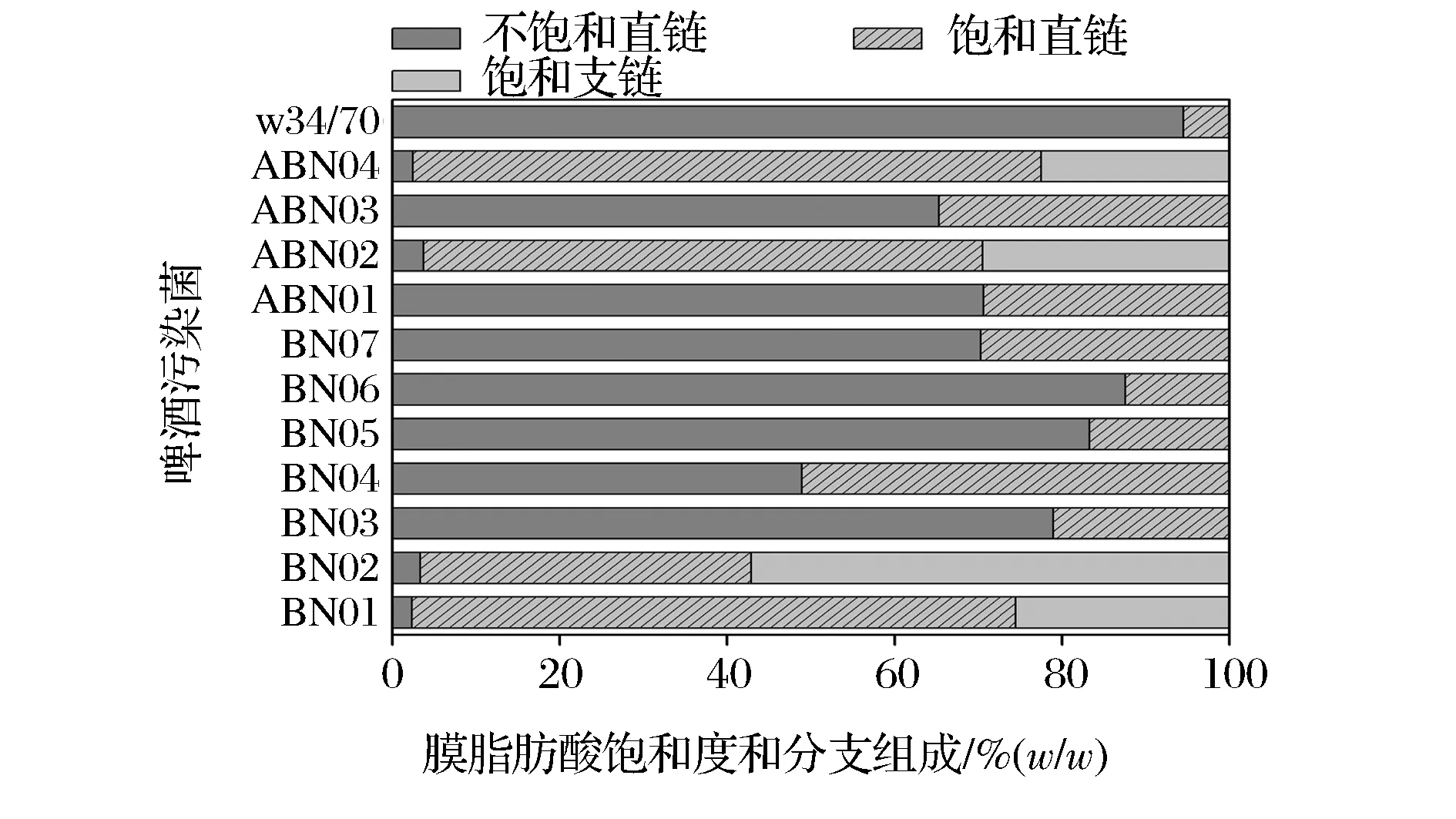
图2 啤酒污染菌细胞膜脂肪酸组成(饱和度和链分支)Fig. 2 Desaturation and branched distribution of membrane fatty acid of beer bacteria
由图2可知,11株菌细胞膜中均含有大量饱和直链脂肪酸,含量从12%到60%,这说明饱和直链脂肪酸在啤酒污染菌的分类及适应环境胁迫方面都是必不可少的成分。但是,这11株啤酒污染菌细胞膜脂肪酸组成(饱和度和链分支)存在显著差异。11株菌膜脂肪酸的饱和度和链分支情况大致可分为2大类,其中以BN03~BN07、ABN01、ABN03号菌为一类,含有不饱和直链和饱和直链脂肪酸,两者比例从86∶12到46∶48。另外,以BN01、BN02、ABN02和ABN04为另一类,与第一类相比,这2株菌不饱和直链脂肪酸含量明显降低,出现比例较高的饱和支链脂肪酸,含量分别为21.18%和53.29%。酿酒酵母菌的不饱和直链脂肪酸含量高达94.5%,饱和直链脂肪酸含量为4.9%,这一比例与污染乳酸菌具有明显的区别。

图3 啤酒污染菌细胞膜脂肪酸组成(链长)Fig. 3 Chain length distribution of membrane fatty acid of beer bacteria
图3表示11株啤酒污染菌细胞膜脂肪酸的链长分布。这些菌中含有链长为C14到C20的脂肪酸,但组成上存在差异,BN03~BN07、ABN01、ABN03号菌的脂肪酸链长组成相对集中。主要含有C16和C18脂肪酸,占总脂肪酸的99%以上。酿酒酵母脂肪酸链长分布与此相似,C16和C18脂肪酸的含量占总脂肪酸97.5%。BN01、BN02、ABN02、ABN04号菌的脂肪酸链长组成相对复杂,BN01、ABN02、ABN04号菌主要是C15和C20占总脂肪酸约50%,C16、C17和C18占约48%。BN02号菌主要是C16和C17占总脂肪酸70%。
结合前文所述,以16S rRNA序列构建的进化树分布为依据来分析脂肪酸组成的变化趋势。根据16S rRNA序列进化树分布可将11株啤酒污染菌分为3类,这与细胞膜脂肪酸组成分类高度一致。脂肪酸是微生物细胞膜重要组成成分,微生物具有其独特的膜脂肪酸指纹图谱,与微生物分子生物学分类具有高度同源性。目前国内外已有将脂肪酸用于微生物分类鉴定的报道[16]。因此,可以通过膜脂肪酸组成对啤酒污染菌进行分离和鉴定,可以缩短检测时间和节省检测经费。
2.5啤酒环境胁迫对细胞膜脂肪酸组成的影响
细胞膜脂肪酸组成会随着细胞环境的变化而发生相应的变化。本研究以BN01、BN02和BN03号菌和乳酸短杆菌ATCC367(分离于青贮)为例,研究其细胞膜脂肪酸对啤酒环境胁迫的响应。将BN01、BN02和BN03号菌分别接种到培养基M(MRS培养基)、培养基M/B(50%MRS培养基+50%啤酒)及培养基B(啤酒)中,ATCC367菌接种到培养基M(MRS培养基)和培养基M/B(50%MRS培养基+50%啤酒)中,然后在对数期和稳定期收集菌体,对其膜脂肪酸组成进行分析及分布规律进行总结,结果见图4和图5。
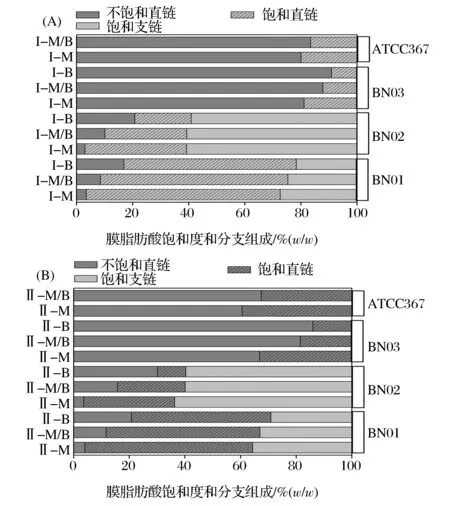
I-M:对数期-培养基M;I-M/B:对数期-培养基M/B;I-B:对数期-培养基B;II-M:稳定期-培养基M;II-M/B:稳定期-培养基M/B;II-B:稳定期-培养基B图4 不同啤酒含量条件下乳酸短杆菌BN03和ATCC367细胞膜脂肪酸组成(饱和度和链分支)Fig. 4 Desaturation and branched distribution of membrane fatty acid of Lactobacillus brevis BN03 and ATCC 367 at different content of beer
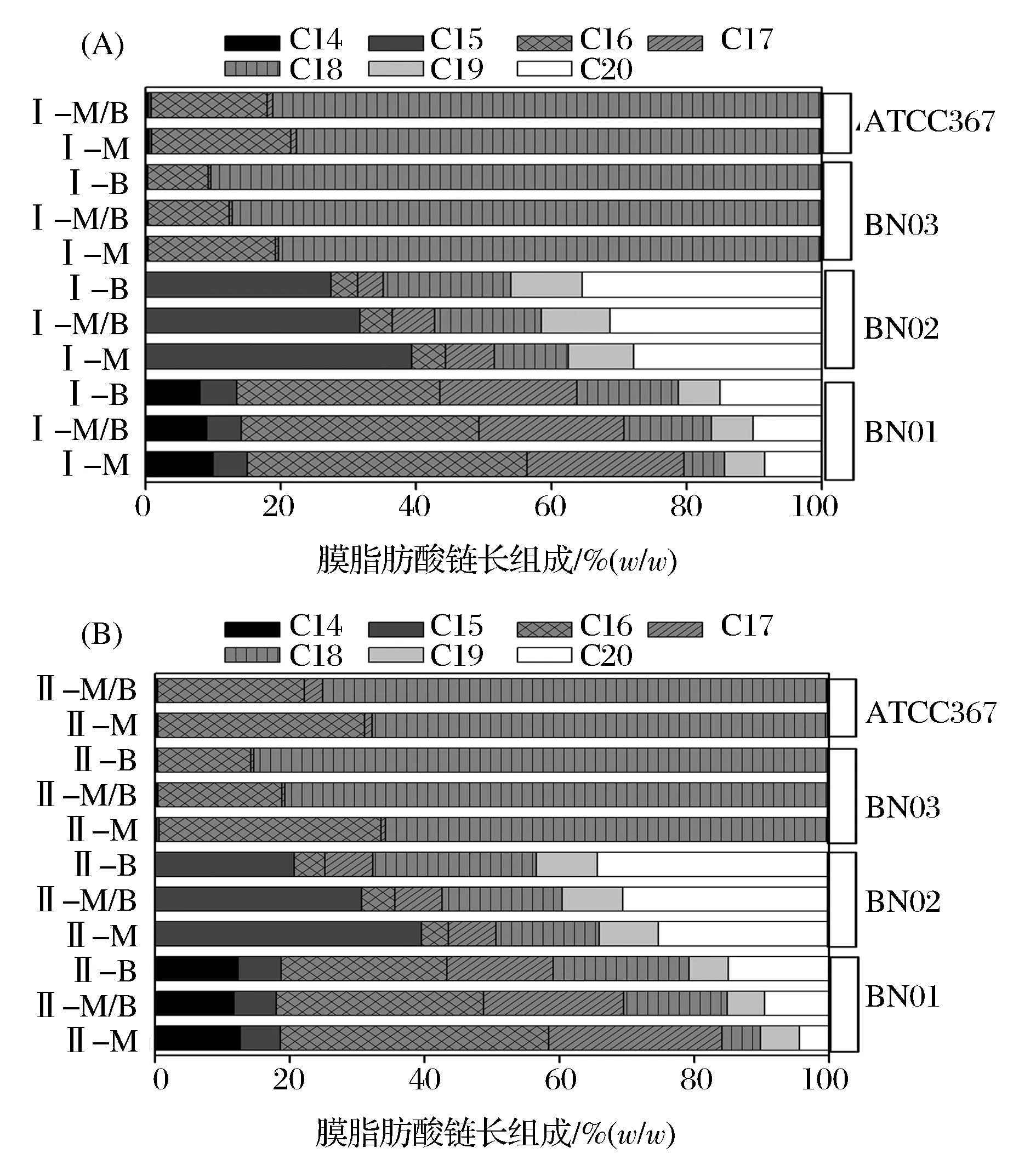
I-M:对数期-培养基M;I-M/B:对数期-培养基M/B;I-B:对数期-培养基B;II-M:稳定期-培养基M;II-M/B:稳定期-培养基M/B;II-B:稳定期-培养基B图5 不同啤酒含量条件下乳酸短杆菌BN03和ATCC367细胞膜脂肪酸组成(链长)Fig. 5 Chain length distribution of membrane fatty acid of Lactobacillus brevis BN03 and ATCC 367 at different content beer
由图4可知,在不同条件下BN01、BN02和BN03号菌膜脂肪酸类型保持不变,含有饱和、不饱和直链脂肪酸和饱和支链脂肪酸,但它们比例发生变化,随着啤酒含量的增加,膜不饱和脂肪酸直链含量逐渐增加,饱和直链和饱和支链脂肪酸含量逐渐降低。这种脂肪酸组成变化在稳定期比对数期更加显著。由此可见啤酒腐败乳酸菌膜不饱和脂肪酸含量增加在适应啤酒环境胁迫方面起到重要作用。
短乳酸杆菌ATCC367与BN03的16S rRNA的同源性匹配达到99%,但ATCC367菌来源于青贮,不具备在啤酒中繁殖生长的能力。达到稳定期,ATCC菌在MRS培养基的生物量(8.14 lg CFU/mL)比BN03菌生物量(8.05 lg CFU/mL)略低;在50%MRS培养基+50%啤酒中,ATCC367菌的生物量(3.54 lg CFU/mL)显著低于BN03菌的生物量(6.39 lg CFU/mL);ATCC菌在啤酒中不能生长繁殖,BN03菌在啤酒中的生物量为5.06 log cfu/mL。ATCC367菌在MRS培养基和50%MRS培养基+50%啤酒中膜脂肪酸组成类型与BN03相似。对数期ATCC367菌在含50%啤酒的MRS培养基中不饱和直链脂肪酸含量比在MRS培养基中升高了4.31%;稳定期分别升高了11.62%。由此结果可知,ATCC367菌膜脂肪酸含量随啤酒含量增加而增加,但是其增加量显著低于BN03菌。这一结果说明啤酒腐败菌膜不饱和脂肪酸的增加范围比非腐败菌较高,这可能是腐败菌适应啤酒环境胁迫的主要原因。
啤酒中含有高浓度乙醇(0.5%~10% vol),酒花苦味质(约17~55 mg/L异α-酸)和pH值呈酸性(3.8~4.7)等环境胁迫条件[17]。这些啤酒环境胁迫对啤酒污染菌膜脂肪酸组成产生了影响。研究发现乳酸菌细胞膜脂肪酸的不饱和度决定了细胞膜的厚度和黏度,进而提高对环境胁迫的适应性[18]。赵文英等[7]研究发现酒酒球菌SD-2a在乙醇胁迫条件下,细胞膜通过调整层膜脂与乙醇平衡,进而抵制由于乙醇在膜上聚集所产生毒性作用。另外,JOBIN等[19]研究发现乳酸菌细胞膜流动性增强可诱导表达膜结合蛋白。因此推测BN03号菌在适应乙醇胁迫环境时,细胞膜流动性增强,诱导膜上胁迫蛋白大量表达,增加了细胞膜中蛋白与磷脂的比例,从而抵抗啤酒中乙醇引起的膜脂无序性的增加。啤酒的低pH值和异α-酸也会对乳酸菌膜脂肪酸组成产生影响。在酸性环境中,细胞膜不饱和脂肪酸数量会随着环境条件变化而发生改变。研究表明,细胞膜脂肪酸组成变化在细胞适应低pH条件方面起到关键作用。酸胁迫可提高细胞膜脂质中不饱和脂肪酸含量,进而增加细胞膜在低pH条件下的正常流动性和生理功能。袁峥等[20]对嗜酸乳杆菌的细胞膜中脂肪酸进行检测,发现随着pH下降,细胞膜单不饱和脂肪酸和长链脂肪酸的含量增加。单不饱和脂肪酸和长链脂肪酸作为“阻渗层”降低H+对细胞膜的渗透[13]。可推测,细胞膜组成变化,尤其是不饱和脂肪酸含量的增加,是乳酸菌适应酸性环境维持正常生理功能的结果。
由图5可知,在不同条件下BN01、BN02和BN03号菌膜脂肪酸链长组成保持不变,但它们比例发生变化,随着啤酒含量的增加,BN01号菌中C18和C20脂肪酸含量增加,C16脂肪酸含量降低,BN02号菌中C18和C20脂肪酸含量增加,C15脂肪酸含量降低,BN03号菌中C18脂肪酸含量增加,C16脂肪酸含量减低。这种脂肪酸链长变化在稳定期比对数期更加显著。对数期ATCC367菌在含50%啤酒的MRS培养基中C18脂肪酸含量比在MRS培养基中升高了4.71%;稳定期分别升高了11.13%。酸胁迫条件下,乳酸菌膜脂肪酸碳链长度增加,使脂肪酸更容易横跨膜双分子层,通过疏水作用与其他脂类和蛋白结合,使脂肪酸链更紧凑,膜环境形成“凝胶状”,增加膜稳定性,进而提高对酸胁迫的适应性[21]。
3 结论
对纯生啤酒中富集分离得到7株啤酒污染菌进行16S rRNA同源性分析和系统发育树构建。这11株菌均属于乳酸杆菌,包括植物乳杆菌(Lactobacillusplantarum)、类布氏乳杆菌(Lactobacillusparabuchneri)和乳酸短杆菌(Lactobacillusbrevis)3个种。
对11株菌的膜脂肪酸组成进行分析,其脂肪酸组成变化规律与16S rRNA进化分布高度一致。将BN01、BN02和BN03号菌接种到不同程度啤酒环境胁迫的培养基中,研究发现随着啤酒成分增加,BN03号菌的膜不饱和直链脂肪酸和链长18和20碳的脂肪酸含量增加。
参考文献
[1] LIN J, CAO Y, SUN J, et al. Monitoring spoilage bacteria and wild yeasts in eastern Chinese breweries [J]. J Am Soc Chem, 2008, 66(1): 43-47.
[2] PREISSLER P, BEHR J, BOGEL R. Detection of beer spoilageLactobacillusbrevisstrains by reduction of resazurin [J]. J Inst Brew, 2010, 116(4): 399-404.
[3] SILVETTI T, BRASCA M, LODI R., et al. Effect of lysozyme on the microbiological stability and organoleptic properties of unpasteurized beer [J]. J Inst Brew, 2010, 116(1): 33-40.
[4] SUZUKI K. 125th anniversary review: microbiological instability of beer caused by spoilage bacteria [J]. J Inst Brew, 2011, 117(2): 131-155.
[5] 李杨,李妍,刘艳,等.不同处理对Lactobacillusdelbrueckiisubsp. Bulgaricus LB 细胞膜脂肪酸的影响[J]. 中国乳品工业,2011,39(8):4-7.
[6] SUZUKI K, IIJIMA K, SAKAMOTO K, et al. A reviw of hop resistance in beer spoilage lactic acid bacteia [J]. J Inst Brew, 2006, 112(2): 173-191.
[7] 赵文英,李华,王华. 乙醇胁迫处理对酒酒球菌SD-2a生理特性的影响[J]. 微生物学通报,2011,35(3):51-57.
[8] 乌日娜,武俊瑞,孟和,等.乳酸菌酸胁迫反应机制研究进展[J]. 微生物学杂志,2007,27(2):62-67.
[9] EUROPEAN BREWERY CONVENTION (EBC). Analytica-EBC [M]. Nürnberg: Verlag Hans Getränke-Fachverlag,2004.
[10] GIL G, DEL MONACO S, CERRUTTI P, et al.Selective antimicrobial activity of chitosan on beer spoilage bacteria and brewing yeasts [J]. Biotechnol Lett., 2004, 26:569-572
[11] 李欣,武俊瑞,田甜,等.大庆自然发酵酸菜中乳酸菌的分离鉴定及耐酸菌株初步筛选[J].食品科学,2014,35(1):150~155.
[12] 李博,DIETRICH M., 李艳,等. 内陆土壤冷适应细菌的筛选分类与细菌膜脂肪酸的适冷机制[J]. 微生物学通报,2010,37(8):1110~1116.
[13] MENZ G, ANDRIGHETTO C, LOMBARDI A, et al. Isolation, identification, and characterisation of beer-spoilage lactic acid bacteria from microbrewed beer from victoria, australia [J]. J Inst Brew, 2010, 116: 14-22.
[14] HOLLEROVA I, KUBIZNIZLCOVA P. Monitoring gram positive bacterial contamination in Czech breweries [J]. J Inst Brew, 2001, 107: 335-358.
[15] LIN J, CAO Y, SUN J, et al. Monitoring spoilage bacteria and wild yeasts in eastern chinese breweries [J]. J Am Soc Brew Chem, 2008, 66: 43-47.
[16] 朱育菁,肖荣凤,王秋红,等. 茄科作物清枯病原菌的脂肪酸鉴定[J]. 植物保护科学,2008,24(8):392~396.
[17] SUZUKI K, ASANO S, LIJIMA K, et al. Sake and beer spoilage lactic acd bacteria—a reviw [J]. J Inst Brew, 2008, 114(3): 209-223.
[18] 吴重德,黄钧,周荣清. 调控乳酸菌酸胁迫抗性研究进展[J]. 微生物学报,2014,54(7):721-727.
[19] JOBIN MP, DELMAS F, GARMYN D, et al. Molecular characterization of the gene encoding an 18-kilodalton small heat shock protein associated with the membrane of leuconostoc oeni [J]. Appl Environ Microbiol, 1997, 63(2): 609-614.
[20] 袁峥. 嗜酸乳杆菌耐酸机理研究[D]. 新乡:河南科技学院,2013.
[21] MYKYTCZUK NCS, TREYORS JT, LEDUC LG, et al. Fluorescence polarization in studies of bacterial cytoplasmic membrane fluidity under environmental stress [J]. Progress in Biophysics & Molecular Biology, 2007, 95(3): 60-82.
Identificationofbeer-spoilagebacteriumandanalysisofitsmembranefattyacidscomposition
QIU Ran, LU Jian*
(The Key Laboratory of Industrial Biotechnology,Ministry of Education,National Engineering Laboratory for Cereal Fermentation Technology,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
A total of 11 strains of beer-spoilage bacteria were isolated from draft beer. The homology of 16S rRNA was analyzed and phylogenetic tree was structured for these 11 beer-spoilage bacteria. These 11 beer-spoilage bacteria were all classified intoLactobacillusgenus, includingLactobacillusplantarum,LactobacillusparabuchneriandLactobacillusbrevis. Variation of beer-spoilage bacteria membrane lipid composition was consistent with the result of 16S rRNA. The contents of straight chain unsaturated fatty acids and C18 and C20 fatty acids of BN01, BN02 and BN03 were increased with increase of beer content. These results not only classified and identified beer-spoilage bacteria but also expound tolerance mechanism of beer environmental stress based on regulation of fatty acids of beer bacteria membrane.
beer; beer-spoilage bacteria;Lactobacillus; identification; membrane fatty acids
10.13995/j.cnki.11-1802/ts.013105
博士研究生(陆健教授为通讯作者,E-mail:jlu@jiangnan.edu.cn)。
863计划(啤酒用新酶创制与低碳制造关键技术研究2013AA102109);江苏高校优势学科建设工程项目
2016-10-08,改回日期:2017-03-27
