鱼皮抗冻多肽的制备及其对冷冻面团热力学性质的影响
2017-09-03孙丽洁张晖王立钱海峰齐希光
孙丽洁,张晖,王立,钱海峰,齐希光
(江南大学 食品学院,江苏 无锡,214122)
研究报告
鱼皮抗冻多肽的制备及其对冷冻面团热力学性质的影响
孙丽洁,张晖*,王立,钱海峰,齐希光
(江南大学 食品学院,江苏 无锡,214122)
以鱼皮明胶为原料酶解制备鱼皮抗冻多肽。以鱼皮抗冻多肽的热滞活性为指标,确定制备鱼皮抗冻多肽的最适蛋白酶及酶解时间,并对获得的鱼皮抗冻多肽的微生物保护活性和对冷冻面团热力学性质的影响进行研究。结果表明,选用木瓜蛋白酶,当底物浓度为30 g/L,加酶量为3 000 U/g,酶解温度为40 ℃,酶解pH为6.0,酶解时间为2 h 时得到的三文鱼鱼皮抗冻多肽 (Salmon skin antifreeze peptide, SaAFP)的THA最高,为0.53 ℃。SaAFP的分子质量主要分布在小于3 000 Da的范围内。对SaAFP溶液的微生物保护活性测定结果表明,添加量为20 mg/mL时大肠杆菌的存活率为75.71%。差示扫描量热法的试验结果表明,SaAFP不仅能降低新鲜面团的冻结温度(Tf),熔融温度(Tm)和可冻结水含量(Fw),且使面团的熔融区间缩小。此外,在冻融循环过程中,SaAFP能显著降低面团中的可冻结水含量,进而提高冷冻面团的品质。
鱼皮;抗冻多肽;热滞活性;冷冻面团;热力学性质
抗冻蛋白 (antifreeze proteins, AFPs),又称冰结构蛋白 (ice structuring proteins, ISPs)或热滞蛋白 (thermal hysteresis proteins, THPs),是一类能提高生物抗冻能力的蛋白质类化合物的总称[1]。它能非依数性降低溶液的冰点,而对熔点影响甚微,熔点和冰点之间的差值称为热滞值(thermal hysteresis, TH),这种性质称为热滞活性 (thermal hysteresis activities, THA)[2]。AFPs具有热滞活性,修饰冰晶形态,抑制重结晶等特性,因而受到食品研究者的广泛关注。
目前,国内外研究者主要从鱼类[3-4]、植物[5-7]、昆虫[8]及菌类[9]中提取得到AFPs。天然分离得到的抗冻蛋白数量极少,成本较高,限制了其在食品工业中的应用前景。而转基因抗冻蛋白在食品应用中的安全隐患又成为广大消费者担忧的焦点。因此获得安全的高活性抗冻蛋白成为抗冻蛋白领域研究的新方向。
胶原蛋白中存在连续的三元重复肽段Gly-X-Y(其中,X多指脯氨酸,Y多指羟脯氨酸),该结构与雪蚤抗冻蛋白的活性结构域相似[10],因此以胶原蛋白为原料制备抗冻多肽具有可行性。有研究表明,胶原蛋白水解液具有抗冻活性[11-12]。鱼皮是鱼类加工过程中的下脚料,富含丰富的胶原蛋白。与传统抗冻蛋白相比,以鱼皮为原料制备抗冻多肽能大大降低生产成本,且产物数量多,可进行大规模生产。
本研究以三文鱼鱼皮为原料,采用热水抽提法提取鱼皮明胶,并选用不同的蛋白酶对明胶进行水解,以热滞活性(THA)为测试指标,选取活性最高的抗冻多肽,并以冷冻面团为研究对象,研究抗冻多肽对冻融面团热力学性质的影响。
1 材料与方法
1.1材料与试剂
三文鱼鱼皮,深圳悦胜贸易公司提供;木瓜蛋白酶(2.33×104U/g),国药集团化学试剂有限公司;碱性蛋白酶(2.74×105U/mL),中性蛋白酶(1.25×105U/mL),诺维信(中国)有限公司;酸性蛋白酶(3.48×104U/g),Spectrum 100~500 Da透析袋,上海源叶生物公司;新良中式面点粉,新乡良润全谷物食品有限公司;大肠杆菌BL21,江南大学生物工程学院提供。
1.2仪器与设备
MP-501A超级恒温循环槽,上海一恒科技有限公司;FE20实验室pH计,梅特勒-托利多仪器(上海)有限公司;T6新世纪型紫外分光光度计,北京普析通用仪器有限公司;SH420消解仪、K9860全自动凯氏定氮仪,济南海能仪器股份有限公司;GR21GⅢ型高速冷冻离心机,日本日立公司;冷冻干燥机,美国Laboconcor公司;DSC8500,美国Perkin Elluer公司;5K5SS型和面机,美国KitchenAid公司; Waters 1525高效液相色谱仪,美国Waters公司。
1.3方法
1.3.1 抗冻多肽的制备
三文鱼鱼皮明胶的提取参照LICHAN等[13]的方法进行。以30 g/L的明胶溶液为底物,分别采用木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、酸性蛋白酶在最适温度和pH下分别酶解30 min,1 h,2 h,3 h,4 h。酶解过程中采用1 mol/L的NaOH(HCl)溶液保持反应体系pH恒定。水解反应终止时沸水浴灭酶10 min,冷却后以8 000 ×g离心15 min,取上清液冷冻干燥后备用。对不同酶解时间不同蛋白酶的酶解液的热滞活性(THA)进行测定,确定最适合的蛋白酶和酶解条件。将活性最高的多肽命名为三文鱼鱼皮抗冻多肽(Salmon skin antifreeze peptides,SaAFP)。
1.3.2 THA的测定
THA的测定参照CAO等[12]的方法并略作修改。将多肽样品配制成20 mg/mL的水溶液。取5 μL的多肽溶液密封于坩埚内,置于DSC中测定抗冻多肽的THA。初始温度为20 ℃,以5 ℃ /min的速率降温至-20 ℃,保持2 min,再以相同的速率升温至20 ℃,保持2 min,根据熔融曲线计算多肽溶液的熔融焓(ΔHm)和熔点(Tm)。接着,以相同的速率降温至-20 ℃,保持2 min,然后以1 ℃ /min的速率缓慢升温至样品呈部分熔融状态,这一温度称为保留温度(Th),保持2 min,再以相同的速率降温至-20 ℃。重复上述过程,选取不同的Th,分别按照公式(1)和(2)计算THA和冰晶含量(φ)。
THA=Th-To
(1)
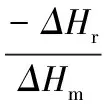
(2)
式中:THA,热滞活性, ℃;Th,保留温度, ℃;To,起始结晶温度, ℃;φ,冰晶含量,%;ΔHr,结晶焓,J/g;ΔHm,熔融焓,J/g。
1.3.3 微生物保护活性测定
SaAFP对微生物的保护活性参照阮功成等[14]的方法进行。
1.3.4 SaAFP分子质量分布的测定
SaAFP分子质量分布参照阮功成等[14]的方法进行。
1.3.5 中式非发酵面团的制作及冻融循环
面团的基本配方:面粉100 g,水50%,热力学特性测定中不添加酵母以减少发酵对测定结果的影响。试验组面团需添加0.5% (w/w)的SaAFP。
部分新鲜面团用于直接测定,部分新鲜面团用于制备冷冻面团和DSC样品。冷冻面团是将新鲜面团迅速放入-40 ℃冰箱中冻结2 h,然后放入-18 ℃的冰箱中冻藏实现的。DSC样品是将新鲜面团放入DSC用坩埚中,密封后迅速放入-40 ℃冰箱中冻结2 h后放入-18 ℃的冰箱中冻藏实现的。
为模拟冻藏过程中的温度波动,对冷冻面团进行冻融处理。一个冻融循环包括25 ℃下解冻1 h,然后将其放入-18 ℃冰箱中冻藏24 h。经冻融循环后的冷冻面团及DSC样品按照冻融循环次数分别编号为C0,C1,C2,C3,C4,C5。
1.3.6 新鲜面团的冻融特性
面团的冻融特性测定参照DING等人[15]的方法并略作修改。具体步骤如下:以空坩埚作为参比,初始温度为20 ℃,以5 ℃ /min的速率降温至-70 ℃,以2 ℃ /min的速率升温至20 ℃。在冻融曲线中读取冻结曲线的峰值温度(Tf),熔融的起始温度(Tm,o)、峰值温度(Tm,p)和终点温度(Tm,c),计算熔融温度区间Tm,δ,并计算可冻结水含量(Fw),计算方法见公式(3):
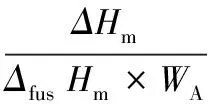
(3)
式中:Fw,面团可冻结水含量;ΔHm,面团的熔融焓,J/g;ΔfusHm,冰的熔融潜热,334 J/g;WA,面团的水分含量,%。
1.3.7 冷冻面团可冻结水含量测定
冷冻面团的可冻结水含量Fw的测定是在DSC样品中进行的,测定方法参照KONTOGIORGOS等人[16]的方法并略作修改。将样品从冰箱中取出迅速放入已预冷至-20 ℃的DSC腔体中,尽量避免水在坩埚表面形成的冷凝。样品放入DSC炉腔后,在-20 ℃条件下保温3 min,以2 ℃ /min的速率升温至10 ℃,从熔融曲线中积分得到熔融焓,并计算Fw。
1.3.8 数据分析
试验数据采用(平均值±标准差)表示。采用Origin8.5软件进行数据统计及图表绘制。采用SPSS 22.0软件进行数据显著性分析。当P<0.05时则认为具有显著性差异。
2 结果与分析
2.1蛋白酶的选择及酶解时间的确定
蛋白酶的种类及酶解时间对酶解产物的影响很大。酶具有专一性,蛋白酶种类不同,其对底物的作用位点不同,酶解产物的结构和功能存在差异。同一种酶经不同的酶解时间得到的酶解产物也不同。因此,本文重点研究不同蛋白酶及酶解时间对酶解物THA的影响,研究结果如图1所示。
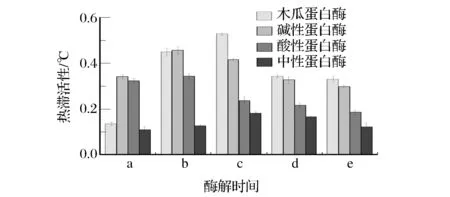
a、b、c、d、e代表的酶解时间分别为30 min,1 h,2 h,3 h,4 h图1 不同蛋白酶不同酶解时间下酶解物的THAFig. 1 Effect of different proteases and hydrolysis time on THA
由图1可知,选用木瓜蛋白酶,在其最适酶解温度(40 ℃)和最适酶解pH(6.0)的条件下,酶解2 h,酶解物的THA值最大,为0.53 ℃。这可能与蛋白酶的酶切位点不同有关。木瓜蛋白酶是一种巯基蛋白酶,可裂解蛋白质和多肽中精氨酸和赖氨酸的羧基端。鱼皮明胶经木瓜蛋白酶酶切后所暴露出来的基团可能更有利于其发挥抗冻活性。
在明胶浓度为30 g/L,木瓜蛋白酶的添加量为3 000 U/g,酶解温度40 ℃,酶解pH为6.0,酶解时间2 h,得到的酶解物的THA测定曲线图如图2。计算不同保留温度Th下,部分熔融溶液再冻结的过程中的起始冻结温度(To)、冰晶含量(φ)及THA,相关数据见表2。从图2中可以看出,随着Th的增大,放热焓增大,在该Th下样品中的冰晶含量逐渐降低。当Th为-0.62 ℃时,可以看出To几乎没有延迟,THA为0.07 ℃。当Th为-0.54 ℃时,样品中冰晶含量降低,THA增大为0.42 ℃。随着Th的升高,当Th为-0.46 ℃时,THA达到最大值0.53 ℃,此时冰晶含量为14.28%。进一步升高Th,溶液全部熔融,在过冷温度下冻结。

图2 SaAFP在不同保留温度下的DSC曲线Fig. 2 DSC curves of SaAFP at various Th
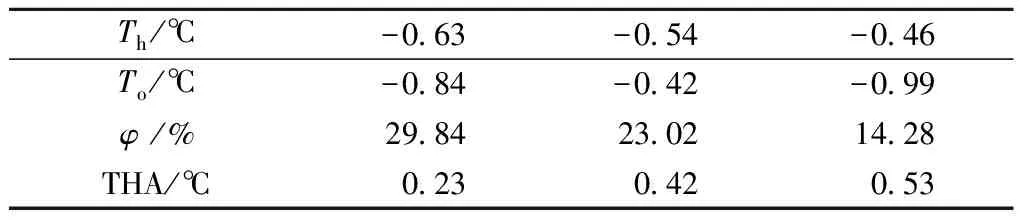
表1 SaAFP的DSC曲线中不同Th下的T0,φ和THA
植物来源的AFPs的THA通常为0.06~0.35 ℃,鱼类为0.2~0.6 ℃,昆虫为0.6~6 ℃[17]。SaAFP的THA高于植物来源的AFPs,与鱼类AFPs相当,低于昆虫AFPs,符合鱼类来源AFPs热滞活性特征。
1.2SaAFP对微生物的低温保护作用
在明胶浓度为3%,木瓜蛋白酶的添加量为3 000 U/g,酶解温度40 ℃,酶解pH为6.0,酶解时间2 h,得到SaAFP,用于微生物低温保护的实验。将稀释倍数为105的大肠杆菌BL21菌液分别加入100 μL 20 mg/mL的SaAFP和蔗糖溶液,以无菌水作为空白对照,-20 ℃冻藏24 h前后分别培养计数,存活率如图3所示。
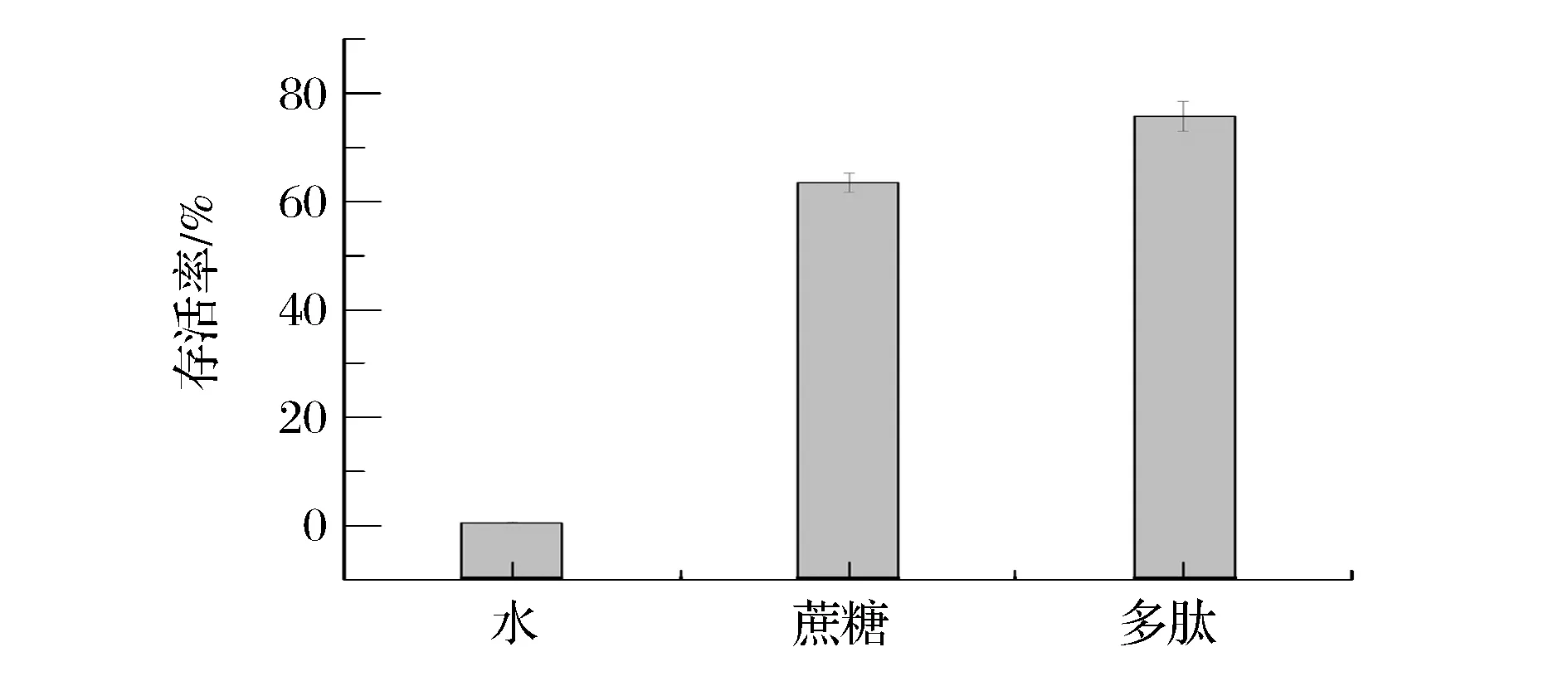
图3 SaAFP对大肠杆菌的低温保护作用Fig. 3 The hypothermia protection effect of SaAFP on the Escherichia Coli
由图3可知,加入无菌水的空白对照组低温处理后大肠杆菌存活率较低,仅为0.61%。添加20 mg/mL的蔗糖溶液,低温处理后大肠杆菌的存活率为63.48%。添加同等浓度的SaAFP溶液,低温处理后大肠杆菌的存活率为75.71%,高于蔗糖溶液。由此可见,SaAFP对大肠杆菌具有很强的低温保护作用。
冷冻过程中的导致细胞损伤的主要因素为胞内冰晶形成和溶液效应[18]。在冻藏过程中,冰晶会在细胞内大量形成,损伤细胞膜,导致细胞死亡。同时冰晶的形成使得细胞质离子浓度提高,导致细胞脱水,影响细胞活性。SaAFP具有抑制重结晶的作用,使得冻藏过程中细胞内的冰晶形成量变少,因此加入SaAFP后大肠杆菌的存活率较高。
2.3SaAFP的分子质量分布
由表2及图4可见,SaAFP的分子质量主要分布于3 000~180 Da,占总酶解物的89.31%。这与DAMODARAN的研究结果一致。DAMODARAN[11]通过Sephadex G-50将酶解物按分子质量分离,并观察每一组分的重结晶抑制作用,发现分子质量低于3 000 Da的组分具有抗冻活性。此外,WANG等人[19]通过Sephadex G-50和SP-Sephadex C-25将酶解物按分子量和带电特性分离,发现分子质量分布在700~1 400 Da的组分具有抗冻活性。
抗冻蛋白通过羟基及疏水相互作用与冰晶表面结合,阻挡冰晶的生长,导致冰晶表面曲率变大,使冰晶表面积增大,冰晶生长状态发生改变,因而冰晶需要在更低的温度下才能生长,从而表现出抗冻蛋白的抗冻活性[20]。 SaAFP的分子质量较低,表现出较强的抗冻活性,可能是因为分子质量较小的肽更容易与冰晶表面结合,使得抗冻活性增强。
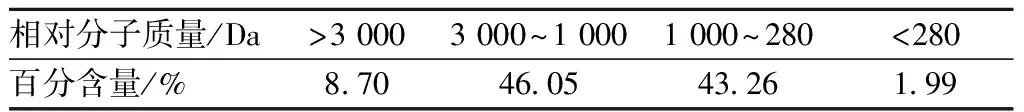
表2 SaAFP分子质量分布
图4 SaAFP分子质量分布图Fig. 4 Molecular weight distribution of SaAFP
2.4SaAFP对新鲜面团冻融特性的影响
新鲜面团的冻融曲线如图5,冻融参数及可冻结水含量见表3。

图5 SaAFP对新鲜面团冻融特性的影响Fig. 5 Effect of SaAFP on the freezing and melting properties of fresh dough

表3 SaAFP对新鲜面团冻融参数及可冻结水含量的影响
注:同列中不同上标字母表示有显著性差异(P<0.05)。
如图5所示,添加SaAFP后,面团的冻结曲线的峰值温度Tf由-9.53 ℃降低到-13.10 ℃,变化显著(P<0.05)。与空白对照相比,SaAFP面团的放热曲线比较平滑。由表3可知,两种面团的熔融起始温度Tm,o,峰值温度Tm,p和熔融区间Tm,δ均有显著性差异(P<0.05)。由于在面团降温过程中DSC曲线容易出现过冷峰(本实验中未检测出过冷峰),通常将面团熔融曲线中的起始熔融温度Tm,o定义为冻结温度。添加SaAFP后,面团的Tm,o由-3.76 ℃降低至-4.31 ℃,与Tf的变化趋势一致。由此可见,SaAFP能降低面团体系的冻结温度。研究表明,面团的熔融区间越窄,说明面团内部形成的冰晶越均匀[21]。SaAFP面团的Tm,δ为3.97 ℃显著低于空白面团,由此可以推断,与空白面团相比,添加SaAFP后面团内部形成的冰晶更均匀。
由表3可以看出,SaAFP面团的熔融焓和Fw显著低于空白面团,这与丁香丽对大麦籽粒抗冻蛋白的研究结果相似[22]。这可能是因为SaAFP与其周围水分子结合,使得该部分水由可冻结状态变为不可冻结状态[23],使得SaAFP面团的Fw降低。
2.5SaAFP对冻融面团可冻结水含量的影响
以冻融5次的面团为例,冷冻面团可冻结水含量测定典型的DSC曲线如图6所示。由图6可以看出,相同的冻藏条件下,添加0.5% SaAFP的冷冻面团熔融区间小于空白面团,且SaAFP面团的DSC曲线面积明显小于空白面团,即SaAFP面团的熔融焓ΔHm小于空白面团的ΔHm。
用DSC测定的冻融面团熔融焓ΔHm,105 ℃恒重法测定的水分含量及计算得到的Fw值如表4所示。由表4可以看出,在相同的冻融次数下,SaAFP面团的ΔHm均小于空白面团,Fw显著低于空白面团。随着冻融次数的增加,面团的熔融焓ΔHm增大,Fw增大。经5次冻融循环后,空白面团的ΔHm由52.88 J/g增大到57.11 J/g,增大了8.0%,SaAFP面团的ΔHm由44.96 J/g增大到47.70 J/g,增大了6.09%;空白面团的Fw由38.70%增大到44.34%,增大了14.57%,SaAFP面团的Fw由32.81%增大到36.66%,增大了11.73%。SaAFP面团的ΔHm和Fw均显著低于空白面团,且在冻融循环过程中,SaAFP面团的ΔHm和Fw的变化比空白面团小。
研究表明,冻藏过程中ΔHm和Fw的增加可能与冰晶重结晶有关,冰晶的重结晶破坏了面团的面筋结构,使得水分析出[24]。试验结果表明,SaAFP不仅能减低面团中ΔHm和Fw的大小,而且能减缓ΔHm和Fw的增加。
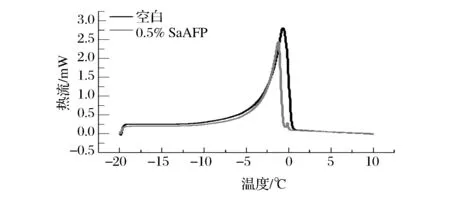
图6 冷冻面团可冻结水含量测定的典型DSC曲线Fig. 6 Typical DSC curves of frozen dough
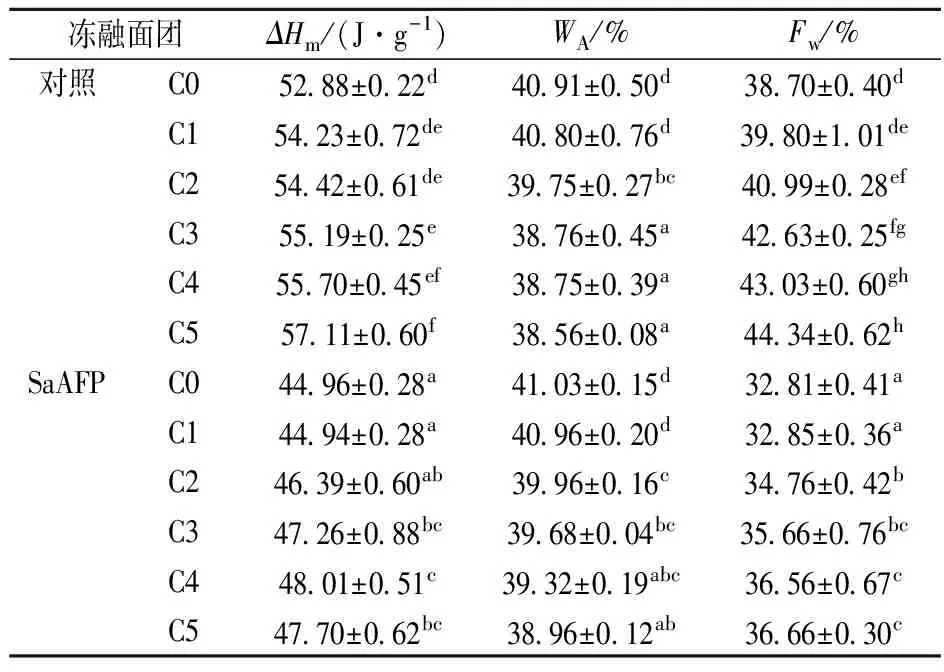
表4 SaAFP对冻融面团可冻结水含量的影响
注:同列中不同上标字母表示有显著性差异(P<0.05)。
3 结论
以木瓜蛋白酶酶解鱼皮明胶制备鱼皮抗冻多肽,当底物浓度为30 g/L,加酶量为3 000 U/g,酶解温度40 ℃,酶解pH 6.0,酶解时间2 h时,得到的混合多肽SaAFP具有最高的THA,为0.53 ℃。在大肠杆菌菌液中添加20 mg/mL的SaAFP溶液,经-20 ℃冻藏24 h后大肠杆菌存活率为75.71%,表明鱼皮抗冻多肽对微生物具有显著的低温保护效果。分子质量分析结果表明,SaAFP的分子质量主要分布在3 000~280 Da。对冷冻面团的研究结果表明,添加0.5%的SaAFP后的新鲜面团的冻融特性得到改善;在冻融循环过程中,SaAFP面团的Fw显著低于对照组,这说明SaAFP能显著提高冷冻面团的品质。
[1] 张晖, 丁香丽. 抗冻蛋白在食品中应用研究进展及安全性分析[J]. 食品与生物技术学报, 2012, 31(5):455-461.
[2] 汪少芸, 赵珺, 吴金鸿,等. 抗冻蛋白的研究进展及其在食品工业中的应用[J]. 食品科学技术学报, 2011, 29(4):50-57.
[3] GAUTHIERS Y, MARSHALL C B, FLETCHER G L, et al. Hyperactive antifreeze protein in flounder species [J]. Febs Journal, 2005, 272(17):4 439-4 449.
[4] HARDING M M, ANDERBERG P I, HAYMET A D J. “Antifreeze” Glycoproteins from Polar Fish [J]. European Journal of Biochemistry, 2003, 270(7):1 381-1 392.
[5] GRIFFITHM, YAISH M W. Antifreeze proteins in overwintering plants: a tale of two activities [J]. Trends in Plant Science, 2004, 9(8):399-405.
[6] CHAO Z, HUI Z, LI W, et al. Effect of carrot (Daucus carota) antifreeze proteins on texture properties of frozen dough and volatile compounds of crumb [J]. LWT - Food Science and Technology, 2008, 41(6):1 029-1 036.
[7] ZHANG Y, ZHANG H, WANG L, et al. Extraction of oat(AvenasativaL.) antifreeze proteins and evaluation of their effects on frozen dough and steamed bread [J]. Food & Bioprocess Technology, 2015, 8(10):2 066-2 075.
[8] AMORNWITTAWAT N, WANG S, DUMAN J G, et al. Polycarboxylates enhance beetle antifreeze protein activity [J]. Biochimica Et Biophysica Acta, 2008, 1784(12):1 942-1 948.
[9] LIZ, XIONG F, LIN Q, et al. Low-temperature increases the yield of biologically active herring antifreeze protein in pichia pastoris [J]. Protein Expression & Purification, 2001, 21(3):438-445.
[10] GRAHAM L A, DAVIES P L. Glycine-rich antifreeze proteins from snow fleas [J]. Science, 2005, 310(5747):461-461.
[11] DAMODARAN S. Inhibition of ice crystal growth in ice cream mix by gelatin hydrolysate [J]. Journal of Agricultural & Food Chemistry, 2007, 55(26):10 918-10 923.
[12] HUI C, YING Z, YU B Z, et al. Antifreeze and cryoprotective activities of ice-binding collagen peptides from pig skin [J]. Food Chemistry, 2016, 194:1 245-1 253.
[13] LICHAN E C Y, HUNAG S L, JAO C L, et al. Peptides Derived from Atlantic Salmon Skin Gelatin as Dipeptidyl-peptidase IV Inhibitors [J]. Journal of Agricultural & Food Chemistry, 2012, 60(4):973-978.
[14] 阮功成, 曹慧, 徐斐,等. 胶原酶解复合物的制备及其抗冻活性[J]. 食品与发酵工业, 2015, 41(2):7-12.
[15] DING X, ZHANG H, WANG L, et al. Effect of barley antifreeze protein on thermal properties and water state of dough during freezing and freeze-thaw cycles [J]. Food Hydrocolloids, 2015, 47:32-40.
[16] KONTOGIORGOS V, GOFF H D, KASAPIS S. Effect of aging and ice-structuring proteins on the physical properties of frozen flour-water mixtures [J]. Food Hydrocolloids, 2008, 22(6):1 135-1 147.
[17] HASSAS-ROUDSARI M, GOFF H D. Ice structuring proteins from plants: Mechanism of action and food application [J]. Food Research International, 2012, 46(1):425-436.
[18] HAN B, BISCHOF J C. Direct cell injury associated with eutectic crystallization during freezing [J]. Cryobiology, 2004, 48(1):8-21.
[19] WANGS Y, AGYARE K, DAMODARAN S. Optimisation of hydrolysis conditions and fractionation of peptide cryoprotectants from gelatin hydrolysate [J]. Food Chemistry, 2009, 115(2):620-630.
[20] USTUN N S, TURHAN S. Antifreeze proteins: characteristics, function, mechanism of action, sources and application to foods [J]. Journal of Food Processing & Preservation, 2015, 39(6):3 189-3 197.
[21] CARINIE, VITTADINI E, CURTI E, et al. Effect of different mixers on physicochemical properties and water status of extruded and laminated fresh pasta [J]. Food Chemistry, 2010, 122(2):462-469.
[22] 丁香丽. 大麦籽粒抗冻蛋白的制备及抗冻机制的研究[D]. 无锡:江南大学, 2015.
[23] LIU J, LI Q. Theoretical model of antifreeze protein-ice adsorption: Binding of large ligands to a two-dimensional homogeneous lattice [J]. Chemical Physics Letters, 2006, 422(1-3):67-71.
[24] KONTOGIORGOS V, GOFF H D, KASAPIS S. Effect of aging and ice structuring proteins on the morphology of frozen hydrated gluten networks [J]. Biomacromolecules, 2007, 8(4):1 293-1 299.
Thepreparationofantifreezepeptidesfromsalmonskingelatinandtheireffectsonthethermalpropertiesoffrozendough
SUN Li-jie, ZHANG Hui*, WANG Li, QIAN Hai-feng, QI Xi-guang
(School of Food Science and Technology,Jiangnan University, Wuxi 214122, China)
In this study, the thermal hysteresis activity (THA) was used as the main parameter to determine the optimum protease and hydrolysis time for salmon skin gelatin hydrolysis. The effects of peptides on biological antifreeze activity and thermal properties of frozen dough were investigated. The results showed the antifreeze peptide with maximal THA was obtained from papain treated gelatin, and hydrolysis at pH 6.0 for 2 h at 40 ℃. The substrate concentration was 3% (w/v) and papain proportion was 3 000 U/g. The THA was the highest of 0.53 ℃ under the above conditions. Their molecular weight were mainly distributed below 3 000 Da. When the concentration of SaAFP was 20 mg/mL, the survival rate ofEscherichiacoliwas up to 75.71%. Differential scanning calorimeter measurement showed that SaAFP did not decreased the freezing temperature (Tf), melting temperature (Tm) and the freezable water content (Fw), but narrowed down the melting temperature (Tm,δ) of fresh dough. The SaAFP significantly loweredFwof frozen dough after freeze-thaw cycles.
fish skin; antifreeze peptide; thermal hysteresis activity; frozen dough; thermal properties
10.13995/j.cnki.11-1802/ts.013469
硕士研究生(张晖教授为通讯作者,E-mail:zhanghui@jiangnan.edu.cn)。
国家自然科学基金(31671891)
2016-11-23,改回日期:2017-01-05
