盐酸曲美他嗪调控自噬对大鼠心肌缺血再灌注损伤的保护作用
2017-08-07龙玉莹葛华王月王微
龙玉莹,葛华,王月,王微
(沈阳医学院1.基础医学院病理学与病理生理学教研室,沈阳110034;2.附属中心医院循环科,沈阳110075)
盐酸曲美他嗪调控自噬对大鼠心肌缺血再灌注损伤的保护作用
龙玉莹1,葛华2,王月1,王微2
(沈阳医学院1.基础医学院病理学与病理生理学教研室,沈阳110034;2.附属中心医院循环科,沈阳110075)
目的观察盐酸曲美他嗪(TMZ)在大鼠心肌缺血再灌注损伤中的作用,及其与自噬相关蛋白微管相关蛋白轻链3蛋白-Ⅱ(LC3-Ⅱ)和自噬流的另一个标志物p62的关系,并探讨其作用机制。方法将54只雄性SD大鼠随机分成假手术组(Sham组)、心肌缺血30 min再灌注组(I/R组)、心肌缺血30 min再灌注药物干预组(I/R+TMZ组),每组18只。制备大鼠在体心肌缺血再灌注损伤模型,于即刻、4周、8周后处死大鼠,实时定量PCR和Western blotting检测心肌组织LC3-Ⅱ和p62的表达水平,HE染色观察心肌组织形态改变。结果与Sham组相比,I/R组大鼠心肌细胞内LC3-Ⅱ和p62的表达水平增高(P<0.05);与I/R组相比,I/ R+TMZ组大鼠心肌细胞内LC3-Ⅱ和p62的表达水平降低(P<0.05)。在第4周时心肌细胞中LC3-Ⅱ和p62的表达水平增高(P<0.05);在第8周时心肌细胞中LC3-Ⅱ和p62的表达水平降低(P<0.05)。结论TMZ的干预可能通过调节自噬流对大鼠损伤的心肌起保护作用,并存在一定的时间效应。
盐酸曲美他嗪;心肌缺血再灌注损伤;自噬;LC3-Ⅱ;P62
临床上,对急性心肌梗死患者的治疗,主要是溶栓、经皮冠状动脉介入治疗和冠状动脉搭桥。再灌注治疗可导致心肌细胞凋亡[1-2],即心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)。近年来,对于自噬在MIRI中发挥的保护作用已有比较清晰的了解。自噬相关蛋白-微管相关蛋白连链3蛋白(microtubule-associated protein light chain 3 protein,LC3)是目前所知的唯一在自噬体上表达的蛋白,被称为自噬标志物[3],p62与LC3直接结合[4],在自噬调节中发挥关键的作用。盐酸曲美他嗪(Trimetazidine,TMZ)在早期MIRI中有抗细胞凋亡的作用[5],对心肌细胞具有独特的保护作用,并已在临床上广泛应用。TMZ对于MIRI后的心肌有保护作用,但对于其在LC3和p62介导的自噬中少有研究报道。本研究选用大鼠MIRI模型,给予TMZ治疗,观察其能否对MIRI的心肌细胞发挥保护作用,并初步探讨其机制。
1 材料与方法
1.1 材料
健康成年雄性SD大鼠54只,由辽宁长生生物技术有限公司提供[SCXK(辽)2015-0001]。TMZ:施维雅(天津)制药有限公司,准字H20100077,小动物呼吸机:ALC-V系列动物呼吸机,垂直电泳仪(北京六一高压双稳电泳仪电源DYY-4C),北京六一DYCZ-24DN迷你双垂直电泳仪电泳槽蛋白凝胶电泳仪转膜仪,水平摇床(北京市六一仪器厂),转膜仪(美国BIO-RAD公司,Trans-Blot cell),化学发光成像系统Western blotting成像分析(Clinx上海勤翔,ChemiScope 3600 Mini)。
1.2 动物分组处理和模型制备
将大鼠随机分为假手术组(Sham组),心肌缺血30 min再灌注(I/R组),心肌缺血30 min再灌注+ TMZ组(I/R+TMZ组),每组18只。Sham组不结扎冠状动脉左前降支;I/R组、I/R+TMZ组结扎大鼠心脏冠状动脉左前降支30 min后解开结扎线,释放血流,建立大鼠在体心肌缺血再灌注损伤模型。I/R+ TMZ组每天15:00用20 mg/(kg·d)[5]TMZ溶于1 mL生理盐水灌胃至取材,Sham组和I/R组每天15:30给予同体积的生理盐水灌胃至取材。
造模完成后,分别于即时、4周、8周随机抽取6只处死大鼠。取左心室前壁心肌组织,HE染色标本置于4%甲醛溶液中保存,实时定量PCR标本置于Trizol溶液中保存,Western blotting检测标本放入-80℃冰箱保存。
1.3 HE染色
取左心室前壁的心肌组织,4%甲醛固定,冲洗,逐级脱水,二甲苯透明,浸蜡,包埋,切片,粘片,烤片,苏木精伊红染色,透明、封固后在光学显微镜下观察各组大鼠心肌组织形态学的变化。
1.4 实时定量PCR反应
取左心室前壁心肌组织,加入Trizol试剂匀浆,提取总RNA后,测定浓度,进行逆转录和PCR反应。GAPDH上游引物序列5’-GGCACAGTCAAGGC TGAGAATG-3’,下游引物序列5’-ATGGTGGTGAA GACGCCAGTA-3’,p62上游引物序列5’-GGGCTTT GGTTCGTG-3’,下游引物序列5’-CCTTGACTCTGG CTGTAAT-3’,LC3-Ⅱ上游引物序列5’-CGGCGTCT TTGTGGGT-3’,下游引物序列5’-ATGCCTCTTGAT ACTGCTTGA-3’。进行实时定量PCR,实验设3次重复,应用RT-PCR仪中自带的软件分析出相应的Ct值,再用power(2-ΔΔCt)法计算出各实验组细胞的LC3-Ⅱ、p62和GAPDH的mRNA的表达水平。
1.5 Western blotting
取左心室前壁心肌组织,加入裂解液后,10 000 r/min离心20 min,收集上清,测定蛋白浓度。进行SDS-PAGE电泳并转膜于PVDF膜上,5%脱脂牛奶封闭2 h。依次用1∶1 000的鼠抗p62、抗LC3-Ⅱ和GAPDH抗体,孵育2 h后TBST洗涤,然后使用1∶5 000山羊抗鼠二抗孵育2 h,TBST洗膜。最后用ECL发光液进行曝光显影,Bio-Rad照相系统拍照,并用Image J软件分析蛋白的相对表达量。
1.6 统计学分析
应用SPSS 16.0软件进行统计分析。实验数据计量资料的正态性检验采用Shapiro-Wilk法。2组间的比较采用t检验,多组间的比较采用方差分析,用LSD法进行两两组间的比较。采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 HE染色
Sham组心肌细胞排列整齐,胞膜完整,胞质染色均匀;I/R组和I/R+TMZ组即刻取材标本大部分心肌纤维肿胀,少量炎症细胞局灶浸润;I/R组第4、8周取材标本心肌细胞破坏最为严重,有明显的梗死灶,胞质肿胀,炎症细胞浸润明显,心肌细胞断裂、坏死;I/R+TMZ组第4周取材标本心肌细胞排列不齐,少量炎症细胞浸润,心肌间质内可见少量胶原纤维增生;I/R+TMZ组第8周取材标本细胞排列较整齐,部分心肌纤维波纹样改变。见图1。
2.2 各组自噬相关基因LC3-Ⅱ和p62mRNA水平的比较
Sham组即刻、第4周和第8周,LC3-Ⅱ和p62 mRNA表达水平无差异(P>0.05);I/R组第4周LC3-Ⅱ和p62mRNA高于即刻,第8周低于第4周(均P<0.05);I/R+TMZ组第4周的LC3-Ⅱ和p62 mRNA高于即刻,第8周低于第4周(均P<0.05),见表1。
I/R组各时相的LC3-Ⅱ和p62mRNA较Sham组表达增加(P<0.05),具有时间效应;I/R+TMZ组各时相的LC3-Ⅱ和p62 mRNA表达水平较I/R组下调(P<0.05),亦呈时间效应,且与Sham组比较,差异无统计学意义(P>0.05),见表1。
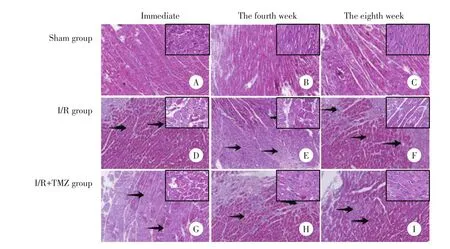
图1 各组大鼠心肌组织形态学染色HE×100Fig.1 Morphologica l staining o f m yocardia l tissue in each group of rats HE staining×100

表1 实时定量PCR法检测自噬相关蛋白LC3-Ⅱ和p62在大鼠心肌中的表达Tab.1 Exp ression of autophagy associated proteins LC3-Ⅱand p62 in rat m yocardium by rea l-tim e PCR
2.3 各组LC3-Ⅱ和p62蛋白水平比较
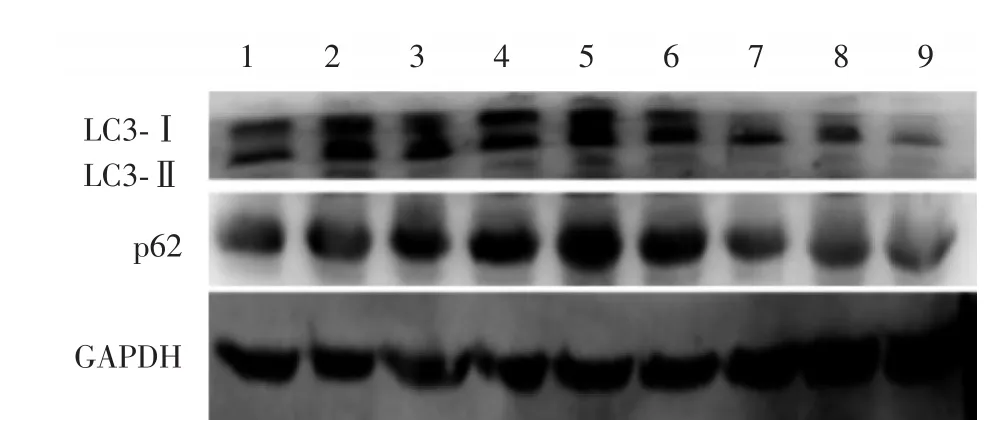
图2 各组心肌LC3-Ⅱ和p62蛋白电泳Fig.2 Electrophoresis of LC3-Ⅱand p62 proteins in each group
各组自噬相关蛋白质LC3-Ⅱ和p62电泳结果见图2。组内和组间比较的统计学结果与其mRNA相似,见表2。I/R组LC3-Ⅱ和p62蛋白表达水平(P< 0.05)增加,且具有时间效应;与I/R组比较,I/R+ TMZ组LC3-Ⅱ和p62蛋白表达水平(P<0.05)下调,且呈时间依赖性;与Sham组比较,I/R+TMZ组LC3-Ⅱ和p62蛋白表达水平无统计学差异。
3 讨论
大鼠MIRI模型是目前关于心肌MIRI实验中应用最多的模型[6]。TMZ已被证明可以导致骨骼肌肌管[7]自噬,抑制压力超负荷诱导的心肌纤维化[8],减少吸烟诱导的细胞凋亡[9]。本研究HE染色结果显示,I/R+TMZ组心肌细胞排列明显优于缺血再灌注组;实时定量PCR和Western blotting结果也提示了I/R+TMZ组的自噬标志蛋白LC3-Ⅱ表达水平均明显低于I/R组,表明TMZ可能通过抑制心肌细胞自噬而降低心肌缺血再灌注而带来的损伤。
过去的研究认为,心肌细胞丢失的主要机制是心肌细胞的凋亡和坏死,近些年来发现,另一种新型的细胞死亡的方式—自噬,也参与了这个过程。自噬是一个双膜囊泡(自噬体)结构,通过与溶酶体膜结合,被溶酶体中含有的酶水解[10],清除功能障碍的细胞成分[11]称为自噬溶酶体。大量的自噬体会导致与自噬体结合的溶酶体数量不足,进而自噬体不能被完全降解,导致自噬流被破坏不能完整的进行下去,同样对细胞产生损伤[12]。有研究[13]表明,活体猪在体心肌冬眠模型中缺血区域梗死的心肌组织内自噬相关蛋白表达全部增多。目前认为,“自噬流”影响并决定了自噬的水平,反映了从自噬体的合成、将底物运输至溶酶体以及降解过程,因此能更可靠地反映自噬活性[6]。LC3-Ⅱ是形成自噬体的重要因素,LC3从LC3-Ⅰ到LC3-Ⅱ结合在自噬体膜上,直至在溶酶体中降解[11]。所以,自噬的活性和LC3-Ⅱ的表达水平相关。泛素结合蛋白p62募集泛素化蛋白通过LC3结合到自噬体,并通过自噬降解。所以p62的表达水平和自噬水平呈负相关[14]。

表2 Western blotting法检测自噬相关蛋白LC3-Ⅱ和p62在大鼠心肌中的表达Tab.2 Exp ression of autophagy associated proteins LC3-Ⅱand p62 in rat m yocardium by Western b lotting
本研究结果表明,大鼠MIRI后,LC3-Ⅱ蛋白表达水平上调,说明心肌细胞内的自噬体被激活;而p62蛋白表达水平上调,说明心肌细胞自噬流不完整,由此推测,MIRI破坏了细胞内的自噬流,使自噬体大量积聚,导致细胞自噬性死亡。同时还表明,心肌细胞在不用药物的情况下,机体自身可以部分降低MIRI后LC3-Ⅱ和p62的表达水平,而应用TMZ后可以明显降低LC3-Ⅱ和p62的表达,所以猜测TMZ的治疗加速修复了损伤后自噬流的破坏,最终加速了自噬的降解。同时也表明,随着时间的延长,修复自噬流的效果越明显,即第4周取材与即刻取材相比,LC3-Ⅱ和p62的表达水平增高,说明效果不明显,而第8周取材与第4周取材相比,LC3-Ⅱ和p62的表达水平降低,随着时间的延长,修复自噬流的效果越明显。综上所述,TMZ处理可以减轻大鼠MIRI损伤,其机制可能与修复了自噬流有关。
[1]FRANK A,BONNEY M,BONNEY S,et al.Myocardial ischemia reperfusion injury:from basic science to clinical bedside[J].Semin Cardiothorac Vasc Anesth,2012,16(3):123-132.DOI:10.1177/ 1089253211436350.
[2]WANG W,ZHANG H,XUE G,et al.Exercise training preserves ischemic preconditioning in aged rat hearts by restoring the myocardial polyamine pool[J].Oxid Med Cell Longev,2014,2014:457429.DOI:10.1155/2014/457429.
[3]曾敏,颜红兵.自噬与心肌缺血再灌注[J].中华心血管病杂志,2012,40(8):711-713.DOI:10.3760/cma.j.issn.0253-3758.2012. 08.020.
[4]NODA NN,OHSUMI Y,INAGAKI F.Atg8-family interacting motif crucial for selective autophagy[J].FEBS Lett,2010,584(7):1379-1385.DOI:10.1016/j.febslet.2010.01.018.
[5]罗文,李悦山.曲美他嗪与帕瑞昔布联合给药对急性心肌梗死期大鼠心脏的保护作用[J].中国病理生理杂志,2011,27(8):1502-1507.DOI:10.3969/j.issn.1000-4718.2011.08.009.
[6]QIAO S,XIE H,WANG C,et al.Delayed anesthetic preconditioning protects against myocardial infarction via activation of nuclear factor-κB and upregulation of autophagy[J].J Anesth,2013,27(2):251-260.DOI:10.1007/s00540-012-1494-3.
[7]FERRARO E,GIAMMARIOLI AM,CALDAROLA S,et al.The metabolic modulator trimetazidine triggers autophagy and counteracts stress-induced atrophy in skeletal muscle myotubes[J].FEBS J,2013,280(20):5094-5108.DOI:10.1111/febs.12484.
[8]LIU X,GAI Y,LIU F,et al.Trimetazidine inhibits pressure overloadinduced cardiac fibrosis through NADPH oxidase-ROS-CTGF pathway[J].Cardiovasc Res,2010,88(1):150-158.DOI:10.1093/cvr/ cvq181.
[9]ZHOU X,LI C,XU W,et al.Trimetazidine protects against smokinginduced left ventricular remodeling via attenuating oxidative stress,apoptosis,and inflammation[J].PLoS One,2012,7(7):e40424. DOI:10.1371/journal.pone.0040424.
[10]杨乐,邹晓静.心肌自噬研究进展[J].内科急危重症杂志,2010,16(5):265-268.DOI:10.3969/j.issn.1007-1024.2010.05. 017.
[11]GEDIK N,THIELMANN M,KOTTENBERG E,et al.No evidencefor activated autophagy in left ventricular myocardium at early reperfusion with protection by remote ischemic preconditioning in patients undergoing coronary artery bypass graftin[J].PLoS One,2014,9(5):e96567.DOI:10.1371/journal.pone.0096567.
[12]覃琴,谢红,殷明,等.细胞外信号调节激酶通路介导的自噬对七氟烷后处理大鼠心肌缺血再灌注的保护机制[J].中华老年心脑血管病杂志,2015,17(8):859-863.DOI:10.3969/j. issn.1009-0126.2015.08.021.
[13]JAHANIA SM,SENGSTOCK D,VAITKEVICIUS P,et al.Activation of the homeostatic intracellular repair response during cardiac surgery[J].J Am Coll Surg,2013,216(4):719-726.DOI:10.1016/j.jamcollsurg.2012.12.034.
[14]KOMATSU M,WAGURI S,KOIKE M,et al.Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice[J].Cell,2007,131(6):1149-1163.DOI:10.3969/j. issn.1009-0126.2015.08.021.
(编辑于溪)
Protective Effect of Trimetazidine against Autophagy-induced M yocardial Ischem ia-reperfusion Injury in Rats
LONG Yuying1,GE Hua2,WANG Yue1,WANG Wei2
(1.Department of Pathology and Pathophysiology,Basic Medical College,Shenyang Medical College,Shenyang 110034,China;2.Department of Circulation Section,The Affiliated Central Hospital,Basic Medical College,Shenyang 110075,China)
Objective To observe the protective effects of trimetazidine against myocardial ischemia-reperfusion(I/R)injury in rats and relationship with the autophagy-related protein,microtubule-associated protein light chain 3 protein-Ⅱ(LC3-Ⅱ)and another autoclaved marker sequestosome 1(p62)as well as to investigate the mechanism of action.Methods Fifty-four male SD rats were randomly divided into three groups with 18 rats in each group:sham group,myocardial I/R group,and TMZ plus myocardial I/R group.The rats in each group were sacrificed at model completion,and 4 and 8 weeks later.RT-PCR and Western blotting were performed to determine the levels of LC3-Ⅱand p62.The morphological changes in the myocardium were observed by HE staining.Results Compared with the sham group,the I/R group demonstrated increased expression of LC3-Ⅱand p62(P<0.05).Compared with that in the I/R group,the expression of LC3-Ⅱand p62 in the I/R+TMZ group decreased(P<0.05).The expression of LC3-Ⅱand p62 increased at week 4(P<0.05).At week 8,the expression levels of LC3-Ⅱand p62 decreased in cardiomyocytes(P<0.05).Conclusion Intervention with trimetazidine may protect the myocardium of rats against ischemia-reperfusion injury by regulating autophagy and the effect is maintained for a certain period.
trimetazidine;myocardial ischemia-reperfusion injury;autophagy;LC3-Ⅱ;P62
R541.4;R972.4
A
0258-4646(2017)07-0656-04
10.12007/j.issn.0258-4646.2017.07.019
龙玉莹(1988-),女,硕士研究生.
葛华,E-mail:gehua2009@163.com
2016-11-03
网络出版时间:
