过表达m icroRNA-486对大鼠心肌梗死后心脏功能损伤的改善
2017-08-07刘鹏飞张海涛齐弘炜王楠楠张博阳袁彪李田昌
刘鹏飞,张海涛,齐弘炜王楠楠,张博阳,袁彪,李田昌
(1.山东省济宁市第一人民医院心内科,山东济宁272000;2.承德医学院附属医院心外科,河北承德067000;3.北京同仁医院心外科,北京100730;4.海军总医院心内科,北京100037)
过表达m icroRNA-486对大鼠心肌梗死后心脏功能损伤的改善
刘鹏飞1,张海涛2,齐弘炜3王楠楠4,张博阳4,袁彪3,李田昌4
(1.山东省济宁市第一人民医院心内科,山东济宁272000;2.承德医学院附属医院心外科,河北承德067000;3.北京同仁医院心外科,北京100730;4.海军总医院心内科,北京100037)
目的观察直接心肌注射腺病毒搭载microRNA-486(miR-486)基因对大鼠心肌梗死后心脏功能损伤的影响。方法SD雄性大鼠,随机分成假手术组(Sham组)、心肌梗死+生理盐水组(MI组)、心肌梗死+空载腺病毒组(Ad组)、心肌梗死+miR-486腺病毒组(miR-486组)。于梗死区周围心肌注射不同目标物质。于不同时间点利用实时定量聚合酶链式反应测量各组梗死周边区域miR-486表达水平。4周时行超声心动图检查,并取各组大鼠心脏行TTC染色,苏木精-依红(HE)染色,马松(Masson)染色,Tunel染色和免疫组化染色。结果随着心肌梗死时间延长miR-486在3组内的含量有下降的趋势,但miR-486组miR-486表达量均较MI组和Ad组明显增加;超声心动图示miR-486组心功能优于MI组和Ad组;miR-486组心肌梗死面积较MI组、Ad组明显减少;Masson染色提示miR-486组、MI组和Ad组胶原容积分数(CVF)明显高于Sham组,但miR-486组CVF低于MI组和Ad组;MI组和Ad组心肌细胞凋亡指数显著上升但2组间比较差异无统计学意义,miR-486组与MI组和Ad组相比心肌细胞凋亡指数下降,Sham组未见明显心肌细胞凋亡;miR-486组微血管密度(MVD)显著高于Sham组、MI组和Ad组,且MI组、Ad组心肌MVD显著高于Sham组。结论miR-486的心肌注射可通过抑制大鼠心肌梗死后纤维化,减少心肌细胞凋亡和促进缺血区域微血管新生,进而对心肌梗死后心脏功能有所改善。
心肌梗死;microRNA-486;心肌纤维化;心肌细胞凋亡;微血管新生
心肌梗死(myocardial infarction,MI)是一种常见的心血管疾病,不仅可以导致心肌细胞坏死、凋亡,还可诱发一系列复杂的病理生理过程而导致心脏重构,最终发展为心衰[1]。其中microRNA(miRNA)起到了重要的作用。miRNA是一种长约20~25个核苷酸的小分子单链RNA分子,通过与信使RNA(messenger RNA,mRNA)结合抑制其翻译或促进其降解,对靶mRNA的稳定及翻译效率起到重要的调控作用,参与凋亡、增殖、分化和细胞周期等[2]。miR-486是一种高分布于心肌的miRNA[3],且最近一项临床研究发现急性S-T段抬高型心肌梗死患者血浆中miR-486含量较高[4]。然而国内外关于miR-486对心肌梗死后的功能变化的影响及其作用机制报道较少。本研究采用大鼠心肌梗死模型,检测心肌梗死交界区miR-486的表达情况,观察过表达miR-486对大鼠心肌梗死后心功能的影响。
1 材料与方法
1.1 实验动物
成年雄性SD大鼠120只,体质量230~250 g,随机分成4组,假手术组(Sham组)、心肌梗死+生理盐水组(MI组)、心肌梗死+空载腺病毒组(Ad组)、心肌梗死+miR-486腺病毒组(miR-486组),每组30只。
1.2 试剂及仪器
腺病毒载体Ad-miR486及空载腺病毒(上海汉恒生物公司)。Trizol、TaKaRa反转录试剂盒及SYBR Green(美国Invitrogen公司)。苏木素-伊红(HE)染色试剂盒(北京中杉金桥生物科技有限公司)。马松(Masson)染色试剂盒(南京森贝伽生物有限公司)。氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)染色试剂盒及Tunel原位末端标记检测试剂盒(德国Roche公司)。双路小动物呼吸机ZS-V9A(北京众实迪创公司),自动分析心电图机FCP-Z155(北京福田电子医疗器械公司),超高分辨率小动物彩色多普勒超声成像系统Vevo2100(美国FUJIFILM VisualSonics公司)
1.3 方法
1.3.1 大鼠心肌梗死模型的制备及转染:采用10%的水合氯醛溶液(3 mL/100 g)腹腔注射麻醉大鼠。气管插管连接呼吸机,开胸后于左心耳下缘与肺动脉圆锥连线中点下2~3 mm处结扎前降支。结扎点靠心尖部左心室前壁呈灰白色,心电图S-T段抬高则证明造模成功。Sham组不予任何干预。MI组、Ad组和miR-486组用微量注射器分别吸取75 μL生理盐水、腺病毒载体溶液、携带miR-486腺病毒溶液,于心肌梗死周围区域选取3点,直接注射入心肌内。闭合肋间伤口,抽取胸腔负压,缝合手术切口,待大鼠恢复自主呼吸后拔出气管插管。
1.3.2 实时荧光定量PCR(qRT-PCR)检测miR-486的含量:分别于1周、2周和4周时间点处死大鼠。以SD大鼠心肌梗死的边带为标志[5],剪取梗死交界区域,Trizol法提取各组心肌组织的RNA,TaKaRa反转录试剂盒,特异性引物反转miR-486和U6,SYBR Green荧光染料法检测miR-486表达。将U6snRNA作为内参,2-ΔΔCt方法计算miR-486相对表达水平。
1.3.3 小动物心脏超声心动图检测:4周后,使用小动物超声成像系统,记录左心室收缩期末径和左室舒张期末径,计算出左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fractional shortening,LVFS),取连续3个以上心动周期的平均值。
1.3.4 染色方法:(1)TTC染色,4周后处死大鼠后取出心脏,用PBS溶液冲洗血污,纱布吸干后放入-20℃冰箱中冷冻15 min,连续切片后置入1%的TTC溶液中,于水浴箱中37℃避光孵育15 min,染色完成后拍照。砖红色为正常区域,灰白色为梗死区域,用Image Pro Plus 6.0计算梗死面积,梗死百比分%=梗死面积/心脏切面总面积×100%。(2)HE染色、Masson染色及Tunel染色,4周后处死大鼠,将心脏置于多聚甲醛溶液中固定,石蜡包埋,切片后脱蜡、脱水,应用相应的试剂染色制片。Masson染色后,通过Image Pro Plus 6.0采图、分析,每张病例切片随机选取5个心肌梗死周围区域视野,胶原组织面积占所测视野面积的百分比的平均值即为胶原容积分数(collagen volume fraction,CVF)。Tunel染色后,细胞系呈棕褐色或棕黄色颗粒且具备凋亡细胞形态学特征判定为凋亡细胞,400倍光学显微镜下,每张切片拍摄5个阳性视野,心肌细胞凋亡指数(apoptotoc index,AI)=(凋亡心肌细胞系数/正常心肌细胞系数)×100%。
1.3.5 免疫组化法测定微血管密度(micro-vascular density,MVD):切片后用小鼠抗大鼠CD31多克隆抗体免疫组织化学染色[6],内皮细胞被染成棕褐色。Weidner法计数MVD[7],400倍光学显微镜下,在MI周围区域随机选取5个高倍视野计数微血管数目,求得计数的平均值作为该份标本的MVD。
1.4 统计学分析
采用SPSS 20.0统计软件进行统计分析。计量资料用x±s表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 实验动物的一般情况
120只大鼠建模过程中死亡12只(Sham组2只、MI组3只、Ad组4只、miR-486组3只),饲养过程中死亡8只(MI组2只,Ad组3只,miR-486组3只),最终存活100只(Sham组28只、MI组25只、Ad组23只、miR-486组24只)。
2.2 各组大鼠在不同时间点miR-486表达量的比较
qRT-PCR测得,MI组、Ad组和miR-486组心肌梗死大鼠在1周、2周和4周时心肌组织miR-486的表达量随时间推移逐渐下降。1周时4组之间相比较,miR-486的表达量有统计学差异(P<0.05);MI组和Ad组miR-486的表达量低于miR-486组,但高于Sham组(P<0.05),且MI组和Ad组之间miR-486的表达量无统计学差异(P>0.05)。2周时4组之间相比较,miR-486的表达量有统计学差异(P<0.05),且Sham组、MI组和Ad组的表达量低于miR-486组,但Sham组、MI组和Ad组3组之间miR-486的表达量无统计学差异(P>0.05)。4周时4组之间相比较,miR-486的表达量有统计学差异(P<0.05),MI组和Ad组miR-486的表达量低于Sham组和miR-486组,且MI组和Ad组miR-486的表达量无统计学差异(P>0.05),见表1。
2.3 miR-486转染改善大鼠心肌梗死后心功能
4周后大鼠心肌梗死模型超声结果示,与Sham组相比,miR-486组、MI组和Ad组的LVEF和LVFS明显减低(P<0.01);miR-486组与MI组和Ad组比较,LVEF和LVFS明显升高(P<0.05);而MI组和Ad组间,LVEF和LVFS无明显差异(P>0.05),见表2。
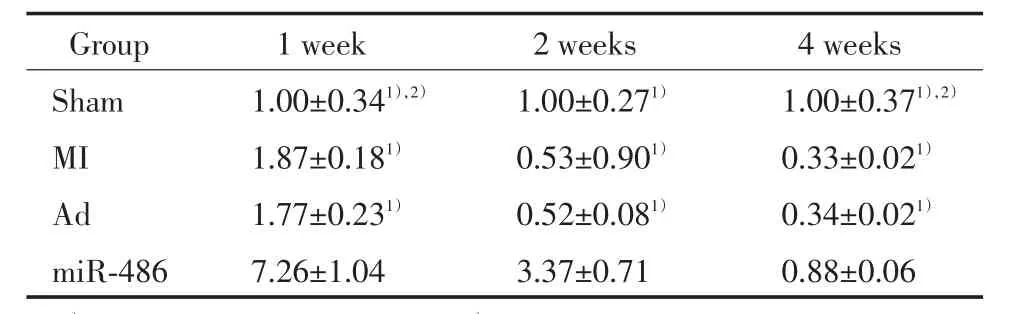
表1 不同时间点各组大鼠心脏梗死交界区m iR-486表达量的比较(x±s)Tab.1 Com parison of the expression o f m iR-486 in 4 groups atdifferent time points(x±s)

表2 术后4周时各组大鼠心功能超声心动图检查结果(x±s)Tab.2 Com parison of the cardiac function of 4 groups measured by cardiac ultrasound at 4 weeks a fter surgery(x±s)
2.4 不同组大鼠心肌梗死面积的比较
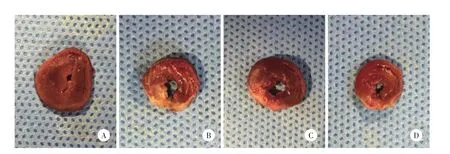
图1 4周后不同组大鼠心肌T T C染色Fig.1 TTC staining of 4 groups’m yocardium after 4 weeks
Sham组未见心肌梗死,其余3组可见明显的乳白色梗死区域(图1)。miR-486组心肌梗死面积[(30.75±1.96)%]明显小于MI组和Ad组(P<0.05),MI组[(35.81±1.51)%]与Ad组[(35.05± 1.75)%]心肌梗死面积无统计学差异(P>0.05)。
2.5 大鼠心脏组织病理学改变
心肌HE染色显示:Sham组左心室前壁心肌细胞排列正常;MI组和Ad组左心室前壁心肌细胞排列紊乱,心肌细胞肿胀,细胞核固缩或碎裂,周围有大量炎症细胞浸润,存活心肌细胞呈岛样分布,周围纤维肉芽组织增生,坏死心肌为纤维组织取代;miR-486组左室前壁梗死病变程度轻于MI组和Ad组,心肌纤维排列轻度紊乱,细胞形态较为均一,有少量炎症细胞和纤维组织浸润。见图2。
2.6 大鼠心肌Masson染色
Sham组大鼠心肌组织形态正常,胶原纤维含量较少;心肌梗死后大鼠心肌组织排列紊乱,胶原纤维含量明显增多,纤维化程度明显。见图3。通过Image Pro Plus 6.0图像分析系统量化分析,与Sham组[(7.45±1.37)%]相比MI组、Ad组和miR-486组CVF含量明显增加,差异有统计学意义(P<0.05),且miR-486组CVF含量[(53.72±2.89)%]较MI组[(62.87±3.30)%]和Ad组[(64.38±5.25)%]降低,差异有统计学意义(P<0.05),MI组和Ad组之间CVF无统计学差异(P<0.05)。
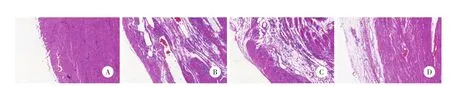
图2 HE染色光镜下不同组大鼠心肌组织切片×100Fig.2 HE staining of 4 groups’myocardium after 4 weeks under light m icroscope×100

图3 Masson染色光镜下不同组大鼠心肌组织切片×200Fig.3 Masson staining of 4 groups’myocardium after 4 weeks under light m icroscope×200
2.7 各组大鼠心肌Tunel染色
与Sham组AI值[(9.40±0.85)%]相比,MI大鼠心肌凋亡细胞数显著增多、AI值显著增高(P<0.05)。经过miR-486治疗,4周后miR-486组AI值[(38.78±2.64)%]明显低于MI组[(44.41±4.80)%]和Ad组[(45.96±3.49)%],差异有统计学意义(P<0.05),且MI组与Ad组之间差异无统计学意义(P>0.05)。见图4。
2.8 各组大鼠心肌MVD变化
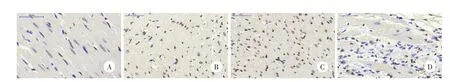
图4 Tune l染色光镜下不同组大鼠心肌组织切片×400Fig.4 Tunel staining o f 4 groups’m yocardium a fter 4 weeks under light m icroscope×400
MI大鼠心肌MVD明显高于Sham组[(58.8± 6.60)个/视野](P<0.05)。且miR-486组心肌MVD[(117.88±10.81)个/视野]高于MI组[(95.76±9.18)个/视野]和Ad组[(98.32±9.70)个/视野](P<0.05),MI组与Ad组之间心肌MVD无统计学差异(P> 0.05)。见图5。
3 讨论
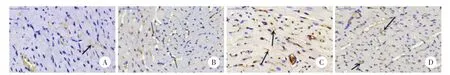
图5 CD31染色光镜下不同组大鼠心肌组织切片×400Fig.5 CD31 staining of 4 groups’myocardium after 4 weeks under light m icroscope×400
急性心肌梗死(acute myocardial infarction,AMI)是危害人类健康的常见疾病之一。本研究采用结扎大鼠心脏前降支的办法构建MI模型,很好的再现AMI的发病过程,为后续观察心肌梗死后心脏的病理生理改变提供了良好的依据[8]。
研究[9]发现miRNA对心脏的发育过程中有着精细的调控。本研究通过构建大鼠心肌梗死模型,以直接心肌注射腺病毒搭载miR-486的形式,提高心肌中miR-486的表达水平,并通过一系列检测证明,心肌过表达miR-486后可以减少心肌梗死面积,抑制心肌细胞凋亡和心肌纤维化,增加微血管密度,从而改善了MI大鼠的心功能。
miR-486在心肌细胞中高丰度表达[10],但miR-486减少心肌梗死面积和改善心肌重构和心功能的机制尚不明确。通过miRNA靶点数据库TargetScan的生物信息学分析以及查阅相关文献miR-486的靶基因为Pten和FoxO1a[3,10]。FoxO家族参与调节多种细胞功能,包含促进细胞分化、增生、代谢,且FoxO1a在血管形成中起关键作用,促进血管生成、分支增生,改善心肌供血,提高心肌细胞有氧代谢,抑制心肌细胞凋亡[12-13]。本研究发现高表达miR-486组的心梗大鼠新生血管明显增多,AI值明显降低。miR-486通过抑制靶基因的mRNA表达,有效提高PI3K/Akt信号通路的表达,抑制心肌纤维化改善心室重构[3,11],这在本研究中得到证实,miR-486组大鼠胶原纤维含量较MI组大鼠胶原纤维含量明显降低,进一步行心脏超声检查提示,miR-486组的心肌梗死大鼠心功能明显优于MI组和Ad组,可见miR-486对心肌梗死后性能的改善是有效的。
综上所述,本研究证明通过提高心肌中miR-486的表达水平改善心肌梗死后心脏功能是安全的、有效的,因而miR-486有可能为心肌梗死后基因治疗提供新的线索和治疗的靶点。
[1]QIU H,LIU JY,WEI D,et al.Cardiac-generated prostanoids mediate cardiac myocyte apoptosis after myocardial ischaemia[J].Cardiovasc Res,2012,95(3):336-345.DOI:10.1093/cvr/cvs191.
[2]ZELLER T,KELLER T,OJEDA F,et al.Assessment of microRNAs in patients with unstable angina pectoris[J].Eur Heart J,2014,35(31):2106-2114.DOI:10.1093/eurheartj/ehu151.
[3]SMALL EM,O’ROURKE JR,MORESI V,et al.Regulation of PI3-kinase/Akt signaling by muscle-enriched microRNA-486[J].Proc Natl Acad Sci USA,2010,107(9):4218-4223.DOI:10.1073/ pnas.1000300107.
[4]WEI T,FOLKERSEN L,EHRENBORG E,et al.MicroRNA 486-3P as a stability marker in acute coronary syndrome[J].Biosci Rep,2016,36(3)337-346.DOI:10.1042/BSR20160023.
[5]Van ROOIJE,SUTHERLAND LB,THATCHER JE,et al.Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J].Proc Natl Acad Sci USA,2008,105(35):13027-13032.DOI:10.1073/pnas.0805038105.
[6]ZYMEK P,BUJAK M,CHATILA K,et al.The role of platelet-derived growth factor signaling in healing myocardial infarcts[J].J Am Coll Cardiol,2006,48(11):2315-2323.DOI:6.10.1016/j. jacc.2006.07.060.
[7]WEIDNER N.Intratumor microvessel density as a prognostic factor in cancer[J].Am J Pathol,1995,147(1):9-19.
[8]杨涛涛,肖颖,奚赛飞,等.大鼠心肌梗死模型构建和评价方法的改良[J].中国比较医学杂志,2014(02):46-51.DOI:10.3969.j. issn.1671.7856.2014.002.011.
[9]SMALL EM,FROST RJ,OLSON EN.MicroRNAs add a new dimension to cardiovascular disease[J].Circulation,2010,121(8):1022-1032.DOI:10.1161/CIRCULATIONAHA.109.889048.
[10]孙燕,肖凤君,张怡堃,等.微小RNA-486在造血细胞红系分化中的表达研究[J].军事医学,2013(04):263-266.DOI:10.7644/ j.issn.1674-9960.2013.04.006.
[11]KAPPEL BA,STOHR R,DE ANGELISL,et al.Posttranslational modulation of FoxO1 contributes to cardiac remodeling in postischemic heart failure[J].Atherosclerosis,2016,249:148-156. DOI:10.1016/j.atherosclerosis.2016.04.001.
[12]黄益民,张颖,辛毅,等.mitoK_(ATP)通道经FOXO1-PGC1α通路调节后负荷过载小鼠心肌线粒体的代谢功能[J].中国病理生理杂志,2010(07):1306-1310.DOI:10.3969/j.issn.1000-4718.2010.07.012.
[13]WILHELM K,HAPPEL K,EELEN G,et al.FOXO1 couples metabolic activity and growth state in the vascular endothelium[J].Nature,2016,529(7585):216-220.DOI:10.1038/nature16498.
(编辑北辰)
Overexpression of m icroRNA-486 Improves the Cardiac Function in Rats w ith M yocardial Infarction
LIU Pengfei1,ZHANG Haitao2,QI Hongwei3,WANG Nannan4,ZHANG Boyang4,YUAN Biao3,LI Tianchang4
(1.Department of Cardiology,Jining First People’s Hospital,Jining 272000,China;2.Department of Cardiac Surgery,Affiliated of Chengde Medical College,Chengde 067000,China;3.Department of Cardiac Surgery,Beijing Tongren Hospital,Beijing 100730,China;4.Department of Cardiology,Navy General Hospital,Beijing 100037,China)
Objective To investigate the effects of microRNA-486(miR-486)expression on the cardiac function in rats with myocardial infarction(MI),through direct injection of an adenovirus carrying the miR-486 gene into the myocardium.Methods Totally 120 male rats were divided into 4 groups.Different target materials were infused into the surrounding areas of MI after building a successful disease model.Expression of miR-486 in the surrounding areas of left ventricular MI was detected using real-time PCR at different time points.Cardiac function was measured by cardiac ultrasound at 4 weeks.Using TUNEL,TTC,Masson,and CD31 staining to measure the organic changes in heart tissues.Results The expression of miR-486 in miR-486 group was higher than the other three groups.The expression of miR-486 in the three groups decreased when the time of MI in rats was prolonged.The cardiac function of the miR-486 group was better than that of the MI and AD groups.The MI area in the miR-486 group was smaller than that in the other two groups.Compared to the Sham group,the CVF at the infarct border zone was increased in the MI,Ad,and miR-486 groups.The AI in the MI and Ad groups was significantly increased compared to that in the miR-486 group.MVD was increased in the miR-486 group compared to that in the Sham,MI,and Ad groups.Conclusion miR-486 improved the cardiac function after MI in rats,through lightening collagen deposition,inhibiting apoptosis,and inducing angiogenesis in ischemic regions.
myocardial infarction;microRNA-486;collagen;apoptosis;microvessel density
R541.4
A
0258-4646(2017)07-0595-05
10.12007/j.issn.0258-4646.2017.07.005
国家自然科学基金(81370237)
刘鹏飞(1989-),男,医师,硕士.
李田昌,E-mail:ltc909@aliyun.com
2016-11-03
网络出版时间:
