纯化兔血清对氧磷酶1与传统方法对敌敌畏所致大鼠肝脏损伤的疗效比较
2017-08-07王聪陶维晨李琦吴泽扬郭镇豪赵敏
王聪,陶维晨,李琦,吴泽扬,郭镇豪,赵敏
(中国医科大学附属盛京医院急诊科,沈阳110004)
纯化兔血清对氧磷酶1与传统方法对敌敌畏所致大鼠肝脏损伤的疗效比较
王聪,陶维晨,李琦,吴泽扬,郭镇豪,赵敏
(中国医科大学附属盛京医院急诊科,沈阳110004)
目的探讨纯化兔血清对氧磷酶1(PON1)对敌敌畏中毒大鼠肝损伤的疗效是否优于传统方法。方法将30只雄性SD大鼠随机分为5组:空白对照组(A组)、敌敌畏染毒组(B组)、传统治疗组(C组)、PON1治疗组(D组)、联合治疗组(E组),每组6只。B、C、D、E组均给予敌敌畏(9 mg/kg)腹腔注射染毒,C组在染毒后立即(<2 min)给予阿托品(10 mg/kg)+碘解磷定(45 mg/kg)腹腔注射,D组在染毒前30 min给予PON1 9 600 U/kg尾静脉注射,E组染毒前30 min给予PON1 9 600 U/kg尾静脉注射,染毒后立即(<2 min)给予阿托品(10 mg/kg)+碘解磷定(45 mg/kg)腹腔注射,A组给予等量的生理盐水对照。各组于造模前(0 min)、造模后10 min、30 min、1 h、2 h、4 h、6 h分别颈内动脉取血,运用ELISA方法检测血清乙酰胆碱酯酶活性。各组分别于造模后12 h取肝脏组织,HE染色观察不同组肝脏的病理改变,运用免疫组化及Western blotting检测不同组肝脏4-羟基壬烯醛(4-HNE)的定性及定量表达。结果B组胆碱酯酶明显下降,光镜下出现肝细胞严重脂肪变、核固缩等病理改变,可见4-HNE高度表达;C、D、E组上述各指标改变均较B组轻,且各组与B组之间均存在统计学差异(P<0.05);D、E组病理改变较C组轻,上述指标与C组之间均有统计学差异(P<0.05);E组较D组病理改变稍轻,上述指标无统计学差异(P>0.05)。结论PON1对急性敌敌畏中毒大鼠肝损伤发挥保护作用,且效果优于传统治疗。
对氧磷酶1;敌敌畏中毒;肝损伤;氧化应激;4-羟基壬烯醛
农药中毒是目前关乎全球人类健康的重要问题。在过去30年里,每年均有成千上万人死于农药中毒,据统计有机磷中毒所致死亡率占据其中的首位[1]。有机磷农药既可以直接通过消化道、呼吸道、黏膜等吸收损伤肝脏,也可以通过增强脂质过氧化以及改变抗氧化酶的活性导致氧化应激,产生肝脏毒性,进而可出现肝功能紊乱、肝功能衰竭,甚至导致死亡[2]。传统的有机磷中毒治疗方法是联合阿托品及解磷定对症治疗,无法真正清除有机磷毒物以及减轻氧化应激反应。对氧磷酶1(paraoxonase 1,PON1)是由肝脏产生的一种能够特效水解有机磷的生物酶,它被认为是最有前途预防和治疗有机磷中毒的酶类[3]。本研究通过建立急性敌敌畏中毒大鼠肝损伤模型,观察PON1对于敌敌畏中毒肝损伤是否有保护作用及其可能的保护机制,并与传统方法进行比较。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级SD雄性大鼠30只,体质量300~400 g,购自北京华阜康有限公司,合格证号SCXK(京)2014-0004,由中国医科大学附属盛京医院本溪实验基地动物实验中心饲养。
1.1.2 试剂:77.5%敌敌畏乳油(河南省春光农化有限公司),胆碱酯酶(AChE)试剂盒(南京建成生物工程研究所),4-羟基壬烯醛(4-hydroxy 2-nonenal,4-HNE)兔抗鼠多克隆抗体(美国Abcam公司),兔SP检测试剂盒(北京中杉金桥生物技术有限公司),DAB染色试剂盒(北京中杉金桥生物技术有限公司),纯化的兔血清PON1(中国医科大学药学院代提纯)等。
1.1.3 仪器:图像采集软件(NIS-Elements F3.0),图像分析软件(NIS-Elements BR3.0),显微镜(NikonE800)。
1.2 方法
1.2.1 动物模型建立:将30只雄性SD大鼠随机分为空白对照(A)组、敌敌畏染毒(B)组、传统治疗(C)组、PON1治疗(D)组、联合治疗(E)组,每组6只。B组给予敌敌畏9 mg/kg腹腔注射;C组给予敌敌畏9 mg/kg腹腔注射,后立即(<2 min)给予阿托品(10 mg/kg)+碘解磷定(45 mg/kg)腹腔注射;D组给予PON1 9 600 U/kg尾静脉注射30 min后,敌敌畏9 mg/kg腹腔注射;E组给予PON1 9 600 U/kg尾静脉注射30 min后,敌敌畏9 mg/kg腹腔注射,随后立即(<2 min)给予阿托品(10 mg/kg)+碘解磷定(45 mg/kg)腹腔注射;A组给予等量的生理盐水对照。
1.2.2 标本检测:5组分别于造模前(0 min)、造模后10 min、30 min、1 h、2 h、4 h、6 h于颈内动脉取血,3 500 r/min离心10 min,取血清,-80℃保存待测。各组分别于造模后12 h取肝脏左叶小块肝脏组织(约1 cm×1 cm×0.5 cm),4%多聚甲醛固定待测。
1.2.3 记录各组大鼠的中毒症状以及评分:中毒症状包括毒蕈碱样(M样)症状,流涎、大小便失禁、气促;烟碱样(N样)症状,肌束颤动、肌无力;中枢神经系统症状(CNS症状),烦躁不安、共济失调、昏迷。其中肌束震颤评分参考Bleeckler标准进行。0分,无肌束震颤;1分,口周肌肉出现震颤,其他肌肉偶见震颤;2分,腹肌、后肢肌多处出现震颤;3分,腹肌、后肢肌频繁出现多发性震颤。
1.2.4 生化指标检测:取颈内动脉血离心后,取上清液,按照胆碱酯酶试剂盒说明书,应用酶标仪检测血清乙酰胆碱酯酶的活力。
1.2.5 肝脏HE染色:取肝脏左叶小块组织,行组织脱水、透明、浸蜡、包埋、切片,苏木素、伊红染色,树胶封片,光镜下观察病理改变。
1.2.6 免疫组化检测4-HNE在肝脏中的表达:取肝脏左叶小块组织进行固定、脱水、透明、包埋、切片,二甲苯脱蜡,微波炉热修复,过氧化氢孵育,血清封闭,加入兔抗大鼠4-HNE抗体,4℃过夜,加二抗孵育,DAB显色,染色后封片光镜观察,每张切片随机挑选4个视野,以平均吸光度表示4-HNE的表达水平。
1.2.7 Western blotting观察4-HNE在肝脏中的表达:肝组织经充分研磨、裂解、离心后,取上清液测蛋白浓度,电泳分离蛋白,转到PVDF膜上,封闭洗涤后与兔抗大鼠4-HNE抗体,4℃过夜,加二抗孵育,发光,应用Quantity One分析软件分析4-HNE的表达水平。GAPDH作内参对照。
1.3 统计学分析
2 结果
2.1 临床表现
A组未出现中毒症状,一般状态良好;B组出现小便失禁、流涎、气促症状,肌束震颤评分3分,并伴有肌无力、烦躁不安症状;C组出现流涎、气促,肌束震颤评分2分;D组仅出现轻微肌束震颤,肌束震颤评分1分;E组未出现中毒症状。
2.2 胆碱酯酶检测结果
B组血清胆碱酯酶明显降低,2 h下降原来值的94%,C组下降程度较染毒组轻,D组胆碱酯酶在2 h仅下降原来的21%,与C组胆碱酯酶下降程度比较差异有统计学意义(P<0.05),与E组下降程度相比差异无统计学意义(P>0.05)。见表1。
2.3 病理变化
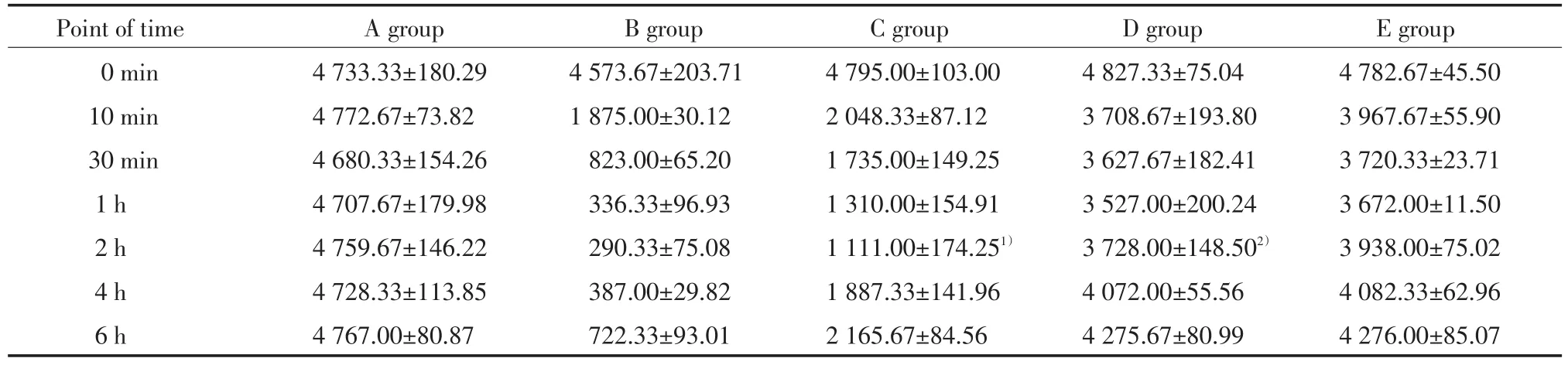
表1 胆碱酯酶检测结果(x±s,U/L)Tab.1 Results o f AChE(x±s,U/L)
A组肝细胞排列整齐,胞核完整,胞质染色正常;B组肝细胞排列及其紊乱,伴严重脂肪变性,胞质淡染,胞质内空泡形成,大量炎症细胞浸润,大量核固缩,碎裂;C组肝细胞排列稍紊乱,伴中度脂肪变,炎症细胞浸润,少量细胞核固缩、碎裂,损伤较B组减轻;D组肝细胞排列稍整齐,伴有轻度脂肪变性,少量炎症细胞浸润,偶可见细胞出现核固缩;E组肝细胞排列整齐,极轻度脂肪变性,偶有少量炎症细胞浸润,偶可见细胞出现核固缩。见图1。
2.4 免疫组化结果
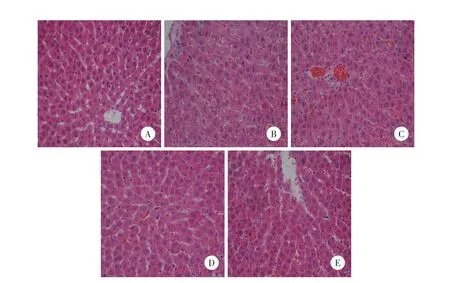
图1 各组肝脏HE染色×400Fig.1 HE staining o f liver ce lls×400
用免疫组化染色平均吸光度值表示4-HNE的表达情况。结果显示A组可见少量的4-HNE表达;B组可见胞质及胞核内4-HNE高表达,C组亦可见胞质及胞核内4-HNE高表达,且与B组比较无统计学差异(P>0.05);D组可见少量的4-HNE表达,与C组比较有统计学差异(P<0.05),与E组比较无统计学差异(P>0.05)。见图2。2.5 Western blotting结果
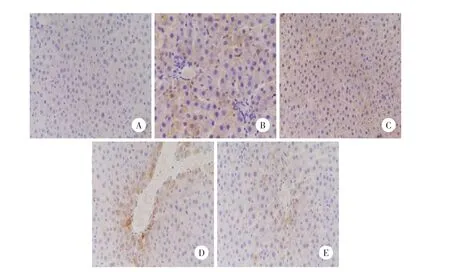
图2 各组肝脏4-HNE免疫组化×400Fig.2 Imm unohistochem ical staining analysis of 4-HNE in liver cells×400
Quantity One分析软件结果显示A组可见少量4-HNE的表达;B组表达高于A组,差异有统计学差异(P<0.05),与C组比较无统计学差异(P>0.05);D组可见少量4-HNE表达,与C组比较有统计学差异(P<0.05),与E组比较无统计学差异(P>0.05)。见图3。
图3 各组肝脏4-HNE表达Western blotting结果Fig.3 Western b lotting for liver 4-HNE expression in each group
3 讨论
目前普遍公认的有机磷中毒机制为乙酰胆碱酯酶抑制学说,有机磷酸酯抑制胆碱酯酶的活性,主要是使丝氨酸残基磷酸化,影响胆碱酯酶活性部位,使胆碱酯酶失去水解乙酰胆碱的能力,导致大量乙酰胆碱蓄积于突触间隙,产生一系列症状[4]。PON1是广泛存在于生物体内的一种与高密度脂蛋白相结合的钙依赖性酯酶[5-6],其在有机磷代谢中具有重要作用,能够催化磷酸酯键的水解,降解有机磷酸酯[7]。本研究观察了大鼠的中毒症状及检测血清胆碱酯酶的活性,结果显示,PON1治疗组疗效明显优于传统治疗组,且单独应用PON1与联合治疗效果未见明显差异。
有机磷既可以直接损伤肝细胞,亦能通过氧化磷酸化解偶联抑制线粒体ATP的生成,导致大量氧自由基的产生[8],从而使正常肝细胞发生水肿及脂肪变性、凋亡和自噬等损伤。有关研究[9-10]证明PON1可参与多种疾病的氧化应激发生发展过程。本研究结果显示,PON1治疗组肝脏损伤较染毒组及传统治疗组轻,与联合治疗组的病理损伤相差不大,证明PON1对敌敌畏所致大鼠肝损伤具有保护作用,且保护作用优于传统治疗。
敌敌畏中毒导致的氧化应激主要出现在中毒的早期。脂质过氧化是指脂类的氧化降解,其过程是自由基从细胞膜的脂质中掠夺电子,导致细胞的损伤,脂质过氧化的最终临床物为活性醛[11],4-HNE是脂质过氧化醛基产物中最具代表性的物质。4-HNE可快速与细胞内的亲核物质反应,对蛋白质的相关位点进行修饰,从而导致蛋白质功能障碍,并且可以通过加成反应修饰细胞外的基质蛋白,诱导巨噬细胞的聚集、活化,刺激活性氧、单核细胞趋化蛋白-1等,引起炎症反应[12]。有机磷中毒过程中4-HNE表达增加,进一步加重肝组织的损伤,导致肝细胞的凋亡,肝组织的炎症反应及纤维化。PON1可以保护低密度脂蛋白不被氧化[6],减少过量的过氧化物酶、氧化型磷脂的生成[13],从而减轻氧化应激反应,并可通过水解氧化磷脂来刺激胆固醇的增高,从而可以有效的缓解有机磷中毒导致的氧化应激损伤[14]。本研究结果显示,染毒组肝组织4-HNE的表达明显高于空白对照组,证明氧化应激确实参与了有机磷中毒过程。而PON1组4-HNE的表达明显减少,减少程度与传统治疗组存在统计学差异(P<0.05),且病理损伤较轻,证明其保护作用优于传统治疗。预测可能与PON1减轻了机体的氧化应激有关。
临床传统治疗有机磷农药中毒过程中易出现阿托品过量,医生很难把握其用量,本研究提示PON1单一治疗即可达到预期治疗效果。研究[13,15]表明,PON1作为有机磷中毒的有效预防用药,其对有机磷的清除作用是催化有机磷的酶促反应,显著优点是不钝化,可以水解成千上万个有机磷分子,直至酶本身失活,并且可以通过目标定向于红细胞表面,从而可以延长循环的时间,这一方案可以用于研究一种预防用药来长期保护有机磷神经毒气危害及农药中毒。
综上所述,PON1不仅能够通过水解有机磷保护有机磷中毒时的肝组织损伤,并且可能够通过减轻氧化应激来保护肝脏组织,且保护效果优于传统治疗。
[1]LANB T,SELVARAJAH LR,MOHAMED F,et al.High lethality and minimal variation after acute self-poisoning with carbamate insecticides in Sri Lanka-implications for global suicide prevention[J].Clin Toxicol(Phila),2016,54(8):624-631.DOI:10.1080/ 15563650.2016.1187735.
[2]郭瑞娟,陈隆望,连洁,等.调控对氧磷酶1基因对急性敌敌畏中毒小鼠肝氧化损伤的保护作用[J].中华危重病急救医学,2015,27(4):285-290.DOI:10.3760/cma.j.issn.2095-4352.2015.04.012.
[3]LI TG,WANG NN,DAI H,et al.Polyethylene glycosylation prolongs the stability of recombinant human paraoxonase-1[J].Toxicol Lett,2012,210(3):366-371.DOI:10.1016/j.toxlet.2012.02. 019.
[4]YADAV P,JADHAV SE,KUMAR V,et al.Protective efficacy of 2-PAMCl,atropine and curcumin against dichlorvos induced toxicity in rats[J].Interdiscip Toxicol,2012,5(1):1-8.DOI:10.2478/ v10102-012-0001-x.
[5]RODRIGUEZ-CARRIO J,LPEZ-MEJÍAS R,ALPERI-LPEZ M,et al.Paraoxonase 1 activity is modulated by the rs662 polymorphism and IgG anti-high-density lipoprotein antibodies in patients with rheumatoid arthritis:potential implications for cardiovascular disease[J].Arthritis Rheumatol,2016,68(6):1367-1376.DOI:10.1002/art.39609.
[6]GOKCE B,GENCER N,ARSLAN O,et al.In vitro inhibition effect of some coumarin compounds on purified human serum paraoxonase 1(PON1)[J].J Enzyme Inhib Med Chem,2016,31(4):534-537. DOI:10.3109/14756366.2015.1043297.
[7]张帆,韩新飞,张娜,等.重组人对氧磷酶1k192亚型对毒死蜱所致sd大鼠急性肝损伤的保护作用[J].中国医科大学学报,2016,45(2):101-105.DOI:10.12007/j.issn.0258-4646.2016.02. 002.
[8]吴斌,王菲,周觉,等.PON1基因过表达对急性敌敌畏中毒小鼠膈肌细胞损伤的影响[J].中华医学杂志,2015,95(36):2955-2959.DOI:10.3760/cma.j.issn.0376-2491.2015.36.015.
[9]ALONSO-NAVARRO H,JIMENEZ-JIMENEZ FJ,GARCIA-MARTIN E,et al.Genomic and pharmacogenomic biomarkers of Parkinson’s disease[J].Curr Drug Metab,2014,15(2):129-181.DOI:10.2174/138920021502140327175404.
[10]MENINI T,GUGLIUCCI A.Paraoxonase 1 in neurological disorders[J].Redox Rep,2014,19(2):49-58.DOI:10.1179/1351000 213Y.0000000071.
[11]GUO H,LIU Y,WANG L,et al.Alleviation of doxorubicin-induced hepatorenal toxicities with sesamin via the suppression of oxidative stress[J].Hum Exp Toxicol,2016,35(11):1183-1193.DOI:10.1177/0960327115626581.
[12]刘桂美,季文萱,黄俊彦,等.4羟基壬烯醛在糖尿病大鼠肾脏中的表达及意义[J].中国中西医结合肾病杂志,2013,14(9):773-775.DOI:10.3969/j.issn.1009-587X.2013.09.006.
[13]韩振坤.对氧磷酶1在有机磷农药中毒中的研究进展[J].中国急救医学,2012,32(1):72-75.DOI:10.3969/j.issn.1002-1949.2012.01.020.
[14]IKHLEF S,BERROUGUI H,KAMTCHUENG SO,et al.Paraoxonase 1-treated oxLDL promotes cholesterol efflux from macrophages by stimulating the PPARγ-LXRα-ABCA1 pathway[J]. FEBS Lett,2016,590(11):1614-1629.DOI:10.1002/1873-3468.12198.
[15]MCCRANOR BJ,HOFSTETTER CA,OLERT MA,et al.Targeting of organophosphorus compound bioscavengers to the surface of red blood cells[J].Chem Biol Interact,2016,259(Pt B):205-210. DOI:10.1016/j.cbi.2016.05.007.
(编辑北辰)
Use of Purified Rabbit Serum Paraoxonase 1 Compared with the Traditional Method of Curative Effect on Dichlorvos-induced Liver Injury in Rats
WANG Cong,TAO Weichen,LI Qi,WU Zeyang,GUO Zhenhao,ZHAO Min
(Emergency Department,Shengjing Hospital,China Medical University,Shenyang 110004,China)
Objective To explore whether the use of purified rabbit serum paraoxonase 1(PON1)for the treatment of dichlorvos-induced liver injury in rats is superior to traditional method.Methods Thirty male SD rats were randomly divided into the followint 5 groups,with 6 rats in each group:control group(A group),dichlorvos group(B group),traditional treatment group(C group),PON1 treatment group(D group),combined treatment group(E group).Rats in groups B,C,D and E were adminstered dichlorvos by intraperitoneal injection 9 mg/kg.In group C,atropine 10 mg/kg and iodine solution 45 mg/kg were injected intraperitoneally within 2 min after dichlorvos administration.In group D,PON1 was injected intravenously at a dose of 9 600 U/kg,30 min prior to poisoning.In group E,PON1 was injected intravenously at a dose of 9 600 U/kg,30 min prior to poisoning,followed by in travenous injection of atropine 10 mg/kg and iodine solution 45 mg/kg within 2 min after poisoning.Rats in A group
normal saline.Blood was collected at different time points to examine the acetyl cholinesterase(AChE)-levels by ELISA method.Liver tissue were collected at 12 hours after model establishment to observe the pathological changes.The expression of 4 hydroxy 2-nonenal(4-HNE)in the liver tissue was detected by immunohistochemistry and Western blotting.Results In group B,AChE levels decreased significantly,liver cells showed severe fatty degeneration,karyopyknosis and other pathological changes,and 4-HNE expression increased.The pathological changes of group D and group E were less obvious than those of group C,and the 4-HNE expression in the group D and group E were significantly different from that in the group C(P<0.05).Conclusion PON1 plays a protective role in dichlorvos-induced liver injury in rats,and this protection is better than that offered by traditional treatment.
paraoxonase 1;dichlorvos poisoning;liver injury;oxidative stress;4-hydroxy 2-nonenal
R575.5
A
0258-4646(2017)07-0582-05
10.12007/j.issn.0258-4646.2017.07.002
国家自然科学基金(81671898);盛京自由研究者计划(201207)
王聪(1992-),女,医师,硕士研究生.
赵敏,E-mail:zhaom@sj-hospital.org
2016-10-25
网络出版时间:
