猪源荚膜血清 F型多杀性巴氏杆菌分离鉴定
2017-08-01董文龙张喜庆田佳琪马红霞高云航
王 羽,董文龙,王 巍,张喜庆,田佳琪,马红霞,高云航
(吉林农业大学动物科学技术学院,吉林 长春 130118)
猪源荚膜血清 F型多杀性巴氏杆菌分离鉴定
王 羽,董文龙,王 巍,张喜庆,田佳琪,马红霞,高云航
(吉林农业大学动物科学技术学院,吉林 长春 130118)
本研究对从病死猪肺脏分离出的1株菌株,经菌落形态观察、培养特性、生化反应、药敏试验、动物致病性试验,并采用PCR对该分离菌株进行菌种及荚膜血清型鉴定。结果显示,该分离菌株为较少见的荚膜血清F型多杀性巴氏杆菌,对小鼠有较强致病性,且对不同药物的敏感性不同,为指导临床科学用药提供依据。
多杀性巴氏杆菌;分离鉴定;荚膜血清型
多杀性巴氏杆菌广泛分布于世界各地,能够引起动物各类疾病,如牛出血性败血症、猪萎缩性鼻炎、兔脓血症、鸟类禽霍乱。在同种或不同种动物间可相互传染。Carter G B等将Pm荚膜血清型分为A、B、D、E和F[1],在我国主要流行A、B型和D型,Townsend K M研究表明,基因Kmt1是Pm种的特异性片段[2]。A、B、D、E血清型和F血清型高度特异性的基因荚膜合成位点分别是hya D-hya C、bcb D、dcb F、ecb J、fcb D[3]。由于荚膜血清型决定病原菌的免疫原性,各血清型之间交叉免疫保护性较低[4],再加上抗生素的不合理使用,该菌逐渐产生了耐药性,这给疾病防控带来了很大困难。
1 材料与方法
1.1 培养基、药物、试验动物 TSA培养基、TSB培养基、麦康凯培养基,胎牛血清,购自北京元亨圣马生物技术研究所;红霉素、氯霉素、阿莫西林、氟苯尼考、阿奇霉素等11种药物,均购自河南惠农联科动物药业有限公司;昆明系小鼠,购自吉林大学实验动物中心。
1.2 发病情况 该猪场不同日龄的猪均有发病,猪舍内湿度大,空气不流通,饲料有受潮现象。8月上旬陆续有23头猪发病,病猪体温突然上升到41℃~42℃,呼吸困难,心跳加快,口鼻黏膜发紫。耳根、颈部、腹部等处发生出血性红斑。2~3 d内出现死亡。
1.3 剖检变化 剖检病死猪可见气管内有大量泡沫样黏液。肺部淤血、水肿,主要位于尖叶、心叶和膈叶前缘。肝病变表面有坏死灶,并与胸膜粘连。胸腔及心包腔积液。胸部淋巴结肿大,切面发红、多汁。
1.4 病原分离培养 无菌分离病死猪肺脏接种于TSA培养基(含50 mL/L胎牛血清)和麦康凯培养基上进行分离培养,置37℃恒温箱培养18~24 h后,观察细菌生长情况,菌落形态。
1.5 涂片镜检 挑取纯化后的单个菌落,进行革兰染色和美蓝染色,镜检。
1.6 细菌生化鉴定 将纯化后的细菌,接种于葡萄糖、果糖、甘露醇、蔗糖、山梨醇、乳糖、鼠李糖、麦芽糖、吲哚、M.R.(甲基红)、V-P(乙酰甲基甲醇)培养基中。
1.7 致病性试验 将分离纯化的菌株接种到TSA培养基(含50 mL//L胎牛血清),37℃培养24 h。将菌液按10倍系数倍比稀释,进行活菌平板计数。随机将小鼠分为2组,每组5只。每个稀释度腹腔注射一组小鼠,0.3 mL/只,对照组每只小鼠接种0.3 mL生理盐水。观察并记录各组小鼠的发病及死亡情况,以寇氏改良法计算半数死量(LD50);同时采集死亡小鼠的肝脏、心脏进行细菌的分离鉴定。
1.8 PCR鉴定 参考Townsend等报道的多杀性巴氏杆菌特异性基因kmt1和荚膜血清型基因hya D-hya C、bcb D、dcb F、fcb D设计引物血清型A、B、D、F型[2]。引物序列送上海生工生物工程技术服务有限公司进行合成。如表1。

表1 引物
挑取单个菌落接种于TSB液体培养基中,置于37℃水平摇床(170 r/min离心)增菌培养。取1.6 mL菌液12 000 r/min离心,弃上清,运用酚-氯仿法提取分离菌株DNA。
以提取的DNA为模板,对kmt1基因及荚膜血清型基因进行扩增。PCR扩增条件为94℃ 5 min; 94℃ 1 min;50℃ 1 min;72℃ 1 min;30个循环; 72℃延伸10 min;4℃保存,随后用琼脂糖凝胶电泳检测PCR产物。对PCR产物进行胶回收纯化,将纯化的PCR产物和pMD-18T连接过夜,将连接产物转化到E.coli.DH5α感受态细胞,按照试剂盒提取质粒进行验证,并送至上海生工生物工程技术服务有限公司测序。
1.9 药敏试验 将多杀性巴氏杆菌接种到TSB液体培养基中,37℃水平摇床(170 r/min离心)过夜。将测定过浓度的多杀性巴氏杆菌菌液进行倍比稀释至,选取浓度为106CFU/mL的菌液作为药敏试验用的细菌标准液进行抗菌药物敏感性试验。
参考CLSI动物源细菌药敏试验标准,分别以敏感、中介和耐药3种形式对MIC值大小进行评定,并进行药物敏感性分析。
2 结果
2.1 多杀性巴氏杆菌分离培养 通过镜检、生化试验及多杀性巴氏杆菌特异性基因扩增,成功分离到猪源多杀性巴氏杆菌。病料接入TSA(含50 mL/L胎牛血清)培养基上,培养24 h后,菌落润滑,似水珠状,在麦康凯培养基上不生长。
2.2 镜检结果 多杀性巴氏杆菌美蓝染色表现两极浓染,革蓝染色表现出阴性菌,单个或成对存在。显微镜检查结果如中插彩版图1所示。
2.3 细菌的生化试验结果 多杀性巴氏杆菌生化试验的结果为,分离菌株可以发酵果糖、葡萄糖、甘露醇,产酸不产气,不能发酵麦芽糖、乳糖、鼠李糖,吲哚、硝酸盐还原试验表现阳性,M.R.V-P试验表现阴性。该分离菌符合多杀性巴氏杆菌生化特征。
2.4 致病性试验结果 活菌平板计数测得菌液浓度为5×1010CFU/ml,LD50值为6.29×107。试验组5只小鼠36 h出现背毛逆立,精神沉郁,站立不稳,48 h后小鼠出现死亡。对照组小鼠无异样。剖检病死小鼠,观察病变,并进行细菌分离及分子生物学鉴定,初步确定为多杀性巴氏杆菌。
2.5 PCR鉴定及分型 以DNA为模板,扩增多杀性巴氏杆菌特异基因引物kmt1,在400~600 bp得到特异性条带,见图2。多杀性巴氏杆菌kmt1有较高特异性和灵敏度,其kmt1序列可不经测序,直接用于对多杀性巴氏杆菌的快速鉴定[5]。对F荚膜血清型特异性引物进行PCR扩增,在约700~1 000 bp得到特异性条带,见图3。
2.6 基因的序列分析 对700~1 000 bp之间的特异性片段的测序结果表明,分离菌株全长为852 bp,扩增序列与GenBank上已公布的荚膜血清型特异性基因fcb D多杀性巴氏杆菌(AY604234.1)序列同源性达到100%,据此可鉴定该菌为F型多杀性巴氏杆菌。

图2 Pm的kmt1基因扩增结果M:Mark;L:kmt1基因扩增产物
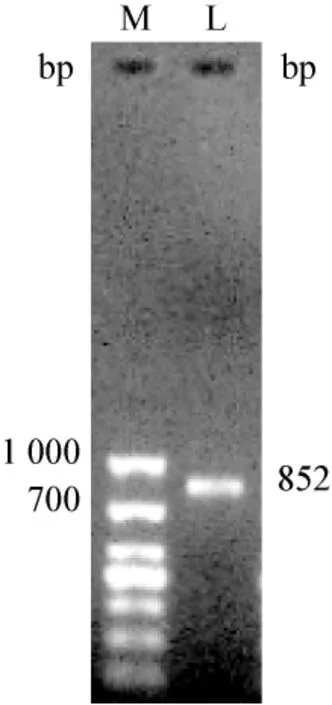
图3 Pm的血清型扩增结果M:Mark;L:Pm血清型扩增
2.7 耐药性分析结果 耐药结果为分离菌株对红霉素、阿米霉素的耐药性表现中等,而对阿莫西林、环丙沙星、庆大霉素、磺胺间甲氧嘧啶表现耐药,对氯霉素、氟苯尼考、阿奇霉素、恩诺沙星、强力霉素敏感。
3 讨论
分离菌株经菌落形态观察、培养特性、生化反应初步判定为多杀性巴氏杆。该菌对人工培养基具有选择性,在TSA(含50 mL/L胎牛血清)培养基上生长良好,在麦康凯上不生长。
我国由多杀性巴氏杆菌引起的猪病主要流行株为荚膜A,B型和D型[6]。其中A型引起猪肺疫,B型引起牛出血性败血症,D型引起猪传染性萎缩性鼻炎[7]。而荚膜血清F型巴氏杆菌报道非常少见[7],1987年,荚膜血清F型巴氏杆菌从火鸡体内被分离出[8],后证实该荚膜血清与禽霍乱有关,对火鸡有十分强的致病性。本研究通过常规方法从仔猪肺脏中分离到一株多杀性巴氏杆菌,用Townsend等人的研究方法对细菌的血清型进行鉴定,结果为F型。该分离菌株对小鼠有较强的致病性。关于荚膜血清F型巴氏杆菌对猪群的致病机制目前还不清楚,还有待进一步研究。
多杀性巴氏杆菌对某一类具有相同或是相似结构的抗菌药物耐药,可能是抗菌药物新作用位点的产生或是作用位点的改变[9]。有研究表明,在印度的8个反刍养殖场的所有抗生素试验中,多杀性巴氏杆菌对恩诺沙星和氯霉素敏感[10]。孔令聪从我国不同地区分离得到12株多杀性巴氏杆菌。此12株菌对新诺明、链霉素高度耐药[5]。本试验分离菌株对阿莫西林、环丙沙星、庆大霉素、磺胺间甲氧嘧啶表现耐药,这可能与抗生素用量不断加大,品种更新快有关。
近年来随着猪饲养量的增加,猪多杀性巴氏杆菌病发病率也越来越高,多杀性巴氏杆菌是一种条件性病原菌,当猪处在不良的环境中,如寒冷、闷热潮湿、气候剧变、通风不良、营养缺乏、长途运输等,致使猪的抵抗力下降,这时病原菌大量增殖并引起发病。另外病猪可经分泌物、排泄物等排菌传染给健康猪。也可由咳嗽、喷嚏经呼吸道传染。此外,吸血昆虫叮咬皮肤及黏膜伤口都可传染。本病一般无明显的季节性,但以冷热交替、气候多变,高温季节多发,一般呈散发性或地方流行性。所以养殖户必须制定相应的防治措施,加强综合饲养管理,以控制传染源,切断传播途径,增强易感动物抵抗力为原则,才能控制多杀性巴氏杆菌病的发病率,为养殖场带来更大的经济效益。
[1] Carter G R,Genus I.Pasteurella.In:Bergey's manual of system atic bacteriology[M].Baltimore:Williams and Wilkins,1984: 554-557.
[2] Townsend K M,Boyce J D,Frost A J,etal.Developmentof PCR assays for species-and type-specific identification of Pasteurella multocida isolates[J].J Clin Microbiol,1998,36(4): 1096-1100.
[3] Townsend K M,Boyce J D,Chung J Y,et al.Genet ic organi zation of Pasteurella multocida caplociand developmentofa multiplex capsular PCR typing system[J].J Clin Microbiol,2001,39 (3):924-929.
[4] Cm J R,Rt E.Polymorphism in repeated16S rRNA genes is a common property oftype strains and environmentalisolates ofthe genus Vibrio[J].Microbiology,2002,148(pt4):1 233-1 239.[5] 孔令聪.牛源荚膜血清A型多杀性巴氏杆菌的分离鉴定及对喹诺酮类抗生素耐药机制[D].长春:吉林农业大学,2013.
[6] 马文戈,于力.牛源荚膜血清A型多杀性巴氏杆菌的分离鉴定[J].中国预防兽医学报,2008,30(10):747-750+754
[7] 高明燕,徐步,赵宝华,等.多杀性巴氏杆菌检测、鉴定和分型研究进展[J].动物医学进展,2010,31(1):67-72.
[8] 李富祥,宋建领,李华春,等.猪源多杀性巴氏杆菌的分离鉴定及其荚膜血清型鉴定[J].上海畜牧兽医通讯,2012,02:19-21.
[9] Rimler R B,Rhoades K R,Serogroup F.a new capsular serogroup of Pasteurella mutocida[J].J Clin Mcrobiol,1987,25(4):615-618
[10] 林志敏,林彬彬,程龙飞.禽源多杀性巴氏杆菌耐药性及其质粒多样性的研究[J].福建农业学报,2015,31(7):648-651.
Isolation and identification of a Pasteurella multocida strain belonged to capsular type F from swine
WANG Yu,DONG Wen-long,WANG Wei,ZHANG Xi-qing,TIAN Jia-qi,MA Hong-xia,GAO Yun-hang
(College of Animal Science and Technology,Jilin Agricultural University,Changchun 130118,China)
In this study,one strain was identified by colonial morphology,culture characteristics,biochemical reaction,antimicrobial susceptibility test,and animal pathogenicity test.Species and capsular serotype were determined using PCR.Results showed that the strain belonged to capasular type F of Pasteurella multocida(Pm),which had a strong pathogenicity to mice,and the sensitivity to different drug was different.
Pasteurella multocida;isolation and identification;capsular serotype
GAO Yun-hang
S828
A
0529-6005(2017)06-0031-03
2016-11-21.
国家自然科学基金项目(31272611)
王羽(1993-),女,硕士生,从事动物疫病防治工作,E-mail:1846020084@qq.com
高云航,E-mail:gaoyunhang@163.com
