超声辅助美拉德反应提高大豆蛋白冻融性质
2017-07-19张泽宇张诗雨王喜波江连洲
张泽宇 张诗雨 于 洁 王喜波 江连洲 徐 日
(东北农业大学食品学院,哈尔滨 150030)
超声辅助美拉德反应提高大豆蛋白冻融性质
张泽宇 张诗雨 于 洁 王喜波 江连洲 徐 日
(东北农业大学食品学院,哈尔滨 150030)
为了提高大豆蛋白的冻融性质,试验采用超声辅助美拉德反应的方法改性大豆蛋白,以改性产物的乳化性质和乳析指数为考核指标,研究大豆分离蛋白与葡聚糖(SPI∶D)质量比、反应温度、超声功率、反应时间对改性产物冻融性质的影响。结果表明,SPI∶D为2∶3、反应温度80 ℃、超声功率500 W、反应时间40 min时,改性产物冻融稳定性较好,SPI-D接枝物与对照SPI相比,乳化活性和乳化稳定性分别提高了39.89%和43.80%,经1、2、3次冻融循环后乳析指数分别降低了57.76%、75.33%、96.20%,在1、2、3次冻融循环后乳液粒径分别降低了34.04%、42.12%、126.9%。
超声波 大豆分离蛋白 乳化性 乳析指数 粒径
大豆蛋白因具有较高营养价值和良好的功能特性在食品工业中广泛应用。大豆蛋白具有表面活性,在食品体系中常被用作乳化剂[1]。许多食品在生产加工及贮存过程中都要经过冷冻-解冻处理,例如冰激淋、植物奶油、蛋黄酱等。蛋白质作为乳化剂制备的乳液在进行冷冻时,随着温度的降低,水相形成冰晶体,体积膨胀,介质被浓缩,当达到饱和状态时,产生沉淀。冰晶体的增多,间隙中的乳液粒子被挤压形成聚结体,当乳液融化时,很难恢复成原来的分散状态,进而表现出絮凝、聚结、乳析、奥氏熟化,最终导致油相水相分离,乳液冻融稳定性较差[2-4]。
孙炜炜[5]利用干法糖基化反应得到乳清分离蛋白-葡聚糖共价复合物,将其作为乳化剂制备的乳液经过冻融循环处理后,粒径无明显增加,没有出现脂肪上浮、絮凝、聚结等不稳定现象。Xu等[6]采用乳清分离蛋白和葡聚糖通过干法制备接枝产物Ⅰ(80 ℃,2 h)和产物Ⅱ(60 ℃,5 d),结果发现糖基化产物Ⅱ由于接枝程度高,比产物Ⅰ的冻融稳定性好。孙洪蕊等[7-8]通过湿法糖基化得到的大豆分离蛋白-葡聚糖接枝物冻融前后乳化性显著提高。窦超然等[9]发现大豆分离蛋白与麦芽糊精湿法接枝物冻融后分层系数和出油率显著降低。在前面学者研究的基础上本试验采用超声辅助美拉德反应进一步改善大豆蛋白的冻融性质,加快反应速率,缩短反应时间。以乳化性和1、2、3次冻融循环后乳析指数为评价指标,研究制备高冻融稳定性的大豆分离蛋白,以期为其在冷冻食品行业的应用提供参考。
1 材料与方法
1.1 材料与试剂
脱脂豆粉:哈高科大豆食品有限责任公司;大豆分离蛋白(蛋白质质量分数90.45%):碱溶酸沉法自制;葡聚糖4万:国药集团化学试剂有限公司;大豆油:九三集团哈尔滨惠康食品有限公司;十二烷基磺酸钠(SDS):Biotopped公司。
1.2 主要仪器
ALPHA 1-4 LSC冷冻干燥机:德国Christ公司;XH-2008D超声波合成萃取仪(探头直径:8 mm,超声波频率:25 kHz):北京祥鹄科技发展有限公司;T18 Basic高速分散机:德国IKA公司;TU-1800紫外可见分光光度计:北京普析通用仪器有限责任公司;Mastersizer 2000激光粒度分析仪:英国Malvern公司。
1.3 试验方法
1.3.1 超声SPI-D的制备
将大豆分离蛋白与葡聚糖按一定比例(2∶1、1∶1、2∶3、1∶2、1∶3)溶解于0.01 mol/L pH 8.0磷酸盐缓冲液,配成蛋白质量浓度为40 mg/mL的溶液,室温下搅拌2 h后置于4 ℃冰箱中过夜。取出平衡至室温,取蛋白样品溶液100 mL置于超声反应器中,预热到超声波合成萃取仪设定的温度(70、75、80、85、90 ℃),以一定功率(200、300、400、500、600 W)处理一定时间(20、30、40、50、60 min),冰水浴冷却5 min使反应停止。反应液在4 000 r/min下离心10 min,上清液即为超声SPI-D接枝物,于蒸馏水中透析24 h,冷冻干燥制成冻干粉。
1.3.2 乳化性测定
将冻干蛋白样品溶解于0.2 mol/L pH 7.0磷酸盐缓冲液,蛋白质量浓度为2 mg/mL。蛋白溶液与大豆油按体积比3∶1混合,11 000 r/min均质1 min形成乳化液,分别在均质后0和10 min时,在混合液底部取100 μL加入到10 mL 0.1% SDS溶液中,混合均匀于500 nm处测定吸光值[10],以0.1% SDS溶液为空白。乳化活性(EAI)表示为:
式中:EAI是每克蛋白质的乳化面积/m2/g;T=2.303;N是稀释倍数100;φ是体系中油相所占体积分数0.25;C是蛋白质的浓度/g/mL;L是比色池光径1 cm。
乳化稳定性(ESI)表示为:
式中:A0为0 min时的吸光值;A10为10 min时的吸光值;ΔT为时间差10 min。
1.3.3 乳液制备
将冻干蛋白样品溶解于0.01 mol/L pH 7.0磷酸盐缓冲液,蛋白质量浓度为20 mg/mL。蛋白溶液与大豆油按体积比9∶1混合,11 000 r/min均质3 min形成粗乳液,再超声处理6 min,形成微乳液[11-12]。
1.3.4 乳析指数测定
参考Taherian等[13]的方法,新鲜制备的乳液立即转移到10 mL塑料管内,在-18 ℃冷冻保存22 h,取出后20 ℃水浴解冻2 h,连续进行3次冻融循环。用刻度尺测量底部乳清层高度和乳液总高度,按下式计算乳液1、2、3次冻融循环后的乳析指数。
式中:HS表示乳清层高度/cm;HT表示乳液总高度/cm。
1.3.5 粒径测定
将乳液分散在1 000 mL去离子水中使遮光率超过10%,设定颗粒折射率为1.460,分散剂折射率为1.330,采用激光粒度分析仪测定0、1、2、3次冻融循环后乳液的体积平均粒径。
1.4 统计分析
所有试验重复3次,结果以均值±标准偏差表示,采用Origin 9软件绘图。
2 结果与分析
2.1 SPI与葡聚糖的质量比对超声SPI-D冻融稳定性的影响
在反应温度80 ℃,超声功率400 W,反应时间30 min下,研究不同SPI∶D质量比对超声SPI-D乳化性和1、2、3次冻融循环后乳析指数的影响。

图1 SPI:D质量比对超声SPI-D乳化性的影响

图2 SPI:D质量比对超声SPI-D乳析指数的影响
由图1可知,随着葡聚糖添加量的增加,超声SPI-D乳化性呈现逐渐增加趋势,乳化活性在1∶1时最大,乳化稳定性在2∶3时最大,二者达到最大值后略有下降。SPI制备的乳液在冻融过程中脂肪球与连续相之间出现密度差,脂肪球上浮,发生乳析现象。从图2可以看出,SPI乳液冻融循环后乳析指数急剧增大,而超声SPI-D乳液在1、2、3次冻融循环后乳析指数有了很大程度的降低。随着糖添加比例的增加乳析指数逐渐下降,在2∶3时最小,后来增加不明显。在超声波作用下大豆蛋白球状分子展开,疏水基团不断暴露,糖分子与蛋白质分子碰撞机会增多,糖链不断接入到蛋白质分子中,增加了蛋白质的溶解性[14],同时多糖还有增稠作用,增加乳液中未冷冻的水的量和水相的黏度,使油滴运动变慢,降低油滴聚结现象的发生[15],因而改性产物冻融稳定性和乳化性显著增加。当葡聚糖含量继续增加,反应体系黏度过大,分子流动性差,不利于美拉德反应进行[16]。综合考虑其乳化性和乳析指数以及葡聚糖成本问题,选取SPI与葡聚糖的质量比为2∶3进行后续试验。孙洪蕊等[7]和窦超然等[9]优化得到蛋白质与葡聚糖质量比分别为1∶3和1∶2,与之相比本试验糖的添加量减少了,降低了成本。
2.2 反应温度对超声SPI-D冻融稳定性的影响
在SPI∶D质量比2∶3,超声功率400 W,反应时间30 min下,研究不同反应温度对超声SPI-D乳化性和1、2、3次冻融循环后乳析指数的影响。
从图3中可以看出,超声SPI-D的乳化稳定性随着温度的增加呈现出先升高后下降的趋势,在温度为80 ℃时最大,超过该温度后急剧下降。而在75~85 ℃间乳化活性增加不是很显著,当温度增大到90 ℃时下降明显。由图4可知,在反应温度80 ℃

图3 反应温度对超声SPI-D乳化性的影响

图4 反应温度对超声SPI-D乳析指数的影响
时乳析指数最低,当温度继续增加时其乳析指数又显著增大。在一定范围内随温度升高,SPI分子结构展开,柔韧性增加,与葡聚糖美拉德反应速度加快,改性产物亲水性增大从而导致乳化性和冻融稳定性提高。当反应温度继续升高到85 ℃时,蛋白质严重变性,结构发生很大变化,改性产物界面活性降低,同时也由于过多的糖链引入而失去油水平衡[17],乳化性和冻融稳定性下降,这与Wu等[18]得到的结果一致。综合考虑乳化性和乳析指数,选取反应温度为80 ℃进行后续试验。孙洪蕊等[7]和窦超然等[9]最佳反应温度分别为95和90 ℃。与二者相比,本试验在超声波辅助下糖基化反应温度降低到80 ℃。
2.3 超声功率对超声SPI-D冻融稳定性的影响
在SPI∶D质量比2∶3,反应温度80 ℃,反应时间30 min下,研究不同超声功率对超声SPI-D乳化性和1、2、3次冻融循环后乳析指数的影响。
由图5可知,在200~500 W范围内随着超声功率的增加超声SPI-D乳化性呈直线增加的趋势,当超过500 W后出现降低。图6中乳析指数随超声功率的增大而逐渐减少。SPI乳化性和冻融稳定性与大豆分离蛋白结构变化存在着密切关系。超声的空化效应和机械震荡效应破坏了蛋白质分子的四级结构,释放出小分子的亚基和肽[19],SPI分子中的α-螺旋和β-折叠明显减少,向无规则卷曲进行转变,SPI分子结构越来越疏松,游离氨基含量不断增加,蛋白分子与糖分子间相互碰撞次数增多,加快接枝反应进行[20],接枝后蛋白质快速吸附到油水界面,形成一层蛋白保护膜,使其可以降低冷冻时产生的冰晶体对乳液造成的破坏,减缓液滴相互聚集而发生乳析现象[21],从而乳化性和冻融稳定性有了很大程度的提高。当功率达到600 W时,由于功率过高会使蛋白发生聚集,体系中不溶性组分显著增多,乳化活性和乳化稳定性均降低,但乳析指数变化不大,500 W时超声SPI-D乳液在油水界面形已形成稳定的二相体系,进一步增加功率对其冻融稳定性影响不大。综合考虑应选取500 W进行后续试验。

图5 超声功率对超声SPI-D乳化性的影响

图6 超声功率对超声SPI-D乳析指数的影响
2.4 反应时间对超声SPI-D冻融稳定性的影响
在SPI∶D质量比2∶3,反应温度80 ℃,超声功率500 W下,研究不同反应时间对超声SPI-D乳化性和1、2、3次冻融循环后乳析指数的影响。

图7 反应时间对超声SPI-D乳化性的影响
由图7可知,对前面3个因素优化的基础上,反应时间增加到40 min后,继续延长时间改性产物乳化活性和乳化稳定性变化不明显。在40 min时乳化活性最大,乳化稳定性在50 min时最大。由图8可知,超声SPI-D制备的乳液冻融后乳析指数随反应时间的延长先降低后升高,在40 min时乳析指数最小。综合考虑选取40 min为最佳反应时间。孙炜炜[5]研究乳清分离蛋白与葡聚糖接枝物冻融稳定性时,采用干法美拉德反应,需要时间一周左右。孙洪蕊等[7]在湿法美拉德反应提高大豆蛋白冻融前后乳化性中优化出最佳时间4 h。窦超然等[9]研究大豆分离蛋白与麦芽糊精湿法糖基化反应,以分层系数和出油率为指标,最优时间为3 h。本试验在超声波辅助作用下进行美拉德反应,大豆分离蛋白冻融稳定性显著提高,同时反应时间缩短至40 min,提高了反应效率。
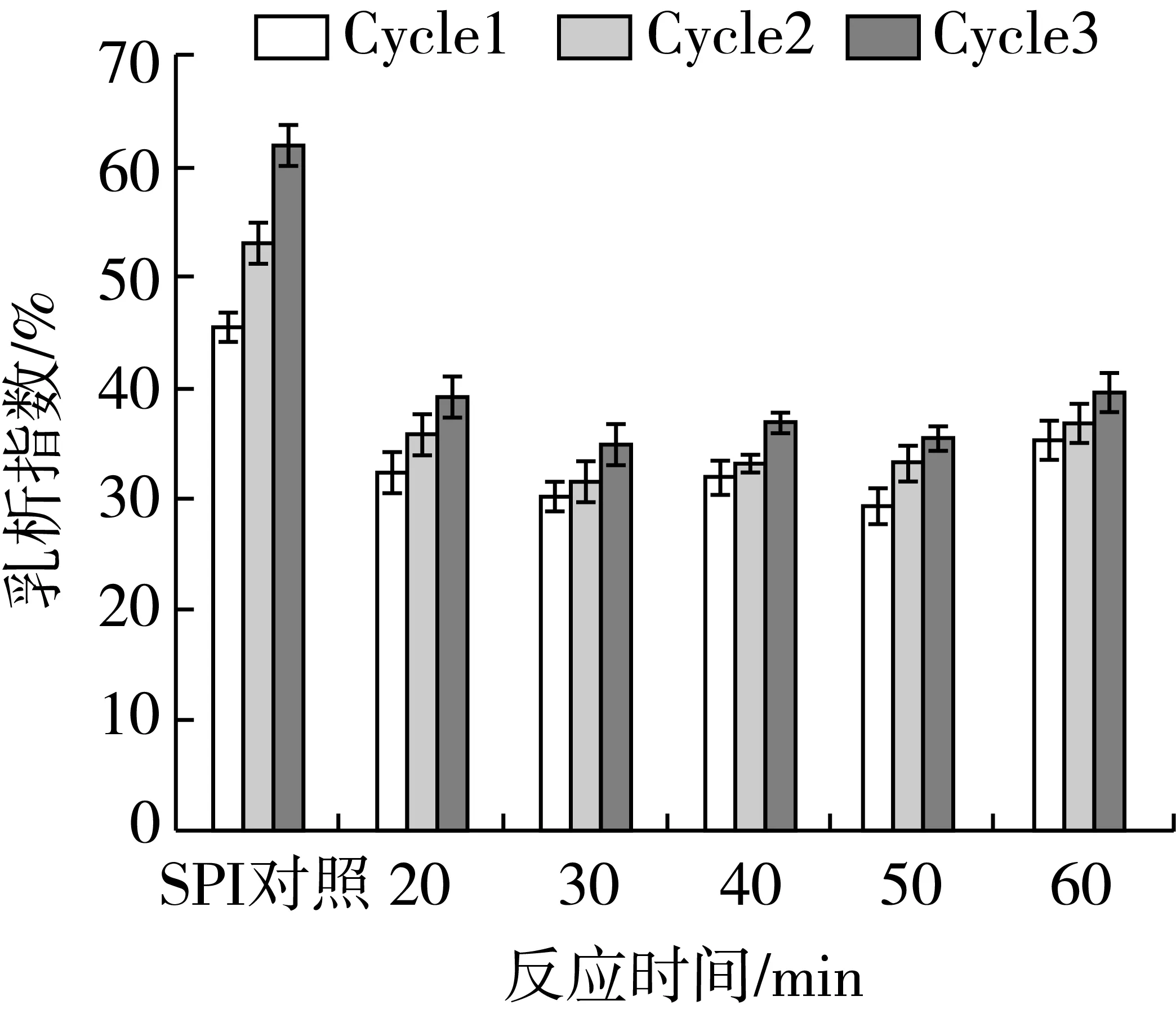
图8 反应时间对超声SPI-D乳析指数的影响
2.5 单因素相关性分析
在单因素试验基础上,运用SPSS19.0软件对4个因素与乳化活性、乳化稳定性和乳析指数间的相关性进行了分析,为下一步优化试验做准备。相关性用Pearson相关系数表示,用*表示显著(P<0.05),**表示极显著(P<0.01)。由表1可知,对乳化活性影响较大的因素为超声功率和反应时间,而乳化稳定性影响较大的为SPI∶D质量比、超声功率和反应时间。超声功率对乳析指数高度负相关,反应温度对其正相关。
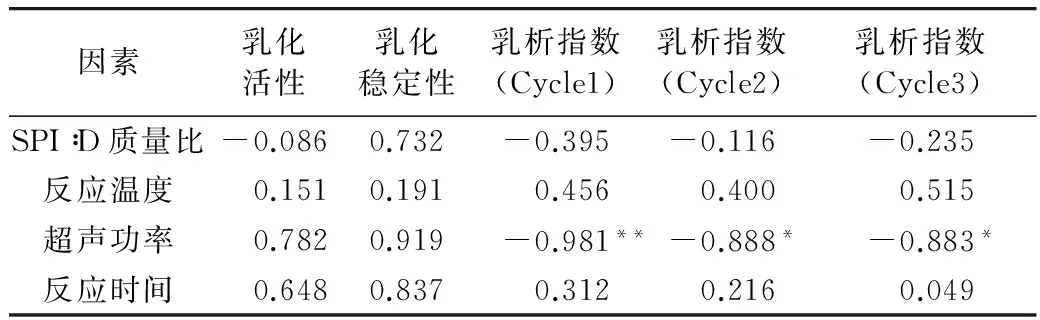
表1 4个因素与指标间相关性分析
2.6 不同样品冻融稳定性
根据单因素的试验结果,较优的试验组合条件为:SPI∶D质量比2∶3、反应温度80 ℃、超声功率500 W、反应时间40 min。在此条件下进行3次验证试验,同时设定SPI、SPI+D混合物(SPI与葡聚糖按质量比2∶3混合溶于磷酸盐缓冲液,再冷冻干燥制成冻干粉)2个对照组。乳化性和乳析指数结果如表2所示。粒度分布是影响乳析的主要因素,乳析指数与粒径呈正相关,粒径越大,上浮速度越快,乳析指数也越大[22]。不同样品冻融循环后粒径见表3。
加入葡聚糖后SPI乳化性略有提高,超声SPI-D改性产物与SPI相比乳化活性和乳化稳定性分别提高了39.89%、43.80%。2个对照组随冻融循环次数的增加乳析指数急剧增加,超声SPI-D随着冻融循环次数的增加乳析指数增幅不大,与SPI对照组相比在1、2、3次冻融循环后乳析指数分别降低了57.76%、75.33%、96.20%。制备的新鲜乳液粒径大小顺序为超声SPI-D>SPI+D混合物>SPI。随着冻融循环次数的增加,SPI、SPI+D混合物乳液的粒径增加显著,且SPI乳液的增加幅度大于SPI+D混合物,葡聚糖的加入在一定程度上减缓了粒径的增加。而超声SPI-D制备的乳液在经历冷冻-解冻循环后,粒径变化不明显。与SPI对照组相比,超声SPI-D在1、2、3次冻融循环后乳液粒径分别降低了34.04%、42.12%、126.9%,和乳析指数结果一致。说明通过超声波辅助大豆分离蛋白与葡聚糖进行美拉德反应来提高其冻融稳定性的方法是可行的。

表2 不同样品乳化性和冻融循环后乳析指数

表3 不同样品冻融循环后粒径
3 结论
利用超声波辅助美拉德反应技术能有效提高大豆分离蛋白的冻融稳定性,并缩短改性时间、提高改性效率、节省了能源、降低了成本,为冷冻食品专用大豆蛋白的产业化开发提供新思路和技术依据。
[1]Palazolo G G, Sobral P A, Wagner J R. Freeze-thaw stability of oil-in-water emulsions prepared with native and thermally-denatured soybean isolates[J]. Food Hydrocolloids, 2011, 25(3): 398-409
[2]Ghosh S, Cramp G L, Coupland J N. Effect of aqueous composition on the freeze-thaw stability of emulsions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 272(1): 82-88
[3]Gu Y S, Decker E A, McClements D J. Application of multi-component biopolymer layers to improve the freeze-thaw stability of oil-in-water emulsions: β-Lactoglobulin-ι-carrageenan-gelatin[J]. Journal of Food Engineering, 2007, 80(4): 1246-1254
[4]Magnusson E, Rosén C, Nilsson L. Freeze-thaw stability of mayonnaise type oil-in-water emulsions[J]. Food Hydrocolloids, 2011, 25(4): 707-715
[5]孙炜炜. 乳清分离蛋白-葡聚糖接枝改性及功能性质研究[D]. 广州:华南理工大学, 2012 Sun Weiwei. Study on the physicochemical and functional properties of whey protein isolate-dextran conjugate[D]. Guangzhou: South China University of Technology, 2012
[6]Xu D X, Yuan F, Wang X Y, et al. The effect of whey protein isolate-dextran conjugates on the freeze-thaw stability of oil-in-water emulsions[J]. Journal of Dispersion Science and Technology, 2011, 32(1): 77-83
[7]孙洪蕊, 张英华, 王喜波, 等. 提高大豆蛋白冻融后乳化性改性工艺优化[J]. 农业工程学报, 2014, 30(7): 281-286 Sun Hongrui, Zhang Yinghua, Wang Xibo, et al. Processing optimization for improving soybean protein’s emulsifying properties after freeze-thaw[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(7): 281-286
[8]孙洪蕊, 王喜波, 张英华, 等. 抗冻融大豆蛋白的制备[J]. 中国粮油学报, 2015, 30(4): 50-55 Sun Hongrui, Wang Xibo, Zhang Yinghua, et al. Preparation of soy protein with high freeze-thaw stabilization[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(4): 50-55
[9]窦超然, 于国萍, 宋岩, 等. 冻融稳定型糖基化大豆分离蛋白的制备[J]. 食品工业, 2013, 34(4): 3-5 Dou Chaoran, Yu Guoping, Song Yan, et al. Preparation of glycosylated soy protein isolate with freeze-thaw stabilization[J]. Food Industry, 2013, 34(4): 3-5
[10]Pearce K N, Kinsella J E. Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J]. Journal of Agriculture and Food Chemistry, 1978, 26(3): 716-723[11]Horn A F, Wulff T, Nielsen N S, et al. Effect of α-lactalbumin and β-lactoglobulin on the oxidative stability of 10% fish oil-in-water emulsions depends on pH[J]. Food Chemistry, 2013, 141(1): 574-581
[12]Noshad M, Mohebbi M, Shahidi F, et al. Freeze-thaw stability of emulsions with soy protein isolate through interfacial engineering[J]. International Journal of Refrigeration, 2015, 58: 253-260
[13]Taherian A R, Britten M, Sabik H, et al. Ability of whey protein isolate and/or fish gelatin to inhibit physical separation and lipid oxidation in fish oil-in-water beverage emulsion[J]. Food Hydrocolloids, 2011, 25(5): 868-878
[14]Zhang B, Chi Y J, Li B. Effect of ultrasound treatment on the wet heating Maillard reaction between β-conglycinin and maltodextrin and on the emulsifying properties of conjugates[J]. European Food Research and Technology, 2014, 238(1): 129-138
[15]Degner B M, Chung C, Schlegel V, et al. Factors influencing the freeze-thaw stability of emulsion-based foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2014, 13(2): 98-113
[16]王延青. 大豆蛋白-多糖共价复合物的制备及功能特性研究[D]. 郑州:河南工业大学, 2010 Wang Yanqing. Forming and functional properties of soybean protein-polysaccharides conjugations [D]. Zhengzhou: Henan University of Technology, 2010
[17]班玉凤, 朱海峰, 关纳新. 热处理对大豆蛋白酶解性能的影响[J]. 现代食品科技, 2005, 21(1): 72-77 Ban Yufeng, Zhu Haifeng, Guan Naxin.Effect of heat treatment on enzymatic hydrolysis of soybean protein[J]. Modern Food Science and Technology, 2005, 21(1): 72-77
[18]Wu S X, Boeke M V, Martins S, et al. Effects of temperatures on Maillard reactions[J]. Food Science, 2005, 26(7): 63-66
[19]杨会丽, 马海乐. 超声波对大豆分离蛋白物理改性的研究[J]. 中国酿造, 2009, 206(5): 24-27 Yang Huili, Ma Haile. Physical modification of soy protein isolate by ultrasound[J]. China Brewing, 2009, 206(5): 24-27
[20]孙英杰. 超声波处理对大豆分离蛋白结构和功能性质影响研究[D]. 哈尔滨:东北农业大学, 2014 Sun Yingjie. Study on the effect of ultrasonic treatments on structure and functional properties of SPI[D]. Haerbin: Northeast Agricultural University, 2014
[21]Pongsawatmanit R, Harnsilawat T, McClements D J. Influence of alginate, pH and ultrasound treatment on palm oil-in-water emulsions stabilized by β-lactoglobulin[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 287(1): 59-67
[22]Robins M M, Watson A D , Wilde P J. Emulsions-creaming and rheology[J]. Current Opinion in Colloid and Interface Science, 2002, 7(5-6): 419-425.
Improving Freeze-Thaw Stability of SPI by Uultrasonic-Glycosylation
Zhang Zeyu Zhang Shiyu Yu Jie Wang Xibo Jiang Lianzhou Xu Ri
(College of Food Science, Northeast Agricultural University, Haerbin 150030)
In order to improve the freeze-thaw stability of soybean protein isolate, the soybean protein isolate was modified by ultrasonic assisted wet glycosylation, emulsifying properties and creaming index as evaluation indexes to study the mass ratio of SPI to dextran (SPI∶D), reaction temperature, ultrasonic power, reaction time on the freeze-thaw stability of glycosylation products. Results showed that under the condition of SPI∶D ratio 2∶3, reaction temperature 80 ℃, ultrasonic power 500 W, reaction time 40 min, the freeze-thaw stability of glycosylation products attained the optimal level. Compared with the control SPI, the emulsifying activity index and emulsifying stability index increased by 39.89% and 43.80%, the creaming index decreased by 57.76%, 75.33% and 75.33%, and the particle size of emulsions decreased by 34.04%, 42.12%, 126.9% after the first, second and third time of freeze-thaw cycle.
ultrasonic wave, soybean protein isolate, emulsifying properties, creaming index, particle size
黑龙江省应用技术研究与开发计划(WB13C10201),国家大豆产业技术体系项目(CARS-04-PS25),“十二五”国家科技支撑计划(2014BAD22B01)
2015-12-30
张泽宇,男,1991年出生,硕士,粮食、油脂及植物蛋白工程
王喜波,男,1975年出生,副教授,粮食、油脂及植物蛋白工程
TS201.2
A
1003-0174(2017)06-0063-06
