菜籽硫苷在水媒法提油中的降解及转移规律
2017-07-05任燕勤
任燕勤
杨瑞金1
张文斌2
赵 伟2
华 霄2
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学食品科学与工程国家重点实验室,江苏 无锡 214122)
菜籽硫苷在水媒法提油中的降解及转移规律
任燕勤1
杨瑞金1
张文斌2
赵 伟2
华 霄2
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学食品科学与工程国家重点实验室,江苏 无锡 214122)
以油菜籽为研究对象,研究处理工艺条件对菜籽中硫苷降解的影响,同时探索菜籽中的硫苷在水媒法提油过程的变化及其在油相、乳状液、水相和渣相中的转移规律。采用氯化钯分光光度法测定硫苷含量,通过单因素试验,考察烘烤和蒸煮两种处理工艺。结果表明:烘烤120 ℃,0.5 h, 硫苷降解率为7.32%;蒸煮115 ℃,10 min,硫苷降解率为21.04%。水媒法提油过程中,硫苷从原料转移至四相中时,基本保持守恒,且在油相和乳状液中未检出;大部分硫苷进入水相,少量留在渣相中,粕中硫苷含量0.3%~0.8%,远低于传统方法饼粕中的硫苷含量,说明水媒法具有提取油脂和脱毒同时进行的优点。未经处理的油菜籽中的硫苷有66.46%~74.52%进入水相中,27.30%~36.15%留在渣相中,经过烘烤和蒸煮处理进入水相的硫苷分别增加了5%~15%和9%~13%。
油菜籽;硫苷;烘烤;蒸煮;水媒法
油菜籽是世界第二大油料作物,中国年产1 200万t以上[1],是最主要的食用油来源之一。油菜籽含有40%~45%的油脂和20%~25%的蛋白质,是一种高油高蛋白农副产品[2]。
硫代葡萄糖苷(glucosinolate),简称硫苷,是油菜籽中的主要抗营养因子[3]30。其本身无毒,易溶于水,有很好的稳定性[4],存在于植物细胞的液泡中,而内源硫苷酶存在于不同的细胞中,当细胞破裂时,硫苷与内源硫苷酶接触,产生异硫氰酸酯、恶唑烷硫酮和腈类等有毒物质[5]。这些物质可引起甲状腺肿大,从而造成动物生长速度下降,繁殖力减退[6]。此外,硫苷及其分解产物具有生物防治作用,可替代部分化学农药,降低农药用量[7],已有学者[8]开始关注它的生物功能,并加以提取利用。
目前,菜籽油的生产方法主要有压榨法、溶剂浸出法和预榨浸出法,但压榨法出油率低[9],浸出法存在有毒溶剂残留等问题[10],同时会产生大量菜籽饼粕,而其中的硫苷必须脱毒后才能继续利用[3]120。因此了解硫苷在加工过程中的变化规律及控制方法具有非常重要的现实意义。传统方法制得的菜籽饼粕中,硫苷占0.8%~2.0%[11],压榨菜籽粕比浸出菜籽粕硫苷含量略低[12]。
水媒法,指以水为主要媒介的提油技术,可辅以或不辅以与水互溶的可食用物质(例如乙醇)、食品级酶、超声波、微波等处理以破坏油料细胞壁和/或破乳的食用油提取技术[13]。已经有学者对花生[14-16]、油茶籽[9,17]、葵花籽[18-19]、玉米胚芽[20-21]、油菜籽[22]7等油料作物的水媒法提油进行了大量的研究,并且实现了花生和油茶籽水媒法提油的产业化。
水媒法提取菜籽油时,会产生油相、乳状液相、水相和渣相,由于硫苷易溶于水,容易进入水相中,蛋白大部分进入渣相中,因此水媒法可以集提取油脂、蛋白和脱毒于一体。硫苷降解会产生部分脂溶性物质(如异硫氰酸酯),扩散到油相中,使油的含硫量增加,品质降低[22]29-30。为了使更多硫苷保持完整的结构,留在水相中,便于后期的提取利用研究,需对处理工艺及条件进行优化。本研究拟在提油率高、油品优质的水媒法新工艺——乙醇水提法的基础上,以油菜籽为对象,研究不同处理工艺条件对菜籽中硫苷降解的影响,同时探索菜籽中的硫苷在水媒法提油过程的变化及其在油相、乳状液、水相和渣相中的转移规律,旨在为油菜籽的水媒法副产物提供新的利用方向。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
油菜籽:市售,产于江苏南通;
黑芥子硫苷酸钾(sinigrin):纯度≥99.0%,美国 Sigma 公司;
氯化钯、羧甲基纤维素钠、氢氧化钠、盐酸等:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
电子天平:LE2002E型,梅特勒-托利多仪器(上海)有限公司;
立式压力蒸气灭菌锅:LDZX-50KBS型,上海申安医疗机械厂;
电热恒温鼓风干燥箱:DGG-9070A型,中国上海森信实验仪器有限公司;
摇摆式高速中药粉碎机:DFY-500型,浙江温岭市林大机械有限公司;
冷冻离心机:TGL-16M 型,上海卢湘离心机仪器有限公司;
电热恒温水浴锅:DK-S24型,上海精宏实验设备有限公司;
自动脂肪测定仪:SZC-101型,上海纤检仪器有限公司;
可见分光光度计:723N型,上海精密科学仪器有限公司;
旋涡振荡器:M348834型,德国IKA公司;
冷冻粉碎机:A11小型,德国IKA公司。
1.2 试验方法
1.2.1 工艺流程

1.2.2 处理工艺的优化试验
(1) 烘烤工艺的单因素试验设计:筛选干净的油菜籽,称取500 g,平铺在不锈钢筛子上,在烘箱中进行烘烤处理,将处理后的样品粉碎,测定硫苷含量,并且采用水媒法提取菜籽油,计算清油得率。首先在烘烤时间为2 h,烘烤温度分别为110,120,130,140,150 ℃的条件下,考察烘烤温度对菜籽硫苷含量、硫苷降解率和清油得率的影响。然后在烘烤温度为120 ℃,烘烤时间分别为0.5,1.0,1.5,2.0,2.5 h的条件下,考察烘烤时间对菜籽硫苷含量、硫苷降解率和清油得率的影响。
(2) 蒸煮工艺的单因素试验设计:筛选干净的油菜籽,称取500 g,以料水比1∶3 (g/mL),装入3 L的大烧杯中,在高压灭菌锅中进行蒸煮处理,处理后的样品放在60 ℃烘箱中烘干,粉碎后测定硫苷含量,并且采用水媒法提取菜籽油,计算清油得率。首先在蒸煮时间为10 min,蒸煮温度分别为105,110,115,120,125 ℃的条件下,考察蒸煮温度对菜籽硫苷含量、硫苷降解率和清油得率的影响。然后在蒸煮温度为115 ℃,蒸煮时间分别为5,10,15,20,25 min的条件下,考察蒸煮时间对菜籽硫苷含量、硫苷降解率和清油得率的影响。
1.2.3 水媒法提油过程中硫苷的转移规律 采用烘烤120 ℃,0.5 h以及蒸煮115 ℃,10 min两种方法对菜籽进行处理,与未作处理的菜籽作对比。将处理后的菜籽进行粉碎,分别加入30%~50%乙醇水溶液,调节pH为9.0,70 ℃反应3 h,5 000 r/min离心10 min,得到不相容的四相:油相、乳状液相、水相和渣相。分别测定经处理后的菜籽原料,水媒法提取菜籽油后得到的油相、乳状液相、水相和渣相中的硫苷含量。
1.2.4 硫苷含量的测定 根据文献[23]稍作修改,测定菜籽原料、水相、油相、乳状液和渣相中的硫苷含量。
(1) 标准曲线的绘制:取黑芥子硫苷酸钾(sinigrin),用去离子水配制成0.1,0.2,0.3,0.4,0.5,0.6,0.7 mg/mL系列浓度的sinigrin标准液,分别取1 mL标准溶液于10 mL离心管中,加入0.15%的羧甲基纤维素钠溶液2 mL,再加入1 mL氯化钯显色液,盖上塞子,充分摇匀,在25 ℃的恒温水浴锅中放置2 h。以水、羧甲基纤维素钠、氯化钯为空白溶液,用分光光度计在波长540 nm处测定吸光度。以标准品溶液浓度(mg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线。
(2) 菜籽原料中硫苷含量的测定:取10 g油菜籽,加液氮研磨成粉末,用石油醚脱脂8 h,室温脱溶后得到脱脂菜籽粉,并测定水分含量。准确称取脱脂菜籽粉0.15 g于10 mL的比色管中,在沸水浴中干蒸10 min以灭酶活性,加入约90 ℃的热水8 mL,再在沸水浴中蒸煮20 min,取出静置冷却后,用水稀释至10 mL,摇匀,10 000 r/min离心30 min。取1 mL上层清液于5 mL离心管中,加入0.15%的羧甲基纤维素钠溶液2 mL,再加入1 mL氯化钯显色液,盖上塞子,充分摇匀,在25 ℃的恒温水浴锅中放置2 h。以水、羧甲基纤维素钠、氯化钯为空白溶液,用分光光度计在波长540 nm处测定吸光度值,通过式(1)、(2)计算硫苷含量和降解率:
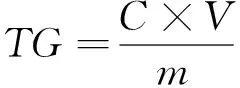
(1)
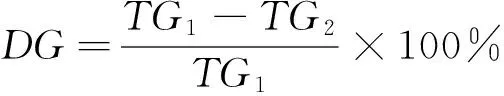
(2)
式中:
TG——硫苷含量(无油干基),mg/g;
m——样品(脱脂干基),g;
C——硫苷提取液浓度,mg/mL;
V——硫苷提取液体积,mL;
DG——硫苷降解率,%;
TG1——未处理原料中的硫苷含量(无油干基),mg/g;
TG2——处理原料中的硫苷含量(无油干基),mg/g。
(3) 水相中硫苷含量的测定:取2 mL水相于10 mL的具塞试管中,加入约90 ℃的热水7 mL,在沸水浴中提取20 min,取出静置冷却,用水稀释至10 mL,摇匀,10 000 r/min离心30 min。取上层清液,用上述相同方法显色,并测定吸光值,通过式(1)、(2)计算硫苷含量和降解率。
(4) 渣相中硫苷含量的测定:水媒法工艺产生的湿渣,经低温烘干后粉碎,用索氏提取器测定其脂肪含量,测定后的脱脂粉末用于测定渣相中的硫苷含量。取脱脂的渣相粉末0.2 g于具塞试管中,加入约90 ℃的热水 8 mL,在沸水浴锅中蒸煮20 min,取出冷却,用水稀释至10 mL,摇匀,10 000 r/min离心30 min。取上层清液,用相同方法显色,并测定吸光值,通过式(1)、(2)计算硫苷含量和降解率。
(5) 油相和乳状液相中硫苷含量的测定:分别取2 mL油相和乳状液于具塞试管中,加入约90 ℃的热水8 mL,在沸水浴中提取20 min,取出冷却,用正己烷萃取混合液中的油脂,摇匀,10 000 r/min离心30 min。吸取下层水系滤液,用相同方法显色,并测定吸光值,通过式(1)、(2)计算硫苷含量和降解率。
1.2.5 数据分析 所有试验重复3次,采用Excel 2016和Origin 8.6进行数据处理和作图,以平均值±标准偏差表示。利用SPSS 17.0进行方差分析和差异显著性分析(Duncan' s test, P=0.05)。
2 结果与分析
2.1 烘烤条件的确定
烘烤温度对菜籽硫苷含量的影响见图1。未经处理的菜籽硫苷含量为28.67 mg/g(无油干基),经过烘烤处理,随着烘烤温度的升高,菜籽中的硫苷含量逐渐下降,硫苷降解率缓慢上升,保持在10%以下。当达到140 ℃后,硫苷降解率迅速上升。硫苷通常比较稳定,但当细胞受到损伤或破碎时,硫苷与硫苷酶接触,发生酶降解;同时也易受高温、pH等因素影响,发生非酶降解[24]。不同温度下分别烘烤2 h,硫苷酶基本钝化,引起硫苷含量减少的主要原因是高温引起的热降解。140 ℃以下的烘烤环境中,硫苷的热稳定性较好,而当温度高于140 ℃后,部分硫苷受热分解,导致含量下降。
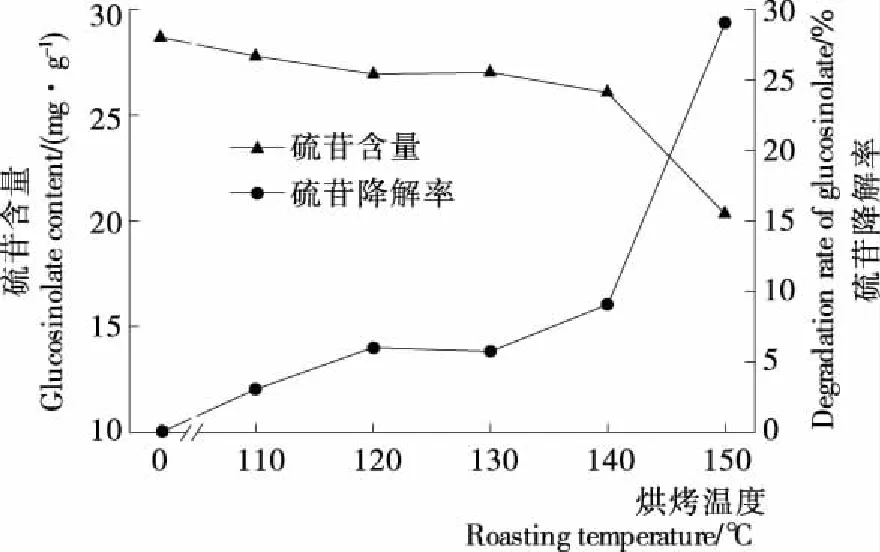
图1 烘烤温度对菜籽硫苷含量的影响Figure 1 Effect of different roasting temperature on the glucosinolate content
烘烤时间对菜籽硫苷含量的影响见图2。随烘烤时间的延长,油菜籽硫苷含量略有下降,硫苷降解率逐渐上升。当时间达到1 h后,即使延长烘烤时间,硫苷降解率变化不大,保持在10%左右。说明烘烤会使菜籽中的硫苷发生一定程度的热降解,但试验范围内的烘烤时间对菜籽硫苷含量和降解率的影响并不大。
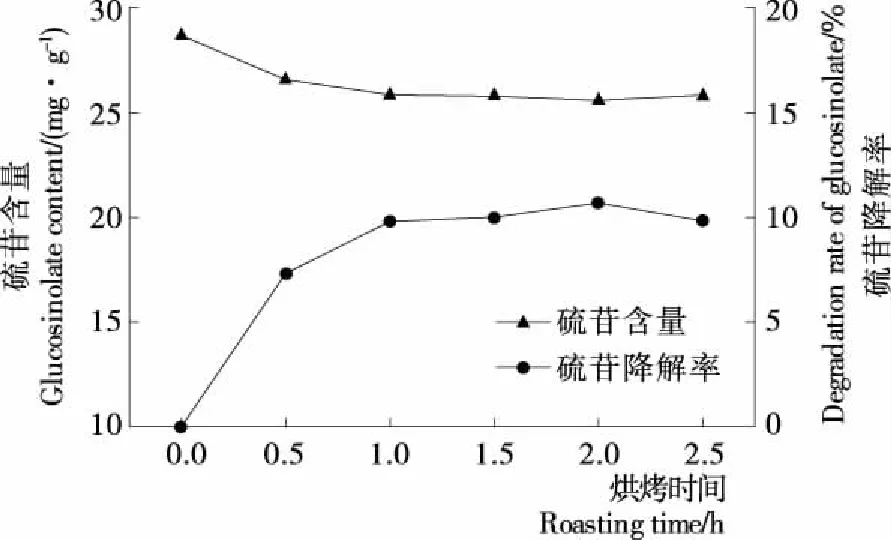
图2 烘烤时间对菜籽硫苷含量的影响Figure 2 Effect of different roasting time on the glucosinolate content
当烘烤温度120 ℃,烘烤时间为0.5 h时,硫苷降解率较低。而烘烤处理辅助水媒法提取菜籽油,会一定程度提高提油率,且随温度升高而提高。该条件下提油率已达到较高水平,综合考虑菜籽提油率、硫苷降解及能耗问题,选择120 ℃烘烤0.5 h为较优的烘烤条件。
2.2 蒸煮条件的确定
蒸煮温度对油菜籽硫苷含量的影响见图3。菜籽硫苷含量与蒸煮温度有很大关系。105 ℃蒸煮10 min,硫苷含量只有15.77 mg/g(无油干基),硫苷降解率达44.99%;当温度提高到110 ℃后,硫苷降解率反而降低到8.52%;继续提高温度,降解率又逐渐上升。当蒸煮温度为125 ℃时,降解率为21.78%。原因可能是105 ℃蒸煮10 min并不能完全钝化内源硫苷酶,除热降解外,菜籽粉碎后硫苷与部分仍有活性的硫苷酶接触发生酶降解。随蒸煮温度升高,硫苷酶大多数钝化,但热降解更严重。

图3 蒸煮温度对菜籽硫苷含量的影响Figure 3 Effect of different boiling temperature on the glucosinolate content
蒸煮时间对油菜籽硫苷含量的影响见图4。蒸煮时间对硫苷含量有很大的影响。当蒸煮时间为5 min时,硫苷含量只有20.73 mg/g(无油干基),降解率高达27.71%,可能是蒸煮时间过短导致硫苷酶没有完全钝化,在菜籽粉碎时发生酶解反应,降解了部分硫苷;当时间延长到10 min时,降解率下降到21.04%;之后随时间的延长,降解率缓慢上升,当蒸煮25 min时,降解率迅速上升到34.91%,可能是蒸煮时间过长导致硫苷发生严重热降解。

图4 蒸煮时间对菜籽硫苷含量的影响Figure 4 Effect of different boiling time on the glucosinolate content
当蒸煮温度为115 ℃,蒸煮时间为10 min时,硫苷降解率较低。而蒸煮处理辅助水媒法提取菜籽油,能有效提高提油率。该条件下提油率已达到极高水平,综合考虑提油率、硫苷降解及能耗问题,选择115 ℃蒸煮10 min为较优的蒸煮条件。
2.3 处理工艺对菜籽中硫苷降解的影响
通过优化温度与时间,确定了提油率高同时硫苷降解率低的烘烤条件(120 ℃,0.5 h)和蒸煮条件(115 ℃,10 min)。由表1可知,烘烤和蒸煮都对硫苷有影响,且蒸煮对硫苷的影响大于烘烤,降解率分别为21.04%,7.32%。主要由于硫苷是水溶性成分,蒸煮促进了细胞中硫苷的释放,并浸出到水
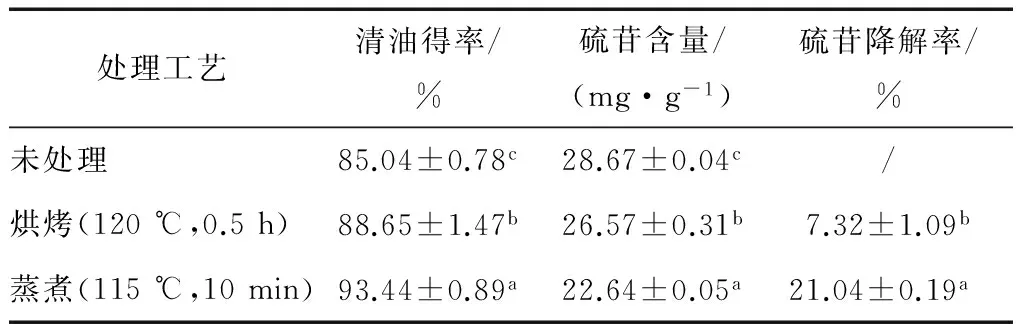
表1 处理工艺对菜籽中硫苷降解的影响†Table 1 Effects of different pretreatment on glucosinolate degradability of rapeseed
† 同列不同小写字母代表0.05水平上存在显著性差异。
中[25];也可能是蒸煮时细胞受到强烈沸腾而破裂,硫苷与硫苷酶接触而发生酶降解[26-27],因此蒸煮处理时硫苷降解率显著高于烘烤处理。
影响硫苷降解的因素很多,如烘烤、烫漂、蒸煮和冷冻等处理都会影响十字花科植物中的硫苷含量[28]。热加工过程中,可能有3种途径导致硫苷含量降低:酶降解、热降解和浸出到加热介质中[29]。Volden等[30]比较了热烫、煮沸和蒸汽3种加工工艺对花椰菜硫苷含量和抗氧化性的影响,发现蒸汽处理对硫苷的影响最小,只降解了19%,其次为热烫,影响最大的是煮沸。Jon Volden等[31]还研究了这3种工艺对卷心菜硫苷含量的影响,热烫、煮沸、蒸气降解率分别是66%,38%,19%。主要是加工方式对硫苷的影响不仅取决于外部因素如温度和pH,还取决于内部因素如植物类型。本研究的降解率较文献[30]和[31]报道的偏低,可能是本试验研究为得到含硫量较低的菜籽油和保留完整的硫苷,对水媒法提取菜籽油工艺条件进行优化时,选择了硫苷降解率低的条件;此外,研究对象的差异也可能异致降解率偏低。
2.4 硫苷在水媒法提油过程中的转移规律
由表2可知,水媒法提取菜籽油过程中,水相、渣相、油相和乳状液相中的硫苷含量总和与反应原料中的硫苷含量接近,表明硫苷在水媒法提油过程基本保持守恒。在油相与乳状液中并未检测出硫苷,主要因为硫苷是水溶性成分,在油相和乳状液中以脂类和腈类形式存在,但试验中采用氯化钯分光光度法,通过硫苷钯复合物来测定完整硫苷的含量。原料中大部分硫苷进入水相,部分留在渣相中,表明大部分硫苷在水媒法提取菜籽油的同时被提取出来。粕中硫苷残留率极低,都少于0.8%,远低于传统方法得到的饼粕中的硫苷含量,无需脱毒便可作为饲料添加。随着乙醇浓度的提高,进入水相的硫苷显著增加(P<0.05),当乙醇浓度从30%提高到50%时,水相中的硫苷比例从66.46%提高到74.52%,而渣相中的硫苷比例从36.15%下降到27.30%,说明乙醇浓度的提高有利于硫苷的提取。
由表3和表4可知,菜籽经烘烤和蒸煮处理后,与未处理的菜籽相似,在水媒法提油过程中,硫苷从原料转移至四相中时,基本保持守恒,且在油相和乳状液中未检出;原料中大部分硫苷进入水相,仅有少量留在渣相中,粕中硫苷含量极低。但有所不同的是,烘烤处理后,随着乙醇浓度的提高,水相中硫苷比例基本不变,都接近80%。而蒸煮处理后,乙醇浓度从30%提高到50%时,水相中的硫苷比例从75.16%提高到87.61%,渣相中的硫苷比例从28.04%下降到15.10%,与未处理相比,水相中的硫苷比例增加了9%~13%,可能是菜籽细胞中的部分硫苷结合在细胞壁上,蒸煮时细胞深度崩解,被结合的硫苷得以释放[32];也可能是热处理引起菜籽成分发生变化,细胞结构变得疏松,更易被粉碎[33],在水媒法提取时,硫苷与乙醇水溶液接触面积增多,更易被提取出来。

表2 未处理菜籽硫苷在水媒法提油过程中的转移规律†Table 2 Transfer law of glucosinolate of untreated rapeseeds during aqueous medium extraction processing
† 同列不同小写字母代表0.05水平上存在显著性差异;ND代表未检测出。
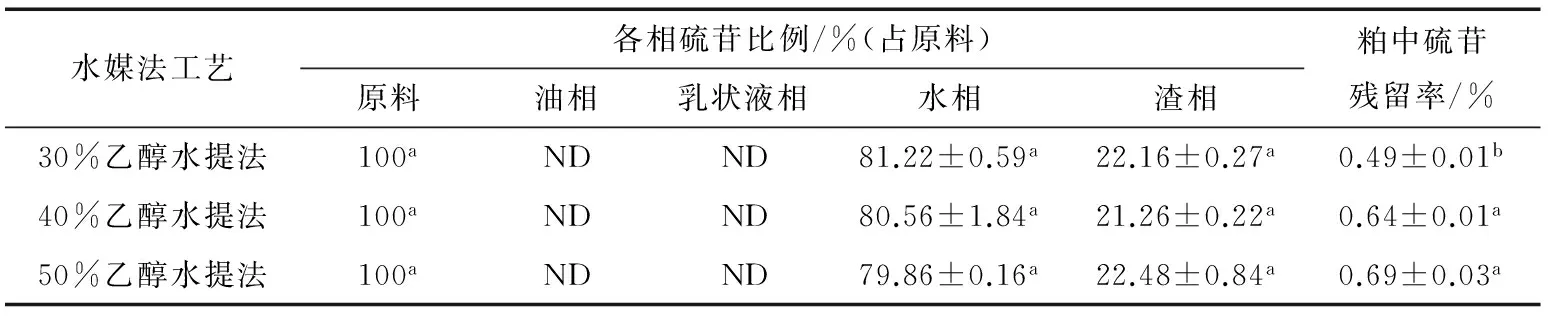
表3 烘烤处理菜籽硫苷在水媒法提油过程中的转移规律†Table 3 Transfer law of glucosinolate of roasted rapeseeds during aqueous medium extraction processing
† 同列不同小写字母代表0.05水平上存在显著性差异;ND代表未检测出。
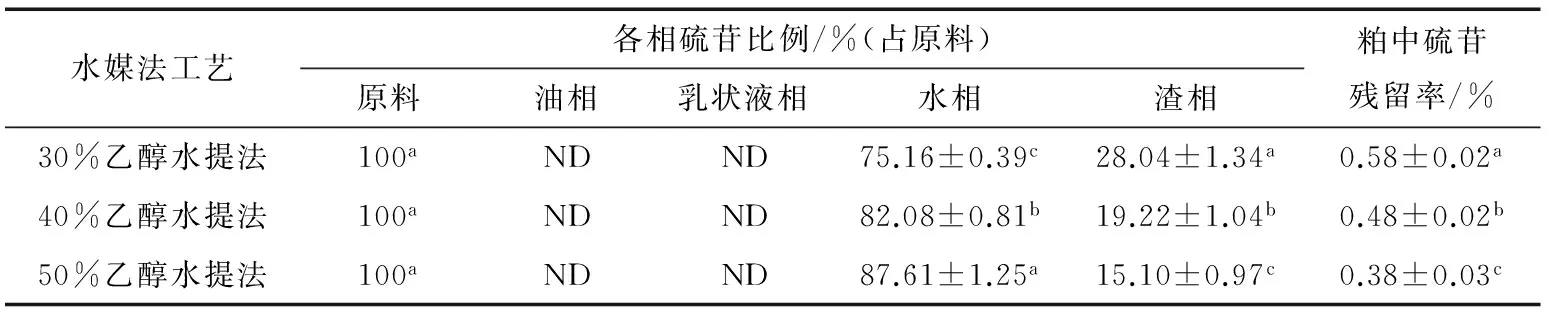
表4 蒸煮处理菜籽硫苷在水媒法提油过程中的转移规律†Table 4 Transfer law of glucosinolate of cooked rapeseeds during aqueous medium extraction processing
† 同列不同小写字母代表0.05水平上存在显著性差异;ND代表未检测出。
3 结论
本研究选用烘烤和蒸煮2种方法对油菜籽进行处理,分别以温度和时间为因素进行优化试验,得出最佳工艺条件:以120 ℃,0.5 h对菜籽进行烘烤处理时,水媒法提取菜籽油,油得率为88.65%,硫苷含量为26.57 mg/g,硫苷降解率为7.32%;以115 ℃,10 min对菜籽进行蒸煮处理时,油得率为93.44%,硫苷含量为22.64 mg/g,硫苷降解率为21.04%。烘烤和蒸煮都能降解部分硫苷,且蒸煮对硫苷的降解大于烘烤。
在水媒法提油过程中,硫苷从原料转移至水相、渣相、油相、渣相和乳状液四相中时,基本保持守恒,且在油相和乳状液中未检出;原料中大部分硫苷进入水相,仅有少量留在渣相中,粕中硫苷含量在0.3%~0.8%,远低于传统方法饼粕中的硫苷含量,说明水媒法具有提取油脂和脱毒同时进行的优点。乙醇浓度的提高有利于硫苷的提取,烘烤处理和蒸煮处理也能一定程度上增加水相中的硫苷比例,且蒸煮处理的效果更明显。该结果表明提取溶剂与处理工艺对脱毒的效果有很大的影响,对今后菜籽脱毒的研究具有指导意义。
[1] NIU Yan-xin, ROGIEWICZ A, WAN Chu-yun, et al. The effect of microwave treatment on the efficacy of expeller pressing of Brassica napus rapeseed and Brassica juncea mustard seeds[J]. Journal of Agricultural & Food Chemistry, 2015, 63(12): 3 078-3 084.
[2] 章绍兵, 王璋. 水酶法从菜籽中提取油及水解蛋白的研究[J]. 农业工程学报, 2007, 23(9): 213-219.
[3] 吴谋成. 油菜籽加工与综合利用[M]. 北京: 中国轻工业出版社, 2009: 30.
[4] 周锦兰, 胡健华. 硫代葡萄糖苷的结构及降解特性[J]. 武汉轻工大学学报, 2003, 22(1): 58-61.
[5] HANSCHEN F S, LAMY E, SCHREINER M, et al. Reactivity and stability of glucosinolates and their breakdown products in foods[J]. ChemInform, 2015, 53(1): 11 430-11 450.
[6] 臧海军, 张克英. 硫代葡萄糖苷及其对动物的抗营养作用[J]. 饲料博览, 2008(1): 13-16.
[7] 周铭. 菜籽粕脱毒液中硫代葡萄糖苷提取工艺研究[D]. 重庆: 重庆大学, 2008: 6-7.
[8] 周政子. 萝卜籽中硫代葡萄糖苷的提取纯化及其降解产物的抑菌特性研究[D]. 杭州: 浙江工商大学, 2013: 7-8.
[9] 谢斌, 杨瑞金, 顾姣. 油茶籽粉碎程度对水酶法提油效果的影响[J]. 食品与机械, 2016, 32(3): 174-177.
[10] LONG Jing-jing, FU Yu-jie, ZU Yuan-gang, et al. Ultrasound-assisted extraction of flaxseed oil using immobilized enzymes[J]. Bioresource Technology, 2011, 102(21): 9 991-9 996.
[11] 中国农科院饲料研究所技术转移中心. 一种新型的高效低毒菜籽粕生产加工技术介绍[J]. 饲料与畜牧: 新饲料, 2008(10): 53-53.
[12] TRIPATHI M K, MISHRA A S. Glucosinolates in animal nutrition: A review[J]. Animal Feed Science & Technology, 2007, 132(1/2): 1-27.
[13] 杨瑞金, 倪双双, 张文斌, 等. 水媒法提取食用油技术研究进展[J]. 农业工程学报, 2016, 32(9): 308-314.
[14] LI Peng-fei, GASMALLA M A A, LIU Jun-jun, et al. Characterization and demusification of cream emulsion from aqueous extraction of peanut[J]. Journal of Food Engineering, 2016, 185: 62-71.
[15] Li Peng-fei, GASMALLA M A A, Zhang Wen-bin, et al. Effects of roasting temperatures and grinding type on the yields of oil and protein obtained by aqueous extraction processing[J]. Journal of Food Engineering, 2016, 173: 15-24.
[16] 迟延娜, 张文斌, 杨瑞金, 等. 顽固乳状液的破乳处理提高花生游离油提取率[J]. 农业工程学报, 2014, 30(8): 257-264.
[17] 李强, 杨瑞金, 张文斌, 等. 乙醇对油茶籽油水相提取的影响[J]. 中国油脂, 2012, 37(3): 6-9.
[18] 冷玉娴, 许时婴, 王璋, 等. 水酶法提取葵花籽油的工艺[J]. 食品与发酵工业, 2006, 32(10): 127-131.
[19] 刘媛媛, 张文斌, 李鹏飞, 等. 水代法提取葵花籽油及乳状液的破除[J]. 食品工业科技, 2016, 37(19): 180-184.
[20] NI Shuang-shuang, YANG Rui-jin, ZHANG Wen-bin, et al. Efficient and eco-friendly extraction of corn germ oil using aqueous ethanol solution assisted by steam explosion[J]. Journal of Food Science and Technology, 2016, 53(4):1-9.
[21] 倪双双, 杨瑞金, 张文斌, 等. 乙醇水溶液提取玉米胚芽油的工艺优化[J]. 农业工程学报, 2016, 34(7): 283-289.
[22] 章绍兵. 水酶法从油菜籽中提取油和生物活性肽的研究[D]. 无锡: 江南大学, 2008: 29-30.
[23] 吴谋成, 黄荣汉. 油菜籽(饼)中硫代葡萄糖甙总量的快速定量测定[J]. 华中农业大学学报, 1983(3): 75-83.
[24] 杨瑛洁, 李淑燕, 胡国伟, 等. 硫代葡萄糖苷的降解途径及其产物的研究进展[J]. 西北植物学报, 2011, 31(7): 1 490-1 496.
[25] SARVAN I, VERKERK R, DEKKER M. Modelling the fate of glucosinolates during thermal processing of Brassica vegetables[J]. LWT-Food Science and Technology, 2012, 49(2): 178-183.
[26] VANESSA R, DUNCAN A J, FULLER Z, et al. Changes in Glucosinolate Concentrations, Myrosinase Activity, and Production of Metabolites of Glucosinolates in Cabbage (Brassica oleracea Var. capitata) Cooked for Different Durations[J]. Journal of Agricultural & Food Chemistry, 2006, 54(20): 7 628-7 634.
[27] JON V, GUNNARB B, TRUDE W. Glucosinolates, l-ascorbic acid, total phenols, anthocyanins, antioxidant capacities and colour in cauliflower (Brassica oleracea L. ssp. botrytis); effects of long-term freezer storage[J]. Food Chemistry, 2009, 112(4): 967-976.
[28] CIESLIK E, LESZCZYNSKA T, FILIPIAKFLORKIEWICZ A, et al. Effects of some technological processes on glucosi-nolate contents in cruciferous vegetables[J]. Food Chemistry, 2007, 105(3): 976-981.
[29] DEKKER M, HENNIG K, VERKERK R. Differences in Thermal Stability of Glucosinolates in Five Brassica Vegetables[J]. Czech Journal of Food Sciences, 2009, 27(2 009): S85-S88.
[30] VOLDEN J, BORGE G I A, HANSEN M, et al. Processing (blanching, boiling, steaming) effects on the content of glucosinolates and antioxidant-related parameters in cauliflower (Brassica oleracea L. ssp. botrytis)[J]. LWT-Food Science and Technology, 2009, 42(1): 63-73.
[31] VOLDEN J, BORGE G I A, BENGTSSON G B, et al. Effect of thermal treatment on glucosinolates and antioxidant-related parameters in red cabbage ( Brassica oleracea L. ssp. capitata f. rubra )[J]. Food Chemistry, 2008, 109(3): 595-605.
[32] CISKA E, MARTYNIAKPRZYBYSZEWSKA B, KOZLOWSKA H. Content of glucosinolates in cruciferous vegetables grown at the same site for two years under different climatic conditions[J]. Journal of Agricultural & Food Chemistry, 2000, 48(7): 2 862-2 867.
[33] SOOKJITSUMRAN W, DEVAHASTIN S, MUJUMDAR A S, et al. Comparative evaluation of microwave-assisted extra-ction and preheated solvent extraction of bioactive compounds from a plant material: a case study with cabbages[J]. International Journal of Food Science & Technology, 2016, 51(11): 2 440-2 449.
The Degradation and Transfer Law of Glucosinolates in Rapeseeds during Aqueous Medium Extraction Processing of Oil
RENYan-qin1
YANGRui-jin1
ZHANGWen-bin2
ZHAOWei2
HUAXiao2
(1.SchoolofFoodScience&Technology,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.StateKeyLaboratoryofFoodScience&Technology,JiangnanUniversity,Wuxi,Jiangsu214122,China)
The effect of different pretreatments on degradation of glucosinolates in rapeseed and its transferring law in oil, emulsion, water and sediment phase during aqueous medium extraction processing was investigated. The glucosinolates content was determined by palladium chloride spectrophotometry method, and the conditions of roasting and boiling were optimized by single-factor experiments. The results showed that under the optimized conditions of roasting at 120 ℃ for 0.5 h, the degradation rate of glucosinolate was 7.32%. While under the optimized conditions of boiling at 115 ℃ for 10 min, the degradation rate of glucosinolate was 21.04%. The glucosinolates were kept substantially constant when transferred from the raw materials to the four phases during aqueous medium extraction processing, whereas they were not detected in oil and emulsion phase. Most of the glucosinolates entered the water phase and a small amount were stayed in the sediment phase. The glucosinolates content in the rapeseed meal was 0.3% to 0.8%, lower than the cake of traditional method. This suggested that aqueous medium extraction processing could extract the rapeseed oil and the most glucosinolates simultaneously. About 66.46%~74.52% glucosinolates of untreated rapeseed entered the water phase, and 27.30%~36.15% was stayed in the sediment phase. The glucosinolates that entered the water phase were respectively increased 5%~15% after roasting and 9%~13% after boiling.
rapeseed; glucosinolate; roasting; boiling; aqueous medi-um extraction processing
国家 863 计划重点项目课题 (编号:2013AA102103)
任燕勤,女,江南大学在读硕士研究生。
杨瑞金(1964—),男,江南大学教授,博士生导师,博士。E-mail:yrj@jiangnan.edu.cn
2017—02—10
10.13652/j.issn.1003-5788.2017.05.031
