大孔树脂吸附纯化黔产龙胆草多糖工艺优化
2017-07-05宫江宁
宫江宁
饶 玉
杨义菊
陈 飞
(贵州师范大学化学与材料科学学院,贵州 贵阳 550001)
大孔树脂吸附纯化黔产龙胆草多糖工艺优化
宫江宁
饶 玉
杨义菊
陈 飞
(贵州师范大学化学与材料科学学院,贵州 贵阳 550001)
采用硫酸—苯酚法测定多糖的含量,研究FL-3树脂对龙胆多糖的吸附和洗脱效果。以多糖的吸附率和解吸量为指标,对FL-3树脂纯化龙胆多糖的工艺条件进行了研究。结果表明,FL-3树脂对龙胆多糖的吸附和洗脱能力较好,最佳工艺条件为:上样浓度5 mg/mL、上样流速2 BV/h、上样量4 BV、 洗脱流速2 BV/h、用30%乙醇溶液200 mL集中洗脱。经过纯化后多糖的颜色变浅,多糖的含量从26.42%提高到71.29%,多糖回收率为49.52%。
龙胆草;多糖;纯化;FL-3树脂
龙胆草(GentianascabraBge),又名地胆草﹑龙胆﹑草龙胆,药用部分为龙胆科龙胆属植物龙胆干燥的根和茎,是一种常用的中草药。龙胆草在中国产地分布较广,主要分布在贵州﹑云南﹑四川等地。黔产龙胆草主要分布在六枝,为黔西北道地药材。龙胆草具有清热燥湿﹑清肝泻胆的作用[1],有着广泛的用途,如中成药“龙胆泻肝丸”就是以龙胆草为主要原料制成的[2]。研究发现龙胆汤对病毒性脑炎[3]、肝胆湿热型带状疱疹[4]、突发性耳聋[5]、湿热型带下病[6]、单纯疱疹性角膜炎的系统评价[7]、面瘫[8]、宫颈炎合并Hpv[9]感染等疾病均有一定的疗效。多糖为龙胆的有效成分之一[10-11],试验发现龙胆多糖有明显的生理活性,具有抗肿瘤[12]﹑抗氧化[1]﹑抗凝血[13]﹑保肝﹑降血脂﹑调节免疫力[14]等作用,因此对龙胆草多糖的研究有一定的意义。
目前对龙胆多糖的研究主要是提取工艺,对龙胆多糖纯化的研究较少。常见的分离纯化方法是DEAE琼脂糖凝胶法[15]﹑DEAE-cellulose DE-52离子交换层析法等[16]。但这些方法成本较高,价格昂贵。大孔树脂法作为一种常见的分离纯化的方法,因其具有吸附量较大、吸附速率快、价格便宜、可再生等优点,而被广泛地应用于天然产物的分离和纯化[17]。本试验拟以黔产龙胆草为原料,提取龙胆多糖,并研究FL-3树脂对龙胆多糖的吸附和洗脱,确定最佳纯化的工艺条件,以期为龙胆多糖的工业化生产和进一步的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
龙胆草:购于贵州济仁堂,产地为贵州六枝;
FL-3树脂:郑州勤实科技有限公司;
试验所用试剂均为国产分析纯。
1.2 仪器
干燥箱:101-1A型,天津泰斯特公司;
电子天平:A 200S型,德国科恩公司;
循环水式多用真空泵:SHB-IIIA型,郑州长城科工贸公司;
分光光度计:U V 2300型,上海天美科学仪器公司;
植物粉碎机:FZ 102型,天津市泰斯特公司。
1.3 方法
1.3.1 龙胆粗多糖的提取 参照文献[18],将龙胆草清洗﹑干燥并粉碎,按照料液比1∶30 (g/mL)加入蒸馏水,在80 ℃热水中浸提2 h,离心(4 000 r/min)取上清液,将上清液80 ℃减压浓缩至原体积的1/5,加入3倍体积的无水乙醇,静置过夜,抽滤,依次用丙酮﹑无水乙醇洗涤沉淀,自然风干,得到龙胆草粗多糖。
1.3.2 葡萄糖标准曲线的绘制 参照文献[19~20],将葡萄糖标准品在105 ℃干燥至恒重,准确配制100 μg/mL的葡萄糖标准溶液。精确移取100 μg/mL葡萄糖溶液0.00,0.10,0.20,0.40,0.60,0.80,1.00 mL,分别置于7支比色管中,补水至1 mL,再加入5%的苯酚2.00 mL,混合均匀后迅速加入浓硫酸7.00 mL,摇匀后静置10 min,放入沸水浴中20 min,冷至室温,在490 nm下测吸光度,并绘制标准曲线(见图1)。葡萄糖标准曲线的回归方程:y=0.050 2x+0.023 5,相关系数R2=0.999 7,在0~10 μg/mL范围内,浓度和吸光度呈现良好的线性关系。

图1 葡萄糖标准曲线Figure 1 Standard curve of glucose
1.3.3 FL-3树脂的预处理 向FL-3树脂中加入3倍体积的95%乙醇,浸泡24 h,再用蒸馏水洗涤树脂至无乙醇味后,加入4%的NaOH浸泡2 h,用蒸馏水洗涤至中性,再用4%的HCl浸泡2 h,用蒸馏水洗涤至中性,并用蒸馏水浸泡以备用[21]。
1.3.4 上样浓度对FL-3树脂动态吸附的影响 将已处理好的FL-3树脂等体积(30 cm3)分别装入5根规格一样的层析柱中,配制浓度分别2.000 0,3.000 0,4.000 0,5.000 0,6.000 0 mg/mL的多糖溶液各50 mL,以2 BV/h的流速分别上样。充分吸附后收集流出液,测定流出液中多糖的含量,按式(1)计算吸附率[22]。

(1)
式中:
R1——吸附率,%;
c0——进样液中多糖的浓度,mg/mL;
V0——进样液的体积,mL;
c1——流出液中多糖的浓度,mg/mL;
V1——流出液的体积,mL。
1.3.5 上样流速对FL-3树脂动态吸附的影响 取5份浓度为5.138 0 mg/mL的多糖溶液,上样量均为2 BV,分别以1,2,3,4,5 BV/h的流速通过装有30 cm3FL-3树脂的层析柱,充分吸附后收集流出液,测定流出液中多糖的含量,并计算吸附率。
1.3.6 上样量对FL-3树脂动态吸附的影响 配制5.445 0 mg/mL的多糖溶液,以2 BV/h的流速上样,总上样量为9 BV(270 mL),并分别在上样量为1,2,3,4,5,6,7,8,9 BV时测流出液中多糖的含量,并计算吸附率。
1.3.7 洗脱液浓度对洗脱效果的影响 将浓度为6.000 0 mg/mL的龙胆多糖溶液100 mL以2 BV/h的流速通过装有30 cm3FL-3树脂的层析柱,待吸附充分后,排净树脂间隙中的多糖溶液,再依次加入100 mL去离子水及10%,30%,50%,70%,90%的乙醇进行梯度洗脱,洗脱流速为2 BV/h,且每25 mL收集一次洗脱液。测定每瓶洗脱液中多糖的含量,并以瓶子编号为横坐标,多糖含量为纵坐标做图。按式(2)计算洗脱量。
Q=c3×V3,
(2)
式中:
Q——洗脱量,μg;
c3——洗脱液中多糖的浓度,μg/mL;
V3——洗脱液的体积,mL。
1.3.8 洗脱液用量对洗脱效果的影响 将50 mL浓度为5.000 0 mg/mL的龙胆多糖溶液以2 BV/h的流速通过层析柱,吸附充分后,先用蒸馏水将树脂颗粒之间的间隙液冲走,再用30%乙醇溶液对树脂进行洗脱,洗脱流速为2 BV/h,前100 mL流出液每隔5 mL检测一次多糖含量,后400 mL每隔25 mL检测一次流出液中多糖的含量,并以累积洗脱体积和多糖的含量为坐标绘制曲线。
1.3.9 洗脱流速对洗脱效果的影响 取5份浓度为5.340 0 mg/mL的多糖溶液,上样量均为2 BV,均以1 BV/h的流速通过装有30 cm3FL-3树脂的层析柱,充分吸附后,用少量的蒸馏水洗涤树脂,再用200 mL 30%的乙醇分别以1,2,3,4,5 BV/h的流速进行洗脱,并测定流出液中多糖的含量。
1.3.10 验证性实验 准确配制0.01 g/mL的粗多糖溶液再从中移取2.5 mL定容至100 mL,取1 mL稀释液按照1.3.2的方法测吸光度,并按式(3)计算粗多糖的纯度。

(3)
式中:
M——多糖纯度,%;
C——稀释后溶液的多糖浓度,μg/mL;
N——稀释倍数;
V——多糖样品液的总体积,mL;
W——粗多糖质量,g。
准确配制一定浓度的粗多糖溶液,以最佳的上样流速通过树脂柱,待充分吸附后,用200 mL的30%乙醇以2 BV/h的洗脱流速洗脱,并将洗脱液旋转蒸发浓缩,冷冻干燥,测冻干多糖的纯度,并按式(4)计算多糖回收率。
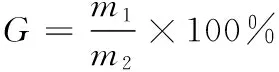
(4)
式中:
G——多糖回收率,%;
m1——提纯多糖的质量,mg;
m2——粗多糖的质量,mg。
2 结果与讨论
2.1 多糖的提取
按上述提取方法得到的龙胆草粗多糖为深棕色颗粒状的固体,味道清香,在水中溶解效果较好,产率为4.5%。
2.2 上样浓度对动态吸附率的影响
由图2可知,上样浓度对龙胆草多糖吸附率的影响较大,吸附率随着上样浓度的增大呈先升高后下降的趋势,上样浓度为5 mg/mL时吸附率最大。所以最佳上样浓度为5 mg/mL,此时吸附率为85.57%。

图2 上样浓度对多糖吸附率的影响Figure 2 The effect of the concentration of polysaccharides on the absorption rate
2.3 上样流速对动态吸附率的影响
由图3可知,上样流速越大,多糖的吸附率越小。如果多糖溶液上样流速过快,多糖还没来得及被树脂吸附,就已经流出层析柱,会使吸附率减少;而如果流速较慢时,溶液中的多糖可以和树脂充分接触,吸附率较高,但如果流速过慢,会使过柱时间过长。由图3可知,当流速为1 BV/h时,多糖的吸附率最高,但速率过慢,而2 BV/h的吸附率与其相差不大,所以选择2 BV/h的上样流速较为合适。
2.4 上样量对动态吸附率的影响
由图4可知,随着上样量的增大,多糖吸附率随之降低,当上样量>4 BV后,吸附率趋于稳定。说明上样量到了一定程度,树脂对多糖的吸附会达到饱和。虽然当上样量为1 BV时,吸附率最高,但树脂对多糖的吸附量较少(仅151.229 mg);而当上样量为4 BV时,吸附率较低,但树脂对多糖的吸附量较高(326.700 mg)。所以选4 BV为上样量较为合适。
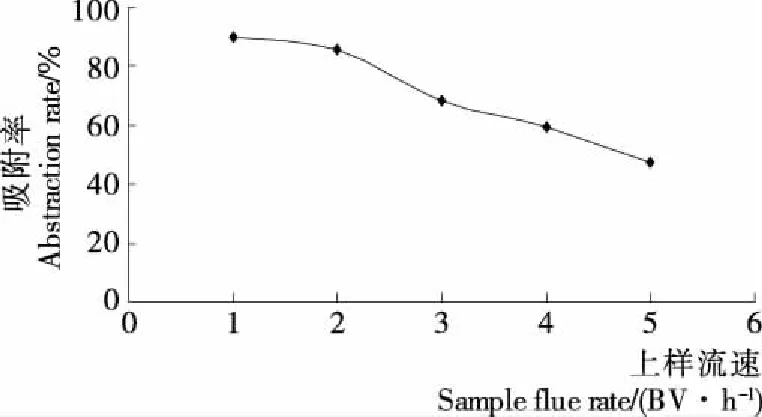
图3 上样流速对多糖吸附率的影响Figure 3 The effect of velocity on adsorption rate of polysaccharides
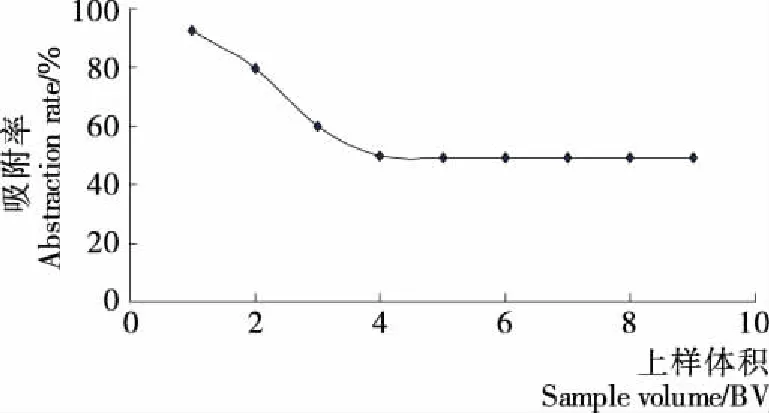
图4 上样量对多糖吸附率的影响Figure 4 The effect of sample size on adsorption rate of polysaccharide
2.5 洗脱液浓度的确定
由图5可知,龙胆多糖的洗脱量主要集中在蒸馏水﹑10%乙醇和30%乙醇洗脱部分,其中最大洗脱峰出现在30%乙醇洗脱部分,30%乙醇部分的总洗脱量也最大且乙醇浓度升高,洗脱量变小。因此选择用30%乙醇做洗脱液。
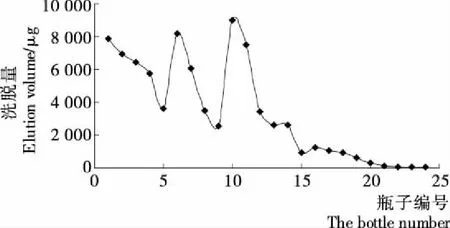
1~4号为水洗脱液;5~8号为10%乙醇洗脱液;9~12号为30%乙醇洗脱液;13~16号为50%乙醇洗脱液;17~20号为70%乙醇洗脱液;21~24为90%乙醇洗脱液
图5 乙醇浓度对多糖洗脱量的影响
Figure 5 Different concentrations of ethanol elution volume
curve of polysaccharide
2.6 洗脱液用量的确定
由图6可知,多糖的洗脱量主要集中在前200 mL的洗脱液中,当洗脱液的体积超过200 mL,再用30%乙醇继续洗脱,多糖的量增加得很少,可以忽略,因此从经济的角度出发,洗脱液的用量为200 mL时最佳。
2.7 洗脱流速的确定
由图7可知,当洗脱量相同时,洗脱流速对洗脱量有一定的影响,流速加快,洗脱量减少,当流速为1 BV/h时,洗脱效果最好,但如果流速过慢,会使时间成本提高,考虑到洗脱流速为1 BV/h时,洗脱量与流速为2 BV/h时的洗脱量相差不大,所以选择的合适的洗脱流速为2 BV/h。
2.8 验证实验
实验测得提取的粗多糖纯度为26.42%,经过树脂纯化后,多糖的纯度提高到了71.29%,多糖回收率为49.52%。说明FL-3树脂对龙胆多糖纯化的效果较好。纯化前的粗多糖颜色为深棕色,经过树脂纯化后,颜色变浅,为浅黄色的粉末,说明FL-3树脂对多糖中的色素也具有一定的吸附和脱色功能。
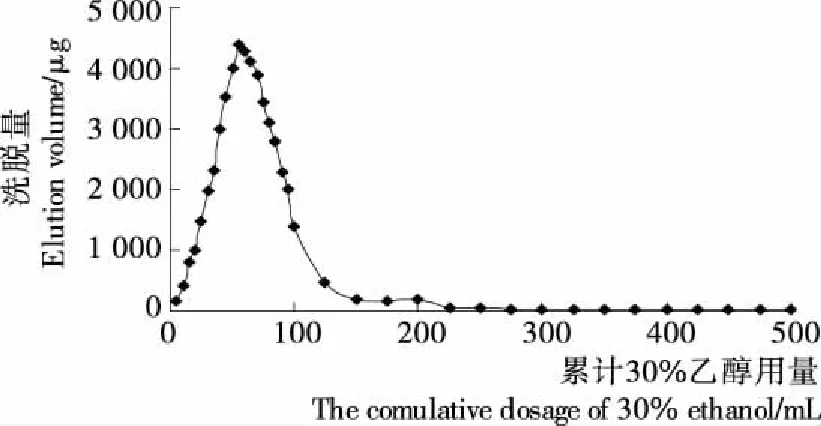
图6 洗脱液用量的考察曲线图Figure 6 The dosage of eluent graph
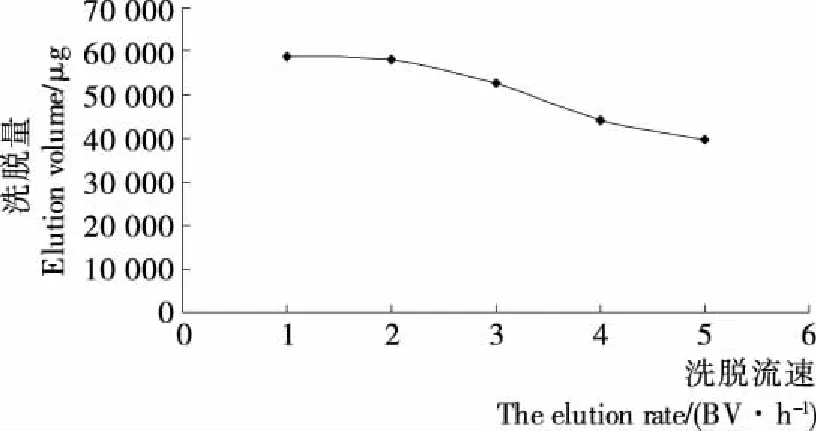
图7 洗脱流速对多糖洗脱量的影响Figure 7 The effect of elution flow rate on the elution of polysaccharide
3 结论
(1) 本试验利用FL-3树脂对龙胆草多糖进行提纯,该树脂对龙胆草多糖具有较好的分离纯化效果,提纯后多糖的颜色变浅,纯度也从26.42%提高到了71.29%,多糖回收率为49.52%。
(2) 通过对FL-3树脂进行动态工艺参数研究,得出最佳的纯化工艺条件为:上样浓度5 mg/mL,上样流速2 BV/h,上样量4 BV,用200 mL 30%乙醇洗脱,洗脱流速2 BV/h。
(3) 本试验仅对FL-3树脂纯化龙胆多糖的工艺进行研究,今后还应该进一步深入研究如何提高龙胆的纯度。此外,用该工艺纯化后是否会影响其生物活性尚未可知,因此在后续的试验中可对提纯前后多糖的抗氧化和抑菌活性进行深入研究。
[1] 程振玉, 于丽颖, 吉惠杰, 等. 龙胆多糖的不同提取工艺及抗氧化活性研究[J]. 河南工业大学学报: 自然科学版, 2016, 37(5): 81-85.
[2] 王聪, 徐峰, 裴莉, 等. 胆草微波真空干燥多因素正交试验研究[J]. 陕西农业科学, 2016, 62(12): 54-56.
[3] 唐宇红, 刘佳, 郭兰, 等. 龙胆汤治疗病毒性脑炎临床疗效分析[J]. 中医药临床杂志, 2016, 28(12): 1 729-1 731.
[4] 于淼, 梅雪靖. 龙胆泻肝汤、刺络拔罐法联合穴位埋线治疗肝胆湿热型带状疱疹60例[J]. 中国民间疗法, 2017, 25(1): 58-59.
[5] 符国庆, 王翔, 李淑芳, 等. 龙胆泻肝汤合葛根方辅助治疗突发性耳聋[J]. 中国实验方剂学杂志, 2016, 22(13): 169-172.
[6] 曾小吉. 龙胆泻肝汤治疗湿热型带下病的临床研究[J]. 中国医学创新, 2016, 13(6): 94-97.
[7] 于莹, 张功, 黄海量, 等. 龙胆泻肝汤治疗单纯疱疹性角膜炎的系统评价[J]. 世界中医药, 2016, 11(9): 1 901-1 904.
[8] 徐敬江, 刘静生. 龙胆泻肝汤加减治疗面瘫50例临床研究[J]. 亚太传统医药, 2016, 12(4): 138-139.
[9] 张泽华, 林洁. 龙胆泻肝汤加减治疗宫颈炎合并Hpv感染25例疗效观察[J]. 湖南中医药杂志, 2016, 32(11): 62-63.
[10] 曹斐华, 李冲. 龙胆属植物化学成分及药理作用的研究进展[J]. 中国新药杂志, 2008, 17(1): 27-29.
[11] 王晨瑜, 刘鑫, 王战勇. 水溶性龙胆多糖的提取工艺研究[J]. 北方园艺, 2013(10): 155-157.
[12] 江蔚新, 江培, 张晓燕, 等. 龙胆多糖的体内抗肿瘤作用的研究[J].中成药, 2008, 30(10): 1 530-1 532.
[13] 许惠玲. 龙胆多糖的提取﹑分离纯化及其体外抗凝血活性研究[D]. 芜湖: 安徽工程大学, 2016: 53-59.
[14] 王金宏. 龙胆中植物多糖保肝﹑降血脂及免疫调节作用的研究[D]. 哈尔滨: 哈尔滨商业大学, 2012: 33-51.
[15] 肖健, 曹荣安, 贾建, 等. DEAE琼脂糖凝胶纯化龙胆多糖及其分子特性[J]. 食品科学, 2016, 37(15): 130-135.
[16] 王晨瑜. 龙胆多糖的制备及生物活性分析[D]. 抚顺: 辽宁石油化工大学, 2014: 23-24.
[17] 杨波, 韩风波, 杨波. AB-8和D-101大孔吸附树脂分离纯化玉竹多糖[J]. 食品研究与开发, 2014, 35(23): 67-70.
[18] 周国海, 张泳, 赵力超, 等. 蛹虫草多糖提取纯化工艺研究[J]. 食品与机械, 2014, 30(5): 220-224.
[19] PIERRE G, GRABER M, RAFILIPOSON B A, et al. Biochemical composition and changes of extracellular polysaccharides (ECPS) produced during microphytobenthic biofilm development[J]. Microb Ecol, 2012, 63(1): 157-169.
[20] 武长飞, 张杰, 刘远青, 等. 金针菇菇柄多糖提取工艺的优化[J]. 食品与机械, 2013, 29(5): 169-172.
[21] 崔紫姣. 甜茶总多酚提取纯化工艺及抗氧化作用的研究[D]. 贵阳: 贵州师范大学, 2015: 25.
[22] 赵瑞超, 刘金福, 陈记峦. 苦瓜多糖的树脂纯化及其对MCF-7增殖抑制作用[J]. 食品与机械, 2011, 27(5): 78-81.
Optimization on adsorption and purification process for gentian polysaccharide in Guizhou by macroporous resin
GONGJiang-ning
RAOYu
YANGYi-ju
CHENFei
(SchoolofChemistryandMaterialScience,GuizhouNormalUniversity,Guiyang,Guizhou550001,China)
The content of polysaccharide was determined by phenol sulfuric acid method. The research investigated FL-3 resin on the adsorption and desorption effect ofGentianascabraBungepolysaccharide. FL-3 resin was used to purify the polysaccharide. Using the adsorption rate and desorption amount of polysaccharide as the index, the FL-3 resin purification process of polysaccharide was studied. The optimum conditions for the adsorption and resolution of polysaccharide by FL-3 resin were obtained. The experimental results showed that the polysaccharide can be effectively adsorbed and desorbed by the FL-3 resin. The optimum purification conditions were as follows: the sample concentration was 5 mg/mL, the sample flow rate was 2 BV/h, the sample volume was 4 BV, the elution flow rate was about 2 BV/h, and the concentration of ethanol solution was 30%,the elution volume was 200 mL. After purification, the color of polysaccharide become shallow, and the content of that was increased from 26.42% to 71.29%.The recovery rate of polysaccharide was 49.52%.
GentianascabraBunge; Polysaccharide; Purification; FL-3 macroporous resin
贵州省科技厅2012年度贵州省科技厅与贵州师范大学联合基金计划项目(编号:黔科合J字LKS[2012]17号)
宫江宁(1979—),女,贵州师范大学副教授,硕士。 E-mail:9121555@qq.com
2017—03—12
10.13652/j.issn.1003-5788.2017.05.036
