细胞破壁对螺旋藻藻蓝蛋白提取效果的影响
2017-07-05俞建峰
俞建峰
傅 剑1,2
马 潇1,2
崔政伟1,2
(1. 江南大学机械工程学院,江苏 无锡 214122;2. 江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
细胞破壁对螺旋藻藻蓝蛋白提取效果的影响
俞建峰1,2
傅 剑1,2
马 潇1,2
崔政伟1,2
(1. 江南大学机械工程学院,江苏 无锡 214122;2. 江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
螺旋藻细胞破壁是藻蓝蛋白提取的关键工序。采用溶胀法、超细剪切法、超声波法、反复冻融法、溶胀—超细剪切法和溶胀—超细剪切—超声波法对螺旋藻细胞进行破壁处理;通过对比分析破壁后提取液中的藻蓝蛋白得率来评价破壁方法的优劣。结果表明,溶胀法、超细剪切法、超声波法、反复冻融法、溶胀—超细剪切法、溶胀—超细剪切—超声波法得到的最高藻蓝蛋白得率分别为8.90%,7.38%,8.00%,8.26%,9.22%,8.88%。综合考虑,溶胀—超细剪切法相对其它5种破壁方法而言,其操作简单便捷,破壁效果更加显著,藻蓝蛋白得率高;溶胀—超细剪切法最佳的提取工艺为:溶胀时间12 h,剪切时间5 min。
螺旋藻;藻蓝蛋白;细胞破壁;提取
螺旋藻(SpirulinaPlatensis)是一种丝状原核多细胞藻类,体长200~500 μm,宽5~10 μm,圆柱形,呈螺旋弯曲状。螺旋藻主要包含钝顶螺旋藻(S.Platensis)、极大螺旋藻(S.Maxim)和盐泽螺旋藻(S.Subsalsa)3种。螺旋藻内部富含藻蓝蛋白、叶绿素、胡萝卜素及不饱和脂肪酸等多种生物活性成分[1],营养丰富,总蛋白质含量高达55%~65%[2]。
藻蓝蛋白(phycocyanin,PC)是一种重要的营养丰富的捕光色素蛋白,具有强烈的荧光性,常被制成生物探针用于成分含量检测[3];藻蓝蛋白内氨基酸组成成分齐全,必需氨基酸含量高,具有抗癌[4-5]、抗氧化[6-8]、提高生理机能等多种生理功能。近年来藻蓝蛋白在生物医疗[9]和食品方面[10]的应用研究正在不断拓展深入,所以藻蓝蛋白的提取分离成为时下技术工程研究的一大热门方向。
现阶段螺旋藻藻蓝蛋白的提取方法种类繁多,然而至今仍没有相关文献提出一种成熟稳定的提取方法,所以藻蓝蛋白的提取研究仍处于创新发展阶段[11]。螺旋藻藻蓝蛋白提取的关键技术在于细胞破壁和分离纯化,因此细胞破壁技术是蛋白提取的关键工艺技术之一[12]。目前常用的细胞破壁技术有溶胀法[13]、反复冻融法[14]、超声波法[15]、珠磨法[16]等,且无相关文献公开提及到超细剪切细胞破壁方法。本试验拟以钝顶螺旋藻为研究对象,通过比较溶胀法、超细剪切法、超声波法、反复冻融法、溶胀—超细剪切法、溶胀—超细剪切—超声波法等细胞破壁方法对螺旋藻藻蓝蛋白提取效果的影响,筛选出一种提取效率高、提取时间短、能耗低的细胞破壁方法。
1 材料与方法
1.1 材料与仪器
螺旋藻干粉:西安禾一生物技术有限公司;
硫酸铵:分析纯,天津市致远化学试剂有限公司;
磷酸二氢钾、氢氧化钠、氯化钠、盐酸:分析纯,国药集团化学试剂有限公司;
台式离心机:TGL-16C型,上海安亭科学仪器厂;
紫外可见分光光度计:UV1800型,日本岛津公司;
精密电子天平:ARB120型,奥豪斯国际贸易(上海)有限公司;
超声波细胞粉碎机:JY99-IIDN型,宁波新芝科技股份有限公司;
食品超细剪切机:HFX280B型,南昌赣康宝工贸有限公司;
电热恒温水槽:DK-80型,上海三发科学仪器有限公司;
冰箱:BCD-300WJ型,LG集团。
1.2 试验方法
1.2.1 藻蓝蛋白浓度及得率 藻蓝蛋白的浓度[17]和得率[18]计算:
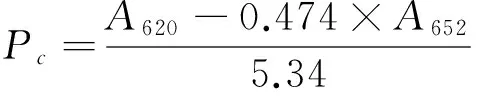
(1)

(2)
式中:
Pc——藻蓝蛋白浓度,mg/mL;
Y——藻蓝蛋白的得率,%;
A620——样品在波长为620 nm处的吸光度;
A652——样品在波长为652 nm处的吸光度;
V——藻蓝蛋白粗提取液体积,mL;
n——稀释倍数;
DB——螺旋藻粉重量,g。
1.2.2 溶胀法 称取一定量的螺旋藻粉,按液料比20∶1 (mL/g)[19-20]加入pH =7的磷酸缓冲液[21],搅拌均匀后,置于4 ℃的低温环境下保存。在溶胀1,2,3,5,6,12,24,48,72 h后分别提取1/9的液体进行离心处理(15 000 r/min,15 min),取离心上清液,加入一定量的饱和度为20%的硫酸铵溶液进行盐析[22]。静置一段时间对盐析液进行离心处理,取沉淀,利用磷酸缓冲液溶解沉淀,得到的溶解液便是最终提取的藻蓝蛋白溶液。用紫外分光光度计检测溶解液的吸光度,并计算出藻蓝蛋白提取液的浓度及得率。
1.2.3 超细剪切法 称取一定量的螺旋藻粉,按液料比20∶1 (mL/g)加入pH =7的磷酸缓冲液,搅拌均匀后,置于4 ℃的低温环境下保存4 h[23]。低温溶胀4 h后将溶胀液分成7等份,用食品超细剪切机分别处理1,2,3,4,6,8,10 min。超细剪切的过程当中由于物料之间的碰撞会产生一定的热量,为防止蛋白质变性,此处采用间歇式工作方法,如剪切30 s,停止30 s。用紫外分光光度计检测溶解液的吸光度,并计算出藻蓝蛋白提取液的浓度及得率。
1.2.4 超声波法 称取一定量的螺旋藻粉,按液料比20∶1 (mL/g)加入pH =7的磷酸缓冲液,搅拌均匀后,置于4 ℃的低温环境下保存4 h。低温溶胀4 h后将溶胀液分成6等分,用超声波细胞粉碎机分别处理2,4,6,8,10,12 min,超声波功率为90 W。由于超声波处理的过程当中会产生一定的热量,为防止蛋白质变性,此处采用间歇式工作方法,如工作2 s,停止5 s。用紫外分光光度计检测溶解液的吸光度,并计算出藻蓝蛋白提取液的浓度及得率。
1.2.5 反复冻融法 称取一定量的螺旋藻粉,按液料比20∶1 (mL/g)加入pH =7的磷酸缓冲液,搅拌均匀后,置于-20 ℃的低温环境中进行冷冻处理。溶液冻结实后取出,进行37 ℃水浴加热处理[24],取溶液的1/5进行离心处理(15 000 r/min,15 min),剩余溶液继续做冻融处理,总共5次。用紫外分光光度计检测溶解液的吸光度,并计算出藻蓝蛋白提取液的浓度及得率。
1.2.6 溶胀—超细剪切法 称取一定量的螺旋藻粉,按液料比20∶1 (mL/g)加入pH =7的磷酸缓冲液,搅拌均匀后,置于4 ℃的低温环境下保存。在溶胀4,8,12,24 h后分别提取1/4的溶液,将每份溶液又分成3等分,等分后的溶液用食品超细剪切机分别处理5,10,15 min。用紫外分光光度计检测溶解液的吸光度,并计算出藻蓝蛋白提取液的浓度及得率。
1.2.7 溶胀—超细剪切—超声波法 称取一定量的螺旋藻粉,按液料比20∶1 (mL/g)加入pH =7的磷酸缓冲液,搅拌均匀后,置于4 ℃的低温环境下保存。在溶胀4,8,12,24 h后分别提取1/4的溶液,等分后的溶液用食品超细剪切机分别处理5 min。提取剪切后的溶液,用超声波细胞粉碎机分别处理5 min,对超声波处理后的溶液进行离心处理(15 000 r/min,15 min),取离心上清液。用紫外分光光度计检测溶解液的吸光度,并计算出藻蓝蛋白提取液的浓度及得率。
2 结果与分析
2.1 溶胀法对藻蓝蛋白得率的影响
溶胀法对藻蓝蛋白得率的影响见图1。
由图1可知,随着溶胀时间的延长,藻蓝蛋白得率呈先增加后逐渐稳定的趋势,溶胀时间为24 h时,藻蓝蛋白得率达到8.9%,且溶胀6 h时藻蓝蛋白得率就已达到8.08%,接近藻蓝蛋白得率的稳定值。综合分析可知,溶胀时间对螺旋藻细胞破壁具有一定的影响,且溶胀24 h后的破壁效果相对更加明显,但是考虑到工厂实际生产情况,溶胀时间一般选用4~8 h。

图1 溶胀时间与藻蓝蛋白得率的关系Figure 1 Relationship between swelling time and yield of phycocyanin
2.2 超细剪切法对藻蓝蛋白得率的影响
超细剪切法对藻蓝蛋白得率的影响见图2。

图2 剪切时间与藻蓝蛋白得率的关系Figure 2 Relationship between ultrafine shearing time and yield of phycocyanin
由图2可知,随着剪切时间的延长,藻蓝蛋白得率先不断增加后趋于稳定,且剪切时间为8 min时,藻蓝蛋白得率达到最大值7.38%。前3个取样点出现的V型曲线,可能是剪切生热导致蛋白质变性的影响大于超细剪切破壁的影响,随着剪切时间不断延长,超细剪切破壁成为影响藻蓝蛋白得率的主要因素。9 min之后曲线出现略微下降,可能是剪切时物料之间的相互运动产生了一定的热量,导致小部分蛋白失活。由此可知,超细剪切对藻蓝细胞的破壁效果影响较大,试验中最低得率值为3.79%,但是仅仅经过了6~8 min的剪切处理,得率上升到了7.38%,增幅较大。综上分析,超细剪切破壁的方法效率比较高,对工业生产具有一定的潜在价值。
2.3 超声波法对藻蓝蛋白得率的影响
超声波法对藻蓝蛋白得率的影响见图3。
由图3可知,超声时间为2 min时,藻蓝蛋白的得率达到最大值(8.0%)。当曲线达到另一个极值点(超声时间为8 min,得率为7.97%)时,得率开始急剧降低,可能是超声产生的高温导致溶出的蛋白质失活[25]。超声时间在0~8 min时,超声波产生的空穴效应使得螺旋藻细胞破裂,藻蓝蛋白溶解到缓冲液中。超声时间在8 min之后,超声产生的热量导致一部分蛋白质变性,曲线整体急剧下降。综上所述,超声波破壁效果较好,但是超声过程中产生的热量对藻蓝蛋白得率的影响较大,且难以精确控制,因此需要进一步研究才能真正应用于工业生产。

图3 超声时间与藻蓝蛋白得率的关系Figure 3 Relationship between ultrasonic time and yield of phycocyanin
2.4 反复冻融法对藻蓝蛋白得率的影响
反复冻融法对藻蓝蛋白得率的影响见图4。

图4 冻融次数与藻蓝蛋白得率的关系Figure 4 Relationship between freezing-thawing times and yield of phycocyanin
由图4可知,随着冻融次数的增加,藻蓝蛋白得率不断升高,而且在反复冻融4次之后,破壁效果最佳,此时藻蓝蛋白得率达到了8.26%。反复冻融处理1~3次时,对藻蓝蛋白提取效果的影响不大;处理4次时,藻蓝蛋白得率显著增加;处理5次时,藻蓝蛋白的得率出现略微下降,可能是温度反复快速的变化导致蛋白质变性[26]。采用冻融法螺旋藻细胞破壁,需要在超低温的环境进行下,所以难以应用到工业大规模生产中,现阶段主要是实验室小规模试验,因此真正的投入使用还需要技术的进一步提升改进。
2.5 溶胀—超细剪切法对藻蓝蛋白得率的影响
溶胀—超细剪切法对藻蓝蛋白得率的影响见图5。
由图5可知,在溶胀时间为4 h或8 h的条件下进行螺旋藻细胞破壁处理,藻蓝蛋白得率均呈上升趋势,且当溶胀时间为8 h时,剪切时间为15 min,藻蓝蛋白得率达到8.9%,与溶胀时间为12 h时藻蓝蛋白得率的水平接近。在溶胀时间为12 h的条件下,藻蓝蛋白得率随剪切时间的变化基本一致,而且出现略微的下降。可能是溶胀时间太长,溶胀12 h后螺旋藻内的藻蓝蛋白基本已经溶出,而且此时进行超细剪切并没有起到破壁的作用,更多的是产生的热量导致蛋白质变性。基于以上分析,溶胀和超细剪切协同作用对螺旋藻细胞破壁的影响较大,可以大大缩短溶胀时间,从而减少整个提取过程所消耗的时间,对工业化生产具有一定的指导意义。

图5 溶胀时间和剪切时间协同作用与藻蓝蛋白得率的关系Figure 5 Relationship of interactions of swelling time and ultrafine shearing time on yield of phycocyanin
2.6 溶胀—超细剪切—超声法对藻蓝蛋白得率的影响
溶胀—超细剪切—超声法对藻蓝蛋白得率的影响见图6。

图6 溶胀—超细剪切—超声法中溶胀时间与 藻蓝蛋白得率的关系
Figure 6 Relationship of swelling time and yield of phycocyanin based on the method of swelling-ultrafine shearing-ultrasonication
由图6可知,溶胀4 h,超细剪切处理5 min,超声波处理5 min,藻蓝蛋白得率为7.72%。从图1可知,在溶胀4 h时,藻蓝蛋白得率大约为6%;从图2可知,溶胀4 h,超细剪切处理5 min,藻蓝蛋白得率大约为6.8%。根据以上分析知,溶胀—超细剪切—超声法应用于螺旋藻细胞破壁中,在相同溶胀时间条件下,其破壁效果比溶胀法和超细剪切法要好。
2.7 不同细胞破壁方法的对比
细胞破壁方法对藻蓝蛋白得率的影响见表1。

表1 不同细胞破壁方法作用下藻蓝蛋白得率的比较Table 1 Comparison on yield of phycocyanin of cell disruption methods
通过对6种破壁方法进行对比分析,可以得出溶胀—超细剪切法在本试验中的提取效果最好,藻蓝蛋白得率最大为9.22%;同时溶胀法得到的藻蓝蛋白得率最大为8.9%,超声波法得到的藻蓝蛋白得率为8.0%,溶胀—超细剪切—超声波法得到的藻蓝蛋白得率为8.88%;以上3种破壁方法的效果基本一致,但是溶胀法得到藻蓝蛋白得率是在溶胀24 h的条件下得到的,时间消耗比较长;超声波法得到藻蓝蛋白得率是在溶胀4 h和超声处理2 min的条件下得到的,消耗时间和能耗均比较少;溶胀—超细剪切—超声波法得到藻蓝蛋白得率是在溶胀12 h,超细剪切处理5 min和超声波处理5 min的条件下得到的,消耗时间和能耗相对较多;反复冻融4次得到的藻蓝蛋白得率为8.26%,相对也比较高,但是其时间消耗和能耗也较大。采用溶胀12 h及超细剪切5 min可获得良好的螺旋藻细胞破壁效果。
3 结论
通过对比分析,溶胀—超细剪切法在本试验中的细胞破壁效果最好,藻蓝蛋白得率达到9.22%;溶胀法存在生产周期长,超声波法和溶胀—超细剪切—超声波法在运行中超声波能量转化为热量造成蛋白变性,反复冻融法能耗高且耗时,这些细胞破壁方法的缺点使得工业化应用存在技术瓶颈。因此,溶胀—超细剪切法可以作为一种新型的螺旋藻细胞破壁方法。
[1] SANTILLAN C. Mass production ofSpirulina[J]. Cellular & Molecular Life Sciences Cmls, 1981, 38(1): 40-43.
[2] MISHRAS K, SHRIVASTAV A, Mishra S. Effect of preservatives for food grade C-PC fromSpirulinaplatensis[J]. Process Biochemistry, 2008, 43: 339-345.
[3] WANG Xiao-yan, YU Jia-luo, KANG Qi, et al. Molecular imprinting ratiometric fluorescence sensor for highly selective and sensitive detection of phycocyanin[J]. Biosensors & Bioelectronics, 2015, 77: 624-630.
[4] 王勇, 钱峰, 钱凯先, 等. 藻蓝蛋白的抗癌活性研究[J]. 浙江大学学报: 工学版, 2001, 35(6): 672-675.
[5] 陈新美, 王晓华. 螺旋藻藻蓝蛋白的稳定性及抗癌活性研究[J]. 氨基酸和生物资源, 2006, 28(1): 59-62.
[6] CHEN Tian-feng, HUANG Ying-chen. Antioxidant and anticancer activities of selenium-containing phycocanin purified fromspirulinaplatensis[J]. Academic Periodical of Farm Products Processing, 2006(8): 55-58.
[7] 张昕, 郦剑勇, 龚兴国. 螺旋藻C-藻蓝蛋白亚基分离及抗肿瘤活性研究[J]. 浙江大学学报: 理学版, 2010, 37(3): 319-323.
[8] SHEU Ming-jyh, HSIEH Yao-yuan, LAI Ching-hsiu, et al. Antihyperlipidemic and antioxidant effects of C-phycocyanin in golden syrian hamsters fed with a hypercholesterolemic diet[J]. Journal of Traditional & Complementary Medicine, 2013, 3(1): 41-47.
[9] LIU Qian, HUANG Ying-hong, ZHANG Rong-hua, et al. Medical application ofspirulinaplatensisderived C-phycocyanin[J]. Evidence-based Complementary and Alternative Medicine, 2016, 2 016(4): 1-14.
[10] BATISTA A P, RAYMUNDO A, SOUSA I,et al. Rheological characterization of coloured oil-in-water food emulsions with lutein and phycocyanin added to the oil and aqueous phases[J]. Food Hydrocolloids, 2006, 20(1): 44-52.
[11] 付丽丽, 那日, 郭久峰, 等. 螺旋藻藻蓝蛋白提取纯化方法研究进展[J]. 生物技术通报, 2016(1): 65-68.
[12] 吴蕾, 庞广昌, 陈庆森. 螺旋藻藻蓝蛋白的规模化提取和色谱纯化技术研究进展[J]. 食品科学, 2008, 29(4): 461-463.
[13] 肖海芳, 马海乐, 孙进良, 等. 不同破壁方法对条斑紫菜藻红蛋白提取效果的影响[J]. 食品研究与开发, 2006, 27(10): 54-56.
[14] 姜剑锋, 赵丽芹, 陈涛, 等. 寇氏隐甲藻不同破壁方法的研究[J]. 中国粮油学报, 2011, 26(8): 92-94.
[15] GERDE J A, WANG Tong, YAO Lin-xing, et al. Optimizing protein isolation from defatted and non-defatted Nannoch-loropsis microalgae biomass, Algal Research, 2013, 2(2): 145-153.
[16] GECIOVA J, BURY D, JELEN P. Methods for disruption of microbial cells for potential use in the dairy industry: a review[J]. International Dairy Journal, 2002, 12(6): 541-553.
[17] BENNETT A, BOGORAD L. Complementary chromatic adaptation in a filamentous blue-green alga[J]. Journal of Cell Biology, 1973, 58(2): 419-35.
[18] SILVEIRA S T, BURKERT J F M, COSTA J A V, et al. Optimization of phycocyanin extraction fromSpirulinaplatensis, using factorial design[J]. Bioresource Technology, 2007, 98(8): 1 629-1 634.
[19] 曲文娟, 马海乐, 张厚森. 钝顶螺旋藻藻蓝蛋白的脉冲超声辅助提取技术[J]. 食品科技, 2007, 32(5): 135-139.
[20] 邵明飞, 张宏宇, 杨金萍, 等. 响应面法优化螺旋藻藻蓝蛋白的超声波提取工艺[J]. 生物学杂志, 2013, 30(4): 93-96.
[21] 李潇飒, 江秀强, 邹宁, 等. 螺旋藻藻蓝蛋白在水和磷酸缓冲液中稳定性的对比研究[J]. 安徽农业科学, 2014(3): 657-657.
[22] LAILA S, ANDREA H, ERIKSEN N T. Purification of the photosynthetic pigment C-phycocyanin from heterotrophic Galdieria sulphuraria[J]. Journal of the Science of Food & Agriculture, 2013, 93(12): 2 933-2 938.
[23] SONI B, TRIVEDI U, MADAMWAR D. A novel method of single step hydrophobic interaction chromatography for the purification of phycocyanin from Phormidium fragile, and its characterization for antioxidant property[J]. Bioresource Technology, 2008, 99(1): 188-194.
[24] YIN Lian-hong, XU Li-na, YU Kun, et al. Orthogonal test design for optimization of suitable conditions to separate C-phycocyanin fromSpirulinaplatensisby high-speed counter-current chromatography using reverse micelle solvent system[J]. Journal of Separation Science, 2011, 34(11): 1 253-1 260.
[25] 郑田要, 杨晓泉. 不同物理法提取高温大豆粕中蛋白的比较研究[J]. 中国油脂, 2009, 34(12): 22-26.
[26] 赵冰冰, 张发宇, 陈裕, 等. 不同冻融条件对破壁提取巢湖水华新鲜蓝藻中藻蓝蛋白的影响[J]. 安徽农业科学, 2014(17): 5 345-5 347.
Comparison of cell disruption methods for the extraction of Phycocyanin fromSpirulinaPlatensis
YUJian-feng1,2
FUJian1,2
MAXiao1,2
CUIZheng-wei1,2
(1.MechanicalEngineeringSchool,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.JiangsuKeyLaboratoryofAdvancedFoodManufacturingEquipment&Technology,Wuxi,Jiangsu214122,China)
The cell disruption is an important step during the extraction of phycocyanin fromSpirulinaPlatensis. Six methods including swelling, ultrafine shearing, ultrasonication, freezing and thawing, swelling-ultrafine shearing and swelling-ultrafine shearing-ultrasonication were applied to break the cell-wall ofS.plarensis. The effects of differentwall-broken methods were evaluated based on the the yield of the phycocyanin. The yield rates of phycocyanin extraction were 8.90%, 7.38%, 8.0%, 8.26%, 9.22%, 8.88%, Respectively,by using the swelling, ultrafine shearing, ultrasonication, thawing and swelling, swelling-ultrafine shearing, swelling-ultrafine shearing-ultrasonication. Finally, the swelling-ultrafine shearing was considered as the best way to break the wall, with swelling for 12 h and the shearing for 5 min.
SpirulinaPlatensis; phycocyanin; cell disruption; extraction
中央高校基本科研业务费专项(编号:JUSRP51634B);江苏省食品先进制造装备技术重点实验室开放课题(编号:FM-2015-09)
俞建峰(1974—),男,江南大学副教授,博士。 E-mail:robotmcu@126.com
2016—09—10
10.13652/j.issn.1003-5788.2017.05.035
