缬草总黄酮超声辅助双水相提取工艺优化及抗氧化活性研究
2017-07-05吴德智
吴德智
郑 强1
李 安1
王宇宇1
吴地尧2
(1. 贵州理工学院,贵州 贵阳 550003;2. 江西中医药大学,江西 南昌 330004)
缬草总黄酮超声辅助双水相提取工艺优化及抗氧化活性研究
吴德智1
郑 强1
李 安1
王宇宇1
吴地尧2
(1. 贵州理工学院,贵州 贵阳 550003;2. 江西中医药大学,江西 南昌 330004)
以缬草为原料,缬草总黄酮得率为指标,采用超声辅助乙醇-硫酸铵双水相体系对缬草总黄酮提取工艺进行单因素及Box-Behnken响应曲面试验优化,并与回流提取所得的总黄酮的还原力、DPPH自由基清除能力、羟自由基清除能力进行抗氧化能力比较。结果表明:缬草总黄酮超声辅助双水相提取的最佳工艺条件为超声时间35 min、硫酸铵用量0.20 g/mL、超声温度51 ℃、液料比为24∶1 (mL/g),在该条件下总黄酮提取率为(6.37±0.08)%。两种提取方法所得的缬草总黄酮对DPPH自由基、羟自由基有较强的清除能力和较高的还原力,且超声辅助双水相提取的缬草总黄酮抗氧化能力显著高于一般回流提取。
缬草;总黄酮;超声波;双水相;抗氧化
缬草(ValerianaofficinalisL.)为败酱科缬草属多年生草本植物,具有镇静、催眠、抗惊厥以及调节循环系统和抗氧化、抗肿瘤等药理活性[1]。缬草含有黄酮类、挥发油、环烯醚萜类、生物碱类等活性成分,其中黄酮类成分为其主要活性成分,具有改善微循环、抗肿瘤和抗菌等生理活性[2-3]。近年来“绿色化学”“环境友好型”提取工艺备受青睐[4]。超声辅助提取是利用超声波技术强化提取分离过程,是一种高效、节能、环保的提取方式,能有效缩短提取时间,提高产品得率,还可以减少化学与物理危害,提高产品质量[5]。双水相提取是基于乙醇、异丙醇等有机物与无机盐形成的新型双水相体系,根据被分离物质在不同相中分配系数的不同实现分离[6-7]。醇-盐双水相体系因成本低,有利于醇类的回收且具有良好的分离性能,已经被广泛用于提取分离天然小分子化合物[8-9]。目前缬草总黄酮的提取主要有溶剂提取、超声提取、微波提取、超临界流体萃取等,基于超声的双水相提取缬草总黄酮未见报道。因此本试验拟以缬草总黄酮提取率为指标,通过单因素及Box-Behnken响应曲面试验优化超声辅助双水相提取工艺条件,采用还原力、DPPH自由基、羟自由基清除能力与传统回流提取的总黄酮抗氧化性进行比较,旨在为缬草黄酮的药用、食用及日化产品的开发提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
缬草叶:采自贵州罗甸缬草种植基地。
1.1.2 试剂
无水乙醇、硫酸铵、铁氰化钾、无水碳酸钠等:分析纯,国药集团化学试剂有限公司;
芦丁标准品:纯度≥98%,西安汇林生物科技有限公司。
1.1.3 仪器
数控超声清洗器:KQ5200DE型,昆山市超声仪器有限公司;
电子天平:FA1004型,上海越平科学仪器有限公司;
旋转蒸发器:RE-52AA型,上海上天精密仪器有限公司;
紫外—可见分光光度计:UV-2550型,梅特勒-托利多国际股份有限公司。
1.2 方法
1.2.1 双水相体系的确定及超声辅助双水相提取缬草总黄酮的工艺 准确称取一定量缬草叶,60 ℃干燥后粉碎装入三角烧瓶中,按试验要求加入适宜的乙醇-硫酸铵双水相体系溶液,在超声条件下提取缬草总黄酮。浸提后以3 000 r/min冷冻高速离心20 min。取上清液于60 ℃下旋转蒸发回收溶剂,所得浓缩液真空冷冻干燥,得缬草总黄酮提取物。前期预试验可知,当乙醇体积分数为40%时,硫酸铵用量在0.2~0.6 g/mL 能形成较稳定的双水相体系。因此本试验固定乙醇体积分数为40%进行其他工艺参数的考察。
一般回流提取法对缬草总黄酮进行提取。称取干燥粉碎后的样品适量,加8倍量60%乙醇,提取2次,每次提取1.5 h,取上清液于60 ℃下旋转蒸发回收溶剂,所得浓缩液真空冷冻干燥,得缬草总黄酮回流提取物。
1.2.2 标准曲线的绘制 精密称取芦丁标准品,40%乙醇配制得130.0 mg/L的芦丁储备液。准确移取储备液0.0,1.0,2.0,3.0,4.0,5.0 mL置于10 mL容量瓶中,加入40%乙醇4.0 mL,静置5 min后加入5%亚硝酸钠溶液0.5 mL,摇匀,静置5 min后,加入10%硝酸铝溶液0.5 mL,摇匀,静置5 min,最后加入4% 氢氧化钠溶液3 mL,乙醇定容至10 mL。充分摇匀,静置15 min后,510 nm下测定吸光度,同时以空白试剂作参比。吸光度Y为纵坐标,浓度X为横坐标(mg/L),得标准回归方程Y=0.112 4X-0.001 2,R2=0.999 3。
1.2.3 单因素考察超声提取工艺
(1) 超声时间的选择:固定硫酸铵用量0.4 g/mL,超声温度45 ℃,液料比30∶1 (mL/g),分别考察超声时间为10,20,30,40,50 min时的缬草总黄酮提取率。
(2) 硫酸铵用量的选择:固定超声时间30 min,超声温度45 ℃,液料比30∶1 (mL/g),分别考察硫酸铵用量为0.2,0.3,0.4,0.5,0.6 g/mL时的缬草总黄酮提取率。
(3) 提取时间的选择:固定超声时间30 min,硫酸铵用量0.4 g/mL,液料比30∶1 (mL/g),分别考察超声温度为15,30,45,60,75 ℃时的缬草总黄酮提取率。
(4) 液料比的选择:固定超声时间30 min,硫酸铵用量0.4 g/mL,超声温度45 ℃,分别考察液料比为20∶1,25∶1,30∶1,35∶1,40∶1 (mL/g)时的缬草总黄酮提取率。
1.2.4 总提取率的测定 参照文献[10~11],缬草总黄酮提取率按式(1)计算:
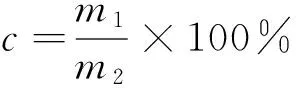
(1)
式中:
c——缬草总黄酮提取率,%;
m1——螯合态钙元素含量提取的总黄酮量,g;
m2——反应体系中钙元素含量缬草总质量,g。
1.2.5 Box-Behnken响应曲面法优选缬草总黄酮提取工艺
在单因素试验的基础上,选取超声时间、硫酸铵用量、超声温度、液料比4个对缬草总黄酮提取率影响较大的因素,采用Design-Expert 8.0.6提供的Box-Behnken试验,以缬草总黄酮提取率为指标优化提取工艺参数。
1.2.6 DPPH自由基清除能力测定 参照Kim等[12]的方法对缬草总黄酮DPPH自由基清除能力进行测定。以无水乙醇为溶剂,以缬草总黄酮为溶质配制成0.1,0.2,0.3,0.4,0.5 mg/mL(以标准曲线计算结果计) 的溶液备用。精密吸取各浓度溶液300 μL,分别加入0.004% DPPH液2 mL,摇匀后,室温下静置20 min,在517 nm处测其吸光度(A1)。以不加样品的DPPH 为空白对照(A0)。精确吸取上述各溶液300 μL,分别与2 mL无水乙醇混合均匀后,以无水乙醇为对照,在517 nm处测定吸光度(A2)。同法对回流提取得到的总黄酮以及VC溶液的DPPH自由基清除能力进行测定。DPPH自由基清除率按式(2)计算:
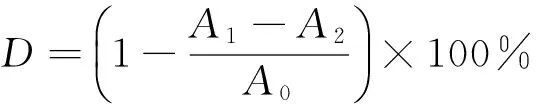
(2)
式中:
D——DPPH自由基清除率,%;
A0——空白对照吸光度;
A2——加无水乙醇的吸光度;
A1——加DPPH溶液吸光度。
1.2.7 铁氰化钾还原法测定还原力 参照陈红梅等[13]的方法进行缬草总黄酮还原能力进行测定。按1.2.6项方法配制不同浓度的缬草总黄酮样品溶液,取1.5 mL样品,加入pH 6.6的磷酸盐缓冲液和六氰合铁酸钾溶液各1.5 mL,混匀后50 ℃恒温20 min,快速冷却后加入10% 三氯乙酸溶液1 mL, 于3 000 r/min 下离心10 min, 取上清液1 mL,再加入蒸馏水和0.1% 三氯化铁溶液各1 mL,充分混匀静置后,于 700 nm 处测定吸光度,以吸光度表示还原能力。同法对回流提取得到的总黄酮以及VC溶液的还原力进行测定。
1.2.8 羟自由基清除率 参照杜丽清等[14]的方法进行缬草总黄酮羟自由基清除能力进行测定。按1.2.6项方法配制不同浓度的总黄酮样品溶液,取1.5 mL样品,分别加入2.5 mmol/L的水杨酸溶液、5 mmol/L的FeSO4溶液各1.0 mL和蒸馏水2.0 mL,充分混匀,加入1.0 mL 5 mmol/L的H2O2,置于37 ℃恒温水浴锅中反应30 min,再置于510 nm波长处测定其吸光度,以蒸馏水作空白参比。同法对回流提取得到的总黄酮羟自由基清除率进行测定。羟自由基清除率按式(3)计算:
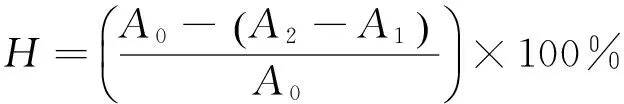
(3)
式中:
H——羟自由基清除率,%;
A0——空白对照吸光度;
A2——加H2O2样品溶液吸光度;
A1——不加H2O2样品溶液吸光度。
1.2.9 统计分析 所有数据测定3次平行、取平均值, 结果以平均值±标准偏差表示, 采用 Excel软件进行统计分析。
2 结果与分析
2.1 单因素考察缬草总黄酮超声辅助提取工艺
2.1.1 超声时间对缬草总黄酮提取率的影响 由图1可知,随着超声时间的增加,缬草总黄酮提取率呈现先上升后下降的趋势。当超声时间为30 min时,缬草总黄酮提取率为(6.12±0.12)%,继续延长超声时间,总黄酮提取率出现下降,当超声50 min时,提取率为(5.88±0.18)%。这主要是由于超声波使某些黄酮类成分发生氧化、降解或缩合等反应而被破坏,使含量有所下降[15]。因此选定30 min为超声时间所需的0水平范围。

图1 超声时间对缬草总黄酮提取率的影响Figure 1 The effect of total flavonoids extraction rate on ultrasonic time
2.1.2 硫酸铵用量对缬草总黄酮提取率的影响 由图2可知,随着硫酸铵用量的增加,缬草总黄酮提取率先稳定在一定水平后出现下降的趋势。当硫酸铵用量在0.2~0.4 g/mL时,提取率稳定在(5.20±0.11)%左右,当继续增加硫酸铵用量时总黄酮提取率出现下降,主要是由于硫酸铵用量增加会与乙醇争夺体系中的水,使缬草总黄酮在乙醇相的含量减少,导致提取率下降。因此选定0.3 g/mL为响应面设计硫酸铵用量的0水平。
2.1.3 超声温度缬草总黄酮提取率的影响 由图3可知,随着超声温度的增加,缬草总黄酮提取率出现先增加后稳定在一定水平再出现下降的趋势。当超声温度在45~60 ℃时,提取率稳定在(5.95±0.09)%左右,随着超声时间的延长总黄酮提取率出现下降,主要是因为温度使沸点低或易分解的总黄酮被破坏或由体系中乙醇中缬草总黄酮部分分解、或乙醇相中总黄酮的分解程度大于硫酸铵相中总黄酮的分解程度所导致双水相体系发生变化。因此选定45 ℃为响应面设计超声温度所需的0水平。
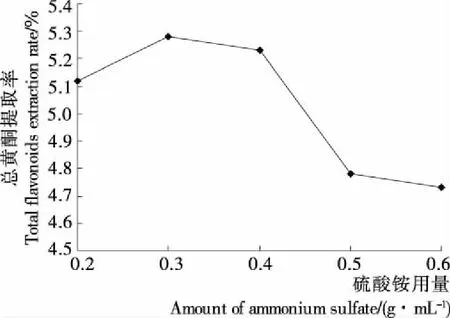
图2 硫酸铵用量对缬草总黄酮提取率的影响Figure 2 The effect of total flavonoids extraction rate on amount of ammonium sulfate
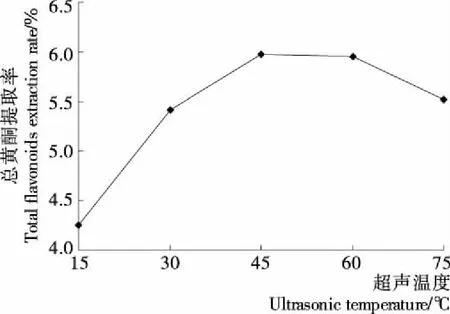
图3 超声温度对缬草总黄酮提取率的影响Figure 3 The effect of total flavonoids extraction rate on ultrasonic temperature
2.1.4 液料比对缬草总黄酮提取率的影响 由图4可知,随着液料比的增加,缬草总黄酮提取率呈现先上升后下降再稳定的趋势。当液料比超过25∶1 (mL/g)时,总黄酮提取率最高为(6.05±0.07)%左右。主要是因为提取液的增加可使缬草与提取溶剂充分接触,有利于黄酮的浸出,当液料比超过25∶1 (mL/g)时,黄酮的提取基本达到饱和状态。因此选定25∶1 (mL/g)为响应面设计液料比的0水平。
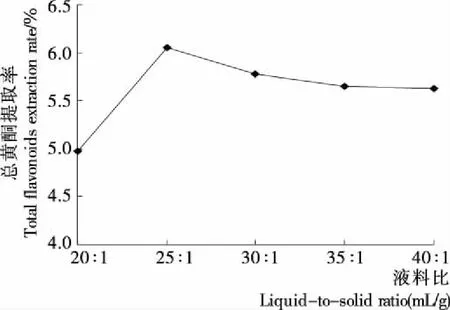
图4 液料比对缬草总黄酮提取率的影响Figure 4 The effect of total flavonoids extraction rate on liquid-to-solid ratio
2.2 Box-Behnken响应曲面设计优化缬草总黄酮微波辅助提取工艺
对缬草总黄酮微波辅助提取的工艺进行Box-Behnken响应曲面设计优化试验,响应面试验因子与水平表见表1,结果见表2。
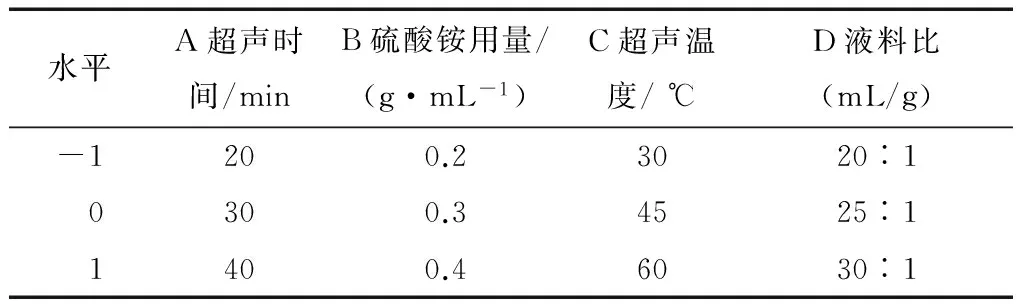
表1 Box-Behnken响应面试验因子与水平Table 1 Factors and levels of Box-Behnken response surface methodology
表2 缬草总黄酮提取的Box-Behnken响应曲面试验设计及试验结果
Table 2 Box-Behnken response surface methodology and results with total flavonoids ofValerianaofficinalisL. extraction parameters
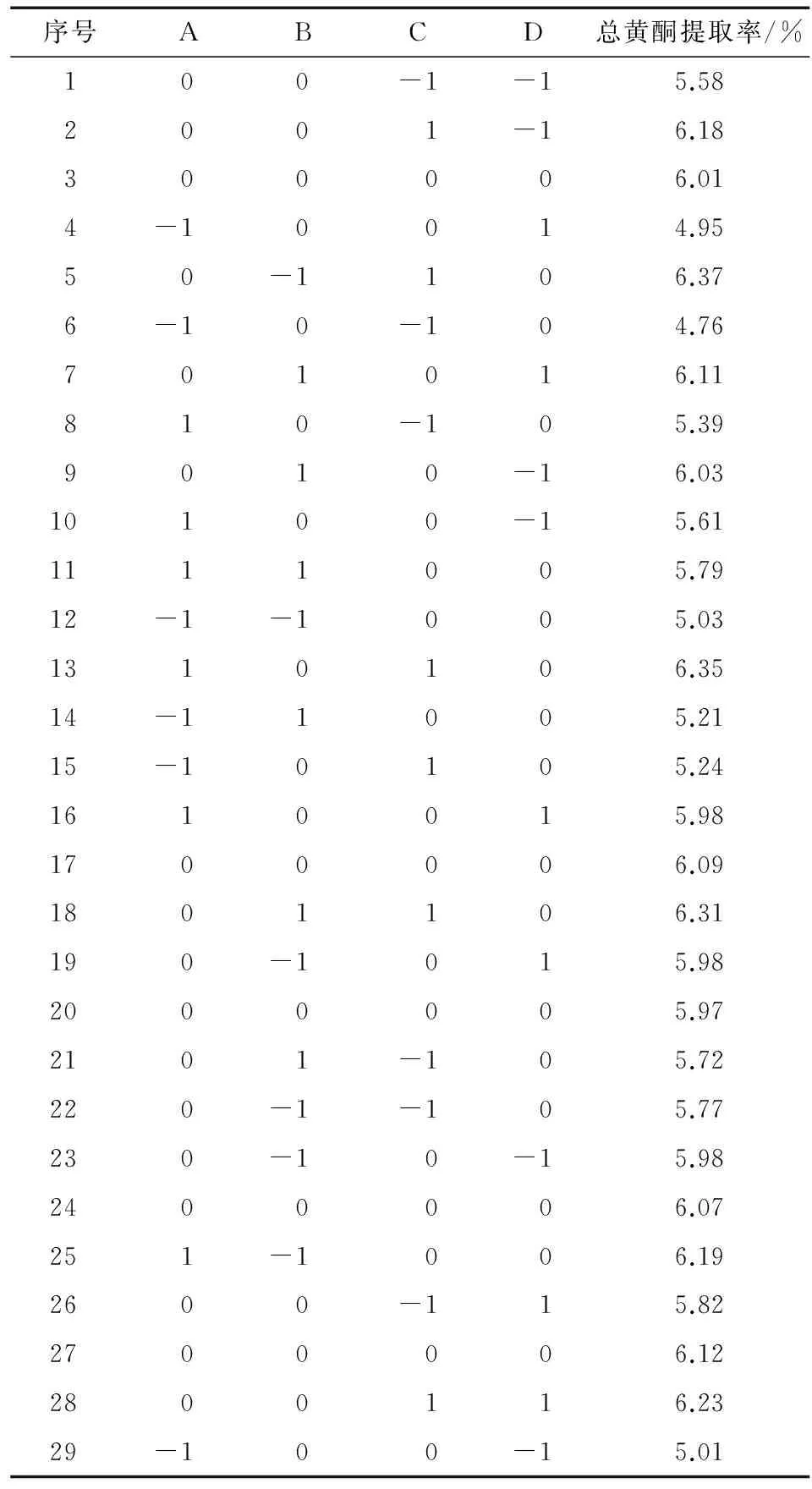
序号ABCD总黄酮提取率/%100-1-15.582001-16.18300006.014-10014.9550-1106.376-10-104.76701016.11810-105.399010-16.0310100-15.611111005.7912-1-1005.031310106.3514-11005.2115-10105.241610015.981700006.091801106.31190-1015.982000005.972101-105.72220-1-105.77230-10-15.982400006.07251-1006.192600-115.822700006.122800116.2329-100-15.01
采用Design-Expert 8.0.6 提供的Box-Behnken试验,对各因素进行拟合,得到多元回归方程为:
R=-2.395 0+0.338 4A+0.160 0B+0.030 1C+0.116 2D-0.145 0AB+8.000 0×10-4AC+2.150 0×10-3AD-1.666 7×10-3BC+0.040 0BD-6.333 3×10-4CD-5.701 7×10-3A2+5.233 3B2-1.951 9×10-4C2-3.056 7×10-3D2。
(4)

由Design-Expert 8.0.6软件得出缬草总黄酮提取的最佳工艺参数是超声时间35.09 min、硫酸铵用量0.20 g/mL、超声温度51.04 ℃、液料比为23.79∶1 (mL/g),总黄酮提取率的预测值为6.37%。为便于生产试验需求,定为超声时间35 min、硫酸铵用量0.20 g/mL、超声温度51 ℃、液料比为24∶1 (mL/g),进一步验证实验,得出的总黄酮提取率为(6.37±0.08)%。该值与预测值比较近,因此选取此为超声辅助双水相体系提取缬草总黄酮的工艺参数。

表3 试验结果方差分析Table 3 Square and significant analysis of regression equation
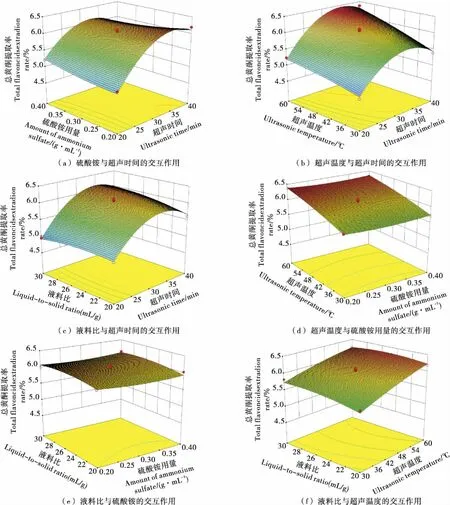
图5 不同提取条件之间的交互作用对提取率相互影响的3D效应面图谱分析Figure 5 3D response surface figures for effects of extration yield on essential oil of Valeriana officinalis L. on different extraction parameters
2.3 不同工艺提取的缬草总黄酮抗氧化活性研究
2.3.1 DPPH 自由基清除能力测定结果 由图6可知,回流提取与超声双水相提取得到的缬草总黄酮对DPPH 自由基均有较强的清除能力,缬草总黄酮的浓度与DPPH自由基清除率存在正相关关系。超声双水相提取的清除能力显著高于一般回流提取(P<0.05)。当浓度为0.5 mg/mL时,超声双水相提的DPPH自由基清除率为(80.80±0.21)%,而回流提取的为(72.90±0.18)%。
2.3.2 还原力测定结果 吸光度与样品的还原力具有正相关关系,吸光度越大,样品的还原力越强。由图7可知,回流提取与超声双水相得到的缬草总黄酮均具有较强的还原能力。在测定的质量浓度范围内,缬草总黄酮的还原力随着浓度的升高而增强,且超声双水相提取的缬草总黄酮还原力显著高于一般回流提取(P<0.05)。当浓度为0.5 mg/mL时,超声双水相提取的吸光度为1.38±0.07,而回流提取的为1.12±0.05。
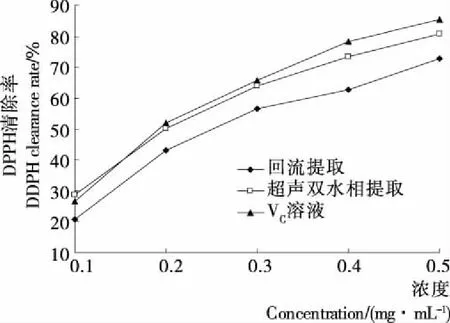
图6 提取方法对DPPH自由基清除率的影响
Figure 6 The effect of DPPH radical scavenging activity on different extraction method (n=3)

图7 提取方法对还原力的影响Figure 7 The effect of reducing poweron on different extraction method (n=3)
2.3.3 羟自由基清除率 由图8可知, 回流提取与超声双水相提取得到的缬草总黄酮对羟自由基均有较强的清除能力,随着总黄酮浓度的增加清除率也随之提高。超声双水相提取的清除能力显著高于一般回流提取(P<0.05)。当浓度为0.5 mg/mL时,超声双水相提取的的清除率为(81.90±0.16)%,而回流提取的为(72.30±0.23)%。
3 结论
本试验以缬草为主要原料采用Box-Behnken响应曲面设计对其总黄酮超声辅助双水相提取工艺条件进行优化,并比较该法与传统回流提取所得的总黄酮进行抗氧化能力比较。结果表明超声辅助双水相提取缬草总黄酮的最佳工艺条件为超声时间35 min、硫酸铵用量0.20 g/mL、超声温度51 ℃、液料比为24∶1 (mL/g),在此条件下总黄酮提取率为(6.37±0.08)%。对DPPH自由基、羟自由基有较强的清除能力以及较高的还原力,且超声双水相提取的缬草总黄酮抗氧化能力显著高于一般回流提取。超声双水相提取缬草黄酮工艺稳定可行,所得总黄酮有较好的抗氧化能力,可为缬草资源的开发提供参考。
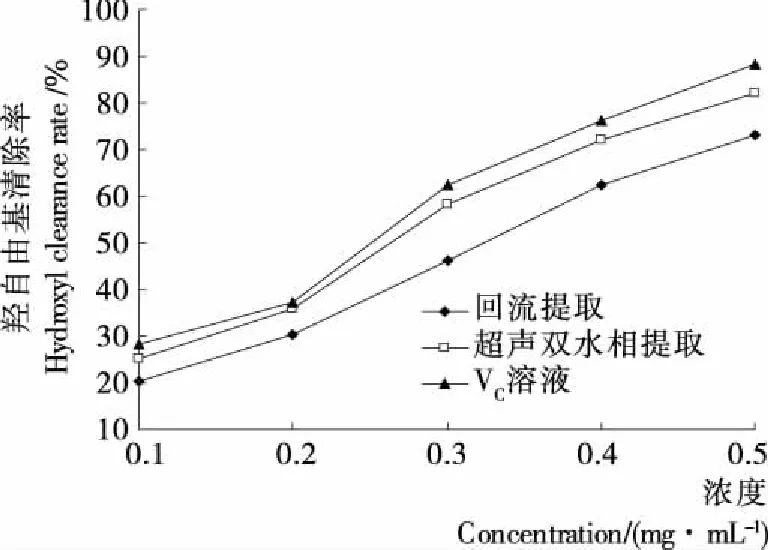
图8 提取方法对DPPH自由基清除率的影响Figure 8 The effect of hydroxyl radical scavenging activity on different extraction method (n=3)
[1] 卢忠英, 陈仕学, 李彦青. 响应面分析法优化缬草中黄酮类化合物的提取工艺[J]. 食品工业科技, 2016, 37(5): 196-200.
[2] 黄宝康, 郑汉臣, 秦路平, 等. 国产缬草属药用植物资源调查[J]. 中药材, 2004, 27(9): 632-634.
[3] 左月明, 张忠立, 曾金祥, 等. 缬草的化学成分研究[J]. 中草药, 2012, 43(7): 1 293-1 295.
[4] TABARAKI R, NATEGHI A. Optimization of ultrasonic-assisted extraction of natural antioxidants from rice bran using response surface methodology[J]. Ultrasonics Sonochemistry, 2011, 18(6): 1 279-1 286.
[5] KARAKATSANIS A, LIAKOPOULOU-KYRIAKIDES M. Comparison of PEG/fractionated dextran and PEG/industrial gradedex-tran aqueous two-phase systems for the enzymic hydrolysis ofstarch[J]. Journal of Food Engineering, 2007, 80(4): 1 213-1 217.
[6] TENG Hui, CHOI Y H. Optimization of ultrasonic-assisted extraction ofbioactive alkaloid compounds from rhizoma coptidis using response surface methodology[J]. Food Chemistry, 2014, 142(1): 299-305.
[7] SHEN Shu-feng, CHANG Zhi-dong, LIU Ji, et al. Separation of glycyrrhizic acid and liquiritin from Glycyrrhiza uralensis Fisch extract by three-liquid phase extraction systems[J]. Separation and Purification Technology, 2007, 53(3): 216-223.
[8] 江咏, 李晓玺, 李琳, 等. 双水相萃取技术的研究进展及应用[J].食品工业科技, 2007, 28(10): 235-238.
[9] 林金清, 董军芳, 李夏兰. 乙醇/硫酸铵双水相体系萃取甘草酸钾的研究[J]. 精细化工, 2004, 21(3): 165-173.
[10] 庞敏, 王远辉, 刘茜. 超声—微波协同辅助提取辣椒总碱的工艺优化[J]. 食品与机械, 2016, 32(12): 175-178, 188.
[11] 齐娜, 李涵, 张志宇, 等. 新疆红肉苹果多酚的超声波辅助提取工艺优化[J]. 食品与机械, 2016, 32(9): 177-182.
[12] KIM D, LEE K W, LEE H J, et al. Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic phytochemicals[J]. J Agric Food Chem, 2002, 50 (13): 3 713-3 717.
[13] 陈红梅, 谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学, 2016, 37(2): 45-50.
[14] 杜丽清, 帅希祥, 涂行浩, 等. 水剂法提取澳洲坚果油的化学成分及其抗氧化活性研究[J]. 食品与机械, 2016, 32(10): 140-144.
[15] 邵金华, 马永强, 何福林, 等. 虎舌红多糖超声波辅助提取工艺优化及其抗氧化活性评价[J]. 食品与机械, 2016, 32(12): 166-169, 195.
The Study on the Ultrasonic-Assisted Aqueous Two-Phase Extraction on Flavonoids ofValerianaofficinalisL. and Antioxidant Activity
WUDe-zhi1
ZHENGQiang1
LIAn1
WANGYu-yu1
WUDi-yao2
(1.GuizhouInstituteofTechnology,Guiyang,Guizhou550003,China;2.JiangxiUniversityofTraditonalChineseMedicine,Nanchang,Jiangxi330004,China)
Flavonoids inValerianaofficinalisL. extracted by ultrasonic-assisted aqueous two-phase extraction was utilized in this study. Effects of ultrasonic time, amount of (NH4)2SO4, ultrasonic temperature and liquid-solid ratio were studied by the single factor methodologies, and then the extraction parameters were determined by Box-Behnken response surface methodology. In addition, reducing power, DPPH radical scavenging and hydroxyl radical scavenging activity were compared to investigate the antioxidant effect of flavonoids by reflux extraction. The results showed that optimized extraction parameters were ultrasonic time 35 min, amount of (NH4)2SO40.20 g/mL, ultrasonic temperature 51 ℃ and liquid-solid ratio 24∶1 (mL/g). Flavonoids yield of (6.37±0.08) % was obtained under such conditions. The extracted flavonoids showed strong reducing ability, DPPH and hydroxyl radicals scavenging activities. Moreover, the antioxidant effected by ultrasonic-assisted aqueous two-phase extraction was much higher than those of reflux extraction.
ValerianaofficinalisL.; total flavonoids; ultrasonic wave; aqueous two-phase; antioxidant activity
贵州省教育厅青年成长项目(编号:黔教合KY字[2016]233);贵州理工学院博士启动基金(编号:XJGC20161218);江西省中医药科研计划(编号:2016A020)
吴德智(1983—),男,贵州理工学院副教授,博士。 E-mail:18970080479@163.com
2017—02—13
10.13652/j.issn.1003-5788.2017.05.033
