菜籽粕硫苷的乙醇提取工艺优化及营养成分研究
2023-10-24闫丽华杨润强
周 洁,闫丽华,王 沛,杨润强,谢 翀
南京农业大学 食品科技学院,江苏 南京 210095
油菜为十字花科、芸薹属植物,是我国四大油料作物之一,可分为芥菜油菜、白菜型油菜和甘蓝型油菜三大品种[1]。油菜籽加工成菜籽油后可产生50%~55%的菜籽粕,其蛋白质含量较高(约35%)且氨基酸组成合理均衡,消化率高[2]。然而,菜籽粕中含有较多的抗营养成分,包括硫代葡萄糖苷、植酸和单宁[3]等,限制了其在饲料和食品中的应用,但硫代葡萄糖苷因独特的生理活性受到广泛关注[4]。
硫代葡萄糖苷简称硫苷,是十字花科类植物中存在的一类重要的次生代谢产物,其在黑芥子酶的催化下可被转化为异硫氰酸酯、恶唑烷硫酮和腈类等多种产物,目前在油菜籽中发现的硫苷种类就高达120多种[5],具有多种生理功能,但过量食用也会产生不良影响[2]。由于硫苷的酶解产物异硫氰酸酯具有抗菌[6]、抗氧化[7]、抗癌[8]等多种生理功能,研究硫苷的绿色高效提取工艺可为菜籽粕的高值化利用提供参考。目前,硫苷的提取主要采用浸提法[9]、超声波萃取法[10]等,通常采用水[11-12]、甲醇[13-14]、氯仿[15]等作为溶剂,但这些方法因操作烦琐、耗时较长等原因,在硫苷提取中的应用有限。王芳等[16]采用78%乙醇溶液从菜籽粕中提取硫苷,最终硫苷提取量为18.72 mg/g;龙芳[17]使用超声辅助提取的方法,以70%甲醇为提取剂从西兰花茎中提取硫苷,硫苷提取量达到0.732 mg/mL;Förster等[18]以70%甲醇为提取剂,硫苷提取量达到118 μmol/g。
菜籽粕中硫苷含量较为丰富,选择安全试剂并找到高效简便的硫苷提取方法十分有必要。虽然甲醇对硫苷的提取效果较好,且相关提取方法较为完善,但考虑到甲醇具有毒性,选用绿色溶剂更具有实际意义和应用价值。根据文献[16]报道,乙醇对硫苷也有较好的提取效果,故本研究以乙醇为提取剂。在硫苷的诸多检测方法中,气相色谱法、高效液相色谱法等耗时较长、工作量较大,相较而言氯化钯比色法[19]更加快速准确且成本低、灵敏度高,适用于大量样品的测定分析,故本研究采用氯化钯法进行硫苷含量的测定。作者以乙醇为提取剂,考察提取时间、料液比、pH值、提取温度等对硫苷提取量的影响,选择具有显著影响的因素进行响应面试验,并探究提取前后菜籽粕中营养物质的变化,从而为菜籽粕的高值化利用提供理论依据。
1 材料与方法
1.1 试材与试剂
菜籽饼粕由南京隆盛植物油脂有限公司提供,所采用的制油工艺为压榨法。将菜籽饼粕粉碎后过100目筛,于-20 ℃储存备用。
烯丙基硫苷(标准品):法国Extrasynthese公司;乙醇(分析纯)、羧甲基纤维素钠:广东光华科技股份有限公司;氯化钯:美国J.T.Baker公司。
1.2 仪器与设备
FSD-100A电动磨粉机:台州市新恩精密粮仪有限公司;TDL-5-A离心机:上海安亭科学仪器厂;WH-3微型旋涡混合仪:上海泸西分析仪器厂;HH-6数显恒温水浴锅:常州国华电器有限公司;JA2003电子天平:上海精密科学仪器有限公司;MUL 9000(B)-H-30超纯水系统:昆山总馨机械有限公司;KQ-250DB数控超声波清洗器:昆山市超声仪器有限公司;DHG-9030A电热恒温鼓风干燥箱:上海一恒科技有限公司;UV-2802紫外-可见分光光度计:尤尼柯上海仪器有限公司。
1.3 方法
1.3.1 硫苷提取方法
参考Alexandre等[20]的方法并稍加修改。0.2 g菜籽饼粕中加入2 mL一定pH值的70%乙醇溶液,70 ℃水浴15 min进行灭酶处理。灭酶后于一定温度下水浴一定时间提取硫苷,其间每隔5 min取出涡旋10 s。6 000 r/min离心10 min后吸取上清液至5 mL容量瓶中,超纯水定容至5 mL后转移到10 mL离心管中,8 000 r/min离心10 min后取上清液测定硫苷提取量。为避免溶剂沸腾汽化,采用密闭的离心管为提取容器,并在离心管内加入少量沸石以防止在加热提取的过程中出现沸腾现象。提取完成后提取液先于水中降至常温再取出进行后续试验。
1.3.2 硫苷提取优化试验
单因素试验:以硫苷提取量作为考察指标,提取时间选择5、10、20、30、40、50 min,提取温度选择40、50、60、70、80、90 ℃,pH值选择3、4、5、6、7。
响应面试验:在单因素试验的基础上以硫苷提取量为响应值进行响应面优化试验,采用Design-Expert对试验数据进行线性回归和方差分析,得出最佳提取条件。
1.3.3 硫苷初提取物的醇沉处理
硫苷初提取物的醇沉操作参考Hui等[21]的方法并稍加修改。称取一定量的硫苷初提取物于烧杯中,按料液比1∶50 g/mL加入90%的乙醇溶液,搅拌2 h后静置过夜。4 ℃下8 000 r/min离心20 min,上清液即为醇沉后的硫苷溶液,合并上清液,旋蒸除去大部分乙醇后预冻于-80 ℃冰箱内,冻干后即为醇沉后的硫苷提取样品。
1.4 测定指标
1.4.1 硫苷提取量测定
硫苷标准曲线绘制:准确称取5 mg烯丙基硫苷(Sinigrin,C10H16KNO9S2)标准品于5 mL离心管中,加入2.2 mL超纯水配制成5.72 μmol/mL的烯丙基硫苷标准溶液。取7支10 mL离心管,依次加入配制好的烯丙基硫苷标准溶液0、0.05、0.1、0.2、0.4、0.6、0.8 mL,并用超纯水补足至0.8 mL,再依次加入2 mL 0.1%羧甲基纤维素钠溶液和1 mL氯化钯溶液,于24 ℃水浴2 h后以第1支离心管内溶液作为参比溶液,于540 nm处测定其他溶液的吸光度,以硫苷浓度作为横坐标,以吸光度作为纵坐标绘制标准曲线。
硫苷提取量测定:加入分散剂羧甲基纤维素钠溶液,可使硫苷与氯化钯反应生成有色硫苷钯溶胶清液,硫苷含量越高,溶液颜色越深,从而通过比色法对硫苷进行定量[22]。参考贺霞等[22]的方法并稍加修改,取1.3.1中制备好的硫苷提取液1.5 mL于10 mL离心管中,并用超纯水补足至2 mL,再依次加入2 mL 0.1%羧甲基纤维素钠溶液和1 mL氯化钯,24 ℃水浴反应2 h。用分光光度计在波长540 nm的条件下,以羧甲基纤维素钠-氯化钯空白溶液作为参比溶液,测定各硫苷提取液的吸光度,再根据烯丙基硫苷标准曲线计算样品中的硫苷提取量。
硫苷提取量(mg/g)=C×V×397/m,
式中:C为由烯丙基硫苷标准曲线计算得到的相应硫苷浓度,μmol/mL;m为称取的菜籽粕粉末的质量,g;V为制得硫苷提取液的总体积,mL。
1.4.2 粗蛋白、脂肪及总糖含量测定
粗蛋白含量的测定参照GB/T 6432—2018;脂肪含量的测定参照GB 5009.6—2016;总糖含量的测定参照GB 5009.8—2016。
1.5 数据统计与分析
试验设3次重复,结果换算成硫苷提取量(mg/g),以平均值±标准差表示,数据采用Design Expert 8.1.6(Version 8.1.6 Stat-Ease Inc.,Minneapolis,MN,USA)软件进行处理,利用SPSS 19.0进行显著性分析,采用Duncan′s进行均值间的多重比较,设定显著性水平为P<0.05,极显著水平为P<0.01。
2 结果与分析
2.1 单因素试验
2.1.1 提取时间
由图1可知,在提取剂为70%乙醇、料液比为1∶10、提取温度为60 ℃、pH 7的条件下,随着提取时间的延长,硫苷提取量不断增加,由5 min时的19.16 mg/g逐步增加至30 min的23.12 mg/g,此时提取液中硫苷含量达到峰值,此后随着提取时间的继续延长,硫苷提取量出现小幅下降,下降幅度约0.5 mg/g。可能是由于提取过程属于溶液内部成分的扩散反应过程,因此溶液内部溶质成分的分解及扩散需要一定的时间[23],故当提取时间较短时,菜籽粕中的硫苷还未能与提取剂乙醇充分接触,硫苷不能及时溶出,故导致硫苷提取量较低;而提取时间过长,菜籽粕中的硫苷已基本溶出,乙醇提取剂与硫苷之间达到动态平衡,继续增加提取时间,反而会导致菜籽粕中其余杂质溶出,从而使提取液中硫苷纯度下降,故确定最佳提取时间为30 min。研究表明,过长的时间可能造成硫苷的降解或杂质溶出,导致最终提取量下降。
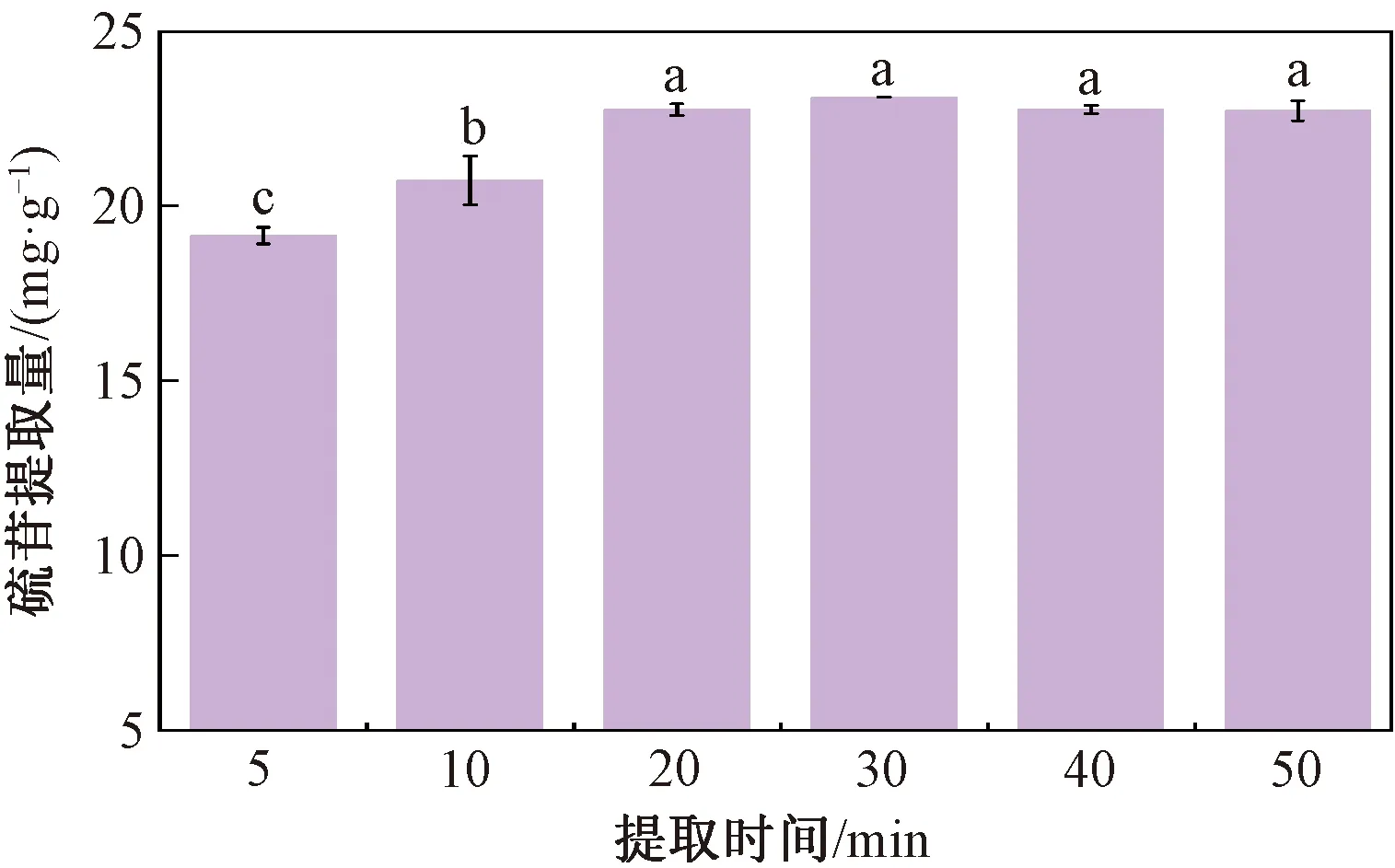
注:不同小写字母表示差异显著(P<0.05)。图2、图3同。图1 提取时间对硫苷提取量的影响Fig.1 Effects of extraction times on the glucosinolates yield
2.1.2 提取温度
由图2可知,在提取剂为70%乙醇、料液比为1∶10、提取时间为10 min、pH 7的条件下,随着提取温度的不断升高,硫苷提取量也相应提高,50~70 ℃时硫苷提取量升高并不显著,仅由20.32 mg/g增至20.89 mg/g,增幅仅为0.57 mg/g。而当提取温度升高至80 ℃时,硫苷提取量显著增加,由20.89 mg/g增至24.46 mg/g,增幅较大,为3.6 mg/g。而后随着温度的继续升高,硫苷提取量逐渐趋于稳定。这可能是由于提取过程属于溶液内部成分的扩散反应过程,温度升高可使扩散反应加剧,促使提取剂乙醇与菜籽粕中的硫苷不断接触,加快硫苷的溶出速率,从而使提取量上升[18]。但考虑到提取温度过高可能会使得提取液中的部分硫苷发生降解而导致提取量下降,故确定最佳提取温度为80 ℃。
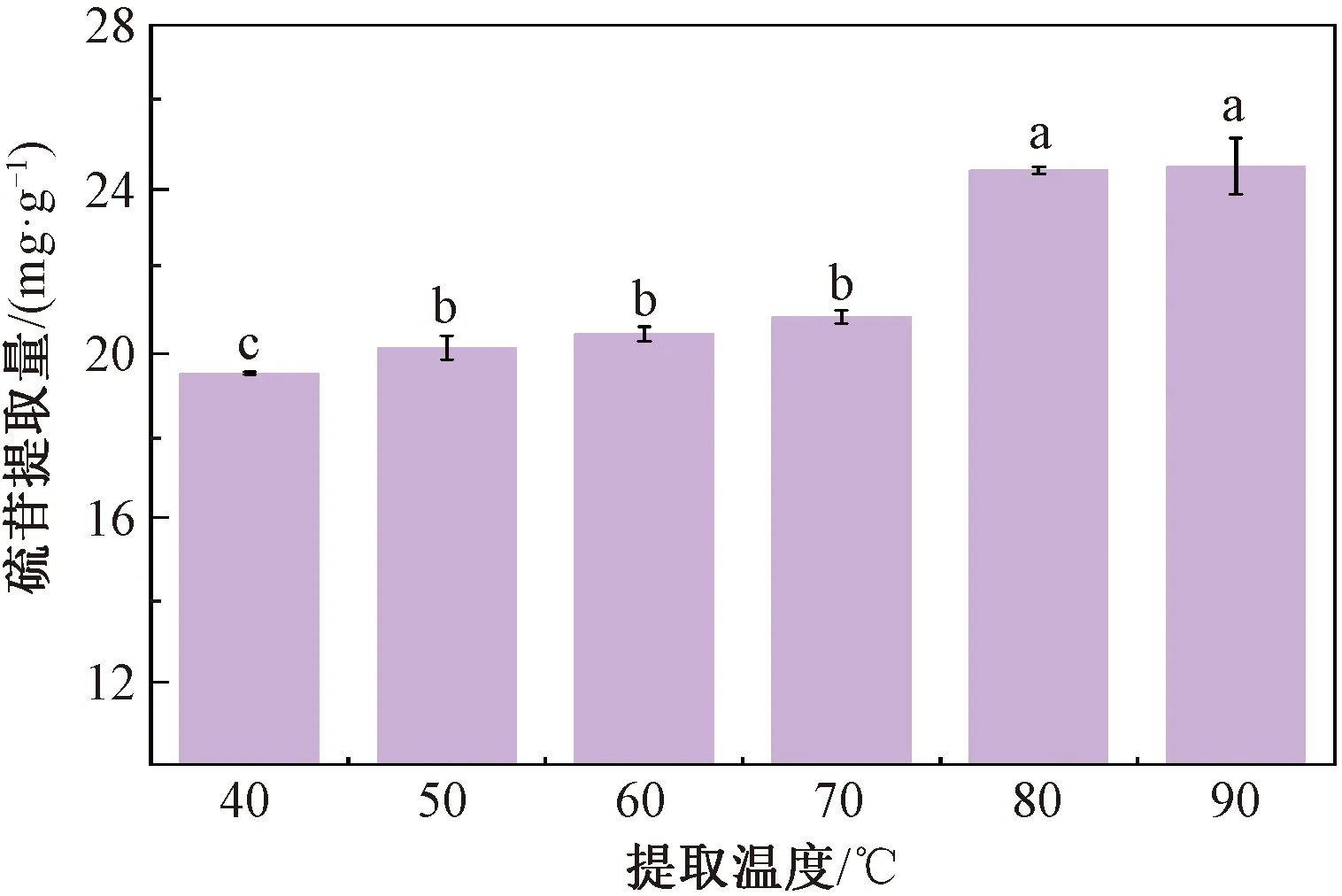
图2 提取温度对硫苷提取量的影响Fig.2 Effect of extraction temperature on the glucosinolates yield
2.1.3 提取pH 值
由图3可知,在提取剂为70%乙醇、料液比为1∶10、提取时间为10 min、提取温度为60 ℃的条件下,当pH值在3~7的范围内变化时,硫苷提取量没有发生明显的变化,最大提取量是pH 3时的21.2 mg/g,最小提取量是pH 4时的20.31 mg/g,仅差0.9 mg/g,可见pH值对菜籽粕中硫苷提取量的影响不明显,因此在后续响应面试验设计优化中不再考虑pH值。

图3 提取pH值对硫苷提取量的影响Fig.3 Effect of extraction pH on the glucosinolates yield
虽然pH值对硫苷提取量的影响不明显,但硫苷本身对pH值是比较敏感的,随着pH值的降低,硫苷的提取量也会不断提升,相较而言中性环境下大部分硫苷具有较好的稳定性[24]。同时考虑到氯化钯法测定的是总硫苷含量,pH值的显著影响或许只针对某种特定品种的硫苷,而对整体硫苷提取量的影响并不十分显著[25]。因此综合考虑,选择pH 7进行硫苷的提取和储存。
2.2 响应面优化试验
2.2.1 试验设计与结果
以硫苷提取量为响应值,采用Design-expert 8.05设计两因素三水平的响应面试验,如表1所示。

表1 响应面试验设计与结果Table 1 Response surface experimental design and results
2.2.2 回归方程与方差分析
对试验数据进行多元回归拟合,得到拟合方程:Y=25.6+0.86A+6.99B-0.23AB-1.47A2+2.4B2-1.38A2B-1.11AB2,方差分析见表2。

表2 回归模型的方差分析Table 2 Analysis of variance of regression model
由表2可知,该模型的P为0.000 9,说明回归方程较为显著;R2=0.997 0,说明该方程的拟合度较好;失拟项P>0.05,不显著,说明模型合适;变异系数为0.67%<15%,说明预计结果比较准确可信。对回归方程中各数据进一步分析可知,单因素对硫苷提取量的影响程度为提取温度(B)>提取时间(A),影响极为显著的有B、A2、B2(P<0.01),较为显著的有A、A2B、AB2(P<0.05)。
2.2.3 因子交互作用分析
提取温度和提取时间交互作用影响硫苷提取量的曲面和等高线见图4,当提取时间一定时,随着提取温度的增加,硫苷提取量呈现逐步上升的趋势;当提取温度一定时,随着提取时间的增加,硫苷提取量呈现先增大后减小的趋势,且响应面坡度比较陡峭,说明提取温度和提取时间的交互作用比较显著。

图4 提取温度和提取时间交互作用影响硫苷提取量的响应曲面和等高线Fig.4 Response surface and contour plots for the effect of variables on the extraction volume of glucosinolates versus extraction time and extraction temperature
2.2.4 模型优化与验证
通过软件分析响应曲面模型得出最佳提取条件:提取时间28.87 min,提取温度90 ℃,在此条件下预测硫苷提取量为35.01 mg/g,综合考虑工业化及实际操作等因素后修正最佳提取条件:提取时间28 min、提取温度90 ℃,进行3次平行验证试验,硫苷提取量为34.32 mg/g,与理论值的相对误差为2.0%,证明试验结果与模型拟合较好。
2.3 菜籽粕及硫苷提取物主要成分分析
为充分了解菜籽粕主要营养成分的变化,对菜籽粕提取前后以及醇沉前后的提取物进行了主要成分分析。
2.3.1 菜籽粕提取前后主要营养成分分析
菜籽粕提取前后的主要成分含量如表3所示,菜籽粕中硫苷含量与总糖含量发生明显变化,其中,硫苷含量由提取前的3.77%下降至提取后的0.37%,下降幅度达90%,相比之下总糖含量下降幅度稍小,约为70%。而提取前后菜籽粕中的粗蛋白与脂肪含量则出现一定程度的上升,粗蛋白含量由提取前的32.41%上升至提取后的42.76%,上升幅度约为30%;脂肪含量则由提取前的3.52%上升至提取后的4.93%,上升幅度约为40%。

表3 提取前后菜籽粕的主要成分Table 3 Main components of rapeseed meal before and after extraction %
通过菜籽粕提取前后主要成分的对比可知,90%的硫苷已被提取出来,可见提取方法效率较高。有研究表明由于前处理方式的不同,菜籽粕蛋白质的溶解度在35%~88%之间变动[26]。蛋白质较难溶于有机溶剂,采用70%乙醇作为提取剂,虽一部分蛋白质会溶于水中,但较大部分蛋白质仍残留于菜籽粕中,硫苷提取物中的蛋白质含量仅为13.12%。经过提取处理后的菜籽粕中硫苷含量不到0.4%,但是蛋白质含量达42%左右,因而有潜力被开发成一种高蛋白原料应用到饲料或食品中。
2.3.2 硫苷提取物醇沉前后主要成分分析
硫苷提取物醇沉前后的主要成分含量如表4所示,硫苷初提取物中粗蛋白含量仅为13.12%,与原菜籽粕的(32.41%)相比较低,但硫苷初提取物中总糖含量明显较高,达到33.56%。同时,提取物中硫苷所占比例仍较低,仅为7.67%,由于3,5-二硝基水杨酸比色法仅能测定样品中的还原糖,因此剩余组分猜测为大部分粗纤维及一小部分水分。

表4 硫苷提取物主要成分分析Table 4 Analysis of the main components of glucosinolates extraction %
与硫苷初提取物相比,通过乙醇的醇沉作用,初提取物中的总糖含量大幅度降低,由33.56%降至13.01%。同时,硫苷含量也得到了明显提升,从初提取物中的7.67%升高至醇沉后的17.79%,增幅约130%。此外,脂肪含量也出现一定程度的上升,由初提取物中的8.10%升高至醇沉后的13.54%,增幅约60%。
试验表明菜籽粕中大部分的糖会被提取液所溶解,菜籽粕中超过70%的糖被提取出来,硫苷提取物中的总糖含量较高,达到33.56%,从而导致硫苷提取物中硫苷含量仍较低,约为7.67%。为了进一步提高最终样品内的硫苷含量,采用醇沉法去除硫苷提取物中的一部分糖类,有研究表明醇含量在50%~60%时可除去淀粉,醇含量在75%时可除去蛋白质,醇含量达80%时可以除去蛋白质、多糖、无机盐[27]。因此,本研究尝试采用90%乙醇对硫苷提取冻干物进行醇沉处理,以进一步除去初提取物中的蛋白质与糖类。由表4可知,虽然醇沉处理对蛋白质的去除效果不是很显著,但醇沉后样品中的总糖含量发生明显下降,降幅达60%,同时硫苷含量大幅上升,升幅达130%,同时醇沉后的硫苷提取物中各主要成分的比例较为均匀,较有利于后续的试验。
3 结论
单因素试验结果显示提取温度与提取时间对硫苷提取量有明显影响,响应面试验结果则显示提取温度相较于提取时间对硫苷提取量的影响更大,而硫苷提取量随提取时间的增加呈现先逐渐上升后略微下降的趋势。最佳条件为提取时间28 min、提取温度90 ℃,硫苷提取量达到34.32 mg/g,可将菜籽粕中90%的硫苷提取出来。本研究确定的菜籽粕硫苷提取方法具有绿色、高效等优点,所得硫苷可进一步通过醇沉法进行纯化后用于开发相关生物制剂,且提取后的菜籽粕硫苷含量大幅度下降,而蛋白质含量仍在42%以上,可用作食品或饲料原料,为菜籽粕的高值化利用提供参考。今后可深入探究如何通过酶解等方式将纯化所得的硫苷进行定向转化,生产具有抗菌、抑癌等特殊生物活性的成分,从而进一步提高菜籽粕的附加值。
