手性农药在红曲菌发酵过程中的立体选择性行为研究
2017-07-05刘银兰陆跃乐嘉晓勤
刘银兰,陆跃乐,嘉晓勤
(浙江工业大学 生物工程学院,浙江 杭州 310014)
手性农药在红曲菌发酵过程中的立体选择性行为研究
刘银兰,陆跃乐,嘉晓勤
(浙江工业大学 生物工程学院,浙江 杭州 310014)
采用高效液相色谱-串联质谱联用技术,研究了手性农药腈菌唑、己唑醇在红曲菌液态发酵和红曲酒酿造过程中的立体选择性降解情况,以及对红曲菌产酶(糖化酶、纤维素酶)和典型代谢产物(红曲色素、桔霉素)的影响.结果表明,腈菌唑、己唑醇的对映异构体的降解速率基本一致,无选择性降解现象发生.腈菌唑、己唑醇的外消旋体及对映异构体对红曲菌产酶和代谢物呈现一定的差异性,其中,在5,0.5 mg/L己唑醇条件下,红曲菌产酶及代谢物表现出显著性变化,且(+)-己唑醇显著性大于(-)-己唑醇,5 mg/L质量浓度下显著性大于0.5 mg/L;在0.05 mg/L己唑醇条件下,红曲菌产酶及次级代谢均不存在显著性差异.此外,不同质量浓度的腈菌唑外消旋体及对映异构体对红曲菌产酶及次级代谢也不存在显著性影响.
红曲菌;手性农药;立体选择性降解;酶活
目前,手性农药占中国使用农药的40%以上[1],不同的对映异构体在生物代谢速率、生物活性、降解速率和毒理学等方面均存在不同程度的差异[2],它们在植物、人和环境中可能会发生不同的转化,从而对人和非靶生物产生不同的毒性[3-8].从食品和环境安全上来说,在对映异构体水平上研究手性农药对映异构体立体选择性行为已经迫在眉睫.
红曲酒是一种以大米为主要原料,经红曲菌、酵母菌等微生物发酵形成的特色饮品,由于含有莫那可林K、红曲色素等活性成分使其具有一定的保健功效,深受消费者喜爱.但大米原料可能会受到农药污染,导致发酵产品存在潜在的风险.腈菌唑(rac-MYC)和己唑醇(rac-HEX)属于三唑类杀菌剂,分别有两种对映异构体.它们作为叶面施用杀菌剂被用于谷物、水果和蔬菜等农作物[9],通过抑制细胞色素P-450介导的氧化脱甲基反应,阻断麦角甾醇的生物合成来阻止真菌菌丝的生长[10-12].腈菌唑和己唑醇在土壤、番茄、黄瓜、草莓、藻类、鱼、水蚤、鼠和兔子等体内具有不同的降解速率[13-17],但其在红曲菌中的研究尚无报道,对映异构体对红曲菌酶系和次级代谢物的影响也不清楚.笔者采用液相色谱和质谱联用技术分析研究了手性农药腈菌唑和己唑醇在红曲菌发酵过程中立体选择性降解行为,并从对映体水平研究手性农药对映异构体对红曲菌酶活和代谢物的影响差异.
1 材料与方法
1.1 材料和试剂
外消体腈菌唑和己唑醇标准品(纯度>99.0%)由农业部农药检定所提供;腈菌唑和己唑醇对映异构体(纯度>98.0%)由大赛璐药物手性技术(上海)有限公司提供;其余试剂均为分析纯.
1.2 红曲米
利用紫色红曲菌MonascuspurpureusFM-4000固态发酵7 d,获得酿造红曲酒所用的红曲米,糖化力为642.5 mg/(g·h),酯化力为2.511 mg/mL,色素含量为2 076.5 U/g.
1.3 红曲菌液态发酵和红曲酒酿造过程
红曲菌发酵液的农药暴露质量浓度为700 mg/L,按体积分数为10%的接种量接种于装液量100 mL/250 mL的三角瓶中,30 ℃,180 r/min培养7 d.
将1 kg糯米冲洗干净后,浸泡于2 g/L腈菌唑和己唑醇丙酮溶液中,加入1 mL吐温-80作为乳化剂,每0.5 h搅拌一次,浸泡过夜.第2天沥干浸泡水,将糯米蒸熟、冷却后放入5 L酒罐中,加入2.5 L水,1 g安琪黄酒专用酵母和100 g红曲米封口,避光发酵35 d.
1.4 样品分析
取5 mL红曲菌发酵液或红曲酒液样品转移至50 mL聚丙烯离心管中,于涡旋混合器上涡旋3 min.4 ℃,8 000 r/min离心30 min,0.22 μm滤膜过滤,取100 μL提取物用900 μL乙腈溶解,混合均匀后用于进一步液质联用[18]分析.
1.5 标准曲线和方法验证
用乙腈溶解逐级稀释不同质量浓度(2.5,5,25,50,100,250,500 mg/L)的标准溶液,绘制质量浓度对峰面积的曲线并进行回归分析,使用Microsoft Excel计算标准偏差(SD)和相对标准偏差(RSD)(RSD=(SD/mean)×100%).因发酵前后发酵基质物质种类变化较大,故在不同时间点进行添加回收试验(每个单体质量浓度为0.5,5,50 mg/L).最小检出限(LOD)为检测实际样本时仪器3 倍信噪比;最低定量限(LOQ)为检测实际样本时仪器10 倍信噪比.
1.6 测定不同浓度下的酶活性
在不同时间点(1,3,5,7 d)进行发酵液取样.样品4 ℃,8 000 r/min离心20 min,在上清中缓慢加入不同饱和浓度的硫酸铵分级沉淀,去上清,沉淀重悬于50 mmol/L PBS缓冲液中,经透析袋去盐后,装入截留分子量为3 kDa超滤管中浓缩,收集粗酶液,检测糖化酶和纤维素酶[19]的酶活.糖化酶酶活单位(U)定义:在40 ℃,pH=4.6条件下,每3 min水解淀粉生成1 mg还原糖所需的酶量为1 U;纤维素酶酶活单位(U)定义:在30 ℃,pH=4.6条件下,每3 min水解羧甲基纤维素钠生成1 mg还原糖所需的酶量为1 U.红曲菌发酵液取样后,8 000 r/min离心20 min,取上清液,测定红曲色素产量和桔霉素含量[20].
2 结果与讨论
2.1 标准曲线和方法验证
质量浓度为2.5~500 mg/L时,腈菌唑和己唑醇的对映异构体呈良好的线性关系(R2≥0.997).在此色谱条件下,外消旋腈菌唑和己唑醇完全拆分,且出峰位置无杂质干扰.
分别在0,3,7 d和0,14,35 d对空白红曲菌液态发酵、红曲酒样本进行添加回收试验,其回收率分别为(96.8±3.9)%~(99.8±2.2)%,(93.2±3.8)%~(99.8±2.0)%;RSD分别为2.1%~4.2%,2.0%~4.2%(表1).在此过程中,腈菌唑和己唑醇两个对映异构体的最小检出限为0.001 mg/L,最低定量限为0.005 mg/L,满足该试验要求.本试验方法的回收率为70%~110%,RSD<15%.因此,本方法可适用于此发酵过程中腈菌唑和己唑醇对映异构体的含量分析.
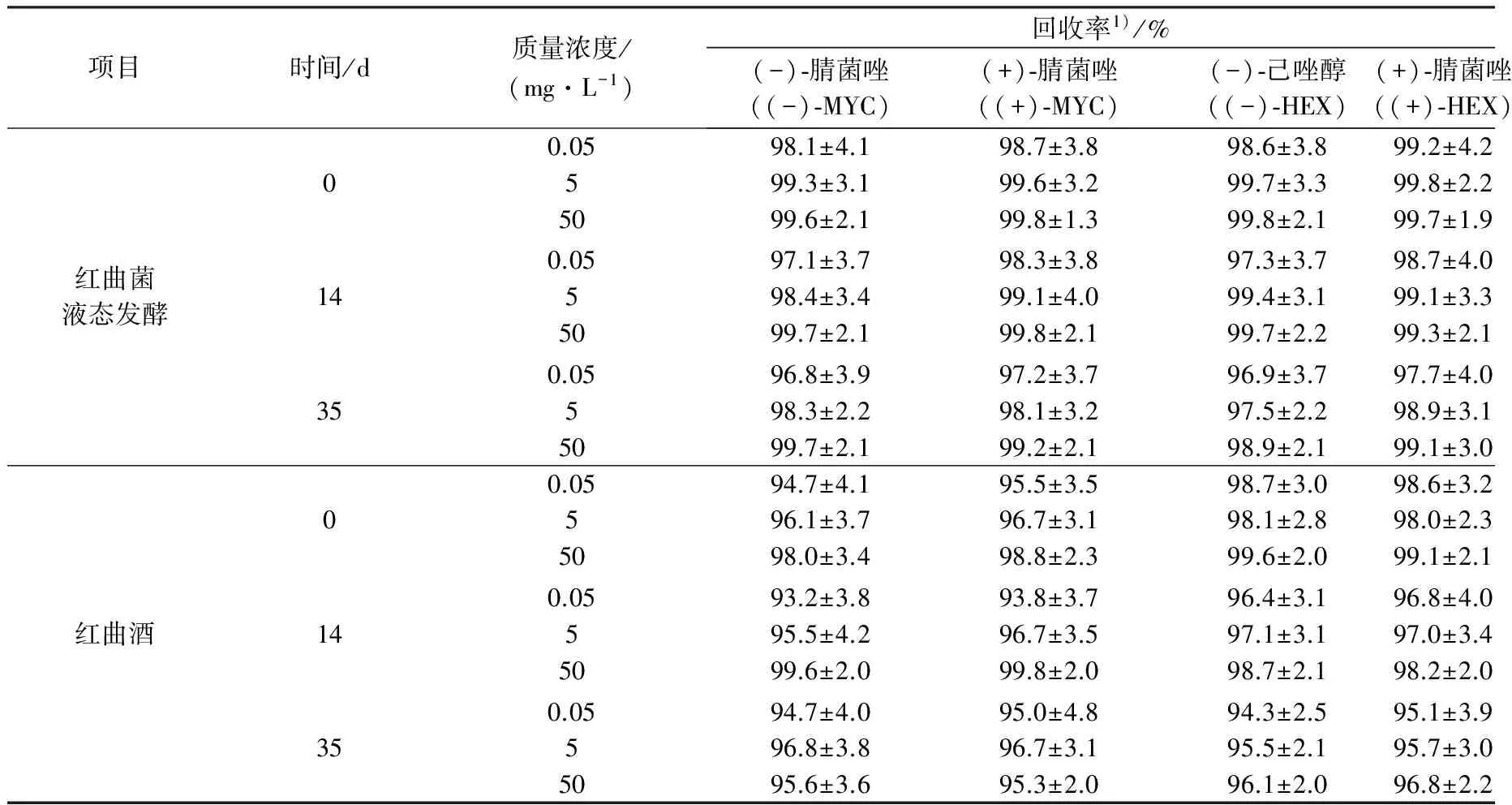
表1 腈菌唑和己唑醇两个对映异构体的添加回收率Table 1 Recoveries of the enantiomers of MYC and HEX in the fermention samples
注:1) 回收率表示平均回收率±SD(n=3).
2.2 腈菌唑和己唑醇的立体选择性降解研究
随着时间的变化,腈菌唑和己唑醇对映异构体的残留情况如图1所示,腈菌唑和己唑醇对映异构体的浓度变化及其趋势基本一致.在红曲菌液态发酵过程中,腈菌唑和己唑醇对映异构体一直有明显的降解现象,(+)-R-MYC,(-)-S-MYC,(+)-R-HEX与(-)-S-HEX分别降解了23.06%,23.42%,16.00%,15.67%,模拟两者的降解曲线,并获得较好的相关系数(R2≥0.993),(+)-R-MYC,(-)-S-MYC,(+)-R-HEX和(-)-S-HEX的半衰期分别为3.355,3.455,6.681,6.696 d,可见(+)-R-MYC,(+)-R-HEX的降解速度均稍高于(-)-S-MYC,(-)-S-HEX.在红曲酒酿造过程中,腈菌唑浓度前5 d一直呈上升趋势,可能是酒液处于吸收状态,之后直至35 d,仅有少量腈菌唑和己唑醇被降解,(+)-R-MYC,(-)-S-MYC,(+)-R-HEX与(-)-S-HEX分别降解了13.85%,13.39%,39.24%,37.29%.同时,计算EF值均接近0.5.可见腈菌唑和己唑醇对映异构体未发生立体选择性降解.
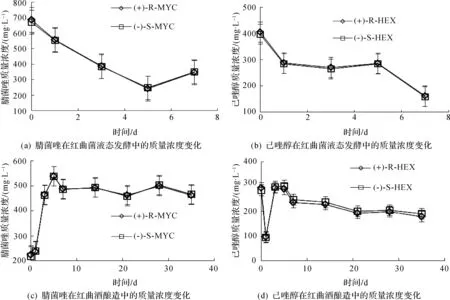
图1 腈菌唑和己唑醇在红曲菌液态发酵和红曲酒酿造中的质量浓度变化趋势图Fig.1 Degradation linear of MYC and HEX enantiomers in the submerged fermentation of Monascus and in the Monascus wine
2.3 手性农药对红曲菌糖化酶活性影响差异
在红曲菌液态发酵中,对照空白样本,3 个浓度的腈菌唑和己唑醇外消旋体及其对映异构体对糖化酶有一定影响(图2).在手性农药质量浓度为5 mg/L时,腈菌唑和己唑醇对糖化酶有抑制作用,其中(+)-R-MYC,(+)-R-HEX及(-)-S-HEX对糖化酶有较强的抑制作用,采用SPSS软件进行方差分析,己唑醇两个对映异构体对糖化酶的影响有显著性差异(P<0.05),且(+)-R-HEX显著性大于(-)-S-HEX;在质量浓度为0.5 mg/L时,rac-HEX,rac-MYC,(+)-R-HEX,(-)-S-HEX使得糖化酶酶活升高,说明手性农药对糖化酶有激活作用,分析表明己唑醇两个对映异构体对糖化酶的影响有显著性差异(P<0.05),且(+)-R-HEX显著性大于(-)-S-HEX;在质量浓度为0.05 mg/L时,手性农药对糖化酶酶活性的影响与对照组基本一致,不受两个农药外消旋体及对映体的影响.
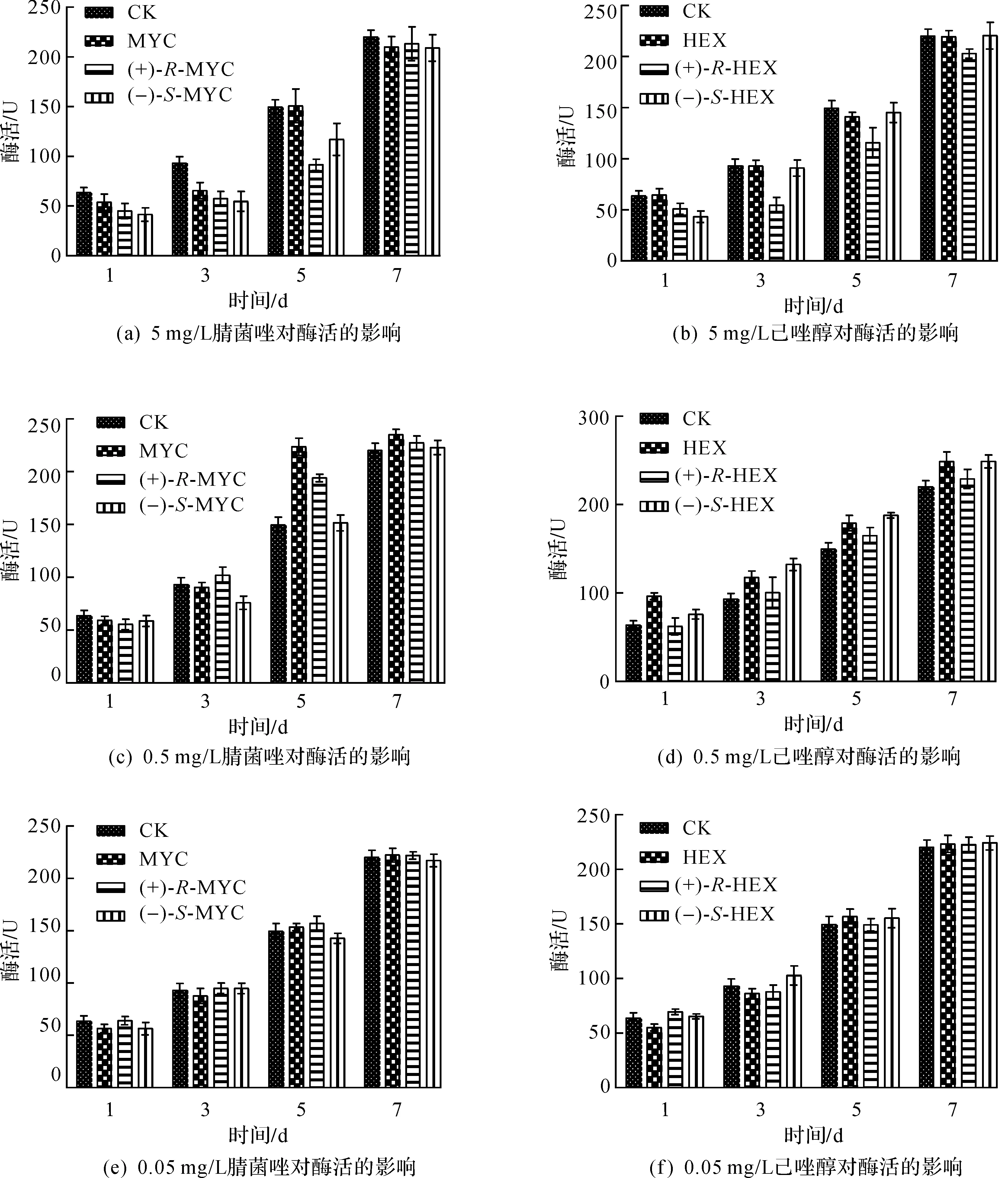
图2 腈菌唑和己唑醇及其对映异构体在不同质量浓度下对糖化酶酶活的影响Fig.2 The impact of different concentrations of test pesticides and their enantiomers on glucoamylase
2.4 手性农药对红曲菌纤维素酶活性影响差异
在红曲菌液态发酵中,从图3可知:在手性农药质量浓度为5 mg/L时,手性农药对纤维素酶酶活有一定的抑制作用,酶活均小于对照组,rac-MYC,(+)-R-MYC,(-)-S-MYC,(+)-R-HEX和(+)-R-HEX对纤维素酶有较强的抑制作用.用SPSS软件数据分析发现,酶活相比对照组有显著性差异(P<0.05),且(+)-R-HEX显著性大于(-)-S-HEX;在质量浓度为0.5 mg/L时,酶活有所上升,且都大于对照组,用软件分析表明有显著性差异(P<0.05),且(+)-R-HEX显著性大于(-)-S-HEX;在0.05 mg/L时,纤维素酶酶活性与对照组基本一致,不受两个农药外消旋体及对映体的影响.
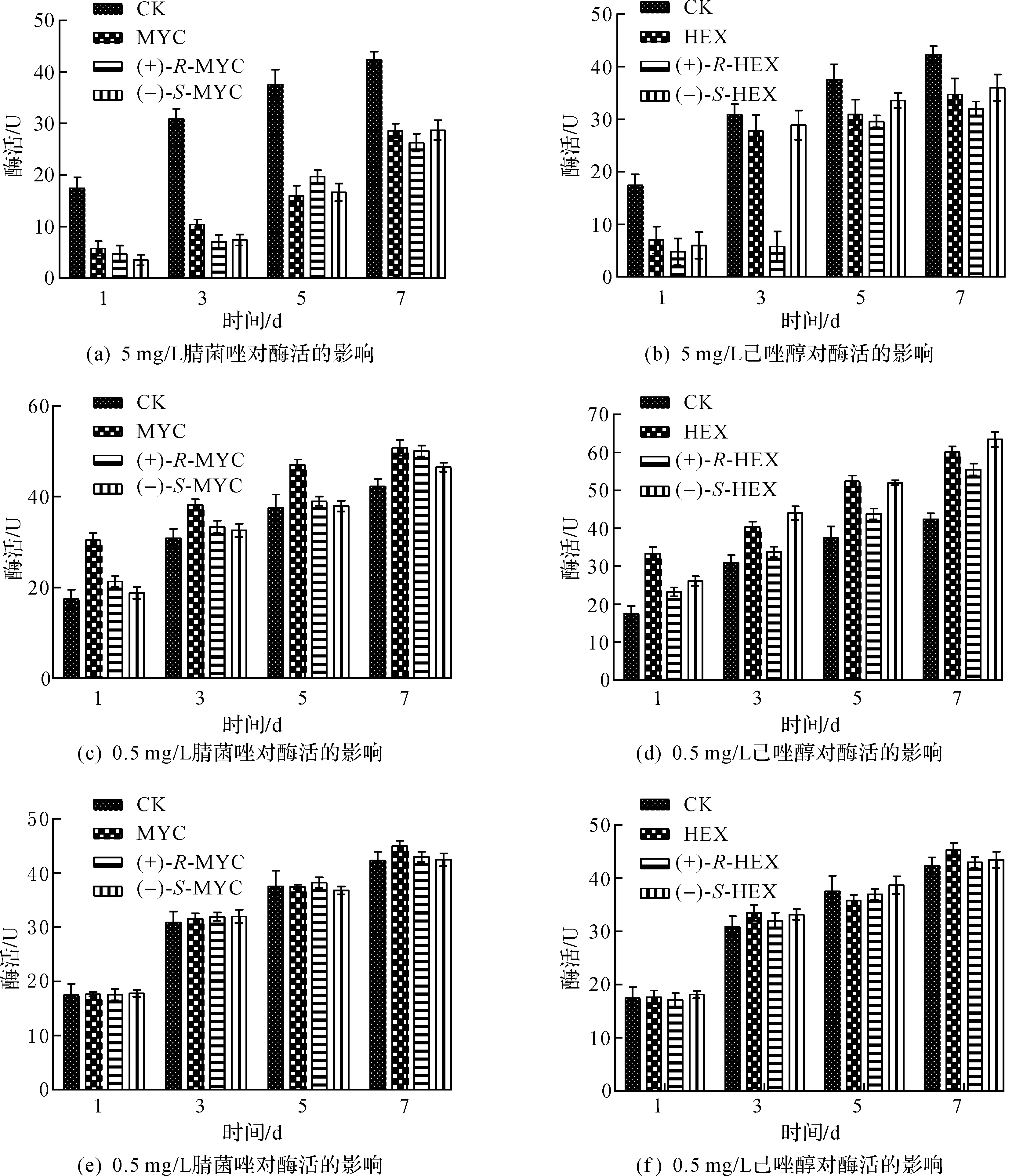
图3 腈菌唑和己唑醇及其对映异构体在不同质量浓度下对纤维素酶酶活的影响Fig.3 The impact of different concentrations of test pesticides and their enantiomers on cellulase
2.5 手性农药对红曲菌色价影响差异
在红曲菌液态发酵中,与空白样本对照(图4),3 个浓度的腈菌唑和己唑醇外消旋体及其对映异构体对色价有不同程度的抑制作用.随着手性农药添加质量浓度逐步增大,手性农药对色价有强烈的抑制作用,尤其rac-HEX,(+)-R-HEX,(-)-S-HEX及(-)-S-MYC对色价影响更为明显,通过SPSS软件数据分析发现,相比对照组色价间均有显著性差异(P<0.05),且(+)-R-HEX显著性大于(-)-S-HEX.

图4 腈菌唑和己唑醇及其对映异构体在不同质量浓度下对色价的影响Fig.4 The impact of different concentrations of test pesticides and their enantiomers on color value
2.6 手性农药对红曲菌桔霉素产量的影响差异
在红曲菌液态发酵中,对照空白样本,3 个浓度的腈菌唑和己唑醇外消旋体及其对映异构体对桔霉素质量浓度有一定影响(图5).随着手性农药添加质量浓度逐渐升高,桔霉素的质量浓度出现不同程度的增加趋势,其中rac-HEX对桔霉素质量浓度的影响极其明显,通过SPSS软件数据分析发现相比对照组有显著性差异(P<0.05),且(+)-R-HEX显著性大于(-)-S-HEX,而导致出现这种现象的原因,可能与rac-HEX对细胞的毒副作用较大有关.
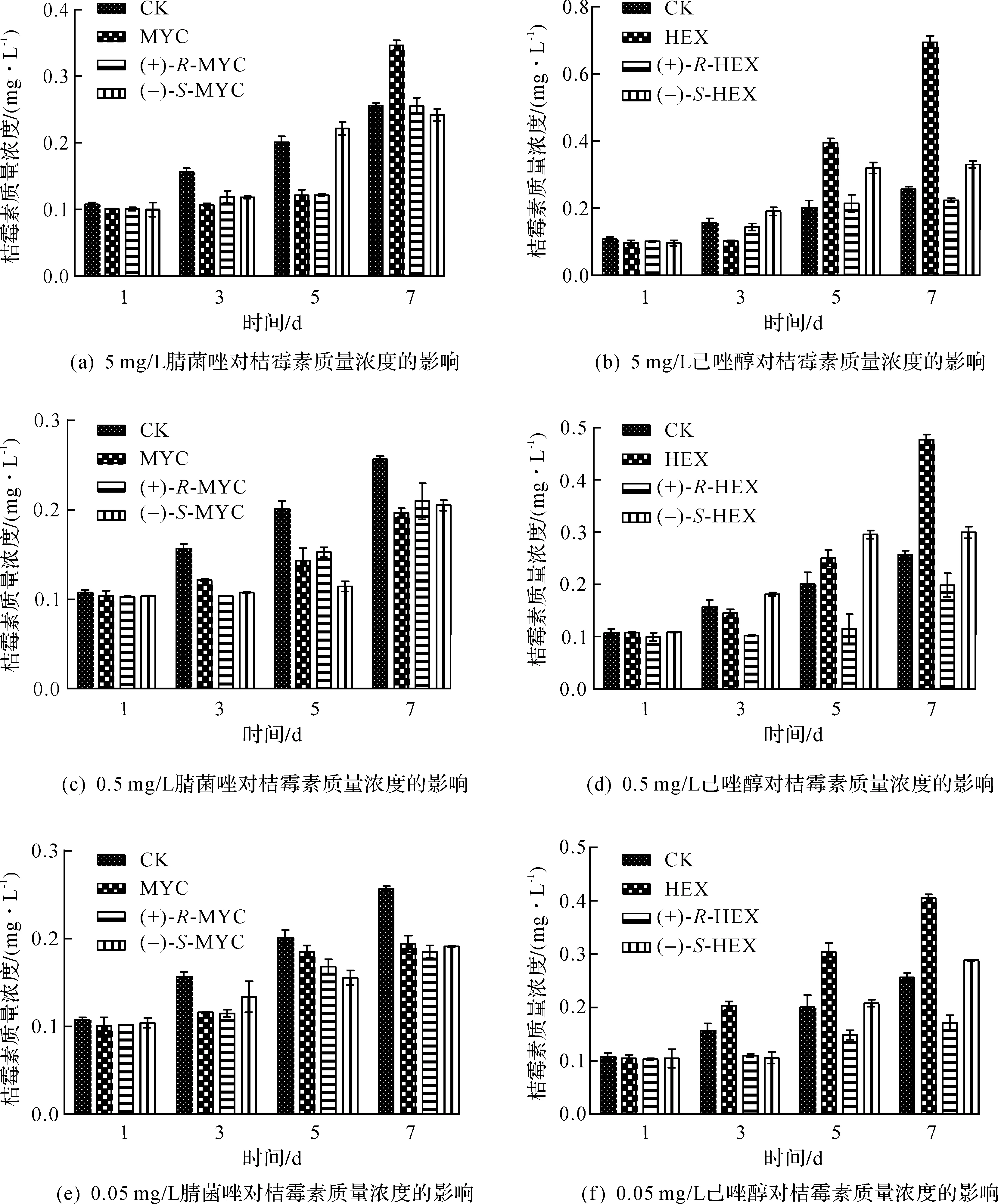
图5 腈菌唑和己唑醇及其对映异构体在不同质量浓度下对桔霉素质量浓度的影响Fig.5 The impact of different concentrations of test pesticides and their enantiomers on citrinin
3 结 论
上述试验的研究发现,腈菌唑和己唑醇的对映异构体在红曲菌发酵过程中都有一定程度的降解,且降解速率基本一致,均小于50%,可见腈菌唑和己唑醇在发酵过程中残留时间较长,并一直残留至最终的产品中,可能会对消费者构成潜在的风险.而手性农药残留对红曲菌酶活性存在不同程度的影响,对映异构体之间存在不同的差异性,且(+)-己唑醇显著性大于(-)-己唑醇.笔者研究了手性农药腈菌唑和己唑醇的不同对映异构体立体选择性降解和生物活性情况,为今后评估环境风险和人类健康安全提供一定的参考.
[1] ZHOU Ying, LI Ling, LIN Kunde, et al. Enantiomer separation of triazole fungicides by high-performance liquid chromatography [J]. Chirality, 2009, 21(4): 421-427.
[2] DONG Fenshou, CHENG Li, LIU Xingang, et al. Enantioselective analysis of triazole fungicide myclobutanil in cucumber and soil under different application modes by chiral liquid chromatography/tandem mass spectrometry [J]. Journal of agricultural and food chemistry, 2012, 60(8): 1929-1936.
[3] GARRISON A W. Probing the enantioselectivity of chiral pesticides [J]. Environmental science & technology, 2006, 40(1): 16-23.
[4] SUM Mingjing, LIU Donghui, DANG Ziheng, et al. Enantioselective behavior of malathion enantiomers in toxicity to beneficial organisms and their dissipation in vegetables and crops [J]. Journal of hazardous materials, 2012, 237: 140-146.
[5] LIU Weiping, GAN Jianying, SCHLENK D, et al. Enantioselectivity in environmental safety of current chiral insecticides [J]. Proceedings of the national academy of sciences of the United States of America, 2005, 102(3): 701-706.
[6] DIAO Jinling, XU Peng, LIU Donghui, et al. Enantiomer-specific toxicity and bioaccumulation of alpha-cypermethrin to earthwormEiseniafetida[J]. Journal of hazardous materials, 2011, 192(3): 1072-1078.
[7] BUERGE I J, BACHLI A, DE J P, et al. The chiral herbicide beflubutamid (I): isolation of pure enantiomers by HPLC, herbicidal activity of enantiomers, and analysis by enantioselective GC-MS [J]. Environmental science & technology, 2012, 47(13): 6806-6811.
[8] ZHANG Xiaoxiang, WANG Se, WANG Yu, et al. Differential enantioselectivity of quizalofop ethyl and its acidic metabolite: direct enantiomeric separation and assessment of multiple toxicological endpoints [J]. Journal of hazardous materials, 2011, 186(1): 876-882.
[9] ZHANG Ping, DANG Ziheng, SHEN Zhigang, et al. Enantioselective degradation of hexaconazole in rat hepatic microsomesinvitro[J]. Chirality, 2012, 24(4): 283-288.
[10] WORTHING P A. Synthesis of 1, 2, 4-triazole compounds related to the fungicides flutriafol and hexaconazole [J]. Pesticide science, 1991, 31(4): 457-498.
[11] WANG Xinquan, ZHANG Hu, XU Hao, et al. Enantioselective residue dissipation of hexaconazole in cucumber (CucumissativusL.), head cabbage (Brassicaoleracea L. var.caulorapaDC.), and soils [J]. Journal of agricultural and food chemistry, 2012, 60(9): 2212-2218.
[12] OBLIQUUS S. Enantioselective toxic effects of hexaconazole enantiomers against [J]. Chirality, 2012, 24(8): 610-614.
[13] LI Yuanbo, DONG Fengshou, LIU Xingang, et al. Enantioselectivity in tebuconazole and myclobutanil non-target toxicity and degradation in soils [J]. Chemosphere, 2015, 122: 145-153.
[14] ZHANG Hu, WANG Xinquan, QIAN Mingrong, et al. Residue analysis and degradation studies of fenbuconazole and myclobutanil in strawberry by chiral high-performance liquid chromatography-tandem mass spectrometry [J]. Journal of agricultural and food chemistry, 2011, 59(22): 12012-12017.
[15] LI Yuanbo, DONG Fengshou, LIU Xingang, et al. Studies of enantiomeric degradation of the triazole fungicide hexaconazole in tomato, cucumber, and field soil by chiral liquid chromatography-tandem mass spectrometry [J]. Chirality, 2013, 25(3): 160-169.
[16] 孙明婧. 四种三唑类手性农药的环境行为研究[D]. 北京: 中国农业大学, 2014.
[17] 李远播. 几种典型手性三唑类杀菌剂对映体的分析、环境行为及其生物毒性研究[D]. 北京: 中国农业科学院, 2013.
[18] QIU Jing, DAI Shouhui, ZHENG Chuangmu, et al. Enantiomeric separation of triazole fungicides with 3-μm and 5-μmL particle chiral columns by reverse-phase high-performance liquid chromatography [J]. Chirality, 2011, 23(6): 479-486.
[19] CHEN Guo, MA Yunhui, SU Pengfei, et al. Direct binding glucoamylase onto carboxyl-functioned magnetic nanoparticles [J]. Biochemical engineering journal, 2012, 67: 120-125.
[20] WANG Changlu, FU Zhiliang, CHEN Mianhua, et al. Blue light effects on pigment and citrinin production inMonascus[C]//Chen Mianhua. Bioinformatics and Biomedical Engineering. Piscataway: IEEE, 2009: 1-4.
(责任编辑:朱小惠)
Stereoselective behaviors of chiral pesticide in theMonascusfermentation process
LIU Yinlan, LU Yuele,JIA Xiaoqin
(College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China)
The stereoselective degradation of myclobutanil and hexaconazole in the submerged fermentation ofMonascusandMonascuswine brewing process were analyzed by HPLC-MS/MS, and the effects of enantiomers on enzyme (glucoamylase, cellulose) and secondary metabolites (Monascuspigment, citrinin) ofMonascuswere investigated. The results showed that the degradation rate of two enantiomers of myclobutanil and hexaconazole was similar, and no stereoselective degradation was found. The racemates and enantiomers of myclobutanil and hexaconazole showed certainly differences in the enzyme production and metabolism ofMonascus. At a concentration of 5 and 0.5 mg/L of racemates and enantiomers of hexaconazole, respectively, the enzyme production and metabolites changed significantly, with (+)-hexoxazole higher than (-)-hexaconazole. However, at 0.05 mg/L of racemates and enantiomers of hexaconazole, no significant changes occurred. In addition, there was also no significant difference between racemates and enantiomers at different concentrations of myclobutanil.
Monascus; chiral pesticide; stereoselective degradation; enzymatic activity
2017-02-28
国家文物局指南针计划项目(20130306)
刘银兰(1990—),女,河南开封人,硕士研究生,研究方向为发酵工程,E-mail:liuyinlan0215@163.com. 通信作者:嘉晓勤副教授,E-mail: monascus@zjut.edu.cn.
Q815
A
1674-2214(2017)02-0092-08
