利用重组枯草芽孢杆菌L-氨基酸连接酶合成丙谷二肽
2017-07-05朱新雅贾子樊范晓光
洪 翔,朱新雅,贾子樊,黄 晗,谭 旭,范晓光
(1.天津科技大学 工业发酵微生物教育部重点实验室,天津 300457;2.天津科技大学 生物工程学院,天津 300457;3.天士力控股集团有限公司 健保食品开发中心,天津 300040)
利用重组枯草芽孢杆菌L-氨基酸连接酶合成丙谷二肽
洪 翔1,2,朱新雅1,2,贾子樊1,2,黄 晗2,谭 旭3,范晓光1,2
(1.天津科技大学 工业发酵微生物教育部重点实验室,天津 300457;2.天津科技大学 生物工程学院,天津 300457;3.天士力控股集团有限公司 健保食品开发中心,天津 300040)
利用大肠杆菌EscherichiacoliBL21(DE 3)克隆并表达来源于枯草芽孢杆菌BacillussubtilisATCC 15245的L-氨基酸连接酶(L-amino acid ligase,Lal)基因,采用Ni-NAT亲和层析法分离纯化得到重组的Lal,并以L-丙氨酸和L-谷氨酰胺为底物制备L-丙氨酰-L-谷氨酰胺(丙谷二肽).Lal属于ATP依赖酶,研究结果表明其最适反应温度和pH值分别为37 ℃和9.0,连续催化反应14 h可催化等摩尔的底物氨基酸(30 mmol/L)生成22.4 mmol/L的丙谷二肽,最高摩尔转化率可达74.7%.成功克隆表达了枯草芽孢杆菌的L-氨基酸连接酶,并将其应用于丙谷二肽的酶法合成,研究结果可为丙谷二肽的生物制造奠定理论基础.
丙谷二肽;L-氨基酸连接酶;枯草芽孢杆菌;大肠杆菌;酶法合成
L-丙氨酰-L-谷氨酰胺(丙谷二肽)是由L-丙氨酸和L-谷氨酰胺缩合形成的二肽,属于氨基酸类的化学药剂,也是国际公认的L-谷氨酰胺的最适载体.丙谷二肽的水溶性可以达到586 g/L,在体内能够迅速地分解为L-谷氨酰胺和L-丙氨酸,并能够被有效地吸收和利用,因此常作为术后病人的必须营养注射液使用[1-2].目前,工业生产丙谷二肽的方法主要为化学法,但化学法反应步骤繁琐,路线较长且需要使用有毒的化学试剂[3-4].近年来,已有报道采用氨基酸酯酰基转移酶催化L-丙氨酸甲酯盐酸盐和L-谷氨酰胺生成丙谷二肽,但由于底物L-丙氨酸甲酯盐酸盐亦需要使用化学合成法进行制备,且反应过程中会生成L-丙氨酰-丙氨酰-丙氨酸、L-丙氨酰-丙氨酸等副产物,导致该方法生产分离过程复杂,不利于工业化放大[5-7].2005年,日本科学家基于细菌中D-丙氨酰-D丙氨酸连接酶的氨基酸序列和结构,通过计算机模拟最终从枯草芽孢杆菌BacillussubtilisATCC 15245中发现了一种L-氨基酸连接酶,该酶具有以无保护的氨基酸为底物合成二肽的能力[8].因此,笔者利用大肠杆菌EscherichiacoliBL21(DE 3)克隆并表达来源于枯草芽孢杆菌BacillussubtilisATCC 15245的L-氨基酸连接酶基因,通过Ni-NAT亲和层析法分离纯化,将其应用于丙谷二肽的酶法合成中,并对反应条件进行了系统优化,以期为丙谷二肽的生物制造奠定理论基础,同时为其他二肽的生产技术改进提供借鉴.
1 材料和方法
1.1 材 料
1.1.1 菌株和质粒
大肠杆菌E.coliDH5α、大肠杆菌E.coliBL21(DE 3)以及质粒pET-His (Ampr)均由本实验室保藏.
1.1.2 培养基
LB(Luria-Bertani)培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.0~7.2,121 ℃灭菌20 min.
1.1.3 主要试剂
限制性内切酶、T4DNA连接酶、ExTaq DNA聚合酶均购自宝生物工程(大连)有限公司;PCR产物回收及质粒提取试剂盒购于北京博大泰克生物基因技术有限责任公司;L-丙氨酸、L-谷氨酰胺、L-丙氨酰-L-谷氨酰胺(丙谷二肽)和L-丙氨酰-L-丙氨酸标品购于美国Sigma公司,其他试剂均为国产分析纯.
1.2 质粒pETHis-Lal的构建
根据Genbank上B.subtilisATCC 15245的氨基酸连接酶编码基因序列,用大肠杆菌中常用的密码子软件对其进行密码子优化,使其可以在大肠杆菌中高效转录.将优化后的序列送到金唯智公司进行合成,得到带有氨基酸连接酶编码基因的重组质粒pUC57-Lal.
利用引物(上游引物:CGGGATCCGAGCGCAAAACAGTTCTGGTTA和下游引物:CCCAAGCTTTTACACCGGCAGAACATATTTG)以及ExTaq PCR试剂盒扩增氨基酸连接酶编码基因.PCR条件为95 ℃ 5 min 1 个循环;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min 30 个循环;72 ℃ 10 min 1 个循环.反应体系为50 μL,PCR产物经质量分数为1.5%琼脂糖凝胶电泳并切胶回收.
目的产物回收后经HindIII和BamHI酶切、电泳和切胶回收后连接至经相同酶切的表达载体pETHis并化学转化至E.coliDH5α感受态细胞中.LB培养基活化后涂布于含氨苄青霉素(100 μg/mL)的LB固体培养基上.过夜培养后,挑取单菌落利用引物进行PCR验证,阳性菌株接入含氨苄青霉素(100 μg/mL)的LB液体培养基中,经37 ℃振荡培养12 h后提取质粒进行酶切验证.将验证正确的重组质粒命名为pETHis-Lal.
1.3E.coliBL21-Lal的构建
取适宜浓度的质粒pETHis-Lal化学转化至E.coliBL21(DE3)感受态细胞中,在Super optimal broth with catabolite repression (SOC)中活化后涂布于含氨苄青霉素(100 μg/mL)的LB固体培养基上,37 ℃倒置培养12 h.挑取单菌落活化后提取质粒并分别利用引物进行酶切验证.将验证正确的重组菌株命名为E.coliBL21-Lal,保存至甘油管中备用.
1.4 菌体培养
将E.coliBL21-Lal以0.1%(体积分数)接种量接种至100 mL含氨苄青霉素(100 μg/mL)的LB液体培养基中,37 ℃,200 r/min培养12 h,再按1%(体积分数)接种量转接至400 mL含氨苄青霉素(100 μg/mL)的LB液体培养基中,37 ℃,200 r/min培养至OD600=0.7时添加终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),28 ℃诱导培养7 h.结束后7 000 r/min 离心10 min去上清,生理盐水洗涤菌体2 次,-80 ℃冻存.
1.5 氨基酸连接酶Lal的纯化
1.5.1 菌体处理
1) 离心收集50 mL发酵液中的菌体,用8 mL的平衡缓冲液重悬并加入适量的苯甲基黄酰氟(PMSF)或其他对镍柱性能没有影响的蛋白酶抑制剂.
2) 高强度的超声破碎1 s/3 s,180 次循环
3) 可选步骤,如果裂解液太稠,加入RNaseA (10 μg/mL)和DNase I (5 μg/mL),冰上孵育10~15 min.
4) 裂解液10 000 g/min离心15 min获得蛋白上清液.
1.5.2 镍柱预处理
1) 轻轻地把瓶子颠倒几次,使树脂完全悬浮.
2) 用移液管将镍树脂浆转移至适当体积的柱子中,让树脂沉淀并将储存缓冲液从柱中排出.
3) 用4倍柱床体积的平衡缓冲液使树脂平衡,或直到A280稳定.
1.5.3 上样及洗脱
1) 将蛋白上清液以0.5~1 mL/min的流速通过镍柱用于吸附带His标签的蛋白,定时收集并保存流出液用于分析.
2) 上样结束后以1 mL/min流速加入8倍柱床体积的清洗缓冲液,直到A280稳定.
3) 以1 mL/min流速用5~10倍体积的洗脱缓冲液洗脱,收集洗脱液,根据蛋白的特性,用10 mmol/L pH为8的Tris-HCl或pH为7.4的PBS缓冲液透析.
1.6 酶催化反应体系
10 mL催化反应体系如下:丙氨酸(Ala)30 mmol/L,谷氨酰胺(Gln)30 mmol /L,Mg2+30 mmol/L,ATP 30 mmol/L,不同pH值的Tris-Hcl缓冲液100 mmol/L以及纯化后的L-氨基酸连接酶0.2 mg/mL.
1.7 丙谷二肽的检测
采用氨基酸分析仪检测反应液中丙谷二肽的含量,其保留时间为24.2 min.
2 结果与讨论
2.1 重组质粒pETHis-Lal的构建
根据Genbank上B.subtilisATCC 15245的氨基酸连接酶编码基因序列,用大肠杆菌中常用的密码子软件对其进行密码子优化.合成获得目的片段经切胶回收并利用Hind III和BamHI酶切后连接至经相同酶切的表达载体pET-His上,获得重组质粒pETHis-Lal,然后转化至E.coliDH5α感受态细胞中获得重组菌株E.coliBL21-Lal.提取重组质粒,利用Hind III和BamHI双酶切验证.结果如图1所示,经Hind III和BamHI双酶切获得分子量约为2 900 bp及1 400 bp的片段,与pETHis和目的基因的片段分子量接近,证明目的基因已成功连接到表达载体上.
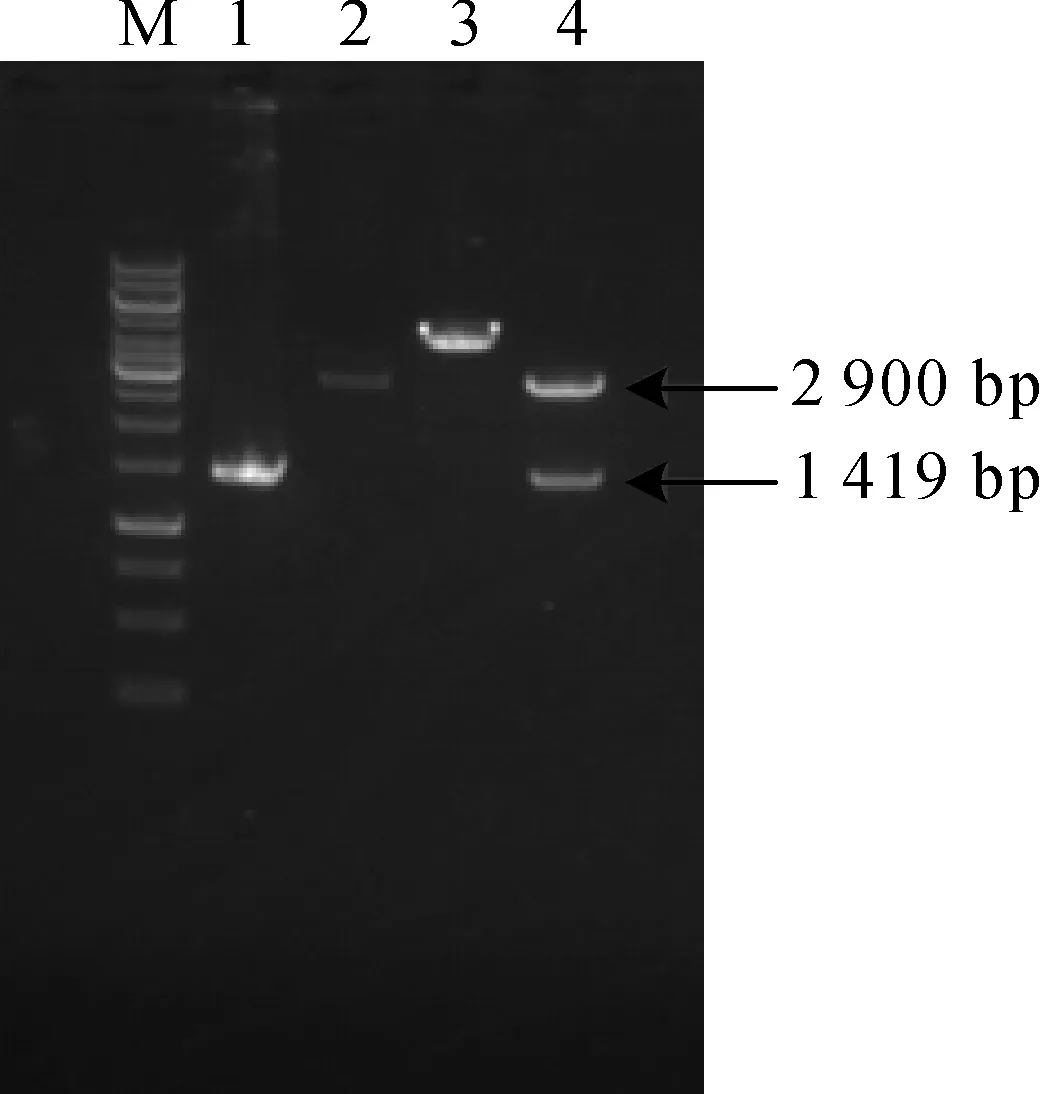
M—Marker;1—目的基因片段;2—pETHis使用Hind III单酶切;3—pETHis-Lal使用Hind III单酶切;4—pETHis-Lal使用Hind III/BamH I双酶切图1 重组质粒pETHis-Lal的酶切验证图谱Fig.1 Identification of recombinant plasmids pETHis-Lal digested by restricted endonuclease
2.2 L-氨基酸连接酶的表达及纯化
将构建菌株E.coliBL21-Lal接种于400 mL含氨苄青霉素(100 μg/mL)的LB液体培养基中,培养至OD600=0.7时添加终浓度为0.1 mmol/L的IPTG,28 ℃诱导培养7 h后收集部分菌体并超声破碎后进行SDS-PAGE.经考马斯亮蓝染色后结果如图2中1,2泳道所示.E.coliBL21-Lal菌体破碎液及上清液中均出现一条分子量约53 kD的条带,与文献报道的携带六个组氨酸标签的L-氨基酸连接酶分子量(53 kD)一致[8],表明来自于枯草芽孢杆菌的目的蛋白可以在大肠杆菌中可溶性表达且表达量较高.

M—Marker;1—对照组E. coli BL21菌体破碎上清液;2—E. coli BL21-Lal菌体破碎上清液;3—E. coli BL21-Lal菌体破碎上清液通过镍柱后的流出液;4,5,6—洗脱的目的蛋白图2 重组L-氨基酸连接酶的SDS-PAGE电泳图Fig.2 SDS-PAGE analysis of recombinant L-amino acid ligase
将剩余菌体破碎液离心后去上清液并采用Ni-NTA亲和层析方法分离纯化重组的L-氨基酸连接酶,经透析、浓缩、SDS-PAGE和考马斯亮蓝染色后出现分子量约为53 kD的单一条带,如图2中6泳道所示,经测定其质量浓度为4 mg/mL,表明该蛋白纯化效果理想,可以用于后续酶催化实验.
2.3 重组L-氨基酸连接酶的催化反应产物分析
采用氨基酸分析仪对丙谷二肽标准品以及重组L-氨基酸连接酶的催化反应产物进行分析,结果如图3所示.标准品和重组L-氨基酸连接酶的催化反应产物均出现保留时间为23.1 min的色谱峰.但图3(b)中还出现保留时间为10.1,17.8,28.3 min的色谱峰,分别对应的物质为L-谷氨酰胺、L-丙氨酸和L-丙氨酰-丙氨酸.因此说明L-氨基酸连接酶可以催化L-丙氨酸和L-谷氨酰胺形成丙谷二肽,但同时会有少量副产物L-丙氨酰-L-丙氨酸的生成.
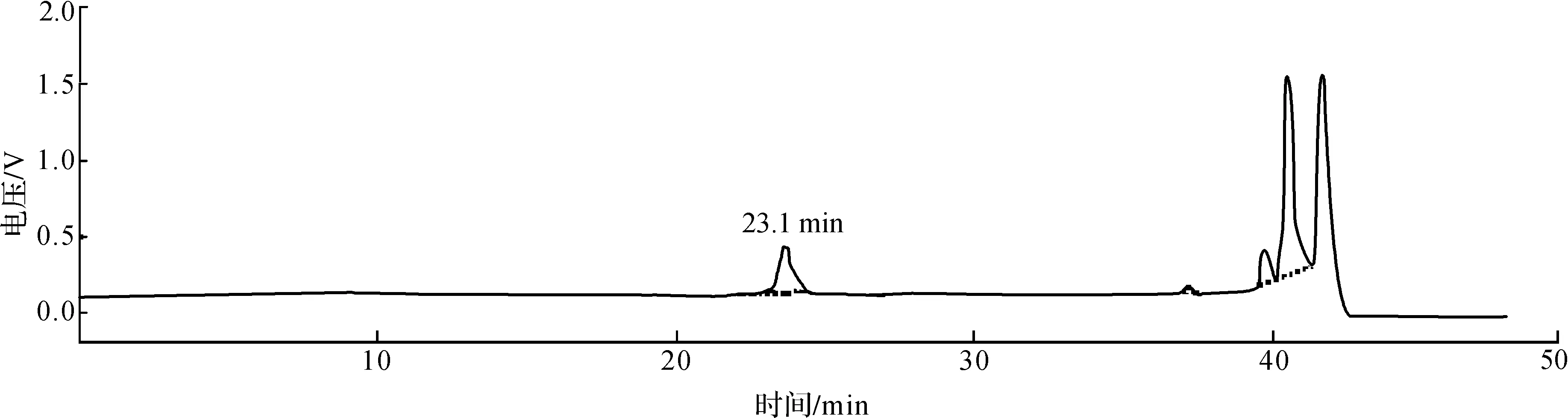
(a) 丙谷二肽标准品色谱图
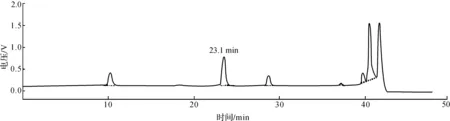
(b) 酶催化产物色谱图图3 丙谷二肽标准品及重组L-氨基酸连接酶的反应产物的色谱图Fig.3 Chromatography of L-Ala-L-Gln standard and product catalyzed by L-amino acid ligase
2.4 重组L-氨基酸连接酶催化反应条件的优化
将纯化的L-氨基酸连接酶Lal加入含有30 mmol/L的L-丙氨酸,30 mmol/L的L-谷氨酰胺,30 mmol/L的ATP及30 mmol/L的MgSO4的反应体系中,在 pH 9.0,不同温度条件下进行酶催化反应,结果如图4所示.由图4可知:Lal的活性随着温度的升高而升高,当温度达到37 ℃时其活性最高,产物丙谷二肽的浓度也达到最大值;温度超过37 ℃时,Lal的活性迅速降低,产物丙谷二肽的浓度也随之减少.

图4 温度对酶催化反应的影响Fig.4 Effect of temperature on enzymatic reaction
在最优的反应温度(37 ℃)下,考察不同pH值对酶催化反应的影响,结果如图5所示.由图5可知:pH为9.0时,Lal的活性最高,产物丙谷二肽的浓度也达到最大值;当pH高于或低于7.0时,随着pH的偏离,Lal的活性急剧下降,产物丙谷二肽的浓度也随之减少.
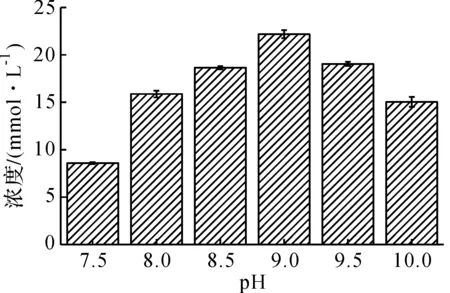
图5 pH对酶催化反应的影响Fig.5 Effect of pH on enzymatic reaction
在最优的反应温度(37 ℃)和反应pH值(9.0)下,考察不同底物浓度对酶催化反应的影响,结果如表1所示.当反应体系中不添加ATP时,无丙谷二肽生成,说明Lal属于ATP依赖酶,且随着反应体系中ATP浓度的增加,丙谷二肽的产量呈现上升趋势.从反应机理上来看,Lal属于羧酸盐-胺/硫醇连接酶超家族,反应时需使用ATP上的高能磷酸键形成活性中间体酰基-磷酸盐[9-10].过量的L-丙氨酸或L-谷氨酰胺均不利于丙谷二肽的合成,过量的L-丙氨酸会形成L-丙氨酰-L丙氨酸(丙丙二肽),而过量的L-谷氨酰胺由于自身性质不稳定,在碱性环境中会缓慢降解成谷氨酸,因此选择等摩尔的底物进行反应有利于丙谷二肽的生成.从表1中还可以看出:在固定的酶添加量(0.2 mg/mL)条件下,随着底物浓度的增加,丙谷二肽的摩尔转化率呈现先升高后降低的趋势,说明Lal对不同氨基酸的催化能力不同,高浓度的底物氨基酸会竞争性地与Lal结合,从而影响目标产物丙谷二肽的生成.
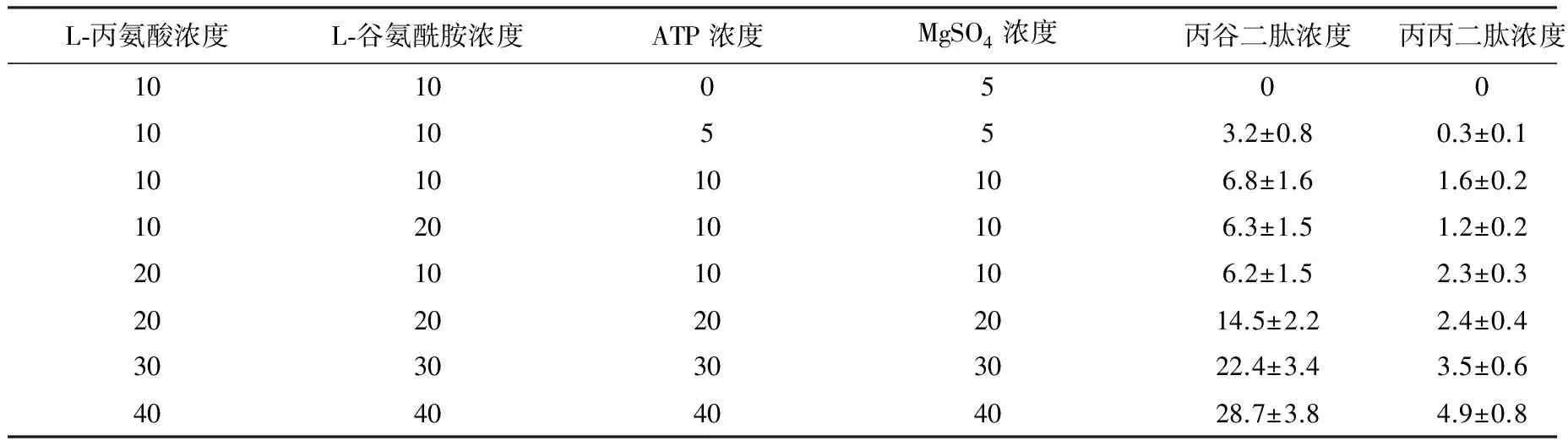
表1 不同底物浓度对酶催化反应的影响Table 1 Effect of different substrates concentrations on enzymatic reaction mmol/L
3 结 论
L-丙氨酸-L-谷氨酰胺(丙谷二肽)是市场应用前景广阔的二肽类物质,已被多个国家批准作为药物使用,然而目前的生产技术存在生产过程复杂、原料成本高和有毒试剂使用等不足.L-氨基酸连接酶的发现使得丙谷二肽的生物合成成为可能.笔者以常用表达系统pETHis和E.coliBL21(DE 3)过表达来自枯草芽孢杆菌B.subtilisATCC 15245中的L-氨基酸连接酶基因,并通过对密码子优化实现了重组酶的大量可溶性表达.在最优的酶催化反应条件即温度为37℃,pH为9.0时,使用0.2 mg/mL纯化后的L-氨基酸连接酶可以催化30 mmol/L的L-丙氨酸和30 mmol/L的L-谷氨酰胺生成22.4 mmol/L的丙谷二肽,最高摩尔转化率可达74.7%.虽然丙谷二肽实现了生物合成,但其转化效率仍有大幅度提高的空间.增加丙谷二肽的积累一方面取决于L-氨基酸连接酶的活性,今后可尝试采用定点突变的方法,获得对底物L-谷氨酰胺亲和力更高的突变体;另一方面取决于副产物丙丙二肽的积累量,今后可尝试采用流加的方式进行酶催化反应,通过控制流加浓度和流加速率减少副产物的积累.在上述研究的基础上,最终获得适用于丙谷二肽生物合成的酶制剂及酶催化方式.
[1] 张丽娟,杜晨冉,田芳,等.5%新型复方氨基酸(19)丙谷二肽注射液(创伤用)在健康受试者中剂量研究[J].医药导报,2015,34(3):322-324.
[2] 李荣辉,谭鸿毅,杨双,等.复方氨基酸(19)注射液配制的全静脉营养液稳定性研究及临床应用[J].中南药学,2012,10(3):168-171.
[3] 柯远.丙谷二肽合成工艺改进[D].济南:济南大学,2013.
[4] 陈晓英.N(2)-L-丙氨酰-L-谷氨酰胺合成路线图解[J].海峡药学,2007,19(12):113-114.
[5] 刘沛沛,张震宇,孙付保,等.酶法产L-丙氨酰-L-谷氨酰胺重组大肠杆菌pepD/pepN基因的敲除及其发酵优化[J].食品与发酵工业,2016,42(6):7-14.
[6] ABE I, HARA S, YOKOZEKI K. Gene cloning and characterization of α-amino acid ester acyl transferase inEmpedobacterbrevisATCC 14234 andSphingobacteriumsiyangensisAJ 2458[J]. Bioscience biotechnology & biochemistry, 2011, 75(11): 2087-2092.
[7] 范晓光,洪翔,朱新雅,等.二肽的生物合成及应用研究进展[J].发酵科技通讯,2016,45(4):199-203.
[8] TABATA K, IKEDA H, HASHIMOTO S.ywfEinBacillussubtiliscodes for a novel enzyme, l-amino acid ligase[J]. Journal of bacteriology, 2005, 187(15): 5195-5202.
[9] TSUDA T, SUZUKI T, KOJIMA S. Crystallization and preliminary X-ray diffraction analysis ofBacillussubtilisYwfE, an l-amino-acid ligase[J]. Acta crystallographica section F structural biology and crystallization communications, 2012, 68(2): 203-206.
[10] YAGASAKI M, HASHIMOTO S. Synthesis and application of dipeptides; current status and perspectives[J]. Applied microbiology and biotechnology, 2008, 81(1): 13-22.
(责任编辑:朱小惠)
Enzymatic synthesis of L-alanyl-L-glutamine by L-amino acid ligase fromBacillussubtilis
HONG Xiang1,2, ZHU Xinya1,2, JIA Zifan1,2, HUANG Han2, TAN Xu3, FAN Xiaoguang1,2
(1. Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education, Tianjin University of Science and Technology, Tianjin 300457, China; 2. College of Biotechnology, Tianjin University of Science and Technology,Tianjin 300457, China; 3. Nutraceutical Research Division, Tasly Holding Group Co., Ltd., Tianjin 300040, China)
L-amino acid ligase (Lal) gene fromBacillussubtilisATCC 15245 was cloned and expressed inEscherichiacoliBL21(DE 3). The recombinant Lal was purified by Ni-NAT. L-alanyl-L-glutamine was synthesized by purified Lal using L-alanine and L-glutamine as the substrate. Lal is an ATP-dependent enzyme, the results showed that the optimal reaction temperature and pH value of Lal was 37 ℃ and 9.0, respectively. 30 mmol/L amino acids substrate was converted into 22.4 mmol/L L-alanyl-L-glutamine by 14 h continuous catalytic reaction, the maximum molar yield reached 74.7%. In this study, Lal fromBacillussubtilisATCC 15245 was successfully expressed and applied to L-alanyl-L-glutamine production. The results can lay theoretical foundation for the bio-manufacturing of L-alanyl-L-glutamine.
L-alanyl-L-glutamine; L-amino acid ligase;Bacillussubtilis;Escherichiacoli; enzymatic synthesis
2017-05-03
工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室(天津科技大学)开放基金资助项目(2016IM101)
洪 翔(1991—),男,江西九江人,硕士研究生,研究方向为酶法合成丙谷二肽,E-mail:kdhongxiang@163.com.
Q78
A
1674-2214(2017)02-0083-05
