新型细胞活力检测EZMTT法的研究
2017-07-05张京京阮奔放
张京京,阮奔放
(浙江工业大学 绿色制药协同创新中心,浙江 杭州 310014)
新型细胞活力检测EZMTT法的研究
张京京,阮奔放
(浙江工业大学 绿色制药协同创新中心,浙江 杭州 310014)
研究四氮唑盐/甲臜类EZMTT法检测细胞活力和增殖的应用并评价EZMTT法的优势.评价EZMTT法检测细胞增殖的准确性,对比EZMTT法与WST-8的灵敏度、毒性及细胞活力长期跟踪的应用.研究表明:细胞量为3 000~500 000时,在4 h内EZMTT法信号值与细胞量成正比,且较现有产品WST-8检测试剂,EZMTT法更灵敏、毒性更低,可实现长达7 d的细胞活力跟踪.0.06%十二烷基硫酸钠或50 μmol/L盐酸可中止EZMTT反应.EZMTT法有望成为更为优秀的新一代细胞活力检测方法.
EZMTT法;四氮唑盐/甲臜反应;细胞活力检测
细胞活力与增殖检测是细胞学研究不可或缺的一部分.其中四氮唑盐/甲臜类检测试剂[1]较为常用,其原理是通过检测细胞代谢水平,参与NAD(P)+/NAD(P)H氧化还原反应而生成有色甲臜,其检测信号与线粒体活力[2-4]、活细胞量呈正比,可通过酶标仪定量.因EZMTT法操作简便、成本低和准确性较高等优点一直被广泛应用于医疗领域的基础研究[5-6],尤其是抗癌药物的细胞毒性筛选[7].该类产品主要有MTT,MTS,XTT和WST系列.其中MTT是首批四氮唑盐/甲臜类显色剂,其缺点为操作繁琐[8],且生成难溶性甲臜可刺穿细胞膜[9]产生细胞毒性.而升级产品XTT,MTS和WST系列产品可带负电荷,可加入电子受体如吩嗪硫酸甲酯(PMS)作为中介转移细胞质或血浆中电子以促进四氮唑反应生成可溶性有色甲臜[10],其主要优点是无需加入试剂溶解甲臜,步骤较MTT法简便,但仍存在一定的细胞毒性,无法满足长期检测,且为了防止信号过饱和一般不超过4 h读数,其反应会受抗氧化剂影响,如谷胱甘肽[11],可造成假阳性结果.
EZMTT反应原理类似WST-8,在PMS的参与下和NAD(P)+/NAD(P)H反应生成水溶性黄色甲臜,该产物在450 nm处有最大吸收值.于分离的NAD(P)H反应中,EZMTT,WST-8与NAD(P)H量均呈线性关系.较WST-8而言,EZMTT检测有着范围更宽、抗氧化剂副反应更小和储存更稳定的特点[12].笔者将重点研究EZMTT法在细胞方法学上的应用.
1 材料与方法
1.1 主要材料及试剂
实验所用T24细胞株购于上海中科院细胞库;荧光GPF-T24细胞购于上海乐辰生物,传代15 代以内;EZMTT,WST-8(CCK-8)试剂,化合物3B购于杭州健昵福生物科技公司;CellTiter-LumTM化学发光法细胞活力检测试剂购于碧云天生物有限公司;RPMI 1640培养,0.25%胰酶+0.02% EDTA溶液,台盼蓝,二甲基亚砜购于杭州吉诺生物科技有限公司;胎牛血清购于美国Hyclone公司;PMS购于东京化学工业公司;细胞培养瓶,96孔板等耗材购于Corning公司;噻唑蓝(MTT)购于美国Sigma公司;Count star细胞计数仪,酶标仪购于上海睿钰生物科技有限公司.
1.2 实验方法
1.2.1 EZMTT法
EZMTT试剂盒由试剂A和试剂B构成,保存于-40 ℃.细胞种于96孔板中,检测前吸尽培养基,加入200 倍稀释的试剂A、试剂B的新鲜培养基,每孔100 μL孵育一定时间后于450 nm处检测光密度值.检测结束后加入不同浓度梯度的十二烷基硫酸钠(调节pH=7)或稀盐酸,继续孵育24 h后检测,并与0 h作对比.细胞存活率=(受试组光密度值-空白组光密度值)/(对照组光密度值-空白组光密度值)×100%.相对光密度值=受试组光密度值-空白组光密度值.
1.2.2 WST-8法
用新鲜培养基工作液10 倍稀释WST-8试剂,得到WST-8工作液.吸尽96孔板中原有培养基,加入WST-8工作液,每孔100 μL.于细胞培养箱内孵育一定时间后于450 nm处检测光密度值.细胞存活率=(受试组光密度值-空白组光密度值)/(对照组光密度值-空白组光密度值)×100%.
1.2.3 噻唑蓝(MTT)法
96孔板中的待测细胞每孔加入10 μL MTT溶液(5 mg/mL),于细胞培养箱内孵育4 h.吸除溶液,且避免吸走紫色甲臜沉淀.每孔加入100 μL DMSO混匀.于570 nm处检测光密度值.细胞存活率=(受试组光密度值-空白组光密度值)/(对照组光密度值-空白组光密度值)×100%.
1.2.4 细胞计数法
吸尽96孔板中待测细胞培养基,每孔加50 μL胰酶.孵育5 min后将细胞吹打均匀,立即加入台盼蓝溶液(最终质量分数为0.04%).于细胞计数仪下读取细胞浓度,并拍照.注意操作时间,胰酶不能消化过头,台盼蓝染色时间在3 min以内.活细胞率=活细胞总数/(活细胞总数+死细胞总数)×100%.
1.2.5 CellTiter-LumTM化学发光法检测EZMTT或WST-8的细胞毒性
加入EZMTT和WST-8检测试剂的孔第7天完成检测后,吸尽检测剂,PBS清洗一遍,加入新鲜完全培养基50 μL/孔,再加入CellTiter-LumTM工作液50 μL/孔,振荡2 min后室温避光静置10 min.将培养基转移至全黑96孔板读取荧光强度(化学发光).
2 结果与讨论
2.1 EZMTT的准确性和灵敏度高
加入EZMTT检测剂后1, 2, 3, 4 h,相对光密度值与细胞量有良好的线性关系(R2=0.99),如图1所示.说明EZMTT检测细胞增殖的准确性.反应饱和前,随孵育时间增加,相对光密度值与细胞量的比值也越大,即检测的灵敏度增加.检测时可注意溶液颜色变化,可多次检测,但注意不要频繁取出样品,保证细胞良好的培养环境.
对于同一条件处理的细胞,通过EZMTT法和WST-8法检测不同时间点的光密度值.由图2(a)可知:EZMTT反应4 h,化合物3B给药浓度370 nmol/L组与123 nmol/L组光密度值相差0.2;而8 h时两组光密度值虽均有所上升,但差异缩小至0.05,说明EZMTT反应可能达到饱和,因此取4 h检测数据用以计算抑制率.图2(b)表明:WST-8法在孵育4 h时信号组间差异较小,化合物3B给药浓度370 nmol/L组与123 nmol/L组光密度值相差0.1,而在8 h时两者达到0.6,说明WST-8法在4 h时信号灵敏度不及8 h,故取后者用以计算抑制率.经比较,EMZTT与MTT,WST-8方法检测的化合物3B[13]抑制T24细胞生长曲线无显著性差异(图3),这也证明了EZMTT方法的可靠性.与台盼蓝染色+细胞计数法相比较,10, 1, 0.1 μmol/L的3B抑制率也相近(图4).但细胞计数法需消化细胞,存在一定的误差.数据显示EZMTT法在4 h时,对于细胞生长无抑制组(3 nmol/L化合物3B)与完全抑制组(10 μmol/L化合物3B),WST-8法检测的光密度值差异约0.4,而EZMTT法的光密度值差异约为0.75,说明EZMTT法反应更快(图2).说明EZMTT法信号准确度较高的同时,灵敏度较WST-8法高.
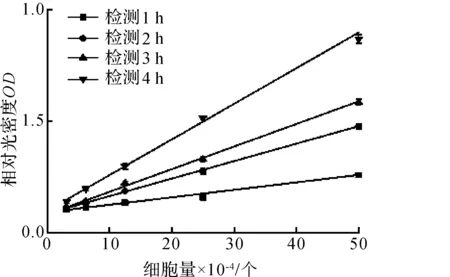
图1 EZMTT反应光密度值与细胞量的关系Fig.1 The relationship between OD value of EZMTT assay and cell amount
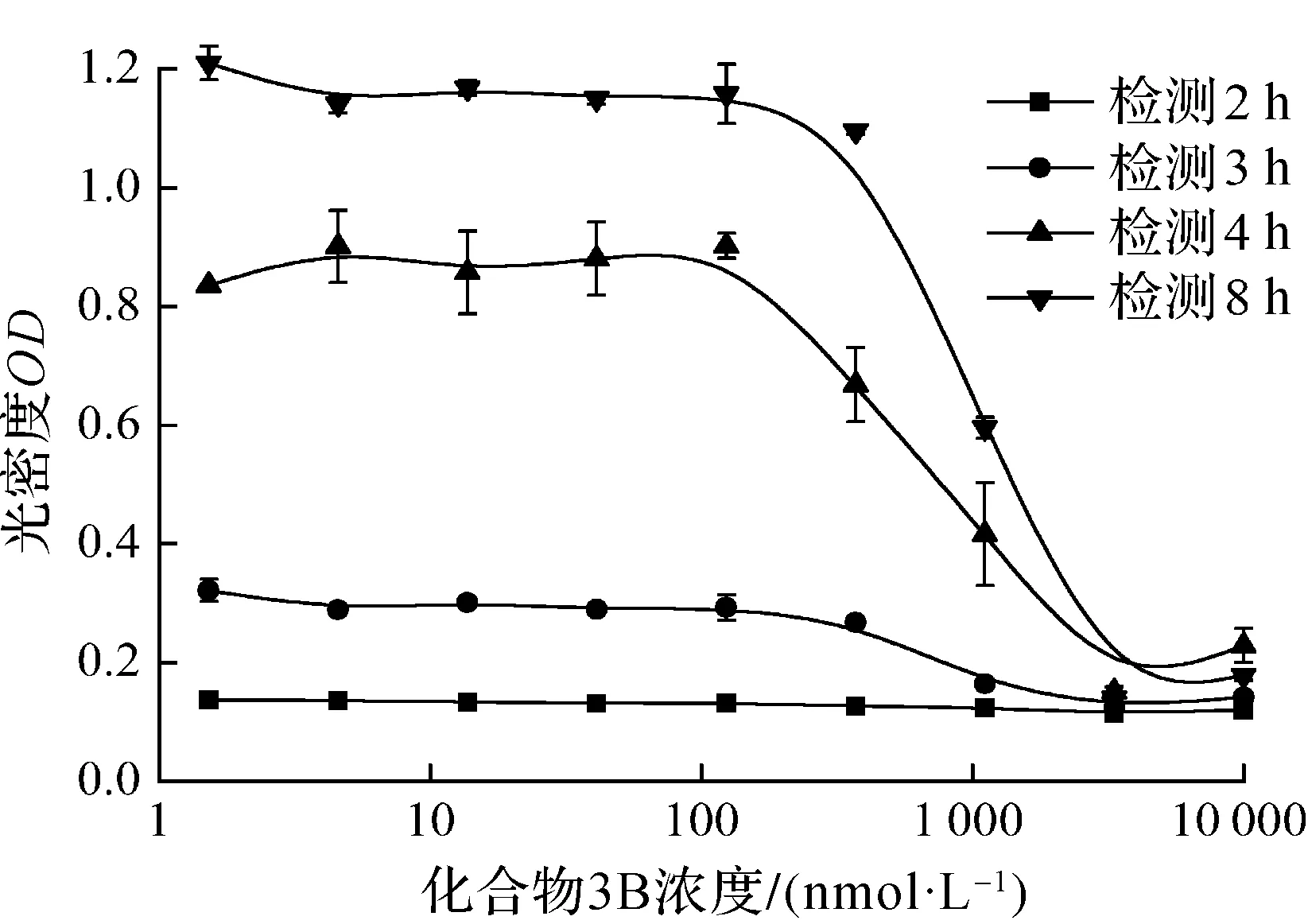
(a) EZMTT法
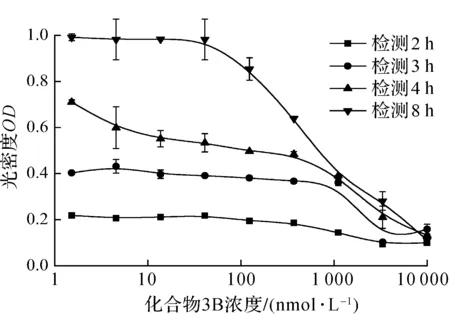
(b) WST-8法图2 EZMTT法和WST-8法检测化合物3B的细胞抑制作用Fig.2 Test inhibition of compound 3B by EZMTT and WST-8 assays
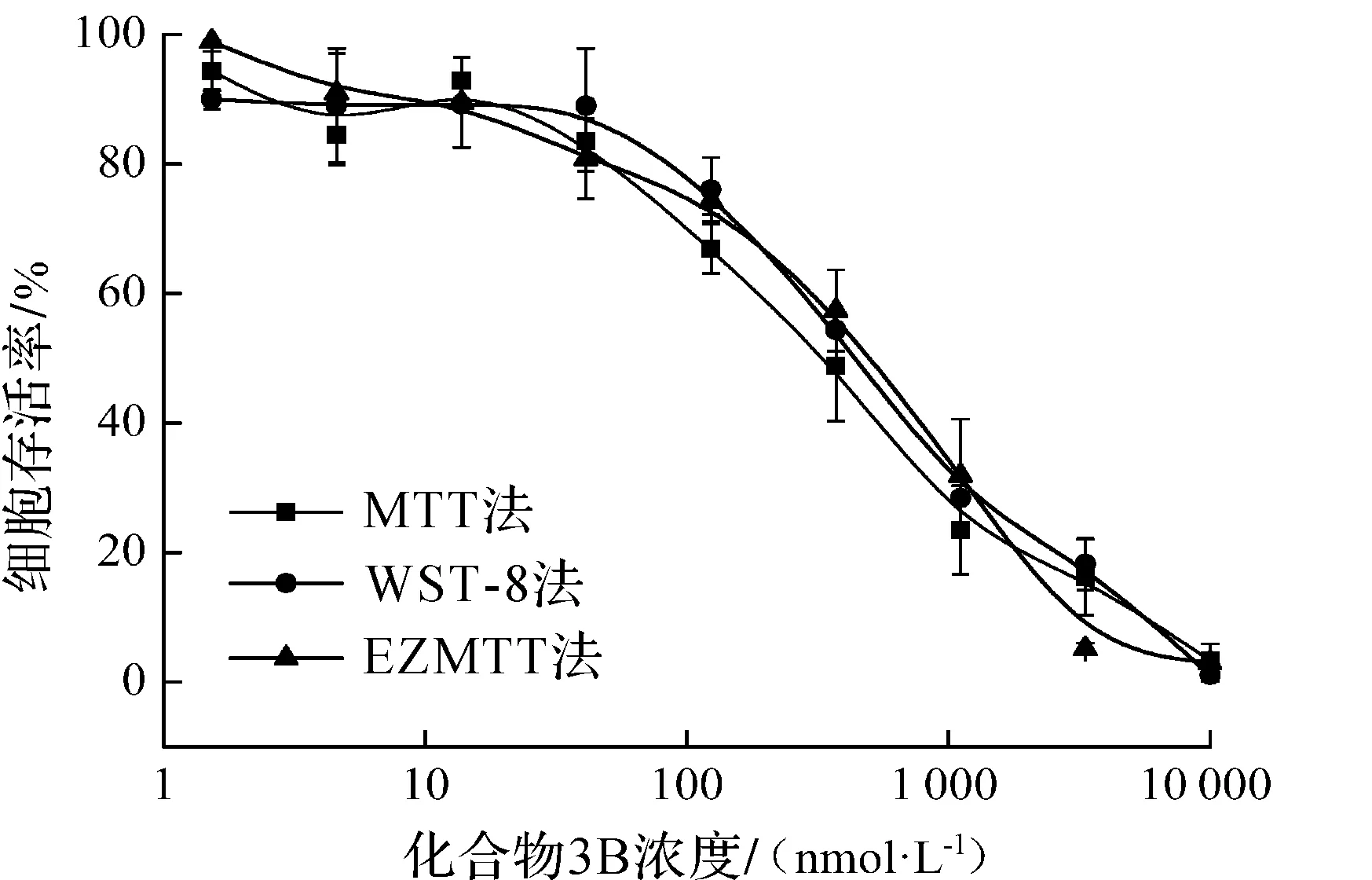
图3 MTT,WST-8和EZMTT法对化合物3B的抑制曲线Fig.3 Inhibition curves of compound 3B that tested by MTT, WST-8 and EZMTT assays
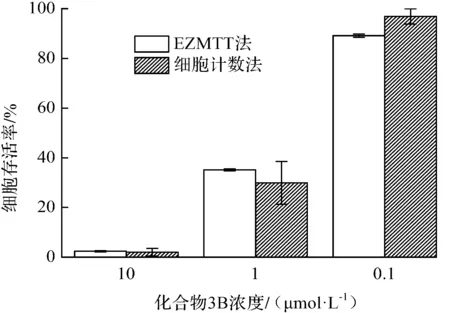
图4 细胞计数法和EZMTT法对化合物3B的抑制曲线 Fig.4 Inhibition bars of compound 3B that tested by cell counting and EZMTT assays
2.2 EZMTT的毒性较低
EZMTT的一大优点为低毒性,可满足长期细胞检测.相同条件下,WST-8检测细胞量3 000~10 000的孔,信号在24 h后达到平台期(图5b),而EZMTT法则可持续长达7 d的跟踪(图5a),说明其检测剂的细胞毒性较低,并未影响细胞活力及增殖.且7 d后检测接种3 000细胞量的孔,WST-8和EZMTT检测剂对其细胞活力的影响相差近200 倍(图6).
2.3 EZMTT方法的终止试剂
由于EZMTT法的低毒性,导致细胞反应无法自然终止,为防止反应过饱和,因此可选择加入终止试剂.数据显示:0.06%十二烷基硫酸钠(pH=7)(图7a)或50 μmol/L盐酸(图7b)可终止反应且光密度值在24 h内无显著性差异.
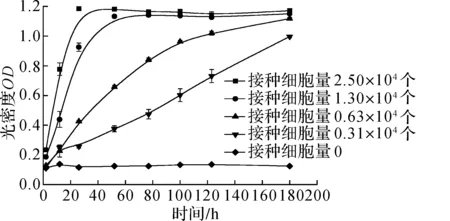
(a) EZMTT法
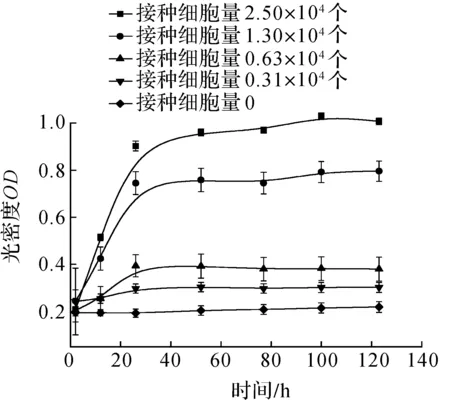
(b) WST-8法图5 EZMTT法和WST-8法跟踪细胞活力Fig.5 Cell viability tracking of EZMTT and WST-8 assays

图6 CellTiter-LumTM法检测WST-8法与EZMTT法的细胞毒性Fig.6 Test cellular toxicity of WST-8 and EZMTT assays by CellTiter-LumTM assay
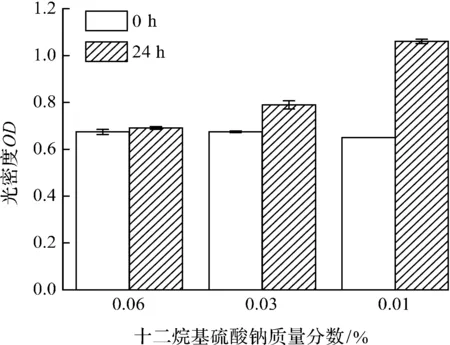
(a) 十二烷基硫酸钠

(b) 盐酸图7 不同浓度十二烷基硫酸钠和盐酸对EZMTT反应的终止 Fig.7 SDS and HCL of different concentrations that stop EZMTT reactions
3 结 论
作为四氮唑/甲臜类检测剂,EZMTT保持了该类检测剂一贯的优点:检测方便且准确性高,且生成的甲臜为水溶性,无需加入有机溶剂溶解,并可根据试剂的颜色变化追踪读数.较CellTiter-LumTM检测剂等荧光产物的信号检测成本更低,使用耗材更廉价,适用于高通量筛选.而较同类检测剂WST-8,EZMTT也有着明显的优势:反应更灵敏,试剂毒性更低.EZMTT的极低毒性可实现长期跟踪的细胞活力检测,且可进行后续反应,而WST-8在24 h后对细胞生长有抑制.因此EZMTT有望成为更为优秀的细胞活力检测试剂,为细胞学研究和药物活性筛选提供更有利的手段.
[1] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. Journal of immunological methods, 1983, 65(1/2): 55-63.
[2] DENIZOT F, LANG R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability[J]. Journal of immunological methods, 1986, 89(2): 271-277.
[3] LÜ L H , ZHANG L H, WAI M S, et al. Exocytosis of MTT formazan could exacerbate cell injury[J]. Toxicologyinvitro, 2012, 26(4): 636-644.
[4] Ying W. NAD+/NADH and NADP+/NADPH in cellular functions and cell death: regulation and biological consequences[J]. Antioxidants & redox signaling, 2008, 10(2): 179-206.
[5] 王浩.壳聚糖及其衍生物在医药领域的应用研究进展[J].发酵科技通讯,2015,44(1):58-61.
[6] 朱芳莹,董正伟,朱文渊,等.糖尿病治疗药物及其合成进展[J].发酵科技通讯,2016,45(3):175-181.
[7] SCUDIERO D A, SHOEMAKER R H, PAULL K D, et al. Evaluation of a soluble tetrazolium/formazan assay for cell growth and drug sensitivity in culture using human and other tumor cell lines[J]. Cancer research, 1988, 48(17): 4827-4833.
[8] GOODWIN C J, HOLT S J, DOWNES S, et al. Microculture tetrazolium assays: a comparison between two new tetrazolium salts, XTT and MTS[J]. Journal of immunological methods, 1995, 179(1): 95-103.
[9] ALTMAN F P. Tetrazolium salts and formazans[J]. Progress in histochemistry and cytochemistry, 1976, 9(3): 1-56.
[10] RAAP A K. Studies on the phenazine methosulphate-tetrazolium salt capture reaction in NAD (P)+-dependent dehydrogenase cytochemistry. III. The role of superoxide in tetrazolium reduction[J]. The histochemical journal, 1983, 15(10): 977-986.
[11] 朱勍,思扬,窦言东.荧光探针技术在谷胱甘肽检测中的应用[J].发酵科技通讯,2016(3):170-174.
[12] ZHANG W ZHU M , WANG F, et al. Mono-sulfonated tetrazolium salt based NAD (P) H detection reagents suitable for dehydrogenase and real-time cell viability assays[J]. Analytical biochemistry, 2016, 509: 33-40.
[13] ZHU M , FANG J Z , ZHANG J J , et al. Bio-molecular interaction assays identified novel dual inhibitors of glutaminase and glutamate dehydrogenase that disrupt mitochondrial function and prevent growth of cancer cells[J]. Analytical chemistry, 2017, 89(3): 1689-1696.
(责任编辑:朱小惠)
Research on novel cell viability EZMTT assay
ZHANG Jingjing, RUAN Benfang
(Collaborative Innovation Center of Yangtze River Delta Region Green Pharmaceuticals, Zhejiang University of Technology, Hangzhou 310014, China)
This study focused on the application of EZMTT assay based on tetrazolium salts/formazans reaction for cell viability, as well as its superiority evaluation. The accuracy of EZMTT assay was evaluated on efficiency and toxicity. When the cell number is 3 000 to 500 000, the linear dose response can be achieved within 4 hours. The EZMTT assay exhibited higher sensibility and effectiveness compared with WST-8 assay in cell viability test. Besides, the low toxicity allows EZMTT track cell growth in long-term, and the EZMTT reaction could be stopped by 0.06 % SDS or 50 μmol/L HCL. The high efficiency and low toxicity demonstrated the great potential of EZMTT assay for cell viability test.
EZMTT assay; tetrazolium salts/formazans reaction; cell viability assay
2017-04-10
浙江省创新人才启动金(414800129)
张京京(1993—),女,四川成都人,硕士研究生,研究方向为细胞生物学,E-mail:zhang-jingjing@outlook.com. 通信作者:阮奔放教授,E-mail:ruanbf@zjut.edu.cn.
Q2-33
A
1674-2214(2017)02-0088-04
