IPTG添加时机对大肠杆菌产α-酮基丁酸的影响
2017-07-05齐俊生李燕军
李 娟,齐俊生,王 婷,毛 倩,韩 超,李燕军,2
(1. 天津科技大学 生物工程学院,天津 300457;2. 代谢控制发酵技术国家地方联合工程实验室,天津 300457)
IPTG添加时机对大肠杆菌产α-酮基丁酸的影响
李 娟1,齐俊生1,王 婷1,毛 倩1,韩 超1,李燕军1,2
(1. 天津科技大学 生物工程学院,天津 300457;2. 代谢控制发酵技术国家地方联合工程实验室,天津 300457)
探究IPTG不同添加时间对大肠杆菌EscherichiacoliTHRD/pWSK29-ilvA发酵生产α-酮基丁酸菌体生长、产酸、代谢副产物和耗糖的影响.摇瓶发酵结果表明:在菌体处于对数生长中后期,菌体OD600值为10~15时,添加IPTG进行诱导,菌体生物量相对较高为6.5 g/L,α-酮基丁酸积累量最高达到16 g/L,同时糖酸转化率较其他诱导时间高,且副产物乙酸含量明显降低.利用7.5 L发酵罐对此诱导条件进行发酵验证,α-酮基丁酸质量浓度为22 g/L,高于已有报道中8 g/L的生产水平.
IPTG;诱导时机;α-酮基丁酸;产量
α-酮基丁酸(α-Ketobutyric acid,αKB)又称2-氧代丁酸,是多种化合物合成的前体物质,如1-丙醇、正丁醇、2-羟基丁酸、保洛霉素和呋喃酮.由于α-酮基丁酸可以转化成丙酮酸,因此可以广泛用于生物和医药行业,此外还可以作为食品添加剂等[1-2].目前α-酮基丁酸的生产方法主要有化学合成法和酶催化法.这些生产方法的缺点包括反应条件复杂、能量消耗过大和底物成本过高等.在大肠杆菌代谢途径中,菌体利用葡萄糖经过糖酵解途径和三羧酸循环生成L-草酰乙酸,然后又经苏氨酸途径生成苏氨酸,而在有氧条件下由ilvA基因编码的苏氨酸脱水酶可直接催化苏氨酸生成α-酮基丁酸[3].α-酮基丁酸作为微生物代谢的中间代谢产物,利用代谢工程改造,可以达到积累α-酮基丁酸的效果.
以苏氨酸高产菌株大肠杆菌EscherichiacoliTHRD作为出发菌株,通过载体pWSK29过表达编码苏氨酸脱水酶的基因ilvA,使得苏氨酸在苏氨酸脱水酶的催化下,大量合成α-酮基丁酸.但是,大量发酵实验证明,α-酮基丁酸确实存在很强的毒性作用[4],即高质量浓度(≥8 g/L)的α-酮基丁酸对大肠杆菌菌体生长和产物合成存在严重的抑制作用,当产物α-酮基丁酸积累到一定浓度时,菌体生物量便不会增加,产物的生成速率也明显降低,而且在之后的发酵过程中,伴随着α-酮基丁酸的抑制作用逐渐加强,产酸速率会越低.为了在α-酮基丁酸发酵过程中获得较高的菌体生物量,适当地增加前体物苏氨酸的合成量,选择合适的时间段添加IPTG进行诱导具有非常重要的作用.针对有毒产物的积累,将菌体的快速生长期和蛋白合成期分隔开,使这两个阶段互不影响,同时保证在产物积累到高浓度时受到的抑制作用减弱或阻断代谢途径之前维持前体物苏氨酸含量在较高水平,才能尽可能多的合成α-酮基丁酸.因此,针对含有诱导型表达载体的生产菌株,利用发酵法生产有毒产物α-酮基丁酸时,确定合适的诱导时间对提高其产量具有重要意义.
1 材料与方法
1.1 菌 株
采用L-苏氨酸高产菌株大肠杆菌E.coliTHRD作为出发菌株[5],菌株保藏于天津科技大学菌种保藏中心,保藏号为TCCC11825,将包含苏氨酸脱水酶基因ilvA的表达质粒pWSK29转入E.coliTHRD,最终得到一株α-酮基丁酸工程菌.
1.2 培养基
LB培养基:胰蛋白胨10 g/L,酵母浸出粉5 g/L,NaCl 10 g/L,pH为6.7~7.0,121 ℃湿热灭菌20 min.
种子培养基:蔗糖25 g/L,酵母粉10 g/L,蛋白胨6 g/L,KH2PO41.2 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,VB11.3 mg/L,VH0.3 mg/L,pH为6.7~7.0,121 ℃湿热灭菌20 min.
发酵培养基:葡萄糖30 g/L,酵母粉2 g/L,蛋白胨4 g/L,柠檬酸钠1 g/L,KH2PO42 g/L,MgSO4·7H2O 0.7 g/L,FeSO4·7H2O 100 mg/L,MnSO4·H2O 100 mg/L,VB10.8 mg/L,VH0.2 mg/L,pH为6.7~7.0,消泡剂2~3滴,苯酚红2%(体积分数),115 ℃灭菌15 min.
1.3 培养方法
活化斜面培养:将保藏菌种划线接种于Ampr活化斜面,37 ℃培养16 h左右.
30 mL摇瓶培养:从新鲜活化斜面上挑取1环大肠杆菌菌体于种子培养基中,500 mL圆底三角瓶装液量30 mL,9层纱布封口,置于旋转式摇床,200 r/min,37 ℃振荡培养至OD600为12~14时,按体积分数为10%的接种量接入发酵培养基中,500 mL挡板三角瓶装液量30 mL(发酵期间根据指示剂苯酚红颜色变化,用氨水调节pH≈7.0).
7.5 L发酵罐培养:吸取适量灭菌的去离子水于4 支新鲜的活化斜面中,刮下斜面表面湿菌体,将所有菌体悬液接入7.5 L发酵罐(装液量为2 L)中.种子培养初始通气量1 L/min,搅拌转速为200 r/min,通过增加通气量和提高转速使溶氧维持在30%~50%.通过自动流加氨水控制pH≈7.0,培养温度37 ℃,培养至OD600为12~14时,按10%接种量弃掉多余的种子液,接入新的发酵培养基,开始恒温发酵培养.发酵过程通过自动流加氨水控制pH≈7.0,溶氧控制在30%~50%.当培养基中葡萄糖浓度降至一定值时,将质量分数为80%的葡萄糖溶液以一定脉冲速度流加至培养基中以维持发酵液中葡萄糖浓度在菌体所需浓度范围内(残糖控制≤2 g/L).
1.4 IPTG添加时间的选择
IPTG添加时间为菌体生长到某个阶段时,添加诱导剂进行诱导的具体时间点.首先绘制α-酮基丁酸生产菌株THRD/pWSK29-ilvA随时间变化的生长曲线,根据生长曲线选取发酵过程中OD600值分别为0(发酵0 h),0.2,0.6,1.0,2.0,4.0,6.0,9.0,12,16,20时添加终浓度为0.2 mmol/L的IPTG,以不添加IPTG诱导为对照组(CK),在37 ℃,200 r/min的条件下恒温发酵28 h,取样品进行处理,经高效液相色谱法检测发酵液中的苏氨酸、α-酮基丁酸和乙酸含量,并进行对比分析.
1.5 分析方法
菌体生物量(g/L):菌体生物量以菌体干重表示,取生长到不同OD600值的发酵液20 mL,8 000 r/min离心10 min,将菌体用蒸馏水吹悬洗涤2 次后置于50 ℃鼓风干燥箱中干燥至恒重,再用分析天平称重,其中菌体OD600值利用752紫外分光光度计测定.
α-酮基丁酸、乙酸质量浓度(g/L):采用高效液相分析系统测定.色谱分离条件:AminexRHPX-87H(300 mm×7.8 mm),5 mmol/L H2SO4等梯度洗脱,流动相流速为0.5 mL/min,柱温30 ℃,检测波长215 nm.
L-苏氨酸质量浓度(g/L):采用高效液相分析系统测定.色谱分离条件:Agilent C18(15 mm×4.6 mm,3.5 μm),2,4-二硝基氟苯柱前衍生,乙腈和NaAc溶液进行梯度洗脱,流动相流速为1 mL/min,柱温33 ℃,检测波长360 nm.
糖酸转化率w计算公式为
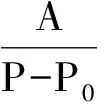
式中:A为发酵液含α-酮基丁酸总量,g;P为发酵过程中投放总糖量,g;P0为发酵液残糖量,g.残糖P0采用SBA-40C生物传感分析仪测定.
2 结果与讨论
2.1 重组质粒pWSK29-ilvA的构建
首先以E. coliMG1655基因组中苏氨酸脱水酶ilvA的基因序列为模板,采用Primerpremier5.0软件设计引物,PCR扩增出ilvA片段,乙醇沉淀法回收产物.再经限制性内切酶BamHI和XbaI分别双酶切回收ilvA片段和质粒pWSK29,经SolutionI在16 ℃条件下连接过夜,连接体系化转入E. coliDH5α感受态细胞中,经过菌落PCR和单双酶切验证后利用试剂盒提取质粒pWSK29-ilvA,结果如图1所示.

M—Marker;1—重组质粒pWSK29-ilvA;2—Xba I单酶切;3—BamH I和Xba I双酶切pWSK29-ilvA图1 重组质粒pWSK29-ilvA的单双酶切验证Fig.1 Single and double digestion digistion of pWSK29-ilvA
XbaI和BamHI双酶切重组质粒pWSK29-ilvA后,分别在约5 300 bp和1 500 bp处有目的条带,其中大片段与空质粒pWSK29(5 343 bp)大小一致,小片段条带与目的基因ilvA(1 545 bp)大小一致,实验结果与预期相符,表明重组质粒pWSK29-ilvA构建成功.以重组质粒为模板,用pWSK29的鉴定引物进行PCR反应扩增出DNA片段进行测序,测序结果显示与E.coliTHRD基因组上ilvA基因序列一致,表明未发生突变.再将重组质粒转入E.coliTHRD中进行一系列摇瓶发酵验证.
2.2 IPTG诱导时间的选择
发酵实验证明,产物α-酮基丁酸对菌株本身存在很强的毒性作用,即高质量浓度(≥8 g/L)的α-酮基丁酸对大肠杆菌菌体生长和产物的合成具有严重的抑制作用,图2为生产菌株E.coliTHRD/pWSK29-ilvA在α-酮基丁酸质量浓度梯度下的生长曲线(LB培养基),可知α-酮基丁酸质量浓度为8 g/L时,菌体质量浓度明显降低,α-酮基丁酸质量浓度高于10 g/L,菌体基本不能正常生长,初步确定了生产菌株对α-酮基丁酸的耐受能力.

图2 α-酮基丁酸浓度梯度下生产菌株的生长曲线Fig.2 Growth curve of strain produced under the concentration gradient of α-ketobutyric acid
图3为α-酮基丁酸生产菌株在摇瓶发酵过程中的生长曲线,可知在发酵4 h后,菌体开始进入对数生长期,持续到16 h菌体浓度达到稳定值.选择在菌体生长对数期开始诱导,将菌体的快速生长期和蛋白合成期分隔开,初步确定诱导时的OD600值为2~16,即处于对数生长期,并最终选择OD600值分别为0(即发酵0 h),0.2,0.6,1.0,2.0,4.0,6.0,9.0,12,16,20时作为添加诱导剂的具体时间点.
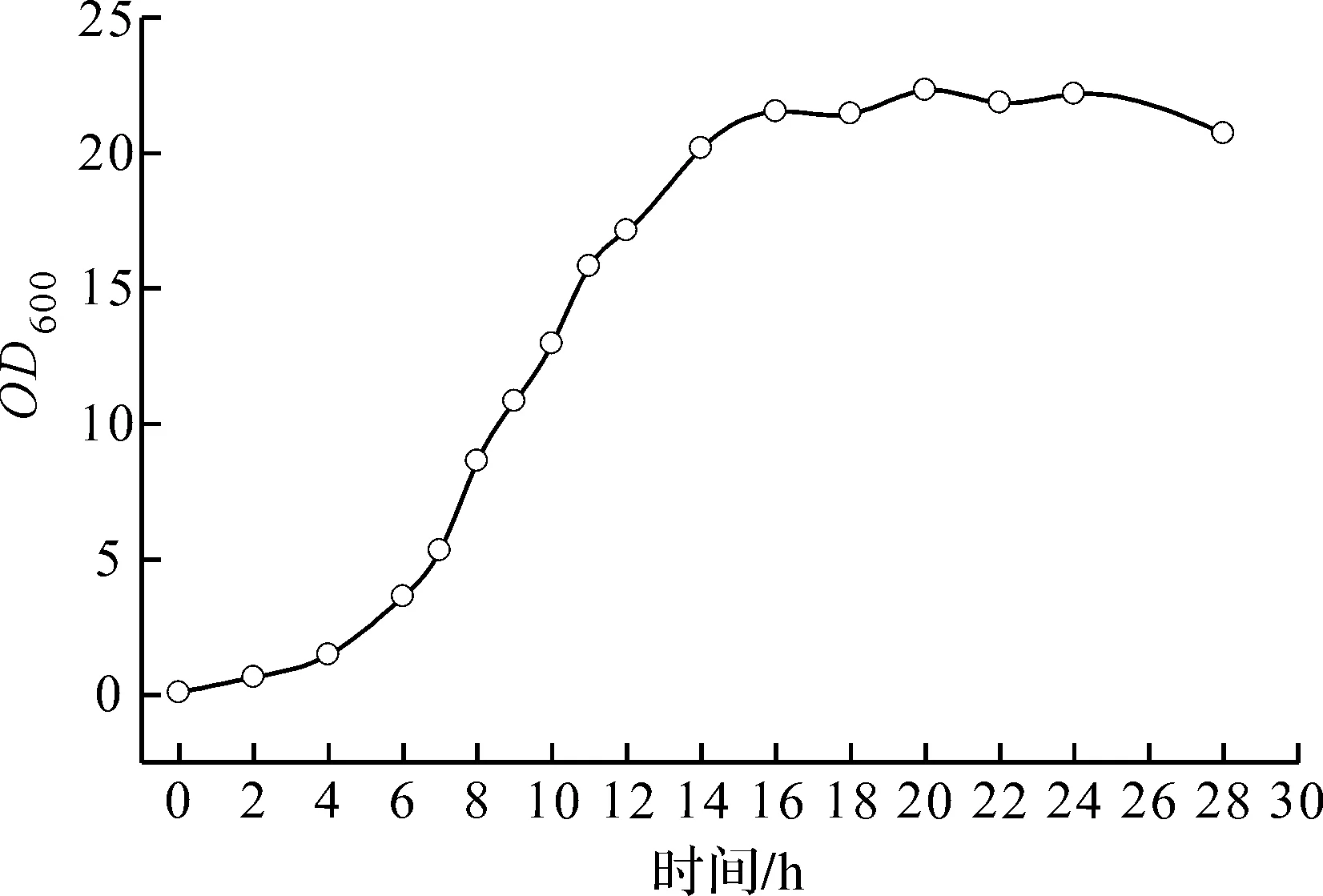
图3 生产菌株THRD/pWSK29-ilvA的生长曲线Fig.3 Growth curve of strain THRD/pWSK29-ilvA
2.3 IPTG添加时间对菌体生物量的影响
通过对菌株耐受α-酮基丁酸能力的测定,明确了当α-酮基丁酸积累到一定浓度时会严重影响菌体的生物量,经过实验确定最佳的诱导时间点,在增加菌体生物量的基础上同时提高生产菌株的α-酮基丁酸积累量.
摇瓶发酵28 h,不同诱导时间(以OD600表示)生产菌株的菌体生物量见图4,用菌体干重表示生物量.同对照组(CK, 未诱导)相比,对数生长期开始诱导的菌体生物量只达到其50%左右,说明菌体生长明显受到了抑制,结合这个时间段α-酮基丁酸的积累量达到10~16 g/L,可知不进行诱导时,菌株能够正常生长,干重达到10 g/L,开始诱导后,在对数生长期内随着诱导时间的逐步延迟,菌体干重呈现小幅度的增加.如果在稳定期开始诱导,虽然诱导之前菌体已经达到很高的生物量,但是稳定期内菌体生长和代谢所需酶系的活力已经大大降低,并不利于产物α-酮基丁酸的积累.

图4 不同诱导时间(以OD600表示)菌体的最大生物量 Fig.4 The maximum cells biomass of the different induction times
2.4 IPTG添加时间对α-酮基丁酸积累量的影响
丰宁的乡村旅游发展,应坚持“文旅结合、农旅联姻,构建文、旅、农三位一体的发展模式”。乡村旅游自身的产业附加性决定乡村旅游与乡村文化、乡村农业具有天然的产业融合优势。丰宁县内山青水秀、村庄错落有致,呈现恬静、怡然的乡村风貌,乡村民俗文化丰富多彩。农业基础较好,已经培育形成黄旗小米、莜面、食用菌等特色农业产业。丰宁县旅游产业规划发展要紧密结合乡村文化与农业基础,形成文旅结合、农旅联姻,构建文、旅、农三位一体的发展模式,保障旅游产业可持续发展。
α-酮基丁酸是一种对菌体生长和自身积累都有明显抑制作用的发酵产物,发酵过程中,如果不经过IPTG诱导,菌体细胞利用葡萄糖经过糖酵解途径和三羧酸循环生成草酰乙酸,进而经过一系列酶促反应合成L-苏氨酸[9],由于染色体上ilvA表达量相对较低,所以只有L-苏氨酸的大量合成,基本没有α-酮基丁酸的积累.一旦加入IPTG启动转录,苏氨酸脱水酶开始大量表达,α-酮基丁酸实现积累并开始抑制菌体生长,同时还对苏氨酸途径中一种或几种酶系产生严重的抑制作用,最直观的表现就是L-苏氨酸合成量严重降低,前体物合成受阻最终导致α-酮基丁酸产量不高.
由图5可知:不加IPTG诱导时,CK组α-酮基丁酸积累量为0 g/L,在菌体OD600值较低时开始诱导(OD600≤1),由于正处于延滞期,菌体刚开始生长,蛋白表达量较低,所以在此阶段诱导,α-酮基丁酸积累量不高且变化量不大;进入对数生长期,菌体代谢旺盛,随着前体物L-苏氨酸合成量增加,在对数生长期延迟诱导时间,α-酮基丁酸的积累量呈递增趋势,如果选择在对数中后期诱导,即菌体OD600值约为12时,α-酮基丁酸产量最高可达16 g/L.另外,当菌体量达到最大值时开始诱导,由于L-苏氨酸浓度过高也会对菌体代谢产生一定抑制作用,且此时细胞活力已经严重降低,所以L-苏氨酸生成α-酮基丁酸的转化效率较低.

图5 不同诱导时间(以OD600表示)α-酮基丁酸的积累量 Fig.5 The amount of accumulation of α-ketobutyric acid at different induction times
2.5 IPTG添加时间对L-苏氨酸积累量的影响
L-苏氨酸为菌体细胞利用葡萄糖发酵合成α-酮基丁酸的直接前体物[7-8],理论上,在菌体细胞具有相当酶活力的基础上,通过增加前体物苏氨酸的量能提高α-酮基丁酸的积累量.因为高浓度α-酮基丁酸会严重抑制苏氨酸合成途径中关键酶的活力,导致L-苏氨酸合成受阻,所以需要延迟诱导时间,保证苏氨酸积累到一定量才开始诱导,这样即使L-苏氨酸合成速率减慢,但合成的苏氨酸量在细胞内已经维持在较高水平.若此时进行诱导,在活性较高的苏氨酸脱水酶催化下,L-苏氨酸会源源不断地转化为α-酮基丁酸,一定程度上弥补了因关键酶受到抑制而导致的L-苏氨酸合成量的不足.
分析图6可知:不添加IPTG诱导,苏氨酸高产菌株THRD的L-苏氨酸积累量高达32 g/L;经过诱导后,可以看出苏氨酸基本全部被转化为产物α-酮基丁酸;而当OD600值为9~16时,前体物苏氨酸稍有富余,质量浓度约为2 g/L.这说明苏氨酸脱水酶的酶活力非常高,苏氨酸生成量决定了α-酮基丁酸的积累量,后期可以考虑继续增加L-苏氨酸的积累量,比如通过诱变手段解除α-酮基丁酸对苏氨酸途径的抑制作用,或是改造L-苏氨酸的转运系统以通过增加细胞内前体物苏氨酸的合成量进而提高α-酮基丁酸的积累量.

图6 不同诱导时间(以OD600表示)L-苏氨酸的积累量Fig.6 The amount of accumulation of L-Threonine at different induction times
2.6 IPTG添加时间对副产物乙酸的影响
乙酸是大肠杆菌高密度培养过程中主要的抑制性代谢副产物,发酵过程中乙酸的过多积累会导致菌体过早衰老、自溶、比活性降低.高浓度的乙酸会减缓菌体生长速率,很大程度上降低发酵过程中的菌体生物量,也是影响重组蛋白表达的重要因素[11].

图7 不同诱导时间(以OD600表示)乙酸的积累量 Fig.7 The amount of accumulation of acetic acid at different induction times
2.7 IPTG添加时间对糖酸转化率的影响
根据发酵过程中不同诱导时间对生产菌株的α-酮基丁酸积累量、葡萄糖总投放量和发酵结束后残糖量计算出每组的糖酸转化率,实验结果如图8所示.
由图8可知:对数生长中后期开始诱导,发酵结束后生产菌的糖酸转化率明显较高,OD600=12时达到18%左右.综合分析可知,因为OD600=12实验组的菌体生物量和α-酮基丁酸积累量最高,而副产物乙酸含量最低,且代谢途径受到严重抑制时,前体物苏氨酸仍稍有富余,在实际耗糖量差别不明显的前提下,本组实验糖酸转化率最高是正常的.

图8 不同诱导时间(以OD600表示)的糖酸转化率Fig.8 Sugar acid conversion rate at different induction times
2.8 7.5 L发酵罐验证最适诱导时间
通过摇瓶发酵结果分析不同的IPTG诱导时间对α-酮基丁酸生产菌株生长、产酸、副产物乙酸和糖酸转化率的影响,初步确定菌体生长到OD600值为12时为最佳的诱导时机.最后根据摇瓶发酵条件在7.5 L发酵罐上进行验证,即37 ℃恒温发酵培养到菌体OD600值为12时添加终浓度为0.2 mmoL/L的IPTG进行诱导,发酵过程中通过增加通风量和提高转速使溶氧维持在30%~50%,pH为6.7~7.0,每隔1 h取样检测各项指标直至28 h发酵结束.
从图9可以看出:未诱导的前4 h苏氨酸合成量不断增加,菌体生物量也在快速增长,而基本不积累α-酮基丁酸;当菌体生长到OD600值为12时,即菌体干重为5 g/L左右时添加终浓度为0.2 mmoL/L的IPTG进行诱导,α-酮基丁酸开始不断积累,此后发酵液中苏氨酸的总量开始降低;随着α-酮基丁酸浓度升高到一定值,对菌体的毒害作用明显显现出来,菌体量达到稳定值,α-酮基丁酸生成速率明显减缓,导致发酵最后10 h α-酮基丁酸产量基本没有太大变化,直到后期菌体开始衰亡.此次利用THRD/pWSK29-ilvA菌株上罐发酵,α-酮基丁酸积累量可达22 g/L,远远高于目前报道中8 g/L的生产水平.

图9 生产菌株E. coli THRD/pWSK29-ilvA7.5 L罐发酵过程曲线 Fig.9 7.5 L fermentation process curve of E. coli THRD/pWSK29-ilvA
3 结 论
大肠杆菌利用葡萄糖经糖酵解等途径可以直接代谢生成α-酮基丁酸,但是在发酵过程中发现α-酮基丁酸积累量较低(8 g/L),其根本原因是α-酮基丁酸严重的毒性作用导致菌体生物量太低,发酵结束菌体干重大约只有6.5 g/L,而且经过大量发酵实验发现α-酮基丁酸很可能抑制了苏氨酸代谢途径中的某一步酶促反应,代谢通路被减弱或阻断导致前体物苏氨酸合成受阻,最终的结果表现为α-酮基丁酸积累量偏低.笔者从诱导剂IPTG添加时间方面入手,了解生产菌株的生长状况,确定了IPTG具体添加时间为对数生长中后期即OD600=12,将菌体的快速生长期和蛋白合成期分隔开,使这两个阶段互不影响,尽可能多地合成α-酮基丁酸.同时,间接解决前体物苏氨酸不足的问题,α-酮基丁酸在诱导后便开始积累,当浓度过高时会抑制苏氨酸合成的关键酶,所以适当延迟诱导时间,使得苏氨酸合成途径在受到严重抑制之前,前体物苏氨酸含量积累到较高水平才开始添加IPTG,但是诱导时间又不能太迟,否则细胞内各种酶系活力降低菌体开始衰亡,而且发酵周期过长使生产成本压力过大.因此,利用发酵实验确定合适的IPTG添加时间对提高α-酮基丁酸积累量有重大意义.经摇瓶实验确定了α-酮基丁酸生产菌株生长到OD600值为12时进行诱导,菌体生物量能够达到相对较高值,乙酸较其他诱导时机含量更低,同时在菌体OD600值为12时进行诱导,糖酸转化率明显最高,更重要的是利用7.5 L罐进行发酵,α-酮基丁酸积累量高达22 g/L.
[1] HIDALGO F J, DELGADO R M, ZAMORA R. Intermediate role of α-keto acids in the formation of strecker aldehydes[J]. Food chemistry, 2013, 141(2):1140-1146.
[2] BREUER M, DITRICHD K, HABICHER T, et al. Industrial methods for the production of optically active intermediates[J]. Angewandte chemie, 2004, 43(7):788-824.
[3] 李进. L-异亮氨酸菌种选育及发酵条件优化[J]. 食品与生物技学报,2006, 25 (1): 55-60.
[4] YANG W, ROTH K S. Defect in α-ketobutyrate metabolism: a new inborn error[J]. Clinica chimica acta, 1985, 145(2): 173-182.
[5] CHEN N, HUANG J, FENG Z.B, et al. Optimization of fermentation conditions for the biosynthesis of L-threonine byEscherichiacoli[J]. Applied biochemistry and biotechnology, 2009, 158(3): 595-604.
[6] XIE X, LIANG Y, LIU H, et al. Modification of glycolysis and its effect on the production of L-threonine inEscherichiacoli[J]. Journal of industrial microbiology & biotechnology, 2014, 41(6): 1007-1015.
[7] 朱晓光, 黄金, 徐庆阳, 等. 基于代谢计量分析的L-苏氨酸发酵过程优化[J]. 生物技术通讯, 2008, 19(2): 247-250.
[8] 徐国栋. L-异亮氨酸生产菌株的构建及发酵条件优化[D]. 天津: 天津科技大学, 2015.
[9] 杨冬美, 李华, 李由然, 等. 大肠杆菌TdcC、SstT和LIV-1系统缺失对胞外L-苏氨酸积累的影响[J]. 微生物学通报, 2017(1): 20-29.
[10] 黄金, 徐庆阳, 陈宁. L-苏氨酸的生产方法及研究进展[J]. 河南工业大学学报(自然科学版), 2007, 28(5): 88-92.
[11] KRISTENSEN A R, GSPONER J, FOSTER L J. Protein synthesis rate is the predominant regulator of protein expression during differentiation[J]. Molecular systems biology, 2013, 9(1): 689.
[12] ZHANG C, QI J, LI Y, et al. Production of α-ketobutyrate using engineeredEscherichiacolivia temperature shift[J]. Biotechnology & bioengineering, 2016, 113(9): 2054-2059.
[13] SHILOACH J, RINAS U. Glucose and acetate metabolism inE.coli-system level analysis and biotechnological applications in protein production processes[M]//Systems Biology and Biotechnology ofEscherichiacoli. Berlin: Springer, 2009: 377-400.
(责任编辑:朱小惠)
Effects of IPTG addition time on fermentation of α-ketobutyric acid inEscherichiacoli
LI Juan1, QI Junsheng1, WANG Ting1, MAO Qian1, HAN Chao1, LI Yanjun1,2
(1.College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China; 2.National and Local United Engineering Lab of Metabolic Control Fermentation Technology, Tianjin 300457, China)
The study investigated the effect of IPTG addition time on the α-ketobutyric acid producing strainEscherichiacoliTHRD/pWSK29-ilvAin the aspects of cell growth, productivity, byproducts formation and sugar consumption. The results indicated that when IPTG was supplemented after theOD600reached 10 to 15, the biomass reached as high as 6.5 g/L with the titer of α-ketobutyric acid 16 g/L. The glucose/acid conversion ratio was the highest compared to other groups with different IPTG addition time, and the acetic acid concentration decreased significantly. The optimized IPTG induction time was applied in a 7.5 L fermentor, and the results showed that the titer of α-ketobutyric acid reached 22 g/L, higher than previously reported results.
IPTG; induction time; α-ketobutyric acid; production
2016-05-03
李 娟(1992—),女,湖北襄阳人,硕士研究生,研究方向为谷氨酸棒杆菌色氨酸生产菌株的构建,E-mail:2546922910@qq.com.
TQ922
A
1674-2214(2017)02-0077-06
