山羊源益生芽胞杆菌的筛选
2017-06-26张焕容徐桂丽张兴民
徐 凤,张焕容,徐桂丽,张兴民,汤 承
(西南民族大学生命科学与技术学院,四川成都 610041)
山羊源益生芽胞杆菌的筛选
徐 凤,张焕容*,徐桂丽,张兴民,汤 承
(西南民族大学生命科学与技术学院,四川成都 610041)
为获得山羊源优良益生芽胞杆菌菌株,利用刚果红染色法对26株山羊源芽胞杆菌进行产纤维素酶初筛,结合滤纸酶以及羧甲基纤维素(CMC)酶活力测定进行复筛,并对其耐酸、耐胆盐生物学特性进行研究,初步确定其益生特性,并进一步对经上述筛选出的菌株的抑菌性以及对药物的敏感性进行了测定。结果显示,从26株山羊源芽胞杆菌中初筛出4株产纤维素酶较好的芽胞杆菌,对4株芽胞杆菌产酶复筛以及对酸和胆盐的耐受性测定后,得到一株枯草芽胞杆菌,该菌株滤纸酶活为4.4 U,CMC酶活为1610 U,在pH3.0的环境中存活率大于50%,在0.3%的牛胆盐溶液中存活率高于70%,对金黄色葡萄球菌具有抑制作用,且对16种常用抗生素敏感。该株枯草芽胞杆菌X7F3可作为山羊源微生态制剂候选菌株。
山羊;芽胞杆菌;纤维素酶;耐酸;耐胆盐;抑菌试验;抗生素敏感性
微生态制剂作为一种新型的饲料添加剂,不仅能治疗和预防疾病、提高动物生产性能,而且具有无污染、无残留、无毒副作用、不产生耐药等特点,是抗生素所无法比拟的[1]。短小芽胞杆菌、迟缓芽胞杆菌、凝结芽胞杆菌、地衣芽胞杆菌以及枯草芽胞杆菌是可添加于饲料的微生物[2],这些芽胞杆菌是微生态制剂研究的重要菌种。芽胞杆菌在代谢过程中,可产生多种酶、维生素、有机酸和未知促生长因子等,参与机体新陈代谢,同时还具有竞争排斥的功能,可以减少动物胃肠道有害菌的数量,调整和维持动物消化道菌群的平衡[3]。动物胃肠道本身就有复杂的环境,其胃的酸性环境以及小肠内胆盐的存在对芽胞杆菌的存活具有重要的影响。然而,不同芽胞杆菌菌株产纤维素酶能力、对动物胃肠道环境的耐受力等却不尽相同。因此,本试验以26株山羊源芽胞杆菌为材料,比较研究其产纤维素酶的能力、耐酸能力、耐胆盐能力、抑菌性以及药物敏感性,旨在筛选出在动物体外具有良好益生作用的山羊微生态制剂候选菌株。
1 材料与方法
1.1 材料
1.1.1 菌株及来源 21株枯草芽胞杆菌、4株短小芽胞杆菌及1株地衣芽胞杆菌均为西南民族大学动物医学实验室自山羊瘤胃分离所得;金黄色葡萄球菌ATCC65213、大肠埃希菌ATCC25922均购自中国兽医药品监察所;山羊源肠炎沙门菌由西南民族大学动物医学实验室分离鉴定并保存。
1.1.2 培养基 胰蛋白胨大豆胨琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)购自青岛海博生物技术有限公司;MH购自杭州百思生物技术有限公司;产纤维素酶筛选培养基:羧甲基纤维素钠10 g/L 、胰蛋白胨10 g/L、酵母粉5 g/L、KH2PO41 g/L、MgSO40.2 g/L、NaCl 10 g/L、葡萄糖2 g/L、琼脂20 g/L,pH为7.0;发酵培养基:蛋白胨 2 g/L、羧甲基纤维素钠20 g/L、酵母膏1 g/L、NaCl 3 g/L、(NH4)2SO42 g/L、KH2PO42 g/L、MgSO4·7H2O 1 g/L、FeSO4·7H2O 0.01 g/L、MnSO4·H2O 0.005 g/L,以上成分混合溶解后,调节pH至7.0,121℃,高压灭菌15 min。
1.1.3 其他试剂 0.05% 苯甲酸柠檬酸-柠檬酸钠缓冲溶液(pH 4.8),0.36 mg/mL的葡萄糖标准溶液,0.5%刚果红染液5% NaCl溶液脱色,3,5-二硝基水杨酸(DNS)溶液,1%羧甲基纤维素钠底物溶液,柠檬酸-柠檬酸钠缓冲液(0.1 moL/L,pH 4.8);四环素、利福平、青霉素,链霉素、环丙沙星等16种药敏片购自杭州微生物试剂有限公司。
1.2 方法
1.2.1 产纤维素酶芽胞杆菌的初步筛选 将各株芽胞杆菌点种至产纤维素酶筛选平板上,同时点种TSA平板上作为对照,37℃恒温培养24 h;用5 g/L的刚果红染色30 min,倒掉染液并用水冲洗,加入适量50 g/L的NaCl溶液脱色60 min,测量透明圈直径(H)、菌落直径(C),并计算水解圈直径与菌落直径大小的比值(H/C值)[4]。
1.2.2 产纤维素酶芽胞杆菌的复筛
(1)粗酶液的制备 将初筛的芽胞杆菌按1% 的接种量接种于发酵培养基,置200 r/min的恒温培养箱中37℃发酵培养24 h,8 000 r/min离心5 min,吸取上清液即为粗酶液,用于酶活力测定。
(2)葡萄糖标准曲线的绘制 用不同浓度的葡萄糖溶液作标准溶液,与DNS共热反应显色后,测出其吸光度OD值,绘制标准曲线。
(3)滤纸酶活力测定 参考文献[5]的方法进行滤纸酶活测定,取1 mL的粗酶液于试管中,并以滤纸为底物,再加入含0.5 g/L苯甲酸钠的柠檬酸-柠檬酸钠缓冲溶液(0.05 moL/L、pH 4.8)1.5 mL,50℃水浴平衡后,加入0.5 mL的粗酶液(不加粗酶液的为空白对照),混匀后使试管内的溶液没过滤纸。50℃水浴1 h后迅速置冰上冷却,向各试管加入3 mL 3,5-二硝基水杨酸(DNS)溶液,再向空白试管中加粗酶液0.5 mL,混匀并于沸水中煮10 min迅速冷却后,用蒸馏水定容至25 mL。以不加粗酶液的试管为参照,于540 nm 波长处测定OD值,并记录结果。滤纸酶活性单位:1 mL 粗酶液,在50℃、pH 4.8的条件下,每分钟水解滤纸底物产生1μg还原糖(以葡萄糖计)所需的酶量定义为1个酶活力单位(U/ mL)。
(4)CMC酶活力测定 参照文献中DNS方法[6],以柠檬酸-柠檬酸钠(0.1 moL/L,pH 4.8)缓冲溶液配制成10 g/L羧甲基纤维素钠底物溶液。取1.5 mL 的底物溶液于50℃温浴10 min,再取0.5 mL粗酶液(不加粗酶液的为空白对照)与1.5 mL的底物溶液混合后置50℃温浴30 min,迅速冷却后再加入3 mL 3,5-二硝基水杨酸(DNS)溶液,再向空白对照试管中加入0.5 mL粗酶液。混匀后于沸水中煮10 min,迅速冷却,用蒸馏水定容至10 mL。以不加粗酶液的试管为参照,于540 nm波长处测定OD值,并记录结果。纤维素酶活力定义:在上述条件下,1 mL 粗酶液每分钟水解羧甲基纤维素钠产生1 μg还原糖的酶量,定义为1个酶活力单位(U/ mL)。
1.2.3 芽胞杆菌耐酸试验 经产酶性能筛选出的菌株接种于TSB液体培养基于37℃扩大培养24 h后,充分混匀,按2% 的接种比例将菌液分别转接至pH为1.0、2.0、3.0、4.0、5.0、6.0、7.0的TSB液体培养基中,37℃恒温培养4 h后。于600 nm处测OD值,设TSB液体培养基为调零对照。取3个重复数值并求平均值,计算细菌存活率代表菌株对酸的耐受性,存活率(%)=经酸处理菌液OD600nm/未经酸处理处理菌液OD600nm×100%[7]。
1.2.4 芽胞杆菌耐胆盐试验 经产酶性能筛选出菌株接种于TSB液体培养基中,37℃培养24 h,充分混匀后,按2%的接种比例将上述菌液分别加到含0.1%、0.2%、0.3%、0.5%、0.7%的牛胆酸盐TSB液体培养基中,同2.3处理,计算存活率代表菌株对胆盐的耐受性[7]。
1.2.5 菌株体外抑菌试验 将待测芽胞杆菌接种于TSB液体培养基中37℃振荡培养12 h后作为种子液,再将培养好的种子液按2%的接种量接种到发酵培养基37℃振荡培养过夜。5000 r/ min离心10 min,取上清,备用。将各金黄色葡萄球菌、大肠埃希菌和山羊源肠炎沙门菌指示菌分别接种至MH液体培养基,200 r/min 37℃培养过夜,将此培养液按1∶100比例稀释后取100 μL均匀涂布于MH琼脂平板上,并将牛津杯放至平板上,每个牛津杯中加150μL芽胞杆菌培养上清液,于4℃冰箱扩散过夜后,37℃恒温培养8 h,记录抑菌圈直径。
1.2.6 菌株对抗菌药物的敏感性试验 参照文献[8],采用纸片扩散法法检测芽胞杆菌对多种药物的敏感性,从而了解该芽胞杆菌作为益生菌的安全性。
2 结果
2.1 产纤维素酶芽胞杆菌刚果红初筛结果
采用刚果红染色法,对本实验室自山羊瘤胃分离的26株芽胞杆菌产纤维素酶的情况进行了初步试验,其结果见表1。由表1可知,26株芽胞杆菌均能产纤维素酶,其中H/C值在3及以上的菌株有4株,分别为枯草芽胞杆菌X7F3、枯草芽胞杆菌X7F4、枯草芽胞杆菌4F3-1、短小芽胞杆菌3F4,利用刚果红染色法初步确定此4株芽胞杆菌中H/C值最大的为短小芽胞杆菌3F4,但其酶活性高低与H/C值是否一致还需要进一步验证。
2.2 滤纸酶活力测定结果
(1)葡萄糖标准曲线 在滤纸酶活测定中,利用不同浓度的葡萄糖与DNS共热反应显色后,测定OD值,得出葡萄糖标准曲线见图1。由标准曲线y=0.020 7x-0.004 3,R2=0.990 7,得到的标准曲线线性关系较好,可用于滤纸酶活力测定。
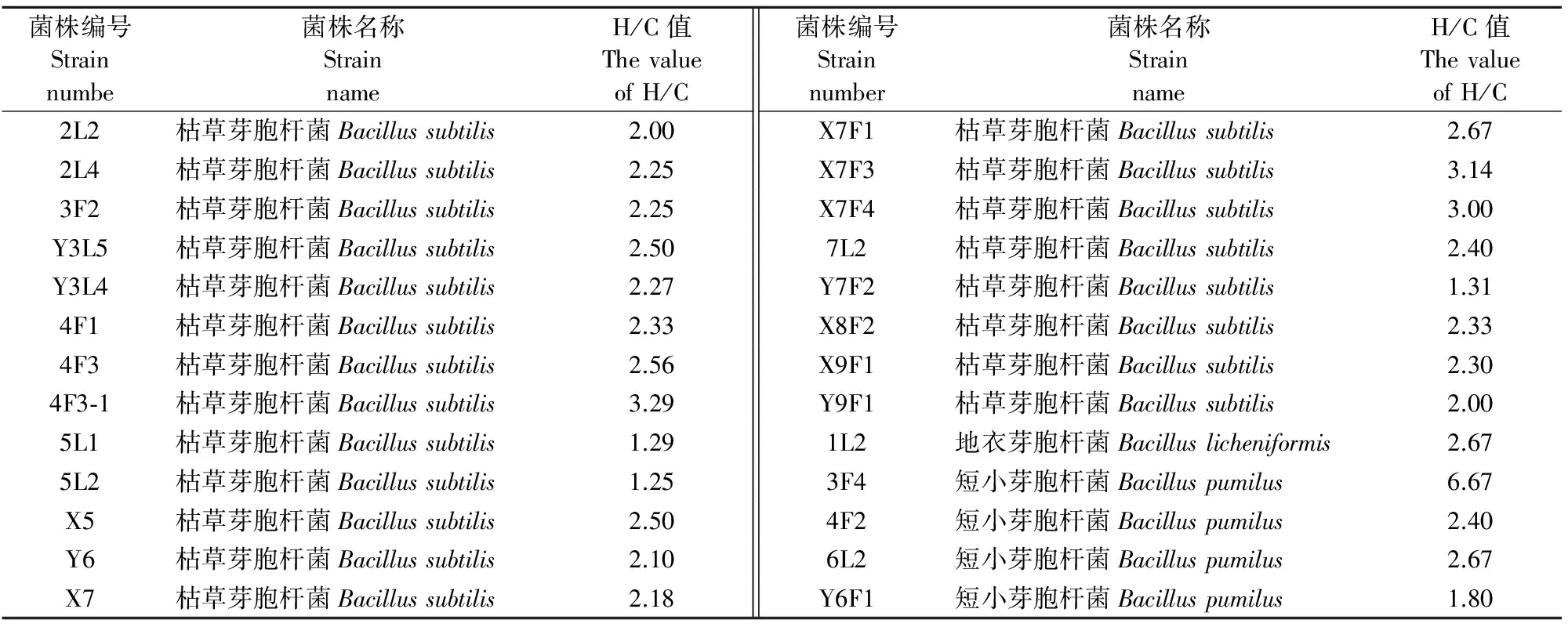
表1 芽胞杆菌产纤维素酶的圈菌值(H/C值)
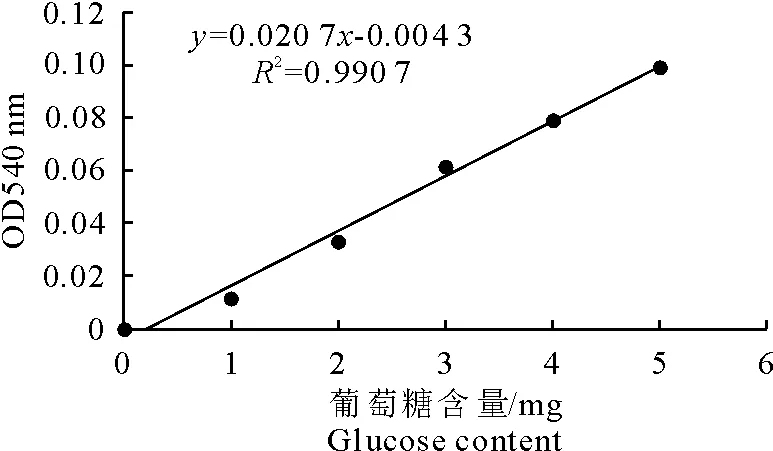
图1 葡萄糖标准曲线
(2)滤纸酶活力 4株芽胞杆菌在同等条件下的滤纸酶活力值及OD540 nm结果见图2。
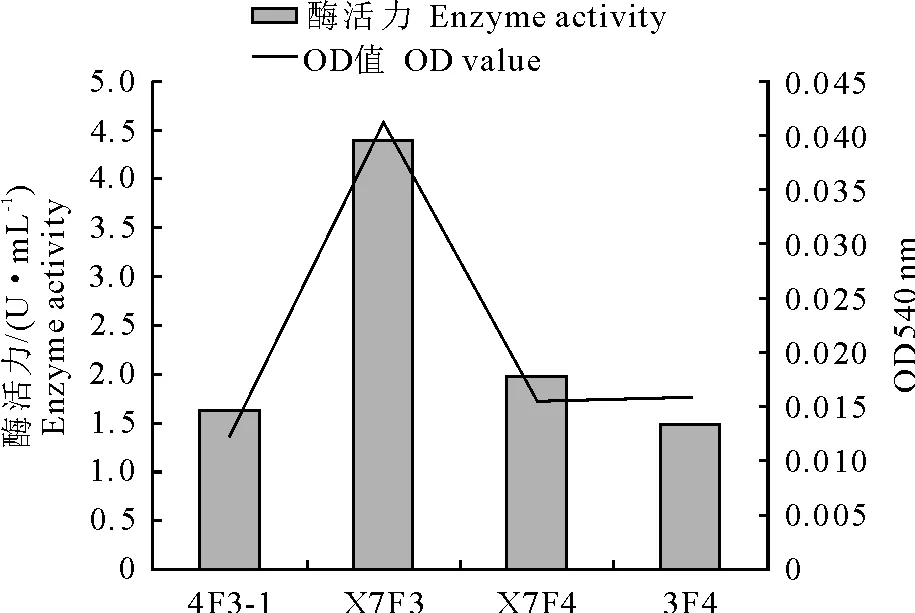
图2 4株芽胞杆菌滤纸酶活力及OD540nm值
由图可以看出,4株芽胞杆菌中滤纸酶活性由大到小依次为枯草芽胞杆菌X7F3、枯草芽胞杆菌X7F4、枯草芽胞杆菌4F3-1、短小芽胞杆菌3F4。
2.3 CMC酶活测定结果
(1) 葡萄糖标准曲线 在CMC酶活测定中,利用不同浓度的葡萄糖与DNS共热反应显色后,测定OD值,得出葡萄糖标准曲线见图3。
由标准曲线y=0.006 7x-0.001 5,R2=0.991,得到的标准曲线线性关系较好,可用于CMC酶活力测定。
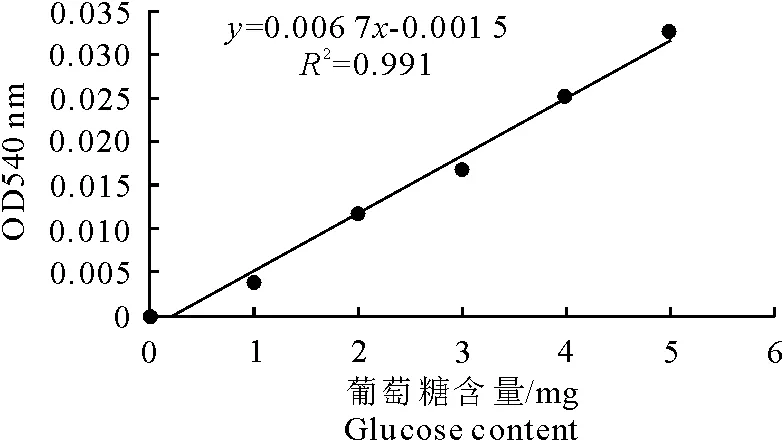
图3 葡萄糖标准曲线
(2)CMC酶活力 4株芽胞杆菌在同等条件下的CMC酶活力值和OD540 nm 结果见图4。
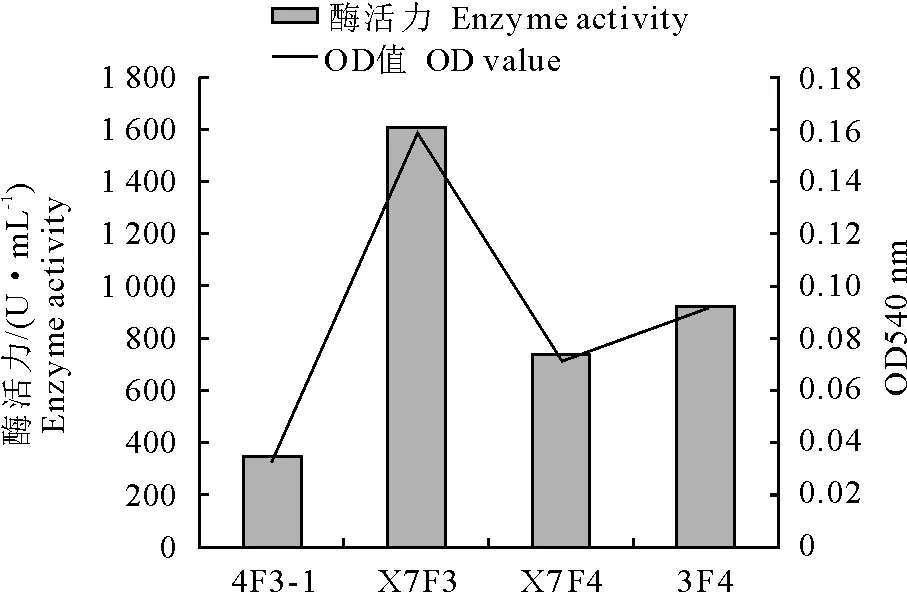
图4 4株芽胞杆菌CMC酶活力值及OD540 nm 值
由图可以看出,4株芽胞杆菌中CMC酶活由大到小依次为枯草芽胞杆菌X7F3、短小芽胞杆菌3F4、枯草芽胞杆菌X7F4、枯草芽胞杆菌4F3-1。
2.4 耐酸测定结果
益生菌进入动物体内,需经过胃内酸性环境到达肠道才能发挥生物学作用,因此良好的耐酸能力是益生菌的必备条件。4株芽胞杆菌耐酸结果见图5。
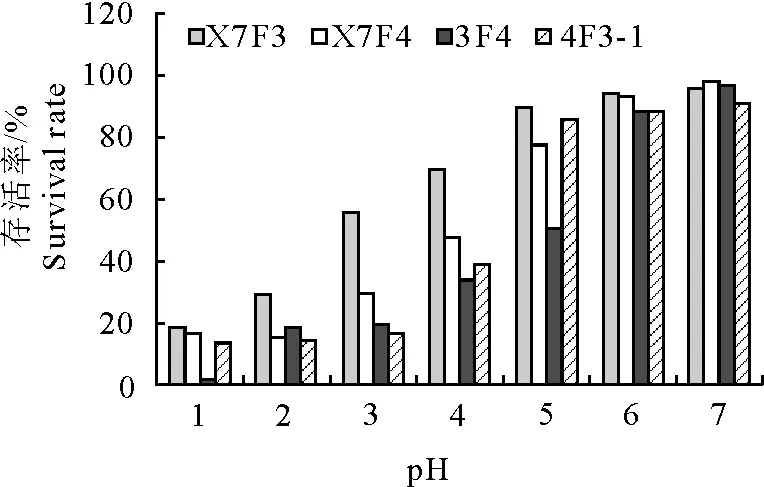
图5 4株芽胞杆菌分离株在不同pH环境下的存活率
由图5可知,4株芽胞杆菌在pH 3.0的环境下培养4 h后,只有枯草芽胞杆菌X7F3的存活率在50%以上。随着pH的升高,其成活率也逐渐升高,当pH在6.0以上时,4株芽胞杆菌存活率均在90%以上,在不同酸性条件下,枯草芽胞杆菌X7F3耐受性最好,其余3株芽胞杆菌耐受性较差。
2.5 耐胆盐试验结果
益生菌进入动物肠道后,会受到动物肠道内胆汁酸盐的抑制作用,因此益生菌必须具有较强的胆盐耐受性。4株芽胞杆菌耐胆盐结果见图6。
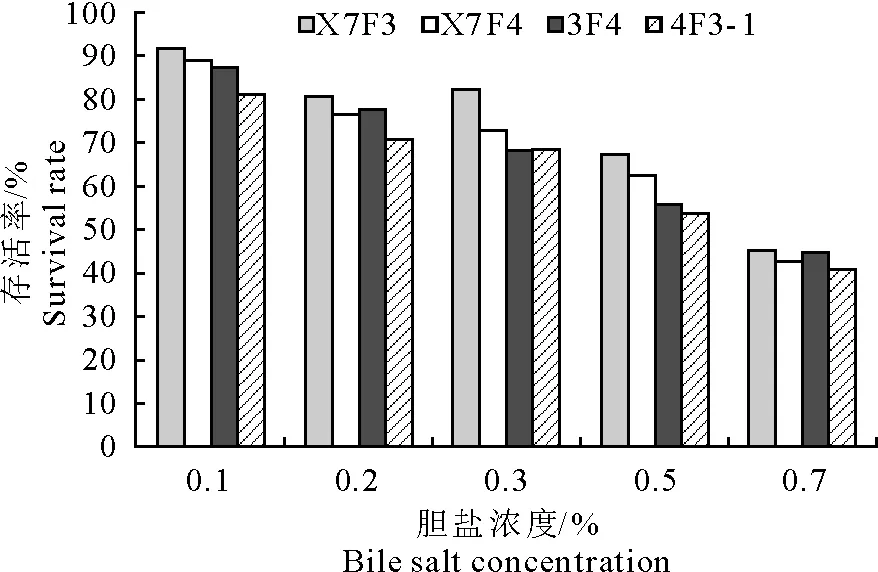
图6 4株芽胞杆菌分离株在不同浓度胆盐中的存活率
由图6可知,4株芽胞杆菌在不同浓度牛胆盐溶液中培养4 h后,在0.3%的牛胆盐溶液中的存活率均在70%以上,其中枯草芽胞杆菌X7F3在各浓度牛胆盐溶液的存活率均高于其于3株芽胞杆菌。
2.6 抑菌试验结果
枯草芽胞杆菌X7F3的发酵上清对金黄色葡萄球菌、大肠埃希菌和山羊源肠炎沙门菌的抑制作用见表2。结果显示,枯草芽胞杆菌X7F3发酵上清对金黄色葡萄球菌有抑菌作用,而对大肠埃希菌以及山羊源肠炎沙门菌没有抑制作用。

表2 芽胞杆菌X7F3对3种细菌的抑菌试验结果
2.7 药物敏感性试验结果
枯草芽胞杆菌X7F3对9类16种抗菌药物的敏感性试验结果见表3。由表3可知,枯草芽胞杆菌X7F3对以上9类16种抗菌药物均敏感,其中对氨基糖苷类的链霉素以及林可胺类的林可霉素中度敏感,对其余的14种抗菌药物高度敏感。

表3 枯草芽胞杆菌X7F3对16种抗菌药物的药敏试验结果
3 讨论
纤维素是植物的重要组成部分,也是地球上最丰富的可再生资源[9],充分利用植物中的纤维素并将其转化为畜禽可利用的饲料具有重要的意义。研究证明,芽胞杆菌能分泌促进动物机体对营养物质降解消化的酶类,比如纤维素酶、淀粉酶等[10]。本试验应用刚果红染色法进行初筛,以测定酶活性进行复筛,综合考虑水解圈和菌落直径的比值(HC值)、滤纸酶活力以及CMC酶活力,从26株芽胞杆菌中筛选得到1株产纤维素酶最优的芽胞杆菌X7F3,该菌株为枯草芽胞杆菌,其滤纸酶活为4.4 U,黄慰情[11]从堆肥样品中分离的芽胞杆菌D-4的滤纸酶活为3.03U,两者相比,枯草芽胞杆菌X7F3滤纸酶活较高。而汤文晶[12]从黄山森林腐木中分离的枯草芽胞杆菌的CMC酶活(586.7 U/mL)与本研究枯草芽胞杆菌X7F3的CMC酶活(1610 U/mL)相比,本研究枯草芽胞杆菌X7F3的CMC酶活较高。
动物胃肠道环境较复杂,影响益生菌存活的因素较多,如酸性环境、胆盐环境等,因此了解益生菌在其中的生长情况对于评价该益生菌是否为优良菌株具有重要意义。本试验中枯草芽胞杆菌X7F3在 pH 3.0 的环境下培养4 h后,存活率在50%以上,在0.3%的牛胆盐溶液中培养4 h后的存活率均在70%以上,说明该菌株具有耐受动物胃肠道不良环境的潜力。在体外抑菌试验中,该菌株发酵上清对大肠埃希菌以及沙门菌没有抑菌作用,但对金黄色葡萄球菌具有较强的抑菌作用。
随着抗生素在临床抗感染治疗上的广泛使用,细菌的耐药性问题也越来越普遍。芽胞杆菌菌株的耐药性评价是目前国际上益生芽胞杆菌生物安全性评价的重要内容。虽然益生菌耐药并非绝对的有害[13],但是对于进入动物机体的外源性活菌,其耐药基因可能以各种方式在肠道内微生物菌群间相互传递[14]。因此,对益生菌进行药敏测试是必要的。本试验中枯草芽胞杆菌X7F3对试验中所用的9类16种抗菌药物均敏感。
理想的益生菌菌株应具有准确的分类鉴定、无毒性、能在消化道目标位置存活、能产生抗菌物质、能够与病原菌拮抗、菌株能够产生代谢活性物质、无耐药性、能够调控免疫反应、能发挥促进健康作用[15]。本研究中枯草芽胞杆菌X7F3能产纤维素酶,且酶活力较高;对酸以及胆盐环境有好的耐受性;发酵上清对金黄色葡萄球菌具有明显的抑制作用;对临床上使用使用的大多数抗生素敏感,因此初步认为该菌株在体外具有较好的益生作用。但该菌株能否调控动物机体的免疫反应、对动物机体是否产生毒性作用以及对是否能够促进动物健康,需要通过动物试验来进一步研究证实。
[1] Duc l H,Hong H A,Barbosa T M,et al.Characterization ofBacillusprobioticsavailable for human use.[J].Appl Environ Microbiol,2004,70(4):2161-2171.
[2] 饲料添加剂品种目录(2013).中华人民共和国农业部公告,2014(1):61-63.
[3] 郭小华,赵志丹.饲用益生芽孢杆菌的应用及其作用机理的研究进展[J].中国畜牧兽医,2010,37(2):27-31.
[4] 吴敏峰,耿秀蓉.产纤维素酶芽孢杆菌的分离鉴定[J].饲料工业,2006,27(20):21-24.
[5] 张瑞萍.纤维素酶的滤纸酶活和CMC酶活的测定[J].印染助剂,2002,19(5):51-53.
[6] Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[7] 郭政宏,周 彪,严亨秀.一株藏绵羊源短小芽孢杆菌的分离鉴定及生物学特性研究[J].中国畜牧兽医,2016(6):1610-1617.
[8] 冯大伟,周家春.益生乳酸菌的纸片扩散法药敏性试验评价[J].微生物学通报,2010,37(3):454-464.
[9] Emsley A M.Cellulosic ethanol reignites the fire of cellulose degradation[J].Cellulose,2008,15(2):187-192.
[10] Sögaard H,SuhrJessen T.Microbials for feed:beyond lactic acid bacteria.[J].Feed Int,1990,11(1):32-34.
[11] 黄慰情.高温纤维素降解菌的筛选、鉴定及产酶条件研究[D].浙江大学,2014.
[12] 汤文晶.一株高产纤维素酶细菌的鉴定及其产纤维素酶的特性研究[D].安徽工程大学,2012.
[13] Madden J A J,Plummer S F,Tang J,et al.Effect of probiotics on preventing disruption of the intestinal microflora following antibiotic therapy:A double-blind,placebo-controlled pilot study[J].Int Immunopharmacol,2005,5(6):1091-1097.
[14] Saarela M,Mogensen G,Fondén R,et al.Probiotic bacteria:safety,functional and technological properties[J].J Biotechnol,2000,84(3):197-215.
[15] 张日俊.动物微生态制剂(益生菌)的标准、评价规程、功能和发展趋势[J].饲料工业,2015(4):1-7.
Screening of ProbioticBacillusfrom Goats
XU Feng,ZHANG Huan-rong*,XU Gui-li,ZHANG Xing-min,TANG Cheng
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China)
In order to select super probioticBacillusstrain,26Bacillusstrains isolated from goats were screened by Congo red staining method for cellulase production,filter paper enzyme activity and CMC enzyme activity of cellulase were further determined,biochemical acid resisting and bile salt resisting characteristics were studied.On this basis,the bacteriostatic and drug sensitivity of the strains were also determined.The results showed that 4Bacillusstrains have better cellulase production characteristics than the other 22Bacillusstrains,oneBacillussubtilisstrain was proved to be the best one to be used for probiotic strain with 4.4 U filter paper enzyme activity,1610 U CMC enzyme activity was over 50% survival rate under the environment for pH 3.0 and over 70% survival rate under the environment for 0.3% bile salt,thisBacillussubtilisstrain had a significant antibacterial effect onStaphylococcusaureus,and sensitive to 16 kinds of commonly used antimicrobials.These results suggest thatBacillussubtilisX7F3 was a candidate of goat probiotics strain.
goat;Bacillus; cellulase; acid tolerance; bile tolerance; bacteriostatic test; antimicrobials sensitivity
2016-08-23
国家民委科技项目(14XNZ025);四川省教改项目“兽医专业学位研究生教育实践基地建设”
徐 凤(1989-),女(土家族),重庆酉阳人,硕士研究生,主要从事动物医学研究。*通讯作者
S852.616
A
1007-5038(2017)06-0043-05
